【导言】
ROS1作为新型的靶点新贵,Nature子刊既往有篇综述不错《ROS1-dependent cancers — biology, diagnostics and therapeutics》,感兴趣的小伙伴可以去瞅瞅。今天分享的算是一个比较新的总结和展望吧,供大家参考

原癌基因ROS1(c-ROS)于1987年在胶质母细胞瘤细胞中首次发现,位于6号染色体长臂6q22位置。ROS1基因编码的ROS1蛋白是属于胰岛素受体家族的I型内在跨膜酪氨酸激酶受体。ROS1的自我突变或重排可激活酪氨酸激酶,促进多种恶性肿瘤的增殖。随后, ROS1于2007年在非小细胞肺癌(NSCLC)中作为染色体重排被检测到,并包含融合基因,例如SLC34A2-ROS1、SDC4-ROS1和CD74-ROS1 。ROS1的融合可导致自身磷酸化,通过丝裂原活化蛋白激酶(MAPK)通路或RAS磷酸化介导肿瘤进展。
ROS1含有47个外显子,其中外显子1~34编码人类受体酪氨酸家族最大的胞外N末端结构域。Springer等研究发现该结构域由3个YWTD结构域和散在的Ⅲ型纤连蛋白(FN3)组成。YWTD结构域呈圆形、折叠的“螺旋桨”形状,能与周围结构紧密相互作用,改变ROS1的结构。 此外,ROS1与间变性淋巴瘤激酶(ALK)结构域在氨基酸水平上非常相似,在ATP结合位点上有77%的同一性。 考虑到ROS1与ALK的相似性,ALK抑制剂也是ROS1突变肿瘤的常用治疗药物。ROS1参与的信号通路与正常细胞的分化和增殖有关 。ROS1可通过特定酪氨酸的细胞内自身磷酸化激活并结合SH2结构域,与特定衔接蛋白一起作用,介导RAS/RAF/MEK/ERK、PI3K/AKT/mTOR、和JAK/STAT319信号通路(图1)。 ROS1可激活PTPN6(SHP1)和PTPN11(SHP2)。尽管PTPN6和PTPN11(SHP2)具有结构同源性,但PTPN6通常通过负调控途径抑制细胞活性,而PTPN11主要作为正信号转导因子。
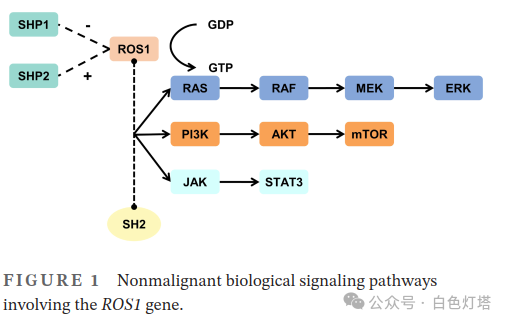
ROS1可通过过表达、突变扩增或基因融合促进多种肿瘤的进展。 ROS1的过表达最初发现于神经系统肿瘤,如原发性神经胶质瘤和脑膜瘤。Cheng等研究发现,胞浆中ROS1基因的表达与口腔鳞状细胞癌(OSCC)的发展呈正相关。有研究表明,ROS1可能通过增强线粒体生物活性和增加细胞ATP水平来介导OSCC的侵袭性,Boyard等研究发现,ROS1的重排和过表达可以激活炎性肝细胞腺瘤中的JAK/STAT通路并促进其进展。
Hou等研究了177例肺腺癌患者的cBioPortal for Cancer Genomics和二代测序(NGS)检测结果, 发现ROS1基因重排在年轻患者中频繁发生(<40岁;p=0.035),但这些突变的意义尚不明确 。与之相一致的是,Wang等也认为 ROS1基因扩增或重排突变在恶性肿瘤中更常见 ,例如胃肠道间质瘤、胆囊癌和软组织肉瘤。但这些突变的意义和影响需要进一步研究。
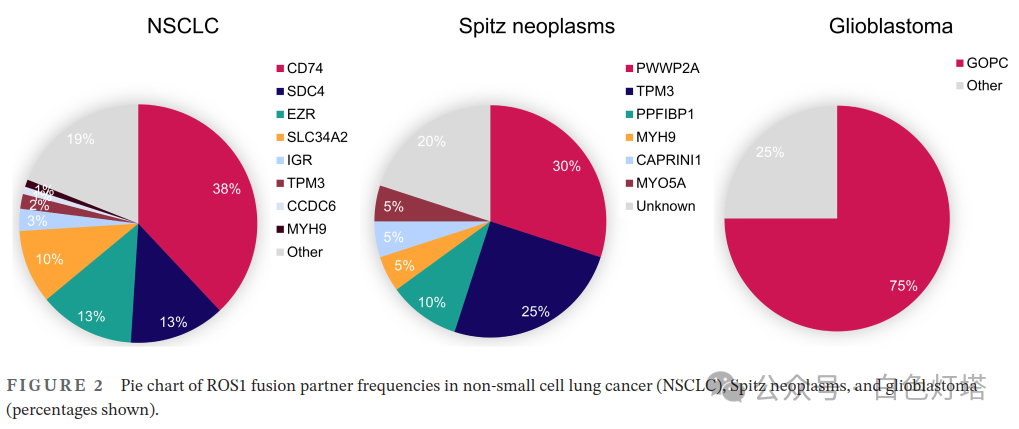
相比于ROS1基因的过表达和扩增,研究者认为ROS1基因融合是肿瘤发生和病情进展的首要驱动力。 在NSCLC、Spitz肿瘤和胶质母细胞瘤中已鉴定出多种ROS1融合基因(图2)。 在 NSCLC中 , CD74是ROS1基因最常见的融合伴侣,约占38%的病例 ,其次是EZR(13%)、SDC4(13%)和SLC34A2(10%)。Gerami等发现在16例Spitz肿瘤中PWWP2A-ROS1融合频率最高。此外,GOPC-ROS1是胶质母细胞瘤中最常见的融合(75%);Richardson等表明这种融合可能是由染色体6q22.1中的微缺失引起的。 总之,高频率的ROS1融合伴侣在不同癌症类型中有所不同,并且与融合基因激活的内在水平和融合位点有关。 例如,与胶质母细胞瘤不同,NSCLC中的ROS1基因融合是通过染色体间易位发生的。融合伴侣的差异导致亚细胞定位的变化,从而影响下游信号通路。例如,与作用于内质网的CD74-ROS1相比,SDC4-ROS1和SLC34A2-ROS1具有更强的激活MAPK通路的能力。此外, ROS1融合与其他致癌突变之间存在互相排斥的关系,这种趋势在NSCLC、神经胶质瘤和Spitz肿瘤中都有观察到。ROS1很少与ALK、EGFR或KRAS基因同时突变 。尽管ROS1和ALK结构域相似且同源性高,但ROS1/ALK双融合很少共存。
👉 ROS1基因突变的诊断
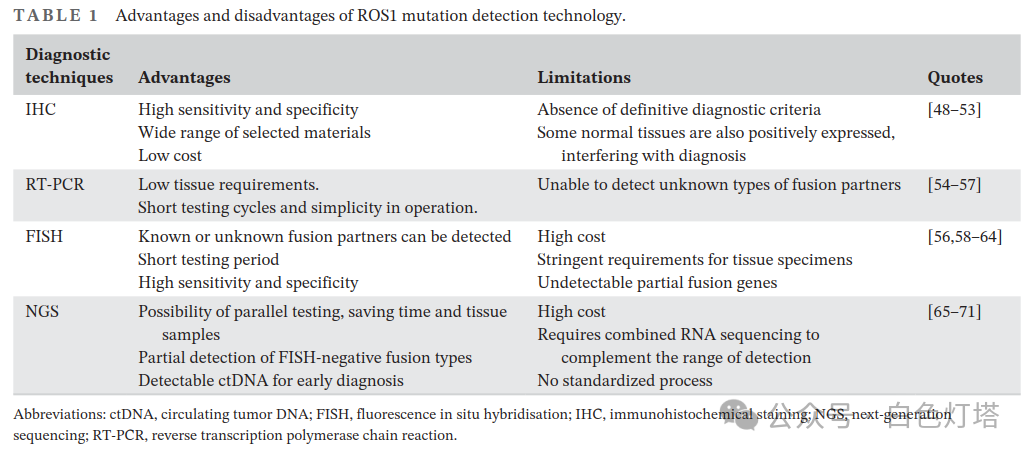
ROS1基因突变可发生在多种肿瘤中,包括NSCLC(1%~2%)、胶质瘤(6%~7%)和胆管癌(1.1%),其中ROS1融合NSCLC是最常见的。 一项对9898例NSCLC患者的荟萃分析表明, ROS1融合多发于无吸烟史的年轻女性患者,并且在晚期患者(III~IV期)中比早期患者更为普遍(p <0.001) 。因此,及时有效地诊断ROS1突变至关重要。目前已报道了多种检测ROS1突变的技术,可用于临床筛查或确诊,如以下章节所述。
1、免疫组织化学染色(IHC)
免疫组织化学染色(IHC)是ROS1融合的有效筛查工具。ROS1的IHC可使用细胞标本、石蜡包埋组织标本和细胞块进行肺癌检测。检测ROS1最常用的抗体是D4D6兔单克隆抗体(Cell Signaling Technology),其敏感性和特异性分别为89%和98%。Conde等人进行的多中心评估。 发现SP384抗体(Ventana)在检测ROS1基因重排方面比D4D6抗体更敏感(93%)。然而,Hofman的实验结果表明D4D6对ROS1重排更准确。 因此,这些抗体在IHC中的使用仍然存在争议。文献中报道的IHC结果主要为1+(弱胞浆染色)、2+(中度染色)或3+(强染色),镜下表现为颗粒状胞浆染色阳性 。IHC是一种廉价且高度准确的筛查方法;然而,它缺乏明确的评分标准,并且在不同的肿瘤细胞中表达水平不同。 此外,正常组织,如II型肺泡和破骨细胞型巨细胞,也可以弱表达ROS1,这会干扰诊断。
2、逆转录聚合酶链式反应(RT-PCR)
逆转录聚合酶链式反应(RT-PCR)通过识别融合mRNA并区分融合伴侣来检测ROS1重排。RT-PCR可用于从福尔马林固定石蜡包埋的组织样本和细胞标本中提取RNA,所需组织样本较少,可在较短的检测时间内轻松完成。 然而,RT-PCR只能检测已知的融合伴侣;它无法识别未知物种的融合基因。由于ROS1融合伴侣数量众多,RT-PCR在临床应用中存在一定的局限性 。
3、荧光原位杂交(FISH)
荧光原位杂交(FISH)是目前唯一可以检测几乎所有ROS1突变的技术 。它使用两种标记有不同荧光颜色(通常为红色、绿色或橙色)的探针来靶向ROS1的5′和3′端。ROS1融合在FISH中表现为5′端探针的丢失或信号中断,从而将两种颜色分开。FISH的优势在于它能够检测ROS1的未知融合伙伴。此外, FISH的循环时间、特异性和灵敏度在临床上令人满意。 然而,FISH价格昂贵,对组织样本的要求严格,例如6个月以下婴儿的组织切片。此外,必须在超过50个细胞核中检测到FISH才具有诊断意义。此外, 由于探针设计的局限性,一些ROS1的融合伴侣(GOPC-ROS1)无法通过FISH检测到 ;自行设计的探针可以克服这一限制。 然而,FISH仍然是检测ROS1基因突变的金标准 。
4、下一代测序(NGS)
NGS技术的范围从突变基因区域分析到全基因组测序,并且能够同时检测多种变异形式,与单靶检测相比,可节省时间和组织样本。 NGS可以检测单核苷酸突变、基因插入/缺失和基因组重排,DNA和RNA均可用作样本。 NGS目前用于检测ROS1基因重排,特别是对于FISH结果为阴性的ROS1融合基因 ,例如GOPC-ROS1。此外,可以使用游离DNA(cfDNA)或循环肿瘤DNA(ctDNA)进行NGS,它们是早期诊断的有效工具。然而,NGS技术在大规模临床应用中存在 局限性。首先,仅分析少数基因时,NGS成本高昂。其次,仅DNA检测不太准确 ,并且不能覆盖具有大量重复核苷酸的内含子断点,而全基因组RNA测序可以克服这一问题。 Benayed等人使用基于RNA的基因组测序仪对2522名肺腺癌患者的样本进行了检测,发现ROS1重排的检测率与DNA样本相比有所提高 。最后,对于不同类型和阶段的肿瘤进展,尚无标准化的NGS流程,因此需要额外的临床信息来定义罕见变异。
综上所述,上述四种检测方法各有优缺点(表1), 对于应该使用哪种检测方法检测ROS1突变,目前尚无定论。由于ROS1与ALK等基因具有相互排斥的趋势,本研究建议在对IHC阳性的标本进行FISH之前,可以使用IHC对ALK表达阴性的肿瘤标本进行筛查。相比之下,NGS可能更适合需要早期诊断和指导用药的病例。
👉 ROS1激酶抑制剂
所有ROS1抑制剂都是多激酶抑制剂,除了ROS之外,还可以抑制ALK、MET和其他激酶(如EGFR、JAK2和TrkA)。早期ROS1-TKI,如克唑替尼和恩曲替尼,可用于未接受过TKI治疗(TKI-naïve)的ROS1阳性NSCLC患者。考虑到早期TKI治疗期间不可避免地会出现耐药突变,下一代TKI如卡博替尼和他曲替尼已在临床试验中进行了测试。然而,其中大多数尚未获准用于ROS1阳性肿瘤。
ROS1激酶抑制剂主要影响ROS1的激酶结构域。根据结构域构象,常规激酶可分为DFG-in(活性,I型)和DFG-out(非活性,II型)激酶。 DFG是指调节激酶活性的活化环,由天冬氨酸(D)、苯丙氨酸(F)和甘氨酸(G)组成。当结构域处于DFG-in状态时,天冬氨酸向内旋转以暴露ATP结合位点。大多数TKI(克唑替尼、塞瑞替尼、恩曲替尼、他曲替尼和雷帕替尼)竞争ATP结合位点,阻止ATP进一步磷酸化激酶,从而抑制激酶活性。在DFG-out状态下,结构域中的天冬氨酸向外旋转并暴露出疏水位点,该位点可被少数TKI(如卡博替尼和福替尼)占据以抑制肿瘤活性。由于DFG-out构象不需要参与催化反应,因此结构限制较少,在抑制剂设计中提供更高的选择性。然而,II型激酶抑制剂的开发仍然具有挑战性,因为大多数激酶缺乏DFG-out结构域构象。
I型和II型ROS1激酶抑制剂均对ROS1融合阳性肿瘤有抑制作用,包括克唑替尼在CD74-ROS1和SDC4-ROS1融合NSCLC中的作用,塞瑞替尼在TFG-ROS1融合炎性肌纤维母细胞瘤中的作用,瑞普替尼在G2032R-ROS1和D2033N-ROS1融合肿瘤中的作用。此外,Davare和Facchinetti的研究表明,TKI对不同ROS1融合表型的抑制作用略有差异。但Drilon等13对临床试验数据进行统计学回顾显示,抑制程度的差异并不影响治疗效果。
👉 ROS1突变肿瘤的治疗
1、NSCLC
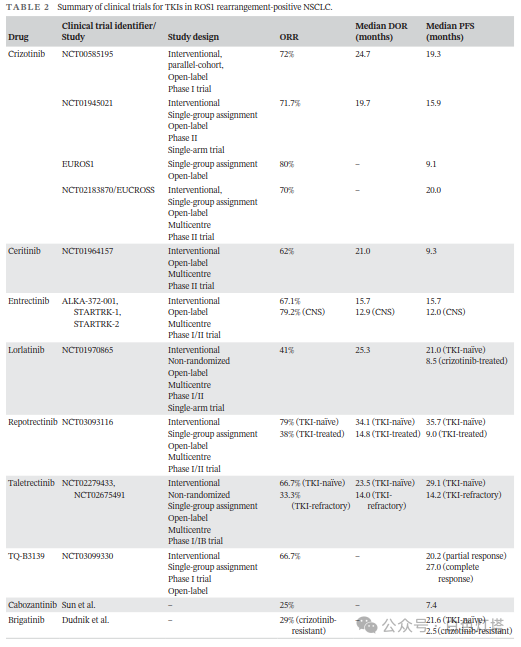
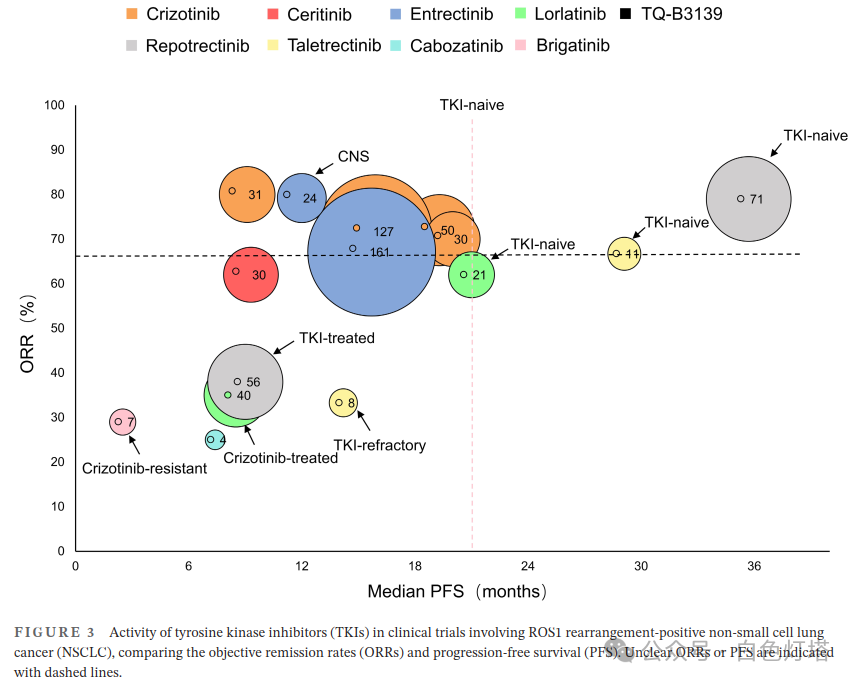
NSCLC约占所有肺癌的80%,其中ROS1融合阳性NSCLC约占NSCLC病例的1%–2%。 目前,ROS1激酶抑制剂是晚期ROS1融合阳性NSCLC的一线治疗方案(表2和图3)。
2、非NSCLC肿瘤
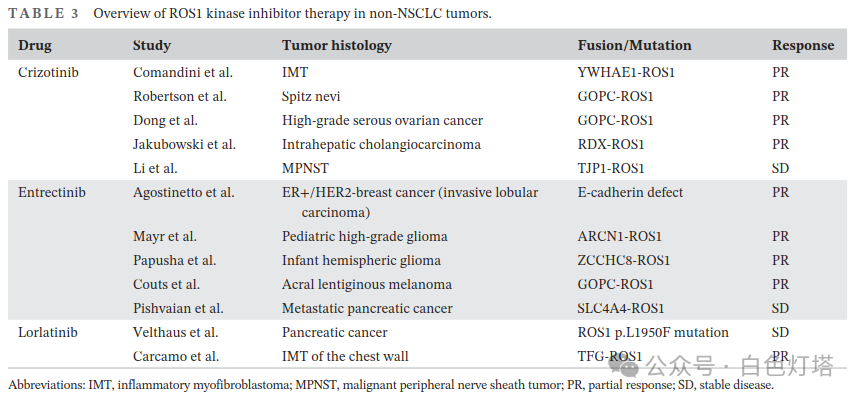
ROS1激酶抑制剂对非NSCLC肿瘤也有效,但由于ROS1重排发生率低,目前尚无相关TKI获批用于治疗非NSCLC肿瘤,文献中也有病例报道(表3) ,例如克唑替尼在YWHAE1-ROS1融合炎性肌纤维母细胞瘤(IMT)、GOPC-ROS1融合Spitz痣、高级别浆液性卵巢癌、RDX-ROS1融合肝内胆管癌和TJP1-ROS1融合恶性周围神经鞘瘤(MPNST)中均表现出良好或部分缓解。也有报道使用恩曲替尼治疗ER+/HER2-乳腺癌、ARCN1-ROS1和ZCCHC8-ROS1融合儿童神经胶质瘤、GOPC-ROS1融合角膜缘黑色素瘤、SLC4A4-ROS1融合转移性胰腺癌的病例。在下一代TKI中,洛拉替尼被提示对ROS1p.L1950F点突变胰腺癌和TFG-ROS1融合胸壁IMT有潜在疗效,尚无其他TKI相关病例报道。
👉 ROS1靶向治疗的6大挑战
1、与ROS1抑制剂相关的不良反应
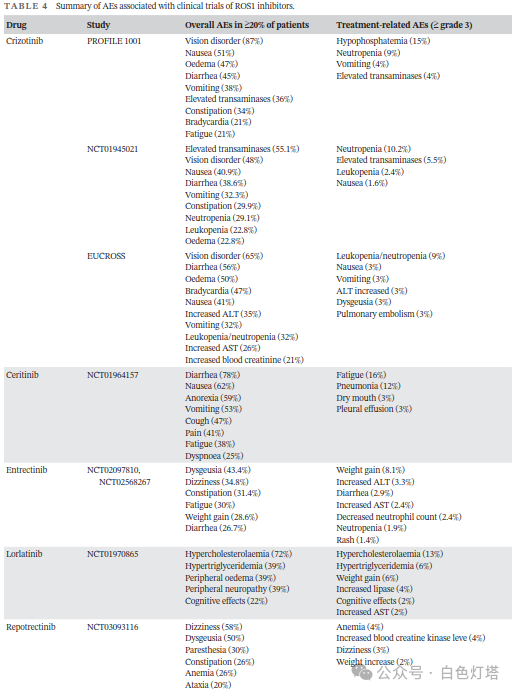
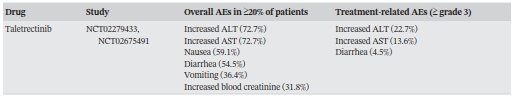
不良事件(AE)是ROS1靶向治疗的一大挑战,大多数ROS1激酶抑制剂在临床上的使用受到限制,因为与其作用机制相关的AE(表4),如水肿、视觉障碍、胃肠道症状,严重者可出现肝功能异常、中性粒细胞减少,甚至危及生命。一些AE与TKI作用的独特系统有关,如恩曲替尼抑制TRK并作用于神经系统,导致靶向治疗期间出现头晕、体重增加和认知障碍。此外,克唑替尼因抑制MET激酶可引起患者外周水肿。但其他不良反应尚缺乏明确机制解释,如肝功能异常、与克唑替尼治疗相关的眼部毒性表现、高脂血症,与洛拉替尼治疗相关的周围神经病变等。目前尚无标准化的临床处理流程来减轻AE带来的损害。Bauer等建议调整药物剂量或对症支持治疗可以控制轻度至中度AE(<3级)。虽然新一代TKI因其高亲和力而被认为在降低AE发生率方面具有潜在价值,但近期研究表明,新一代TKI在治疗AE方面并不具备绝对优势。
2、对ROS1抑制剂的耐药性
ROS1抑制剂的长期使用往往导致肿瘤细胞在疾病进展过程中产生耐药性, 导致肿瘤产生耐药性的机制主要包括激酶结构域的突变和侧支信号的激活。 ROS1激酶结构域的点突变可以改变药物靶点并降低其抑制作用,导致对靶向治疗产生耐药性。G2032R是ROS1中第一个发现的、也是最常见的耐药突变。该突变导致甘氨酸被精氨酸取代,这仍然能够实现ATP结合,但与克唑替尼的哌啶环结构相冲突,导致对ROS1激酶抑制产生耐药性,介导上皮间质转化,并上调Twist1,导致肿瘤进展。另一个突变D2033N通过影响ATP结合位点的溶剂前沿区域导致耐药性。此外,其他耐药突变,如L2155S,会影响蛋白质功能以增强耐药性,以及S1986F/Y(平行突变)和L2026M,通过阻断关键结合位点来促进激酶活性。 这种作用机制占ROS1耐药肿瘤的50%–60% 。
研究表明,旁路信号通路(例如EGFR通路)的激活可通过降低肿瘤对ROS1活性的依赖性并增加其对自身的依赖性来产生耐药性。包括之前报道的KIT和MAPK通路突变、MEK/ERK通路的自身磷酸化或改变可导致肿瘤细胞对克唑替尼产生耐药性(图4)。
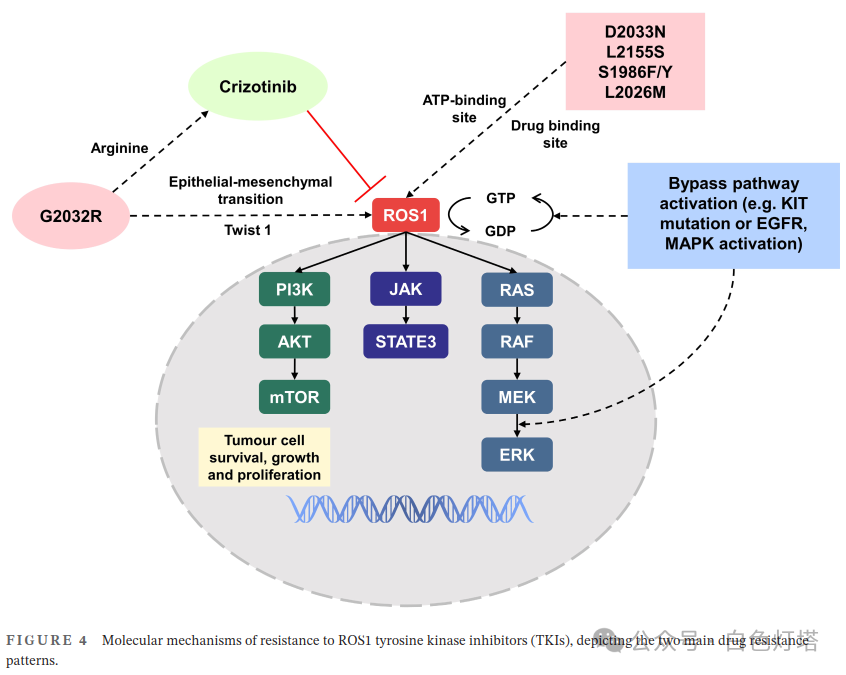
此外, ROS1抑制剂耐药可导致肿瘤细胞表型转变 。Lin等报道一例NSCLC患者在ROS1抑制剂耐药后病理分类转变为腺癌,该表型改变可能与视网膜母细胞瘤-1(RB1)和TP53失活有关。
目前应对激酶抑制剂耐药的主流方法是更换下一代TKI或将其与其他激酶抑制剂联合使用。
Yun等人发现repotrectinib针对G2032R突变具有靶向治疗效果,而foretinib的效果相似。洛拉替尼对其他突变也有治疗作用,例如L2026M和S1986F/Y。尤其是激酶抑制剂组合似乎对抵抗耐药更有效,因为激活了旁路信号通路。Dziadziuszko等人发现将克唑替尼与普纳替尼联合使用可以在体外克服由KIT通路突变引起的耐药性。Vaishnavi等人检测到了SLC34A2-ROS1融合HCC78细胞中EGFR通路的表达,而克唑替尼与EGFR抑制剂吉非替尼联合使用可以降低HCC78细胞的耐药性。除了ROS1结构域的点突变和旁路信号通路的激活外,还存在一些未知的耐药机制,例如ROS1融合阳性NSCLC患者对洛拉替尼的耐药。 因此,在开发下一代TKI时,未来的研究应侧重于表观遗传学、RNA和蛋白质,以阐明ROS1耐药的机制
。
3、CNS转移
CNS转移在ROS1突变恶性肿瘤中很常见。 大约36%的IV期ROS1阳性NSCLC患者会发生CNS转移。Li等发现与非CD74-ROS1融合病例相比,具有CD74-ROS1融合的NSCLC患者的CNS转移发生率更高(p =0.020),这表明融合伴侣的类型与CNS转移有关。 Jun等发现CD74-ROS1通过激活质膜蛋白E-Syt1的磷酸化赋予肿瘤细胞更高的转移潜能。由于克唑替尼穿过血脑屏障的能力较差,不能作为治疗CNS转移的首选药物。然而,新一代TKI在CNS转移病例中表现出了巨大的潜力,包括塞瑞替尼,在一项II期研究中,它在CNS转移患者中的ORR为25%,和洛拉替尼,其ORR为50%。 其中,恩曲替尼最有效,ORR为55%,平均PFS为13.6个月。 与TKI替代疗法相比,CNS转移对放射疗法敏感。因此,当患者无法耐受靶向治疗或病变较少时,它们可以成为控制CNS转移进展的一种选择。
👉 展望与结论
ROS1是一种原癌基因,主要在NSCLC等恶性肿瘤中表达,染色体重排导致的ROS1融合是肿瘤进展的驱动因素,应根据临床情况做出正确诊断。目前仅有少数ROS1激酶抑制剂获批用于NSCLC,其他TKI对NSCLC及其他恶性肿瘤的疗效尚不明确,仍在临床试验中。新一代TKI具有较高的亲和力,有望克服耐药性,延缓中枢神经系统转移,但不良反应发生率较高。新一代TKI在ROS1及其融合蛋白的定位、靶向药物的结合位点(I型vs.II型)以及与其他药物的联合用药等方面仍需进一步研究,此外,TKI与化疗或免疫治疗在临床中的相关性也需要进一步研究。
声 明 : 仅 供 医 疗 卫 生 人 士 内 部 参 考 , 不 指 导 任 何 临 床 实 践 ! ( 部 分 图 片 来 源 于 网 络 , 如 有 侵 权 请 及 时 告 知 , 必 删 ~











 苏公网安备32059002004080号
苏公网安备32059002004080号


