单细胞泛癌分析显示肿瘤浸润髓系细胞在免疫检查点阻断中的变异性
A single-cell pan-cancer analysis to show the variability of tumor-infiltrating myeloid cells in immune checkpoint blockade
Nat Commun
PMID:39034339 [IF=14.7]
研究背景
髓系细胞是免疫系统的重要组成部分,在协调免疫反应中具有关键功能。了解它们在肿瘤微环境中的功能以及它们与肿瘤浸润淋巴细胞的相互作用,对不同类型的癌症,特别是癌症免疫治疗提出了巨大的挑战。
研究方法
研究者通过使用单细胞转录组学对8种不同的癌症类型进行泛癌症分析,包括来自129名患者的192个肿瘤样本,来探索肿瘤浸润髓系细胞(TIM)。
研究结果
TIM景观在不同的癌症类型和治疗组之间有显著差异
为了开始评估不同癌症的TIM异质性,研究者对来自8种不同癌症类型的129例患者的肿瘤样本进行了scRNA-seq分析,包括基底细胞癌(BCC)、乳腺癌、肾透明细胞癌(ccRCC)、结直肠癌(CRC)、肝细胞癌(HCC)、头颈部鳞状细胞癌(HNSCC)、肝内胆管癌(iCCA)和黑色素瘤。其中,五种癌症类型(BCC、ccRCC、CRC、HNSCC和黑色素瘤)有关于治疗反应状态的可用临床信息(图1a)。实施质量控制措施以去除潜在的碎片、受损细胞和双重细胞。使用LISI指数对校正过程前后的批效应进行校正和评估。共纳入47750个髓系细胞进行后续分析。通过使用定义良好的标志物进行手动注释,实现了细胞的精确分类。在8种癌症类型中,研究者鉴定了12种巨噬细胞和单核细胞亚型,4种经典树突状细胞(cDC)亚型和一组独特的肥大细胞(图1b-c)。研究者主要通过FOLR2和APOE的表达来区分三种巨噬细胞亚型。其他标志物也被增强,包括Macro_FOLR2-APOE+和Macro_FOLR2+APOE+中的APOC1和TREM2;Macro_FOLR2+APOE-中的SELENOP以及Macro_FOLR2+APOE+中的GPNMB、CCL18、CCL13、C1QC和C1QA(图1c)。基于LILRA4、GZMB和IL3RA的特异性表达,两个cDC簇从浆细胞样树突状细胞(pDC)簇中明显分离出来(图1c)。HLA-DQA1在两个cDC簇中均有表达,如前所述,cDC_CLEC9A簇的平均表达量更高。肥大细胞特异性标记物也仅在该细胞群中表达(图1c)。
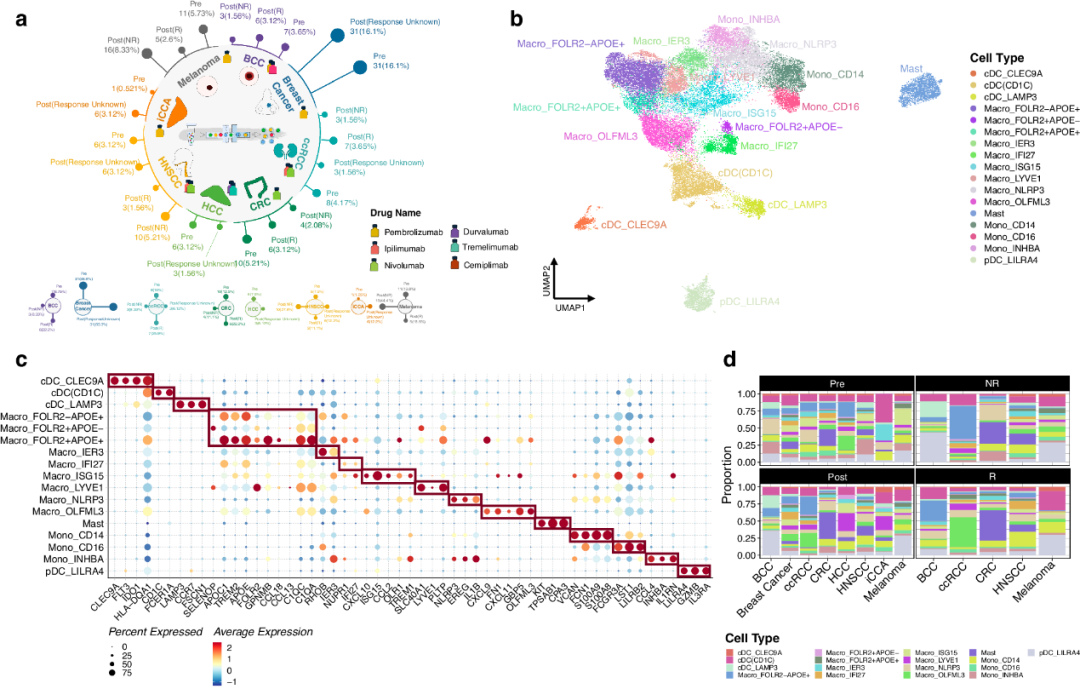
图1 泛癌髓系图谱的人口统计学概览
研究者进一步表征了这17种已鉴定的细胞类型的功能。Macro_APOC1+IFI27+、Macro_ISG15和Macro_OLFML3虽然高表达CXCL9和CXCL11,但功能上存在差异。Macro_APOC1+IFI27+主要参与GTPase激活蛋白结合,Macro_ISG15主要富集于细胞因子受体结合,Macro_OLFML3可能参与脂肪酸合酶活性。此外,在由FOLR2和APOE定义的三种巨噬细胞类型中,Macro_FOLR2−APOE+主要与“蛋白-脂复合物结合”相关,而Macro_FOLR2+APOE−和Macro_FOLR2+APOE+分别与“蛋白丝氨酸苏氨酸/酪氨酸激酶活性”和“磷脂酰肌醇结合”相关。考虑到M1/M2巨噬细胞的特征标记物,M1标记物主要富集于Macro_FOLR2+APOE+,M2标记物主要富集于Macro_LYVE1,而Macro_ISG15、Macro_NLRP3和Macro_FOLR2+APOE+两者均富集。相反,Macro_OLFML3、Macro_APOC1+IFI27+、Macro_FOLR2-APOE+和Macro_FOLR2+APOE-均未显示M1或M2标志物的富集。
研究者还利用Role指数分析了17种细胞类型在免疫检查点阻断(ICB)治疗应答者和无应答者之间的优先分布,发现Macro_ISG15(与干扰素相关),Macro_FOLR2+APOE+(高CXCL9表达)和cDC_CLEC9A(高IDO1表达)在应答组分布较多。令人惊讶的是,研究者观察到cDC(CD1C)和cDC3_LAMP3在无应答组分布较多。这表明尽管DC参与抗原呈递,但其丰度的增加可能代表抗肿瘤细胞毒性和免疫觉醒的增强。总之,上述分析突出了M1和M2分类在捕捉巨噬细胞异质性方面的局限性,强调需要一个更准确的分类系统,将巨噬细胞亚群的多样性和动态功能特征结合起来。
8种癌症类型的样本根据其治疗状态进行分类,包括未经治疗(Pre),治疗后(Post),治疗无应答(NR)和治疗应答(R)。随后,研究者比较了每对分组之间细胞类型的分布,以评估任何变化(图1d, e)。在Pre组中,cDC(CD1C)是iCCA和乳腺癌中存在的主要细胞类型。Macro_NLRP3在BCC和ccRCC中所占比例最大。在Post组中,pDC_LILRA4成为BCC和黑色素瘤的主要细胞类型,而Macro_LYVE1在HCC和iCCA中占主导地位(图1d)。值得注意的是,在治疗前和治疗后两组中,肥大细胞仍然是CRC的主要细胞类型。在四个分组中,肥大细胞始终是CRC的主要细胞类型(图1d)。治疗后,几种癌症类型的Macro_ISG15和Mono_INHBA的比例显著降低,而Macro_FOLR2−APOE+、Macro_APOC1+IFI27+、Macro_LYVE1和Macro_OLFML3的比例在Post组显著增加(图1d, e)。关于治疗的应答,在R组中,Macro_NLRP3和Mono_CD14的比例在许多癌症类型中显著增加,而在NR组中没有观察到明显的比例变化(图1d, e)。研究者还分析了免疫抑制子和免疫刺激子在各种细胞类型中的表达,发现Macro-FOLR2-APOE+表现出最小的免疫检查点基因表达。而Macro-FOLR2+APOE+显示出几种免疫抑制子和免疫刺激子的高表达水平,包括CTLA4和CD274(PD-L1)。
该分析总体上强调了不同癌症类型中TIM组成的显著差异,强调了这些细胞在不同癌症、治疗状态和应答组中的异质性。
治疗和应答状态与不同的TIM动态剖面有关
肿瘤微环境(TME)是一个复杂的环境,由多种细胞类型组成,这些细胞类型经历了连续的动态变化。为了研究TIM的时间变化和发育模式,研究者通过检查每种细胞类型的伪时间轨迹(一种分化进程的测量方法),在泛癌症水平上对TIM的动力学特征进行了全面分析。研究者比较了Pre和Post以及NR和R样本。相关分析显示免疫治疗后TME发生了明显的重构。细胞间相关性发生了显著变化,包括免疫治疗后Mono_CD14和Macro_NLRP3之间的相关性显著增加。接下来,研究者使用Slingshot来确定巨噬细胞/单核细胞和DC分化轨迹的拓扑异质性。免疫治疗后,在特定细胞类型的平均假时间中观察到明显的改变。Mono_CD14、Macro_NLRP3、Mono_CD16和Macro_IER3的平均假时间明显缩短,表明处理后分化程度较低。相反,pDC_LILRA4在免疫治疗后表现出明显的轨迹分化延迟(图2a, b)。同时,cDC(CD1C)、cDC_LAMP3、肥大细胞、Macro_LYVE1和Macro_FOLR2+APOE+在Pre和Post样本之间的平均伪时间变化最小(图2a, b)。与R组相比,Mono_CD14、Macro_IER3、Macro_NLRP3、Macro_ISG15和cDC_CLEC9A在NR组中表现出相当大的伪时间延迟。而在这些组中肥大细胞、Macro_IFI27和Macro_OLFML3没有检测到实质性的动态差异(图2b, c)。有趣的是,研究者观察到在R组与NR组中有较大动态变化的细胞类型比在Pre组与Post组中更多(图2a, b),这表明在不同的疾病状态下,稳态和非稳态分化之间存在潜在的过渡差异。值得注意的是,Macro_FOLR2+APOE+在R组中表现出加速的伪时间,与Macro_FOLR2-APOE+和Macro_FOLR2-APOE-形成鲜明对比,尽管只表达其中一种标记,但它们表现出相反的模式(图2a, b)。
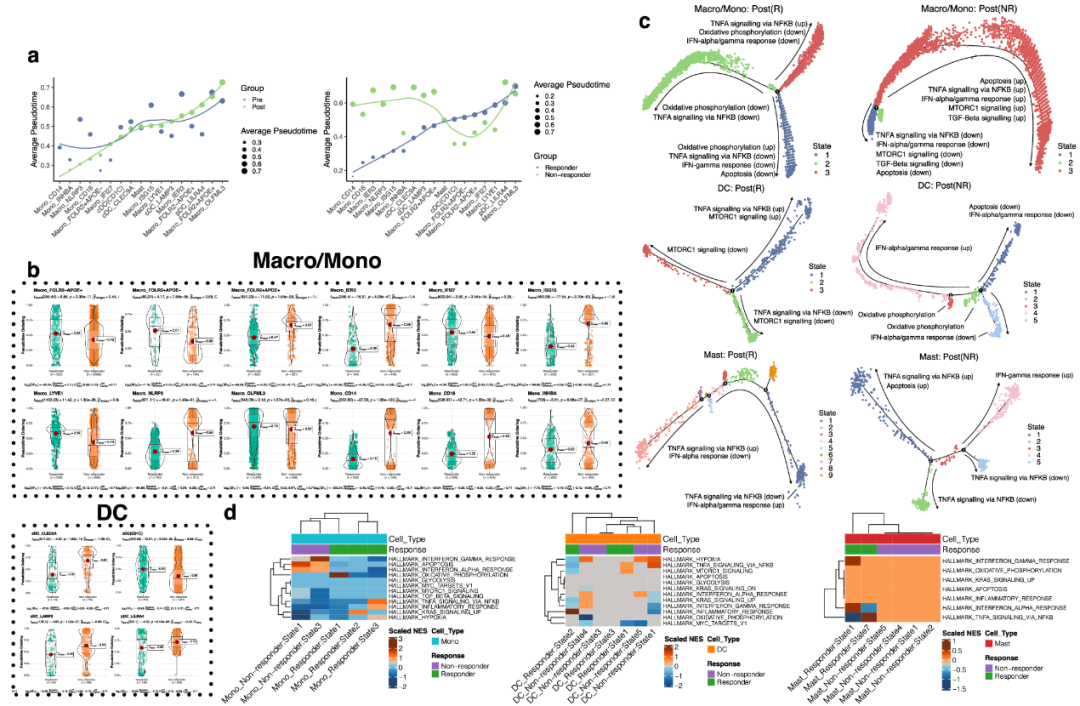
图2 TIM的伪时间转换
研究者的下一个目标是阐明分层疾病队列中流行的生物学状态。为了实现这一目标,研究者根据细胞的动力学状态对细胞进行了分类,并在这些聚类动力学谱中的差异表达基因与分子标签数据库(MSigDB)中的标志基因集之间建立了相关性。研究者观察到促炎或抗炎信号的明显分支(图2c, d)。在R组的巨噬细胞和单核细胞(Macro/Mono)群体中,大多数假时间状态表现出促炎途径的下调(图2c),如IFN-α/γ反应, NF-κb介导的TNF信号和氧化磷酸化(状态1和2),表明存在抗炎信号环境。然而,状态3表现出TNF信号的上调,这表明少数细胞仍然促进促炎信号传导(图2c, d)。相反,在Macro/Mono群体的NR组中,大多数细胞处于促炎状态(状态3),包括mTORC1信号传导升高的细胞。
同样,在DC亚群中,R组的两个状态(状态2和3)表现出抗炎特性,而状态1表现出促炎环境(图2c, d)。在状态1中,大多数细胞被鉴定为cDC(CD1C),一小部分细胞被鉴定为pDC_LILRA4。相反,在NR中,状态2和3观察到促炎氧化磷酸化。状态4显示IFN-α/γ反应上调(图2c, d),在状态1和状态5中下调(图2c, d)。促炎状态4主要由cDC(CD1C)和一小部分pDC_LILRA4组成,反映了R组的观察结果。同时,肥大细胞的动力学状态在R和NR组中显示出不同的簇(图2c, d)。在R组中,在状态簇中观察到抗炎和促炎信号的共同上调。然而,在NR组中,促炎(状态1和4)和抗炎状态簇(状态2和5)之间明显分离(图2c, d)。这些不同的动力学特征表明TME中TIM的可塑性,并表明它们在免疫治疗背景下作为促或抗致病细胞类型的潜在作用。
不同的TIM调节状态表征特定的癌症
随后,研究者分析了基因调控网络,以确定R和NR组TIM中的活性调控元件(RE)。通过评估每种细胞类型中转录因子(TF)的转录活性,研究者测量了不同癌症类型和反应状态中TIM之间的相关性。如图3a所示,来自同一癌症并表现出相同应答状态的细胞类型聚集在一起。研究者还观察到每个R组和NR组与其各自的癌症类型密切相关,这表明RE在TIM中具有较高的癌症特异性,与免疫治疗反应有关。然后,研究者确定了导致这种聚集现象的TF模块(图3b)。值得注意的是,在CRC应答者中,在Macro_FOLR2+APOE+、Macro_FOLR2+APOE-、Macro_APOC1+IFI27+、cDC(CD1C)、Macro_OLFML3和cDC_CLEC9A中观察到YBX1活性升高,而在CRC无应答者中,在Mono_CD14、Macro_NLRP3、Mono_INHBA、Macro_OLFML3和Macro_ISG15中,BCL3活性升高。有趣的是,鉴定的TF主要与巨噬细胞相关。例如,小鼠巨噬细胞中的YBX1缺失与组织损伤增强、肌成纤维细胞活化和纤维化有关。在各种肿瘤浸润性免疫细胞类别(包括Macro/Mono、DC和Mast类别)中,R组与NR组的MAFB活性持续下降(图3c)。先前发现MAFB促进经典TIM的炎症和脂质相关TIM的EMT。最后,在Macro/Mono和DC类别中,与NR组相比,促炎TF JUNB在R组中的活性较低(图3d)。
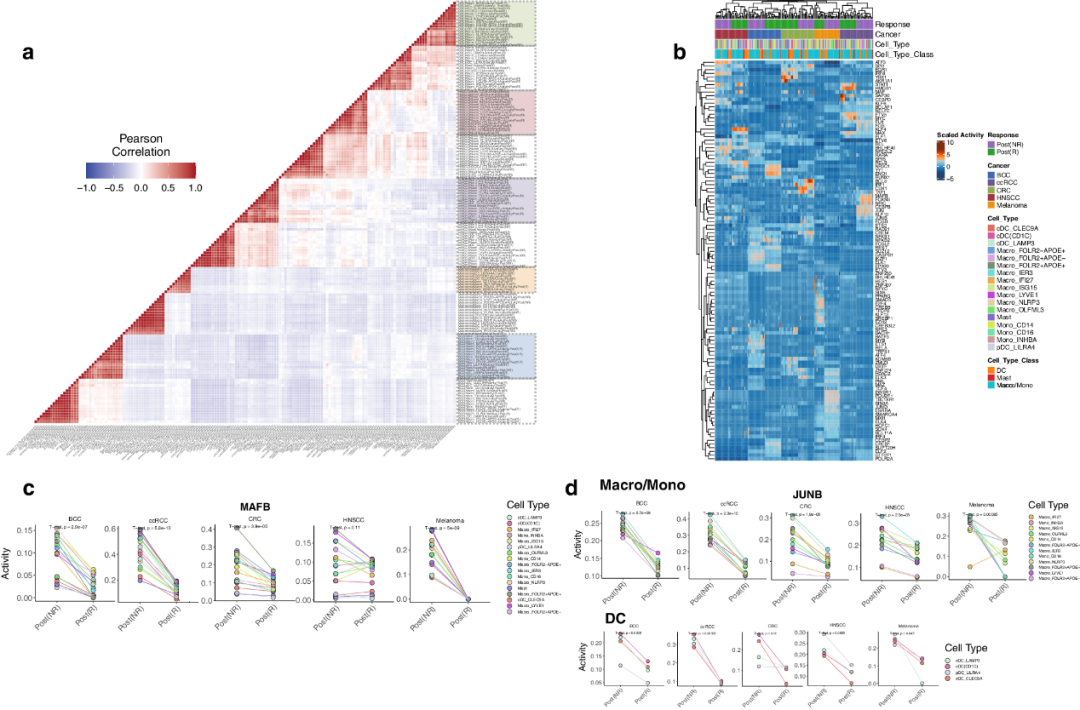
图3 细胞类型特异性调控活性景观
ICB反应中细胞-细胞相互作用的预期靶点
TME内细胞-细胞相互作用的复杂动力学不仅涉及TIM,还涉及其他免疫细胞群,特别是T细胞。研究者利用同一组收集的样本,调查了TIM之间的相互作用(图4a, b)以及TIM与CD4/CD8 T细胞之间的相互作用(图4c, d)。具体而言,研究者分析了治疗后样本中的272017个T细胞,并根据其独特的分子特征注释了12种CD4 T细胞亚型和15种CD8 T细胞亚型。
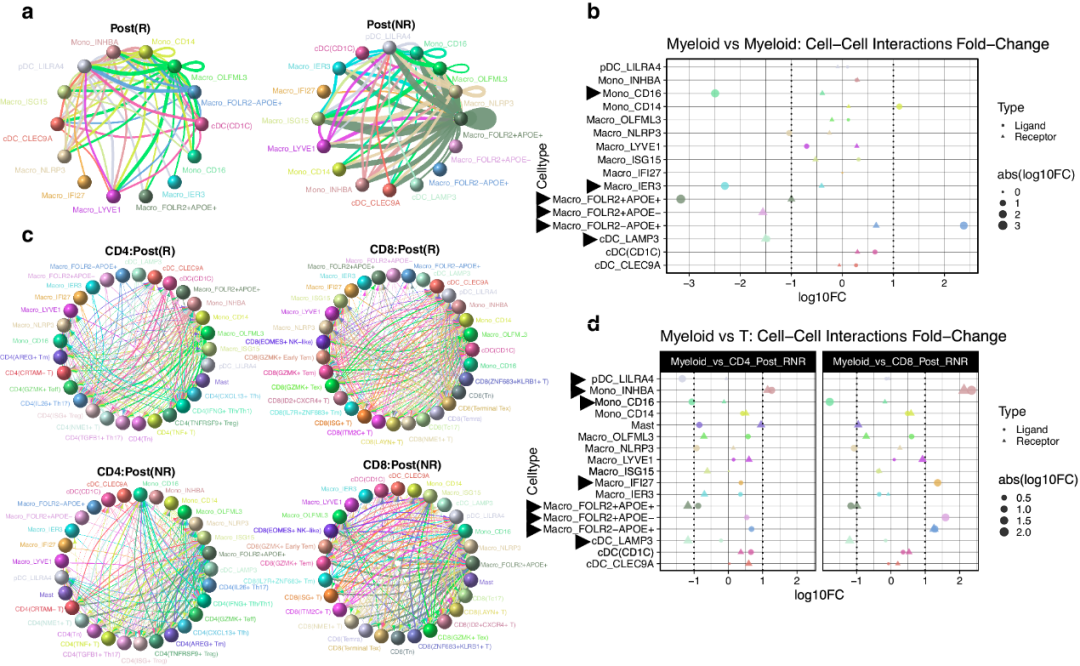
图4 不同应答组中不同细胞
在选择配体-受体相互作用时,研究者采用了严格的标准,考虑到每种样品条件下的总等级<0.01和细胞特异性相互作用频率超过总频率的第75个百分位数。如图4a、b所示,R组和NR组内TIM之间的相互作用存在明显差异。值得注意的是,在NR组中,Mono_CD16、Macro_IER3、Macro_FOLR2+APOE+、Macro_FOLR2+APOE-和cDC_LAMP3在所有细胞类型中都表现出更高的相互作用,而在R组中,Macro_FOLR2-APOE+与其他TIM配体相互作用倍数升高。此外,研究者经常观察到NR组特有的HLA-A/B/C与LILRA1/3相互作用对,表明在各种细胞类型中相互作用倍数变化增加。正如先前报道的那样,这种相互作用可能表明髓系细胞失活和免疫反应降低。
随后,作者研究了TIM与特定CD4/CD8 T细胞亚群之间的相互作用。与TIMs-to-TIMs相互作用相比,较少的髓系细胞类型在TIMs-to-CD4/CD8 T细胞相互作用中表现出大的倍数变化(绝对倍数变化>2)(图4c, d)。尽管如此,研究者观察到pDC_LILRA4与CD4 T细胞;Mono_CD16、Macro_IFI27、Macro_FOLR2+APOE-和Macro_FOLR2-APOE+与CD8 T细胞;以及Mono_INHBA、Macro_FOLR2+APOE+和cDC_LAMP3与CD4/CD8 T细胞的高度相互作用(图4d)。HLA-LAG3相互作用集群只存在于NR组pDC_LILRA4与CD4(IFNG+Tfh/Th1)和Mono_CD16与CD8(GZMK+Tex)、CD8(GZMK+Tem)和CD8(ISG+T)的配体相互作用中。研究者在NR组中观察到RPS19与C5AR1相互作用的独特存在,该相互作用先前已被证明通过产生免疫抑制因子如TGF-β来抑制抗肿瘤免疫反应。在NR组中,CD99与PILRA/CD81的相互作用也显著增加,CD99和CD81与肿瘤迁移、侵袭和转移增加有关,而PILRA传递与自然杀伤(NK)细胞和DC激活相关的抑制信号。尽管TIM与CD4 T细胞之间的相互作用研究较少,但可以推断它们在促肿瘤功能中的积极参与。研究者在NR组的cDC_LAMP3与CD4/CD8 T细胞的受体相互作用中发现了TNFRSF成员(即TNFSF10与TNFRSF11B和LTB与CD40)之间独特的相互作用。
在对R组中表现出更高倍数变化的细胞类型的分析中,研究者观察到Mono_INHBA、Macro_APOC1+IFI27+和Macro_FOLR2−APOE+与特定T细胞亚群的显著配体相互作用。值得注意的是,HLA与LAG3存在相互作用,主要与CD4(IFNG+Tfh/Th1)、CD8(GZMK+Tem)和CD8(Terminal Tex)细胞相互作用。此外,在Mono_INHBA受体与T细胞相互作用的R组中发现了RPS19与C5AR1的相互作用。这些相互作用对与应答状态相关的意义尚不清楚。然而,它们有望成为进一步研究TIM可塑性和两种应答组在髓系-T细胞相互作用中的潜在目标。
高度互动的TIM表现出癌症特异性的调节模式
为了全面了解免疫治疗背景下髓系细胞的转录调控谱,作者研究了R组和NR组之间表现出不同细胞间相互作用的细胞类型的调控模式。研究者的重点是高度交互TIM的TF标签。
研究者观察到不同的调控模块在特定细胞类型中的差异表达。例如,调节模块簇c9由pDC_LILRA4唯一表达,而c11和c3由cDC_LAMP3唯一表达。此外,几种不同的TF特异性调节相关的TIM反应等级(图5a)。在pDC_LILRA4的情况下,来自c3簇和c6簇的调控(不包括REST)由NR组唯一表达。相比之下,来自c12的ELF2、RARA和TAF1在R组中表现出独特的表达模式。其他区分R和NR组的独特特征主要在R组中发现,包括Macro_APOC1+IFI27+的c4簇和Mono_INHBA的c13簇。对于其他细胞类型,R和NR调节表达之间的特征差异由一个或多个TF标记,这些TF没有聚集在一个调节模块中。这些调节特征可能代表了负责相同TIM类型的R和NR组之间细胞相互作用变化的关键调节因子。除了调控子模块,在比较R组和NR组时,研究者进一步确定了不同癌症类型中以相同方向调控的常见TF(图5b)。值得注意的例子包括Macro_FOLR2+APOE+中的FOSB,cDC_LAMP3中的MAFF和SPI1,以及Macro_FOLR2-APOE+中的MAFB。
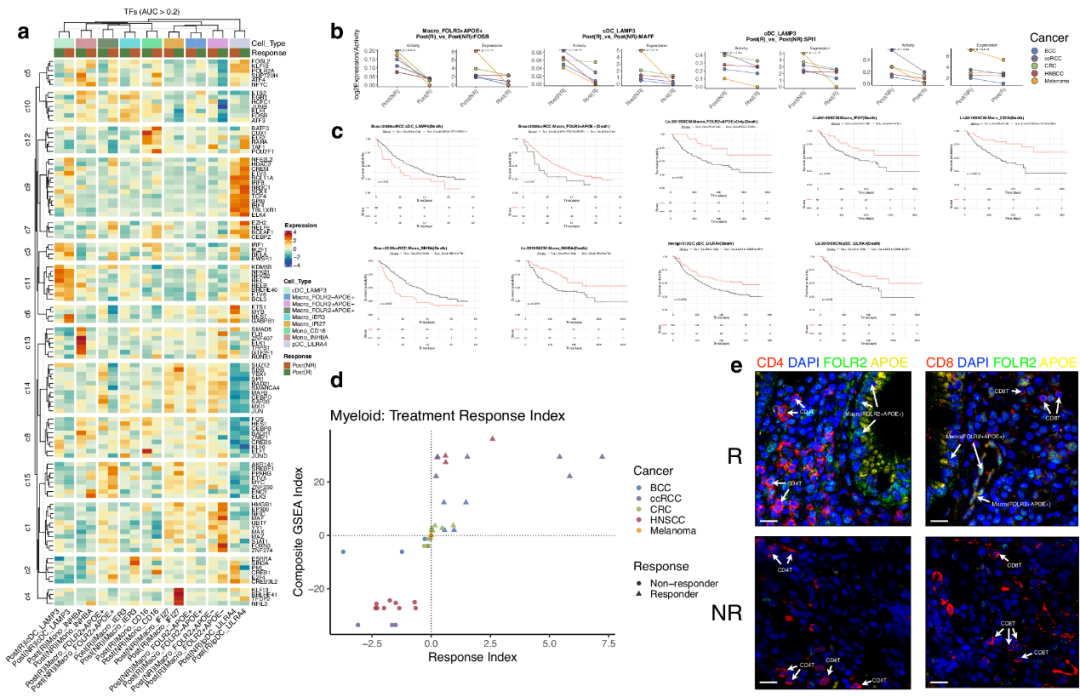
图5 高相互作用TIM的针对性分析
不同的TIM与不同癌症的存活率有关
为了评估个体分层细胞类型对患者预后的影响,研究者使用免疫治疗后的队列进行了生存分析,包括IMvigor210尿路上皮癌(UC)、ccRCC和皮肤黑色素瘤(SKCM)。根据高度互作的TIM的特征标志物的表达对患者进行分类。研究者的分层显示,cDC_LAMP3标志物的高表达与较低的生存率相关,而Macro_FOLR2+APOE-、pDC_LILRA4和Macro_APOC1+IFI27+标志物的高表达与改善的生存率相关(图5c)。这些标志物具有预测免疫治疗后生存结果的潜力。然而,某些细胞类型,包括Mono_INHBA,在不同的癌症类型中表现出相反的生存关系,强调了与生存结果相关的癌症特异性和巨噬细胞异质性(图5c)。
在确定HLA-A/B/C与LILRA1/3的显著相互作用后,主要是在NR队列的Mono_CD16细胞中,研究者旨在阐明这些相互作用的预测能力。为了实现这一目标,研究者评估了HLA-A/B/C、LILRA1、LILRA3、LILRB2和Mono_CD16标记物的集体表达,以量化这些因素对患者预后的累积影响。在UC和ccRCC队列中,表达Mono_CD16标记物的两组之间的生存结果差异不显著(考虑到LILRB2是Mono_CD16的标记物之一),然而,当考虑到HLA-A和/或LILRA1的额外表达时,高表达组在两个队列中表现出明显较低的生存率。相反,在SKCM队列中,这些标志物的高表达与更好的生存率相关。因此,尽管HLA-A/B/C和LILRA1/LILRA3/LILRB2通常在无应答的TIM中观察到,但它们与ICB后患者生存率的关联似乎是癌症特异性的。
建立应答指数和GSEA指数,准确判断治疗反应
随后,研究者利用每个R组中每种TIM细胞类型中最高上调的差异表达基因(DEG)进行了基因本体(GO)通路分析,以揭示与治疗应答相关的潜在变化。结果显示R组和NR组之间存在明显的免疫相关途径差异。在R组中,Macro_FOLR2+APOE+参与了NK介导的免疫应答;Mono_CD16负调控促肿瘤NF-κB活性,上调巨噬细胞耐受诱导,保护宿主免受炎症介质的慢性暴露;Mono_INHBA能正向调节IL-4和IL-1α的产生,两者共同引发抗肿瘤Th9细胞分化。相反,在NR组中,Macro_FOLR2-APOE+、Macro_FOLR2+APOE-和Macro_APOC1+IFI27+与凋亡细胞清除相关,Macro_IER3参与调节抗肿瘤IL-15和IL-12的产生。识别和理解个体TIM在不同反应条件下的作用,有助于针对有害因素改善R组内的状况。
研究者下一步的目标是开发一个专门设计的指数来预测对ICB治疗的应答。该指数基于不同应答条件下每种细胞类型的富集通路以及每种癌症类型在这些条件下每种细胞类型的比例。为了构建索引,研究者在MSigDB标签类别中进行了广泛的基因集富集分析(GSEA),包括每个分组中不同癌症的所有细胞类型。这使我们能够识别每种细胞类型的癌症特异性和应答特异性特征。通过考虑细胞类型的癌症特异性比例和识别的特征的富集分数,研究者创建了一个治疗应答指数,在指数=0时明确区分ICB应答者和无应答者(图5d)。在某些癌症类型中,如HNSCC和CRC,在阴性和阳性应答指数上分别观察到不同的无反应群、既有反应群和无反应群。然而,其他癌症类型的应答指数分布广泛,表明治疗反应的异质性更大。值得注意的是,由于缺乏确定的黑色素瘤特异性特征,基于应答指数的分离在黑色素瘤中是不可能的。这突出了在评估治疗应答和不同癌症类型的应答指数的可变预测性能时考虑癌症特异性特征的重要性。
Macro_FOLR2+APOE+细胞在ICB应答的CRC患者中更为丰富
肿瘤中FOLR2+巨噬细胞的密度与乳腺癌和HCC患者的生存率相关;因此,研究者观察到Macro_FOLR2+APOE+的重要作用及其与T细胞的相互作用是值得注意的。为了证实免疫治疗领域内细胞类型组成的改变,研究者利用从ICB应答和无应答的CRC患者中获得的样本进行了免疫荧光分析。结果显示,与无应答者相比,应答者中Macro_FOLR2+APOE+细胞的丰度更高(图5e)。研究者还观察到在Macro_FOLR2+APOE+细胞附近存在CD4和CD8 T细胞。相反,研究者没有在无应答者中检测到任何Macro_FOLR2+APOE+细胞,这表明这些细胞与治疗应答之间存在正相关。此外,为了确认与髓系细胞相关的关键标志物在泛癌新辅助免疫治疗前后的变化,研究者收集了HNSC和CRC的免疫治疗应答和无应答样本。选择测序结果中治疗后表达水平升高的6个标记物进行单通道免疫荧光染色,包括ISG15(巨噬细胞)、NLRP3(巨噬细胞)、IER3(巨噬细胞)、CD14(单核细胞)、CD16(单核细胞)和LAMP3(DC)。通过免疫荧光染色体验证与这三种髓系细胞相关的结论,证实多组学测序分析的结果:Macro_ISG15、Macro_NLRP3、Macro_IER3、Mono_CD14、Mono_CD16和cDC_LAMP3在应答患者肿瘤组织中的表达水平升高,这些生物标志物可能是泛癌免疫治疗的应答机制之一,也可能为临床监测和疗效预测提供依据。研究者将继续收集更多类型的样品进行验证。这些发现与研究者的整体泛癌结果一致,并强调了这种巨噬细胞亚型在肿瘤预后中的重要性。
讨论与结论
研究者整合了来自不同癌症类型的表达谱,旨在揭示细胞变异性和治疗反应的共同模式。利用伪时间分析,研究观察到TIM的动力学特征发生了显著的动态变化,这取决于治疗方案,并在对ICB治疗有应答和无应答之间表现出差异。此外,研究揭示了在不同应答组中,TIM的细胞内相互作用及其与T细胞的相互作用存在实质性差异。确定了与应答状态复杂相关的特定受体配体对,揭示了与治疗应答独特相关的潜在治疗靶点。还在TIM、应答组和特定癌症类型中发现了常见和独特的转录因子特征,这些特征为未来研究揭示它们对ICB反应的影响提供了基础。
今日评语
Nat Commun这项研究通过分析泛癌单细胞表达谱,阐明了TIM的异质性,并提高了对肿瘤免疫治疗背景下组织特异性和癌症特异性骨髓亚群的理解。针对ICB的应答,研究提出了新的生物标志物,有望用于疗效预测。
致谢
浙江大学公共卫生学院 曹湘韩
对以上文章解读做出的贡献
题图来源于网络
【参考文献】
Li W, Pan L, Hong W, Ginhoux F, Zhang X, Xiao C, Li X. A single-cell pan-cancer analysis to show the variability of tumor-infiltrating myeloid cells in immune checkpoint blockade. Nat Commun. 2024 Jul 21; 15 (1): 6142. doi: 10.1038/s41467-024-50478-8. PMID: 39034339; PMCID: PMC11271490.
免责声明:本平台旨在分享最新科研资讯,所载内容和意见仅供专业人士参考,不构成任何诊疗建议。在任何情况下,作者及作者所在团队不对任何人因使用本平台中的任何内容所致的任何损失负任何责任。本资料难以设置访问权限,若给您造成不便,还请见谅。若有转载需求,请请在公众号后台留言。
特别声明: 本文属于医学专业文章,仅供医疗专业人员学术交流。不适合作为非专业人士疾病教育或科普用途。
排版编辑:肿瘤资讯-Lisa转载











 苏公网安备32059002004080号
苏公网安备32059002004080号


