(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
间接比较GEOMETRY mono-1试验中卡马替尼治疗与标准治疗在METex14跳跃突变的德国局部晚期或转移性非小细胞肺癌患者中的效果[1]
Indirect comparison of capmatinib treatment from GEOMETRY mono-1 trial to SOC in German patients with locally advanced or metastatic NSCLC harboring METex14 skipping mutations.
Anna Kron, et al. (通讯作者:Anna Kron)
Eur J Cancer
IF = 8.4
背景:本研究分析了选择性MET抑制剂卡马替尼与2018年SOC在德国常规治疗的的一线和二线METex 14跳跃突变非小细胞肺癌(NSCLC)患者中的比较证据。
方法:通过回顾性病历审查,从德国常规治疗中收集SOC数据。在GEOMETRY mono-1试验中,对未经治疗和倾向评分校正(PSA)后的患者与接受过卡马替尼治疗的患者进行了比较分析。有效性终点包括总生存期(OS)、无进展生存期(PFS)、总缓解率(ORR)、至CNS进展时间(CNSprog)和探索性安全性终点。
结果:SOC组包含119例1L患者和46例2L患者,而接受卡马替尼治疗的1L和2L患者分别有60例和81例,PSA后基线特征平衡。在1L治疗中,未调整比较显示,与SOC相比,卡马替尼对OS具有显著获益(中位数:25.49个月vs. 14.59个月;HR 0.58;95% CI 0.39-0.87;P=0.011)、PFS(中位数:12.45个月vs. 5.03个月;HR:0.44;95% CI:0.31-0.63;P<0.001)和ORR(事件发生率:68.3% vs. 26.9%;RR 2.54;95% CI 1.80-3.58;P<0.001)方面有显著获益。在2L治疗中,OS、PFS和ORR显示出卡马替尼优于SOC的积极趋势。1L和2L卡马替尼治疗在CNSprog方面带来了显著获益。PSA分析显示与未调整分析一致的结果。探索性安全性终点表明,卡马替尼安全性可控。
结论:本研究展示了卡马替尼为METex14跳跃突变的NSCLC患者提供了强有力的临床获益,以及其在预防脑转移发展方面具有显著作用。
点评专家
北京大学肿瘤医院胸部肿瘤内科
中国协和医科大学临床医学博士、生化与分子生物学博士
中国抗癌协会肿瘤精准治疗专业委员会青年委员会委员
北京医学奖励基金会肺癌专业青年委员会副秘书长
中国老年学学会老年肿瘤专业委员会执行委员会委员
中国人体健康科技促进会肿瘤化疗专委会常委
北京肿瘤病理精准诊断研究会青委会常委
人民卫生出版社《肿瘤综合治疗电子杂志》编委
中山大学肿瘤防治中心《癌症》杂志编委
《Frontiers in Oncology》审稿编委
美国MD 安德森癌症中心访问学者
大约1-3%的晚期非小细胞肺癌患者中检测到METex14跳跃突变[2],与预后不良有关,在无靶向治疗的时代化疗疗效非常有限,一线治疗客观缓解率(ORR)仅26.4%,无进展生存期(PFS)约8.5个月,二线治疗ORR仅6.8%[3]。随着更具针对性的分子靶向药物相继出现,卡马替尼的问世为METex14跳跃突变患者迎来了新希望。因此,卡马替尼作为FDA批准的首个获批且加速获批的MET-TKI,经历了长期研发与临床验证后,无论是注册研究还是真实世界都拥有丰富的数据,这篇文章更加补充了卡马替尼与其他治疗策略进行间接比较的证据。
卡马替尼是一种口服、ATP竞争性、高亲和力和高选择性的MET抑制剂。卡马替尼在全球范围内的获批依据的是一项国际多中心II期临床研究GeoMETry mono-1[4],该研究在 25 个国家的 152 个中心进行,根据既往治疗线和 MET 状态(MET 扩增和/或 METex14 突变)将患者分配到队列,并每天两次接受 400 mg卡马替尼。研究结果显示对于MET ex14跳突初治患者(队列5b和7,n=60)接受卡马替尼治疗ORR为68.3%,DCR为98.3%,中位PFS达12.5个月,中位OS达25.5个月,是目前唯一一款中位OS超过两年的MET抑制剂。无论从短期病灶缓解到长期生存获益,卡马替尼都展现出了令人惊艳的疗效。GEOMETRY -C[5]队列1结果显示,在可评估集中, INV评估ORR达69.2%,疾病控制率为100%,疗效与全球人群的数据一致。此外中国人群中所有级别不良事件及3-4级AE发生率均低于全球人群。6月12日卡马替尼已正式获NMPA批准,用于未经系统治疗的METex14突变的局部晚期或转移性非小细胞肺癌成人患者。
本篇文献分享的RECAP 研究是一项回顾性研究,旨在比较德国临床诊疗中使用卡马替尼与其他疗法的间接比较疗效结果,数据来源是 GEOMETRY mono-1 试验中接受卡马替尼治疗的患者与在德国国家基因组医学网络(nNGM,national Network Genomic Medicine)中记录的 自2018 年至 2020 年期间接受分子诊断确定为MET ex14 突变且未接受卡马替尼的治疗的患者。未调整分析结果显示,与SOC相比一线治疗使用卡马替尼的患者的中位OS、PFS及ORR方面均具有显著获益。倾向性得分加权分析后结果获益结果一致,本研究再一次验证卡马替尼治疗MET ex14 突变人群的显著疗效。
卡马替尼整体安全性良好,不良反应发生率低,严重程度低,且消退快。在亚洲人群中3/4级治疗相关不良事件(TRAEs)的发生率仅为20%,且无致死性TRAE。没有因不良事件导致患者停药。对于目前MET抑制剂常见的不良反应,卡马替尼的水肿发生率显著低于其他MET抑制剂,亚洲人群中治疗相关所有级别水肿发生率仅为26.7%,且无3/4级发生[4-5]。
本文还批露了卡马替尼治疗期间患者未发生中枢神经系统进展事件,没有患者出现新的症状性脑转移。卡马替尼作为高选择MET抑制剂,可有效穿过血脑屏障,在脑转移患者中也显示出初步疗效GEOMETRY -C结果披露,在脑转移患者中观察到颅内病灶的完全缓解率(iCR)达50%,颅内疾病控制率(iDCR)高达100%。GEOMETRY mono-1结果也显示,基于BIRC评估的iORR和iDCR分别为54%(7/13)和92.3%(12/13)。此外卡马替尼还开启了首个肺癌MET ex14跳突肺癌患者围手术期靶向治疗的研究探索,探究卡马替尼用于早期 NSCLC辅助/新辅助治疗疗效。
卡马替尼在中国的获批为晚期MET14ex跳突NSCLC患者一线治疗提供了新的治疗希望,我们期待卡马替尼能够在更广泛的患者群体中得到应用,并进一步验证其疗效和安全性。也希望能有更多的研究探索卡马替尼与其他治疗手段的联合应用,以期为患者带来更深层次的个体化治疗策略。
BRAF突变NSCLC的治疗策略[6]
Therapeutic strategies for BRAF mutation in non-small cell lung cancer: a review
Megha Puri, et al.(通讯作者:Megha Puri)
Front. Oncol.
IF = 5.738
肺癌是导致癌症相关死亡的主要原因。在两种广泛的肺癌类型中,非小细胞肺癌占比约85%。对基因变异的研究促进了靶向治疗的发展。一些重要的治疗靶点包括Kirsten大鼠肉瘤病毒癌基因(KRAS)、表皮生长因子受体(EGFR)、V-RAF小鼠肉瘤病毒癌基因同源物B(BRAF)和间变淋巴瘤激酶基因(ALK)。在众多正在进行的临床试验背景下,定期回顾进展和新药疗法至关重要。在所有突变中,BRAF突变较为常见,总体发病率为8%,在NSCLC中为1.5%至4%。在这里,我们总结了BRAF突变类型,并回顾了针对V600和非V600组的各种治疗方法;BRAF抑制剂的耐药机制及其克服策略;全面分析共存突变的重要性,以及免疫检查点抑制剂在BRAF突变NSCLC中的作用。我们还纳入了目前正在进行的临床试验和近期的进展,包括联合疗法,这些将有助于改善NSCLC的总体生存率和治疗结果。
点评专家
重庆医科大学附属第一医院
日本千叶癌症中心访问学者
重庆英才名家名师
中华预防医学会呼吸疾病预防与控制专委会委员
中华医学会呼吸分会肺血管病学组委员
中国控烟协会呼吸专委会常委
重庆市医院协会血栓与止血专委会主任委员
重庆市抗癌协会肺癌专委会副主任委员
重庆市医学会肿瘤MDT专委会委员
重庆市医学会精准医疗与分子诊断专委会委员
先后完成国自然、重庆市科委等课题, SCI 25篇
本篇综述就NSCLC BRAF突变的治疗策略进行了探讨。从BRAF突变的机制、靶向药物的治疗、BRAF抑制剂的耐药机制、共突变、免疫治疗疗效以及新进展和未来展望等方面全面地阐述了BRAF突变NSCLC的诊疗全貌,希望能为临床医生带来更多思考与启发。
BRAF突变作为一种肿瘤的驱动基因,在所有人类肿瘤中的发生率约为8%,而在NSCLC中的发生率约为1.5%-4%。BRAF突变分为3类,I类突变是包括BRAF V600(E/K/D/R等)在内的突变,其中以BRAF V600E在临床中最为常见,约占所有BRAF突变类型的30%-50%[7]。国内外已上市的针对BRAF的抑制剂包括索拉非尼、维莫非尼、达拉非尼、恩考非尼,针对MEK的抑制剂包括曲美替尼、考比替尼和比美替尼,BRAF抑制剂和MEK抑制剂的联合使用,能够同时阻断MAPK通路上下游,更有效地切断了调控肿瘤生长的信号通路,相较于单药达到更优的疗效。在达拉非尼(Dab)联合曲美替尼(Tram)的多队列、多中心、非随机、开放性Ⅱ期注册研究BRF113928中,Dab+Tram一线治疗BRAF V600突变晚期NSCLC患者,ORR 达到了64%,中位PFS达到14.6个月,中位OS长达24.6个月,5年OS率达到了22%,经治队列5年OS率也能达到19%,这意味着约五分之一的患者可以从达拉非尼联合曲美替尼的治疗中获得长生存获益[8-9]。而中国的注册临床研究结果显示,在一线或后线接受Dab+Tram治疗的20例中国NSCLC患者中,独立中心评估和研究者评估的整体人群ORR均高达75%,且安全性上,中国人群的发热发生率低于全球注册研究中的发热发生率[10]。基于以上研究数据,NCCN、ESMO和CSCO指南均将Dab+Tram作为晚期BRAF V600突变NSCLC一线首选方案推荐。
尽管BRAF和MEK抑制剂为晚期NSCLC患者带来长期生存获益,但随着疾病的进展,耐药总是不可避免会发生。MAPK通路的再激活似乎是耐药的主要原因,包括BRAF剪接变异、BRAF扩增、RAS突变等。对于使用BRAF/MEK抑制剂耐药的NSCLC患者,推荐耐药后再次活检进行NGS检测,进一步明确耐药机制以指导后续治疗。此外,综述中也提到,在BRAF突变的NSCLC中,共存突变率的范围从14.3%到30.2%不等,远高于其他驱动突变的共存突变率(5%),其中TP53是最常见的共存突变,与BRAF共存的其他突变有EGFR、PI3KA、KRAS、ALK融合、c-MET扩增、MSH2突变、AXIN2突变等。2020年ASCO大会上的一项研究发现,Dab+Tram对于BRAF V600E突变合并多种共突变(如IDH1、KRAS G13C、PIK3CA等)同样显示疗效,这些患者一旦获得缓解,PFS最高可达58.1个月[11]。
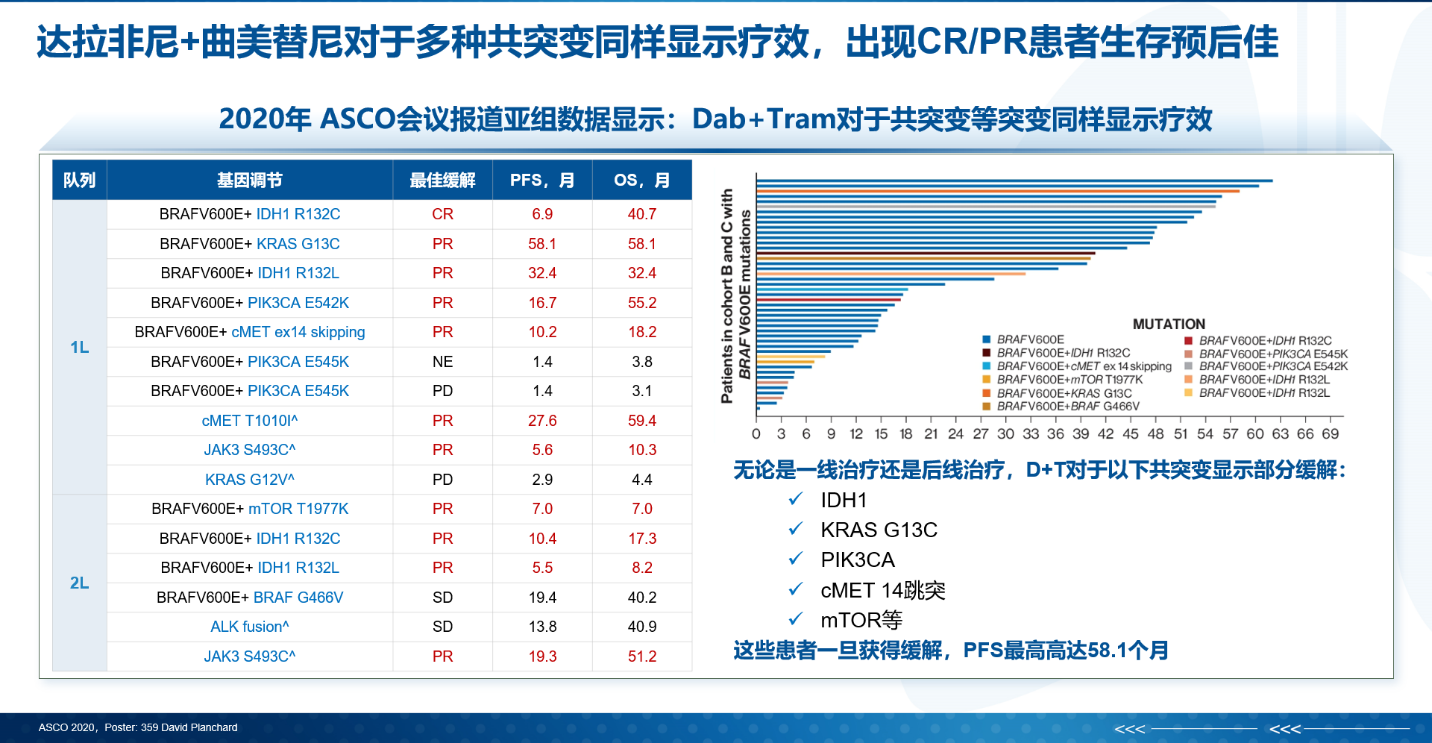
图1 达拉非尼+曲美替尼对BRAF V600E合并多种共突变同样显示疗效
针对BRAF突变的肿瘤,目前临床上还有多种药物正在研发中,如恩考非尼+比美替尼、LXH254 (BRAF抑制剂)+ LTT462 (ERK½抑制剂)、Lifirafenib(新型RAF激酶和EGFR抑制剂)、HM95573(RAF抑制剂)等靶向药治疗BRAF突变实体瘤的各项临床研究还在进行中,未来在临床上,我们将会有更多针对BRAF靶点的药物可及,不管是BRAF V600还是非V600突变的患者,生存都能得到进一步的延长。
总之,针对BRAF突变肿瘤的探索还在不断进行中,在当下的临床实践中,一线应优先选择达拉非尼联合曲美替尼,尽可能地延长BRAF V600突变晚期NSCLC患者的PFS,耐药后需关注再活检及测序,厘清耐药机制,制定患者的全程管理策略,才能最大程度的延长患者的生存。
过去二十年的肺癌治疗进展[12]
Lung cancer treatment: 20 years of progress.
The Lancet
Lancet
IF = 168.9
直至2000年,肺癌都还是一种高度致命的疾病,其治疗选择极为有限,只有铂类化疗可用,导致晚期疾病患者的年生存率仅为33%。2003年首个突破性的EGFR靶向药物获批,以及2004年在EGFR基因上发现特定的体细胞驱动突变,这些发现显著改善了患者治疗结果。这一发现激发了对肺癌中其他驱动基因突变的探索,接下来的20年为患者带来了难以置信的进步。例如,在美国,晚期非小细胞肺癌患者的中位总生存期从靶向治疗前的8-10个月左右增加到50个月以上。对肺癌患者的生物标志物检测已成为肿瘤管理中的重要组成部分(到目前为止,已有九种针对肿瘤突变的治疗方法获得了美国食品药品监督管理局(FDA)的批准)。这一进展持续至今,两项研究——CROWN和LAURA试验——在2024年美国临床肿瘤学会(ASCO)年会上的发表,为难治性转移性肿瘤患者带来了重要的突破。
Pan-RAF-MEK非降解分子胶NST-628是RAS-MAPK通路的有效和脑渗透性抑制剂,在多种RAS和RAF驱动的癌症中具有活性[13]
The Pan-RAF-MEK Nondegrading Molecular Glue NST-628 Is a Potent and Brain-Penetrant Inhibitor of the RAS-MAPK Pathway with Activity across Diverse RAS- and RAF-Driven Cancers.
Meagan B Ryan, et al.(通讯作者:Meagan B Ryan, Bradley Quade)
Cancer discovery
IF =7.9
RAS-MAPK信号通路变异在多种实体瘤中很常见,并且是许多癌症的驱动因素。NST-628是一种强效的泛RAF-MEK分子胶,它阻止了RAF对MEK的磷酸化和激活,克服了传统RAS-MAPK抑制剂的局限性,导致对该通路的深度持久抑制。对RAF-MEK复合物的细胞、生化和结构分析表明,NST-628能够与所有RAF的亚型结合,并阻止BRAF-CRAF异二聚体的形成,这是一种与所有现有RAF抑制剂不同的机制。NST-628对RAF-MEK信号复合物具有强效持久抑制以及在大脑中的高内在渗透性,在包含多种MAPK通路变异的细胞和患者源性肿瘤模型中显示出广泛的疗效,包括原位颅内模型。鉴于其功能和药代动力学机制与以往疗法不同,NST-628有望在未满足的患者需求领域产生临床影响。本研究介绍了NST-628,一种具有不同机制和药物样属性的分子胶。NST-628治疗在多个RAS和RAF驱动的肿瘤模型中具有广泛的疗效、高耐受性和中枢神经系统活性。NST-628有潜力作为单一疗法和垂直组合锚点,提供变革性的临床获益。
BRAF抑制剂达拉非尼在人转移性黑色素瘤细胞2D和3D细胞培养模型中作用的比较分析[14]
Comparative Analysis of the Effect of the BRAF Inhibitor Dabrafenib in 2D and 3D Cell Culture Models of Human Metastatic Melanoma Cells
David Tovar-Parra, et al.(通讯作者:David Tovar-Parra)
In Vivo
IF = 2.3
背景/目的:黑色素瘤是一种皮肤癌的变体,在所有皮肤癌中死亡率最高。尽管靶向治疗、免疫疗法和组织培养技术取得了进展,但缺乏有效的早期治疗模型仍然是一个挑战。本研究调查了达拉非尼对具有不同分子特征的2D和3D细胞培养模型的影响。
材料与方法:我们开发了一个高通量工作流程,使得可以在球状体上进行药物筛选。我们的方法包括培养来自正常黑色素细胞和转移性黑色素瘤细胞的2D和3D培养物,用达拉非尼处理它们,并进行活性、聚集、迁移、细胞周期和凋亡检测。
结果:达拉非尼在多方面产生了影响,特别是在10和25 μM浓度下对迁移的影响。它诱导细胞活力降低,阻碍了细胞对基质的粘附,抑制了细胞聚集和球状体形成,使细胞周期阻滞在G1阶段,并诱导细胞凋亡。
结论:这些结果证实了达拉非尼治疗携带BRAF V600E突变黑色素瘤的治疗潜力,并证实3D模型是研究新分子治疗潜力的有效模型。此外,我们的研究强调了3D模型在模拟生理体内微环境的相关性,为正常细胞和肿瘤细胞之间的不同治疗反应提供了见解。
1. Anna Kron,et al.Indirect comparison of capmatinib treatment from GEOMETRY mono-1 trial to SOC in German patients with locally advanced or metastatic NSCLC harboring METex14 skipping mutations .Eur J Cancer. 2024 Aug:207:114158.
2. Gow CH, Hsieh MS, Wu SG, Shih JY. A comprehensive analysis of clinical outcomes in lung cancer patients harboring a MET exon 14 skipping mutation compared to other driver mutations in an East Asian population. Lung Cancer. 2017;103:82-89.
3. Hotta K, Fujiwara Y, Matsuo K, et al. Time to progression as a surrogate marker for overall survival in patients with advanced non-small cell lung cancer. J Thorac Oncol. 2009;4(3):311-317.
4. Wolf J, et al. Capmatinib in MET exon 14-mutated, advanced NSCLC: Updated results from the GEOMETRY mono-1 study. J Clin Oncol, 2021, 39(15_suppl): abstract 9020.
5. Y-L. W, J. Zhao, J. Hu, J. et al. Capmatinib in Chinese adults with EGFR wt, ALK rearrangement negative (ALK-R−), MET exon 14 skipping mutation (METex14), advanced NSCLC: Results from the phase II GEOMETRY-C study.2022 ESMO Asia abstract 388P.
6. Puri M, Gawri K, Dawar R. Therapeutic strategies for BRAF mutation in non-small cell lung cancer: a review. Front Oncol. 2023;13:1141876.
7. Villaruz LC, Socinski MA, Abberbock S, et al. Clinicopathologic features and outcomes of patients with lung adenocarcinomas harboring BRAF mutations in the Lung Cancer Mutation Consortium. Cancer. 2015;121(3):448-56.
8. Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017;18(10):1307-1316.
9. Planchard D, Besse B, Groen HJM, et al. Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022;17(1):103-115.
10. Fan Yun, et al. Safety and efficacy of dabrafenib plus trametinib in Chinese patients with BRAF V600E mutation-positive metastatic NSCLC. 2022 WCLC, EP08.02-052
11. Planchard, D, et al. The updated overall survival and genomic analysis from a single-arm phase 2 study of dabrafenib plus trametinib in patients with BRAF V600E mutant metastatic non-small cell lung cancer. 2020 ASCO,Poster: 359
12. The Lancet. Lung cancer treatment: 20 years of progress. Lancet. 2024 Jun 22;403(10445):2663.
13. Ryan MB, Quade B, Schenk N, et al. The Pan-RAF-MEK Nondegrading Molecular Glue NST-628 Is a Potent and Brain-Penetrant Inhibitor of the RAS-MAPK Pathway with Activity across Diverse RAS- and RAF-Driven Cancers. Cancer Discov. 2024 Jul 1;14(7):1190-1205.
14. Tovar-Parra D, Zammit-Mangion M. Comparative Analysis of the Effect of the BRAF Inhibitor Dabrafenib in 2D and 3D Cell Culture Models of Human Metastatic Melanoma Cells. In Vivo. 2024;38(4):1579-1593.
审批码TAB0029912-70814,有效期为2024-08-22至2025-08-21,资料过期,视同作废。
排版编辑:winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


