抗体药物偶联物(ADC)、双特异性T细胞衔接器(BTE)和嵌合抗原受体T细胞(CAR-T)疗法等新型靶向免疫疗法彻底改变了多发性骨髓瘤(MM)的治疗。《多发性骨髓瘤免疫治疗的现状及研究进展(上篇)》讨论了目前可用或在研的针对MM患者的靶向B细胞成熟抗原(BCMA)、G蛋白偶联受体家族C组5成员D(GPRC5D)和类Fc受体蛋白5(FcRL5)的各种免疫治疗方法及其相关研究进展。本文将介绍MM患者对此类疗法产生耐药的主要机制,并讨论克服这些机制和改善患者预后的潜在策略。
MM新型免疫治疗的耐药机制
原发性耐药和治疗反应持续时间有限对MM相关免疫治疗的疗效构成了重大挑战。该部分总结了与这些靶向T细胞重定向免疫治疗方法相关的逃逸机制(图1)[10]。
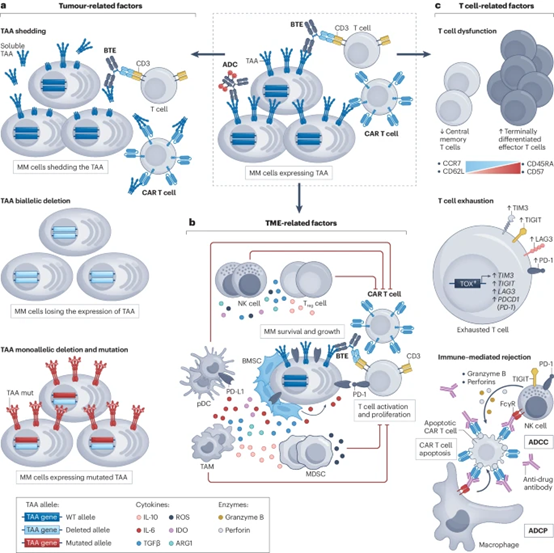
图1. MM新型免疫治疗的耐药机制
与靶向MM细胞上表达的肿瘤相关抗原(TAA)的ADC、CAR-T细胞和BTE相关的各种逃逸机制示意图。a、与耐药相关的肿瘤相关因素,包括TAA从细胞表面脱落和TAA编码基因的丢失或突变。b、肿瘤微环境(TME)相关因子,主要是免疫介导的T细胞活性抑制。c、导致耐药的T细胞相关因素,包括T细胞功能障碍和/或耗竭以及CAR结构中针对非自身序列的免疫应答导致的CAR-T细胞排斥。ADCC,抗体依赖性细胞介导的细胞毒性:ADCP,抗体依赖性细胞吞作用:ARG1,精氨酸酶1;BMSC,骨髓基质细胞;CCR7,CC基序趋化因子受体7;ID0,胺2.3-双加酶;LAG3,淋巴细胞活化基3蛋白;MDSC,髓源性抑制细胞;NK,自然杀伤细胞;pDC,浆细胞样树突状细胞;ROS,活性;TAM,肿瘤相关巨噬细胞;TGF,转化生长因子-B;TIGIT,具有免疫球蛋白和ITIM结构域的T细胞免疫受体;TIM3,T细胞免疫球蛋白粘蛋白受体3(也称为HAVCR2);TOX,胸腺细胞选择相关高迁移率族蛋白;Treg,调节性T细胞;WT,野生型。
T细胞相关的耐药原因
CAR-T细胞和BTE在MM患者中的疗效与T细胞的健康状况密切相关[11,12]。CAR-T细胞疗效依赖于其在体内扩增能力和持久性。为了增强CAR-T细胞的功能性和持久性,多种策略在临床前模型中进行评估。例如,通过破坏组蛋白甲基转移酶(如SUV39H1)来平衡CAR-T细胞的功能和持久性,或通过CRISPR-Cas9基因编辑将CAR序列引入内源性T细胞受体(TCR)α常数(TRAC)位点,以减少基础信号传导和延迟T细胞耗竭。有研究正在评估CAR-T治疗新诊断MM患者。也有研究表明BCMA为靶点的CAR-T细胞Ciltacabtagene autoleucel(Cilta-cel)在接受一线治疗后复发/难治性MM(RRMM)的疗效与之前接受一至三线治疗后的RRMM患者疗效相当。因此,在早期治疗中使用CAR-T细胞是否能产生更长时间的无病缓解仍有待验证。
清淋后宿主骨髓T细胞库也是决定患者预后的一个因素。CAR-T细胞输注后骨髓T细胞组成发生改变,可用于区分持久缓解(>6个月)和短暂缓解(<6个月)的患者。
与之类似,先前存在的T细胞功能状态已成为MM患者对BTE反应的关键决定因素。无应答患者通常具有免疫耗竭特征;应答者在治疗早期即开始克隆型扩张,并持续整个治疗过程。T细胞在肿瘤部位的克隆扩增突显了肿瘤抗原特异性T细胞的潜力。
CAR-T细胞的持久性也可能受到免疫介导的排斥反应限制,非人类序列的scFv可触发抗CAR免疫反应。对于异基因CAR-T细胞,通过基因敲除和抗体治疗可缓解这一现象。了解CAR免疫原性与治疗失败的关系具有重要意义。
肿瘤相关因子促进抗原逃逸
靶抗原的丢失或突变是MM患者对BCMA或GPRC5D靶向免疫疗法产生耐药的关键机制。CAR-T细胞治疗或BTE所施加的治疗压力可能会触发肿瘤免疫编辑机制,进而促进抗原丢失或抗原变异克隆的富集,最终导致疾病复发和治疗抵抗的产生。BCMA CAR-T细胞治疗后,BCMA阴性复发的发生率约为4%[13,14,15],而BCMA BTE治疗的患者中,靶抗原丢失率高达43%[15,16,17]。这一显著差异可能反映出,相对于单次CAR-T细胞输注,在长期和选择性的反复BTE治疗压力下发生了不同的适应性肿瘤演化。BCMA抗原逃逸的主要机制在BTE治疗的患者中表现为双等位基因TNFRSF17(即编码BCMA蛋白的基因)的缺失,这种遗传性缺失导致BCMA蛋白的完全缺失。此外,BCMA抗原逃逸也可能通过BCMA蛋白的细胞外结构域发生突变,这些突变破坏了靶表位,从而干扰了BTE的识别和结合。在GPRC5D靶向治疗后,观察到GPRC5D的抗原丢失现象比BCMA更为普遍,这可能反映了GPRC5D在MM细胞中的功能并非不可或缺,而BCMA则在维持MM细胞生存中扮演着至关重要的角色。
慢性T细胞与BTE(双特异性T细胞引导分子)的结合可能促进了无抗原克隆的出现,这一现象强调了优化给药计划的必要性。此外,该发现对于CAR-T细胞和BTE治疗策略的顺序安排具有重要的临床意义。临床研究显示,先前接受过BCMA靶向治疗的患者对BCMA CAR-T细胞疗法的反应较差。因此,建议在BTE治疗之前优先考虑使用CAR-T细胞疗法,并在BTE治疗前对患者的T细胞进行收集和保存,以预防T细胞耗竭。此外,针对多个抗原的双重或序贯靶向策略可以预防无抗原克隆的出现,初步研究已经显示出了良好的疗效。目前,设计同时靶向两种不同抗原的CAR-T细胞疗法正在积极研究中,并已经进入临床试验阶段。同时,针对FcRL5的研究也在进行中,目的是阐明其在抗原逃逸机制中的作用。
另外,SLAM家族成员7(SLAMF7)被认为是MM免疫治疗的一个潜在靶点。然而,SLAMF7的表达并不局限于MM细胞,也在T细胞、B细胞和NK细胞中表达,这可能引起免疫细胞的自相残杀现象。尽管存在这一挑战,针对SLAMF7的CAR-T细胞治疗已经进入临床试验阶段,并设计了包含安全特性的策略以降低这种风险。此外,首个"现成的"异基因SLAMF7特异性CAR-T细胞产品,即通用型CAR-T细胞(UCARTCS1),已经进入临床开发阶段。UCARTCS1的设计中,T细胞受体α链(TRAC)和SLAMF7基因都被特异性灭活,旨在减少移植物抗宿主病(GvHD)和T细胞自相残杀的风险。尽管如此,UCARTCS1的开发已经暂停,这一决策是由申办方基于战略考量而非出于安全性问题的考虑。
骨髓微环境的作用
CAR-T细胞、BTE治疗MM患者的效果,取决于T细胞能否成功重定向到骨髓微环境中的MM细胞,该微环境包含多种免疫抑制因子和细胞类型,包括基质细胞、成骨细胞、破骨细胞及免疫细胞,如T细胞、NK细胞、单核细胞、髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM)。这些细胞与细胞因子和生长因子共同促进肿瘤生长和免疫逃逸[18,19]。MM患者骨髓中的免疫失调和衰老进一步削弱T细胞功能,影响治疗效果。
研究显示,骨髓基质细胞与MM细胞共培养会降低GPRC5D的表达,会减弱Talquetamab(首个被批准用于治疗MM的GPRC5D靶向BTE)诱导的T细胞介导的细胞毒性。单细胞转录组学分析显示,MDSC的富集与较短的无进展生存期(PFS)相关,而表达1型树突状细胞(DC)标记物的细胞群则与较长的PFS相关。TAM在MM骨髓微环境中是IL-6和活性氧的主要来源,促进疾病进展和免疫抑制。基线时TAM的高水平浸润与不良预后相关,提示TAM和MDSC可能通过损害CAR-T细胞扩增并促进耐药性,影响质量效果。
清淋化疗通过消耗调节性T细胞(Treg)和损伤血管内皮细胞,对骨髓微环境进行调节,从而为CAR-T细胞治疗创造更有利的条件。常用的清淋化疗药物包括氟达拉滨和环磷酰胺,而苯达莫司汀也被证实具有相似的安全性和疗效。精心设计的清淋方案可以减轻对骨髓环境的不利影响,进而提高治疗效率。此外,肠道微生物群的组成对CAR-T细胞治疗的临床效果和细胞因子释放综合征(CRS)的发生具有显著影响,这提示我们在治疗策略中应考虑肠道微生物群的调节。
骨髓微环境在MM中发挥着关键作用。部分临床试验正在评估靶向免疫疗法结合免疫刺激剂的策略,以激发更有效的抗肿瘤免疫反应。这些策略包括在T细胞治疗前通过诱导疗法减轻肿瘤负担,或使用免疫调节剂、免疫检查点抑制剂和抗CD38抗体来调控肿瘤免疫微环境。
MM中免疫疗法的最佳排序
随着BCMA和GPRC5D靶向治疗在RRMM患者中的快速发展,确定这些治疗方法的最佳应用顺序变得至关重要。目前研究显示,BCMA BTE治疗后再使用BCMA CAR-T细胞可能会降低PFS,因此并非首选策略。相反,将BCMA CAR-T细胞作为初始BCMA靶向治疗,随后使用BCMA BTE,可能在抗原逃逸不占主导地位时更为有效。
在BTE的序贯治疗中,复发通常与BCMA细胞外结构域的突变有关,这些突变影响某些BTE的结合能力。因此,考虑先使用针对不同抗原(如GPRC5D)的BTE,或在BCMA靶向治疗后保留这些不同靶点,以应对疾病进展。此外,连续BTE治疗可能引发T细胞耗竭,但临床前研究显示,适当的治疗间期(TFI)可以缓解这一问题。因此,设计合理的BTE治疗周期和休息时间,有助于预防T细胞耗竭和抗原逃逸,优化治疗效果。
鉴于不同机制可能影响对序贯BTE和CAR-T细胞治疗的耐药性,动态监测抗原逃逸和评估T细胞功能是优化RRMM患者免疫治疗策略的关键。
讨论
新型靶向免疫疗法显著改变了MM的治疗方式,为晚期患者提供了新的有效的治疗选择。尽管如此,MM细胞的适应性和免疫逃逸能力限制了这些疗法的长期效果。因此,深入理解这些免疫疗法与骨髓微环境的相互作用对于开发新的治疗策略和优化现有治疗方法至关重要。临床前数据以及临床试验的相关研究可能揭示成功的治疗策略,帮助克服免疫逃逸,增强治疗效果的持久性。
在早期治疗阶段以及评估不同给药方案的研究也对于优化MM患者的治疗至关重要。同时,了解这些免疫疗法可能引发的感染性并发症,并制定相应的预防和治疗策略,也是提高疗效和患者预后的关键。此外,确定这些疗法的最佳应用顺序和评估多抗原靶向性,对于最大化治疗效果和改善患者预后具有重要意义。
10. Neri, P., Leblay, N., Lee, H. et al. Just scratching the surface: novel treatment approaches for multiple myeloma targeting cell membrane proteins. Nat Rev Clin Oncol (2024).
11. Munshi, N. C. et al. Idecabtagene vicleucel in relapsed and refractory multiple myeloma. N. Engl. J. Med. 384, 705–716 (2021).
12. Cohen, A. D. et al. B cell maturation antigen–specific CAR T cells are clinically active in multiple myeloma. J. Clin. Invest. 129, 2210–2221 (2019).
13. Da Vià, M. C. et al. Homozygous BCMA gene deletion in response to anti-BCMA CAR T cells in a patient with multiple myeloma. Nat. Med. 27, 616–619 (2021).
14. Samur, M. K. et al. Biallelic loss of BCMA as a resistance mechanism to CAR T cell therapy in a patient with multiple myeloma. Nat. Commun. 12, 868 (2021).
15. Lee, H. et al. Mechanisms of antigen escape from BCMA- or GPRC5D-targeted immunotherapies in multiple myeloma. Nat. Med. 29, 2295–2306 (2023).
16. Truger, M. S. et al. Single- and double-hit events in genes encoding immune targets before and after T cell-engaging antibody therapy in MM. Blood Adv. 5, 3794–3798 (2021).
17. Firestone, R. S. et al. Antigen escape as a shared mechanism of resistance to BCMA-directed therapies in multiple myeloma. Blood, https://doi.org/10.1182/ blood.2023023557 (2024).
18. Kawano, Y. et al. Targeting the bone marrow microenvironment in multiple myeloma. Immunol. Rev. 263, 160–172 (2015).
19. Giannakoulas, N., Ntanasis-Stathopoulos, I. & Terpos, E. The role of marrow microenvironment in the growth and development of malignant plasma cells in multiple myeloma. Int. J. Mol. Sci. 22, 4462 (2021).
排版编辑:肿瘤资讯-Kaylee











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


