目前针对多发性骨髓瘤(MM)细胞膜蛋白的新治疗方法,主要聚焦于B细胞成熟抗原(BCMA)、G蛋白偶联受体家族C组5成员D(GPRC5D)和类Fc受体蛋白5(FcRL5)这三个重要靶点。近年来,抗体药物偶联物(ADC)、双特异性T细胞衔接器(BTE)和嵌合抗原受体T(CAR-T)细胞疗法相继获批用于治疗复发难治性MM(RRMM)。然而,这些疗法的疗效并非普遍存在,且常出现获得性耐药。近日,发表在Nature reviews clinical oncology的一篇综述讨论了目前可用或正在临床开发的靶向BCMA、GPRC5D和FcRL5的多种免疫治疗方法,并分析了其耐药机制及潜在的解决策略,以提高患者的治疗效果。通讯作者为哈佛医学院Dana-Farber癌症研究所的Kenneth C. Anderson教授。【肿瘤资讯】将相关内容进行了整理,以飨读者。

背景概述
MM是一种以恶性浆细胞异常增生为特征的血液肿瘤,严重影响患者的生活质量和预期寿命。传统疗法对RRMM患者的治疗效果有限,亟需新型治疗策略来改善这些患者的预后。近年,靶向细胞膜蛋白的免疫治疗,如CAR-T和BTE治疗,显示出显著的疗效[1,2,3]。然而,这些疗法的应用面临诸多挑战,包括抗原逃逸、T细胞衰竭及肿瘤微环境的免疫抑制等。
为了提高CAR-T和BTE疗法的效果,研究者们正在探索多种策略,如优化CAR-T细胞的体外扩增和体内持久性、开发双重或多重靶向的CAR-T细胞。这些研究不仅有助于领域人士理解抗原逃逸和耐药机制,还为新一代免疫治疗的发展提供了理论基础和实践指导 。
BCMA靶向免疫疗法
BCMA 也称为肿瘤坏死因子受体超家族成员(TNFRSF17),在成熟的B系细胞中优先表达,并且在恶性和非恶性浆细胞表面均高度丰富[4,5]。BCMA是MM的关键治疗靶点,并且已经开发了几种靶向BCMA的治疗策略。
抗BCMA ADC
抗BCMA ADCs通过特异性靶向BCMA并释放细胞毒性药物,从而诱导肿瘤细胞死亡。目前已有几种基于BCMA的ADC药物被研究用于治疗MM。Belantamab mafodotin (Belamaf) 是一种岩藻糖基化的人源化抗 BCMA IgG1 mAb,通过不可切割的接头与微管蛋白聚合抑制剂单甲基 auristatin F (MMAF) 偶联。在II期DREAMM-2试验中,Belamaf以2.5 mg/kg或3.4 mg/kg剂量静脉注射。试验结果显示,Belamaf对RRMM患者具有显著疗效。在2.5 mg/kg组中客观缓解率(ORR)为32%,中位无进展生存期(mPFS)为2.8个月,中位缓解持续时间(DOR)12.5个月;在3.4 mg/kg组中ORR为35%,mPFS为3.9个月,DOR为6.5个月(表1)。Belamaf最常见的不良反应是眼毒性,包括角膜上皮病变和视力模糊。其他不良反应还包括血小板减少、贫血和中性粒细胞减少等。部分患者可能出现胃肠道反应、疲劳和感染,需综合管理不良反应以提高患者的治疗依从性。
基于以上不良反应,研究者们开发了多种联合策略来提高Belamaf的疗效,详情见表1。
表1. 在RRMM患者中测试BCMA靶向疗法的部分试验总结
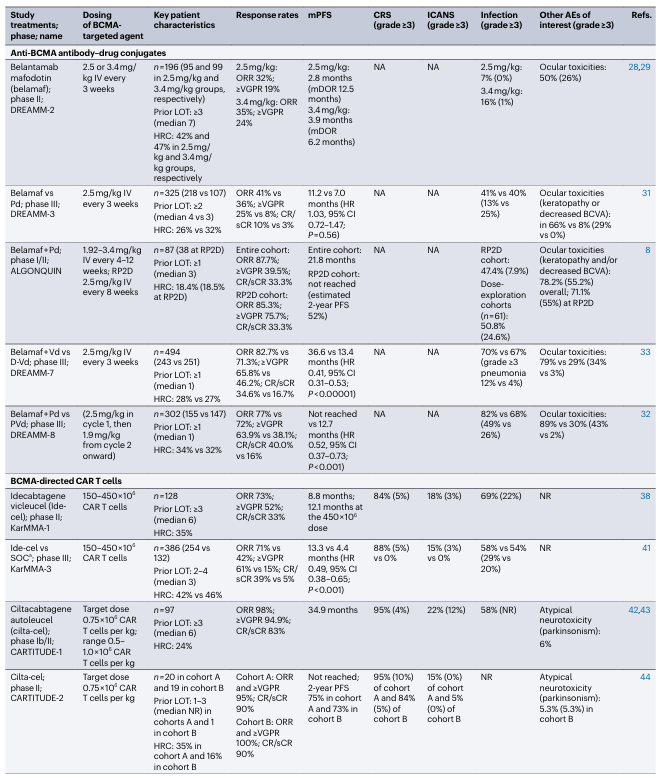
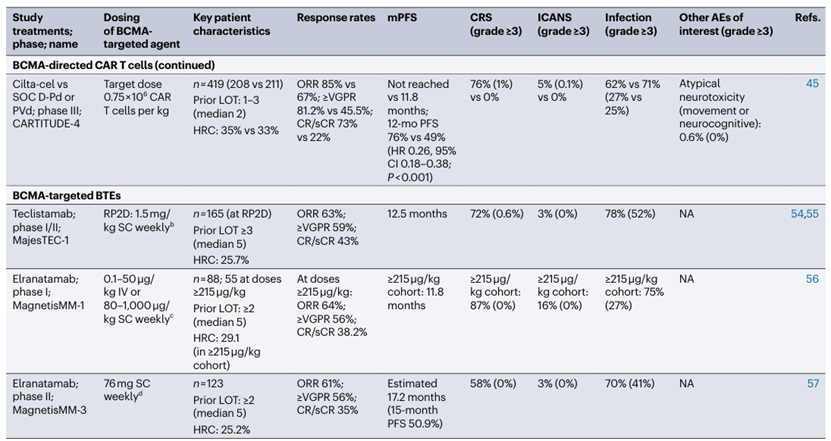
高风险细胞遗传学定义为del17p, t(4;14)和/或t(14;16)变异。AEs, 不良事件; BCVA, 最佳矫正视力;D-Pd, 达雷木单抗联合泊马度胺和地塞米松;D-Vd, 达雷木单抗联合硼替佐米和地塞米松;HRC, 高风险细胞遗传学;IV, 静脉注射;LOT, 治疗线数; NA, 不适用;NR, 未报告;Pd, 泊马度胺和地塞米松;PVd, 泊马度胺、硼替佐米和地塞米松;RP2D, 推荐的II期剂量;SC, 皮下注射;SOC, 标准治疗;Vd, 硼替佐米和地塞米松;≥VGPR, 非常好的部分缓解或更好率。a. D-Vd, D-Pd, 埃罗珠单抗联合Pd,伊沙佐米、来那度胺和地塞米松,或卡非佐米和地塞米松。b. 在I期研究中,若达到部分缓解或更好的患者在四个周期后,或在II期研究中,完全缓解/严格完全缓解持续≥6个月的患者可以选择改为每两周一次。c. 在稳定病情或更好的患者持续≥2个月后,≥6个月后允许改为每两周一次。d. 在部分缓解或更好的患者持续≥2个月后,≥6个月后允许改为每两周一次。
BCMA CAR-T细胞疗法
BCMA是MM治疗的一个重要靶点。目前有几种基于BCMA的CAR-T细胞疗法被研究用于治疗MM。其中,两种CAR-T细胞产品,Idecabtagene vicleucel (Ide-cel) 和 Ciltacabtagene autoleucel (Cilta-cel),分别于 2021 年和 2022 年首次获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准,用于此前已接受过四种或更多线治疗,包括蛋白酶体抑制剂(PIs)、免疫调节剂(IMiD)和抗CD38抗体的RRMM患者。临床试验表明,Ide-cel和Cilta-cel治疗RRMM患者表现出显著疗效。例如,Ide-cel在一项临床试验中显示ORR为96%,完全缓解率/严格意义完全缓解率(CR/sCR)为74%(表1)。
其他几种基于BCMA的CAR-T细胞产品正处于临床研究阶段,主要是针对于RRMM患者。例如,Equecabtagene autoleucel、Zevorcabtagene autoleucel、FHVH-T、CART-ddBCMA等 (表2)。此外,鉴于MM细胞通常也表达CD38和CD19,为降低抗原逃逸的风险,研究者们还设计了同时靶向BCMA和这些附加抗原的CAR-T细胞疗法,用于治疗RRMM,目前也正在临床研究中(表2)。
BCMA靶向的BTE
BTE通过其两个结合域,一个结合在MM细胞上的特定抗原(如BCMA),另一个结合在T细胞上的CD3,促使T细胞靠近癌细胞,从而形成免疫突触,最终导致MM细胞的死亡。
Teclistamab是截至目前第一个获批的BCMA靶向BTE,于2022年先后获得FDA和EMA的批准。I/II期临床试验显示,Teclistamab展现出显著的疗效,ORR为63%,CR/sCR为43%。mPFS为12.5月,表明该药物在高度暴露的RRMM患者中具有持续缓解的潜力(表1)。Elranatamab是另一种BCMA靶向BTE,目前处于I期临床试验阶段,同样也显示出良好的疗效和安全性:接受≥215μg/kg剂量的患者ORR为64%,其中CR/sCR为38.2%,mPFS为11.8个月(表1)。 其他几种靶向BCMA的BTE,包括 Linvoseltamab、Alnuctamab 和 ABBV-383,正在RRMM患者中进行评估(表2)。
在使用BCMA靶向 BTEs治疗的患者中,细胞因子释放综合征(CRS)是最常见的不良反应,发生率为57%,其中2%为3级及以上严重CRS。免疫效应细胞相关神经毒性综合征(ICANS)发生率较低,仅为0.2%,且无3级及以上严重ICANS报告。3级及以上感染的发生率为41%,需在治疗过程中密切监控并及时管理。
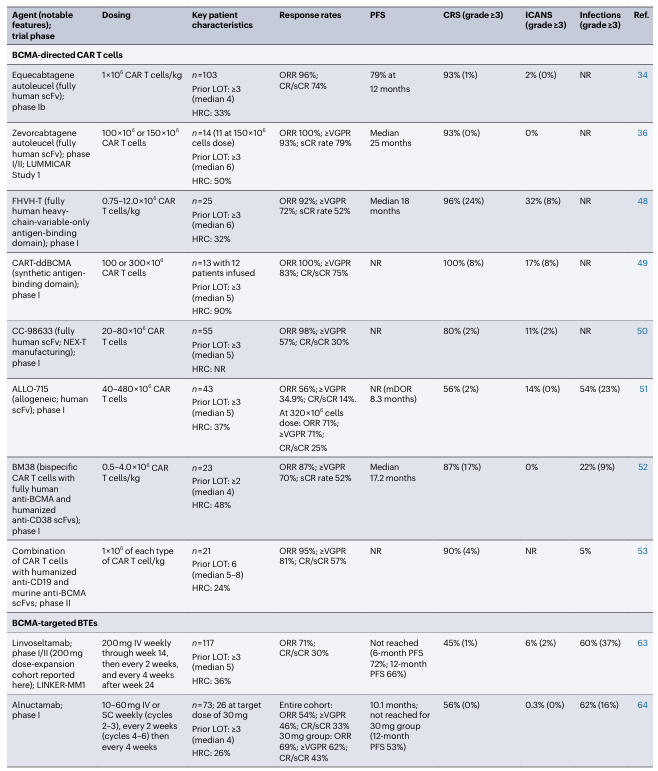
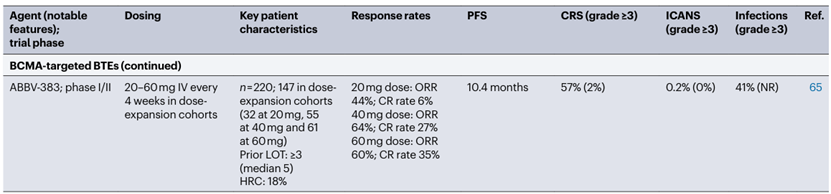
表2. 在RRMM患者中测试的部分BCMA靶向T细胞重定向疗法的总结
GPRC5D靶向免疫疗法
GPRC5D属于G蛋白偶联受体的多样化家族,是MM中具有潜力的治疗新靶点。这种细胞表面蛋白在MM细胞上表达水平较高,在非恶性浆细胞上表达水平较低。在个体患者中,GPRC5D的表达也独立于BCMA水平,这使得GPRC5D疗法成为BCMA靶向药物的有吸引力的替代选择,并且已经开发了几种针对这种膜蛋白的治疗策略[6]。
GPRC5D CAR-T细胞疗法
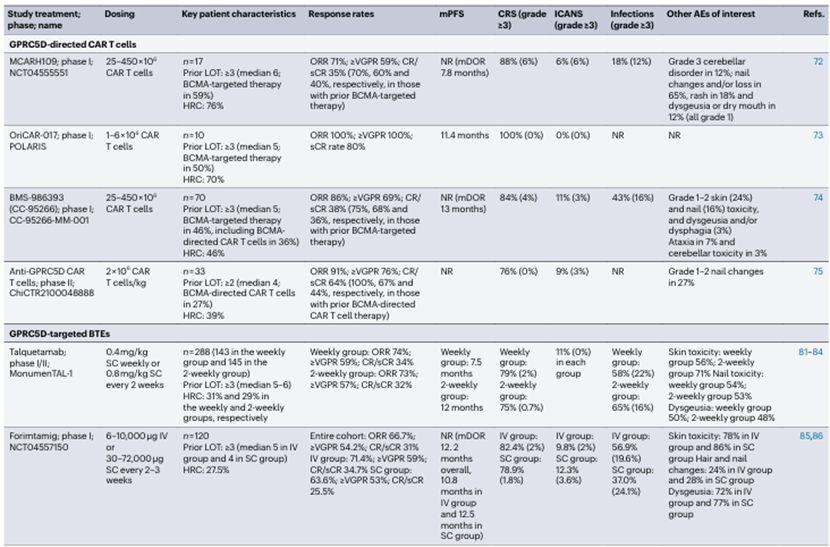
目前全球范围内有四种GPRC5D靶向CAR-T细胞疗法处于临床开发阶段:MCARH109、OriCAR-017、BMS-986393,以及在中国临床试验注册试验中测试的另外一种GPRC5D靶向CAR-T细胞产品(ChiCTR2100048888)。在早期的临床试验中,ORR、CR、mPFS等这些数据表明,这些疗法在RRMM患者中具有高度有效的抗肿瘤活性(表1、表3)。
GPRC5D靶向的BTE
Talquetamab 是第一个被批准用于治疗MM的GPRC5D靶向BTE,于2023年获得FDA和EMA有条件批准用于治疗四线或三线治疗后仍有三重耐药的RRMM患者。在包含288例重度暴露RRMM患者的I/II期MonumenTAL-1研究中,Talquetamab的ORR为74%(34% CR/sCR,剂量每周 0.4 mg/kg)和73%(32% CR/sCR,每 2 周 0.8 mg/kg)。Forimtamig是一种新型的GPRC5D × CD3 BTE,具有2:1的配置,拥有两个GPRC5D结合位点。正在进行的I期研究结果显示,静脉组的ORR为71.4%(34.7% CR/sCR),皮下组为63.6%(25.5% CR/sCR),DOR为12.5个月,在中位随访10.2个月后,整个队列中有61.3%的响应持续存在。研究报告显示,静脉组的CRS发生率为82.4%,皮下组为78.9%。
GPRC5D靶向BTE与口腔毒性有关,包括味觉改变和口干,以及皮肤和指甲变化。这些不良事件反映了GPRC5D在非恶性组织中的表达,通常是可逆的。管理策略包括延迟和/或减少剂量,在某些情况下,可能需要营养补充以防止由于口腔毒性导致的体重减轻。
表3. 在RRMM患者中测试GPRC5D靶向治疗的部分试验总结
FcLH5靶向免疫疗法
FcRL5是一种免疫球蛋白样细胞表面受体,由B淋巴细胞谱系的细胞表达,包括非恶性和恶性浆细胞[7,8,9]。FcRL5在MM细胞中的过表达,独立于BCMA或GPRC5D的表达,使其成为免疫治疗的一个有吸引力的新靶点,并且临床已经开发了几种针对这种膜蛋白的治疗策略。
抗FcRL5 ADC
首个获批临床研究的抗FcRL5 ADC药物DFRF4539A的I期临床试验中,39 例RRMM 患者每周或每3周静脉注射不同剂量的该药物,但只有5%的患者有部分缓解(PR),分别有46%和41% 的患者病情稳定(SD)和疾病进展(PD)。虽然,该研究中没有治疗相关死亡发生,但23%的患者出现了严重不良事件。由于低缓解率,DFRF4539A的研发已被停止。针对其他FcRL5的ADC,目前尚未开展临床试验。
FcRL5 CAR-T细胞疗法
在临床前研究中,FcRL5靶向的CAR-T细胞对MM细胞表现出强大的抗肿瘤活性,并在体外和小鼠异种移植模型中有效。目前,一项I/II期临床试验(NCT06196255)正在评估FcRL5 CAR-T细胞疗法在RRMM患者中的疗效和安全性。为了防止抗原逃逸,研究还在开发同时靶向FcRL5和BCMA的双靶向CAR-T细胞,旨在提高治疗效果。
FcRL5靶向的BTE
Cevostamab是首个在RRMM患者中显示出大量抗MM活性的FcRL5靶向药物。在I期临床试验中,Cevostamab对接受了重度预处理的RRMM患者中表现良好,ORR分别为36.7%(90 mg剂量组)和54.5%(160 mg剂量组)。安全性方面,80%的患者出现CRS,但大多为轻度。此外,13.1%的患者报告了ICANS。值得注意的是,使用抗IL-6抗体Tocilizumab预处理可显著降低CRS发生率并且不影响疗效。目前,多项临床试验正在进一步评估Cevostamab的疗效和安全性,包括作为BCMA靶向CAR-T细胞治疗患者的巩固疗法,以及与其他抗MM药物的联合使用。这些试验的结果将为该药物的临床应用提供更多信息。
小结
针对MM患者,目前大量研究正在探讨靶向BCMA、GPRC5D和FcRL5的各种免疫治疗方法,而这些方法在重度暴露的RRMM患者中显示出前所未有的疗效;但是,这些方法可能会导致独特且较为严重的不良事件。因此,未来研究应进一步探讨如何提升这些新型免疫治疗策略的疗效,同时降低其不良事件的严重性及发生风险。
下篇,我们将介绍靶向BCMA、GPRC5D和FcRL5各种免疫治疗方法的耐药机制,并将讨论克服耐药机制、改善患者预后的潜在策略。敬请期待!
1. Trudel, S. et al. Belantamab mafodotin, pomalidomide and dexamethasone in refractory multiple myeloma: a phase 1/2 trial. Nat. Med. 30, 543–551 (2024).
2. Firestone, R. S. & Mailankody, S. Current use of CAR T cells to treat multiple myeloma. Hematology 2023, 340–347 (2023).
3. Lee, H., Neri, P. & Bahlis, N. J. Current use of bispecific antibodies to treat multiple myeloma. Hematol. Am. Soc. Hematol. Educ. Program. 2023, 332–339 (2023).
4. Avery, D. T. et al. BAFF selectively enhances the survival of plasmablasts generated from human memory B cells. J. Clin. Invest. 112, 286–297 (2003).
5. Tai, Y. T. et al. APRIL and BCMA promote human multiple myeloma growth and immunosuppression in the bone marrow microenvironment. Blood 127, 3225–3236 (2016).
6. Karschnia, P. et al. Neurologic toxicities following adoptive immunotherapy with BCMA-directed CAR T cells. Blood 142, 1243–1248 (2023).
7. Elkins, K. et al. FcRL5 as a target of antibody-drug conjugates for the treatment of multiple myeloma. Mol. Cancer Thera 11, 2222–2232 (2012).
8. Polson, A. G. et al. Expression pattern of the human FcRH/IRTA receptors in normal tissue and in B-chronic lymphocytic leukemia. Int. Immunol. 18, 1363–1373 (2006).
9. Ise, T. et al. Elevation of soluble CD307 (IRTA2/FcRH5) protein in the blood and expression on malignant cells of patients with multiple myeloma, chronic lymphocytic leukemia, and mantle cell lymphoma. Leukemia 21, 169–174 (2007).
排版编辑:肿瘤资讯-Kaylee











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


