2024年6月13日~6月16日,第29届欧洲血液病协会(EHA)年会将于“欧洲之门”西班牙马德里盛大召开。作为最重要的血液学会议之一,本次EHA年会共有3000余项研究的最新结果公布。摘要一经公布,【肿瘤资讯】第一时间邀请到中山大学肿瘤防治中心蔡清清教授,就淋巴瘤领域备受关注的一线(1L)治疗临床研究进行了筛选与点评,内容如下。
中山大学附属肿瘤医院大内科副主任
教育部长江学者特聘教授
中国抗癌协会中西整合淋巴瘤专委会 主任委员
广东省医学会肿瘤学分会淋巴瘤学组 组长
广东省精准医学应用学会淋巴瘤专委会主任委员
中国老年保健协会淋巴瘤专委会副主委
中华医学会肿瘤学分会青年委员会 副组长
中国抗癌协会血液肿瘤专业委员会 常委
近五年以通讯作者(含共同)在Lancet haematology、Blood、SignalTransduction and Targeted Therapy、ClinicalCancer Research、Leukemia等国际权威杂志发表SCI论文20余篇。主持国家自然科学基金共5项,包括国家自然科学基金重点项目一项、面上项目三项,及科技部重点研发课题。获2020年首届中国癌症防治年度大会“淋巴瘤领域杰出贡献奖”、2022年度第七届医学家年会”十大医学菁英专家”等

Abstract P1148:泽布替尼联合利妥昔单抗(ZR)随后短疗程R-DHAOX化疗治疗初治套细胞淋巴瘤(MCL)——II期CHESS试验的结果
标题:FRONTLINE TREATMENT WITH ZANUBRUTINIB PLUS RITUXIMAB (ZR) FOLLOWED BY SHORT COURSE R-DHAOX IN PATIENTS WITH MANTLE CELL LYMPHOMA (MCL) – RESULTS OF PHASE II CHESS TRIAL
作者:Qingqing Cai, et al.
研究背景
Bruton酪氨酸激酶(BTK)抑制剂联合利妥昔单抗作为MCL的1L治疗方案显示出良好的疗效。泽布替尼是新一代高选择性BTK抑制剂,在复发难治MCL取得良好的抗肿瘤活性,客观缓解率(ORR)可达84%。
研究目的
这项多中心II期试验(CHESS)旨在评估ZR 1L治疗,随后进行基于阿糖胞苷的短程化疗,以及泽布替尼维持治疗的疗效和毒性(NCT04624958)。
研究方法
符合入组条件的初治MCL患者接受ZR诱导治疗,直至完全缓解(CR)或最多12个周期,随后进行4个周期的R-DHAOx方案(利妥昔单抗、地塞米松、阿糖胞苷和奥沙利铂)。化疗后达到CR的患者将接受最长1年的泽布替尼维持治疗。主要研究终点是ZR方案诱导治疗后的CR率。通过流式细胞术评估骨髓和外周血的微小残留病灶(MRD)。
研究结果
本研究于2020年10月至2023年11月期间已完成全部42例患者入组。中位年龄为57岁(51~64岁)。Ⅲ~Ⅳ期占92.8%,简化MIPI评分为中高危者占42.8%(图1)。34例(81.0%)为典型组织学亚型。ZR的中位治疗周期为4(2~6)。
截至2024年1月,在37/42例接受治疗后PET评估的患者中,ZR方案的最佳CR率为91.9% (34/37),94.1% (32/34)在2~4个周期后获得CR。骨髓MRD阴性CR率为92.0%(23/25)。其余5/42例患者仍在接受ZR治疗,随后将进行PET评估。在完成化疗并可评估反应的27例患者中,1例患者出现疾病进展(PD)。中位随访时间为11.6个月,1年无进展生存(PFS)率和总生存(OS)率分别为90.1%和96.7%,2例患者分别因淋巴瘤(n=1)和COVID-19(n=1)死亡。ZR方案的3~4级不良事件为中性粒细胞减少(n=3)、疲劳(n=2)和转氨酶异常(n=1)。化疗期间,75.8%的患者出现3~4级血小板减少。
研究结论
ZR诱导治疗后短程R-DHAOx化疗作为MCL 1L治疗具有良好的疗效和安全性,这种减化疗的策略可降低基于阿糖胞苷的化疗的毒性。
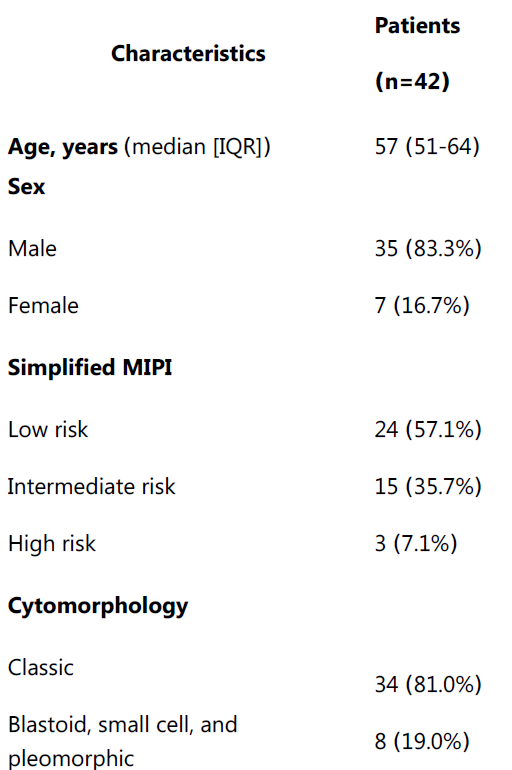
图1. 患者基线特征
Abstract S235:同类首创口服CELMOD™药物戈卡度胺(GOLCA [CC-99282])联合R-CHOP治疗初治侵袭性B细胞淋巴瘤患者
标题:GOLCADOMIDE (GOLCA [CC-99282]), A POTENTIAL FIRST-IN-CLASS ORAL CELMOD™ AGENT, PLUS R-CHOP IN PATIENTS (PTS) WITH UNTREATED AGGRESSIVE B-CELL LYMPHOMA (A-BCL): SAFETY AND 12-MONTH EFFICACY RESULTS
作者:Marc Hoffmann, et al.
研究背景
弥漫性大B细胞淋巴瘤(DLBCL)患者经过1L化学免疫治疗后复发率高达40%。Cereblon(CRBN)是一种泛素连接酶E3底物受体,是沙利度胺、来那度胺等药物免疫调节剂的作用靶点,基于此设计的CRBN E3连接酶调节化合物(CELMoD)药物,是分子胶通过将CRBN募集到目标上,从而能够降解以前“不可成药”的蛋白质。GOLCA是同类首创、口服CELMoD药物,优先分布于淋巴器官,降解靶蛋白Ikaros/Aiolos,产生凋亡和免疫调节活性。CC-220-DLBCL-001(NCT04884035)是一项正在进行的1b期、开放标签、多中心、剂量递增/扩展试验,旨在评估1L GOLCA+R-CHOP在侵袭性B细胞淋巴瘤(a-BCL)中的安全性和初步疗效。
研究目的
提供GOLCA_R-CHOP的安全性和12个月疗效结果。
研究方法
符合条件的患者为≥18岁、ECOG PS≤2、IPI为0~5(第1部分)或2~5(第2部分)、未经治疗的a-BCL。入组患者接受GOLCA+R-CHOP方案治疗≤6个周期。剂量递增阶段,GOLCA的剂量水平(DL)为0.2 mg D1-7(DL-1)、0.4 mg D1-7(DL1)或0.4 mg D1-10(DL2)。在剂量扩展阶段,患者以1:1的比例随机分配到DL-1或DL1组。主要研究终点是DL1时GOLCA的安全性,次要研究终点是疗效。
研究结果
在数据截止时(2024年1月2日),78例患者接受了治疗(DL-1 n=35,DL1 n=37,DL2 n=6)。中位年龄为63岁,大多数患者(82%)为高危疾病(定义为IPI 3-5或IPI 1-2伴≥1个病灶(最大直径≥7 cm)和/或LDH≥1.3 ULN)。51%患者的基于细胞起源(COO)分类,生发中心B细胞来源(GCB)和非GCB/活化B细胞来源(ABC)亚型分别占51%和33%。71例(91%)发生3/4级治疗期间出现的不良事件(TEAE),最常见的是中性粒细胞减少症(n=68,87%)和血小板减少症(n=33,42%);在DL1中,2例(5%)出现3/4级栓塞性/血栓性TEAE,36例(46%)发生严重TEAE,最常见的是发热性中性粒细胞减少症(n=15,19%)。
中位随访10.7个月(0.72~18.1个月),有72例疗效可评估患者(DL-1 n=34,DL1 n=33)。在DL1时,治疗结束(EOT)完全代谢缓解(CMR)率为88%(n=29),所有29例患者在数据截止时都存活且无进展(图2);高危患者的EOT CMR率为89%(n=24),GCB(n=15,88%)和非GCB/ABC(n=9,82%)疗效相似,中位缓解持续时间(DOR)未达到。DL1时,12个月DOR率为96%,高危患者为95%(n=27)。在ITT人群(n=78)中,中位无进展生存期(PFS)未达到,12个月PFS率在DL1时为84%、DL-1时为75%,在高危患者中分别为85%和70%。
研究结论
使用DL1剂量水平的GOLCA联合R-CHOP可达到与COO无关的、高比例的持久CMRs,在总人群和高危人群中均取得了理想的12个月PFS率;该方案表现出可控的安全性。本研究数据支持随机3期试验GOLSEEK-1的开展,对比GOLCA+R-CHOP与R-CHOP方案作为高危DLBCL患者的1L治疗。
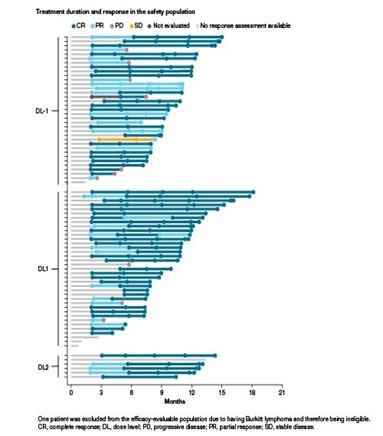
图2 安全人群的治疗时长和应答
Abstract S239:皮下注射Epcoritamab+维泊妥珠单抗、利妥昔单抗、环磷酰胺、多柔比星和泼尼松(POLA-R-CHP)治疗初治DLBCL患者的首批数据:EPCORE NHL-5
标题:FIRST DATA FROM SUBCUTANEOUS EPCORITAMAB+POLATUZUMAB VEDOTIN, RITUXIMAB, CYCLOPHOSPHAMIDE, DOXORUBICIN, AND PREDNISONE (POLA-R-CHP) FOR FIRST-LINE DIFFUSE LARGE B-CELL LYMPHOMA (DLBCL): EPCORE NHL-5
作者:David Lavie, et al.
研究背景
与利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松(R-CHOP)相比,Pola-R-CHP作为DLBCL的1L 治疗提高了缓解率(RR)和PFS。然而,1L DLBCL达到治愈的需求仍未得到满足。Epcoritamab(epcor)是一种皮下注射CD3xCD20双特异性抗体,已证明其与R-CHOP联合作为DLBCL的1L治疗的安全性和有效性,且其在美国、欧洲、日本等地已被批准用于治疗≥2线系统治疗后的复发难治性DLBCL。将epcor与具有不同作用机制的抗肿瘤药物联用可能会为患者提供更佳的临床获益。本研究旨在报告EPCORE NHL-5(NCT05283720)的1b/2期研究结果。
研究目的
评估epcor + pola-R-CHP在初治DLBCL患者中的安全性、耐受性和抗肿瘤活性。
研究方法
EPCORE NHL-5是一项正在进行的、多臂的、开放标签的全球性研究。在第3组中,纳入新近诊断的CD20+ DLBCL[DLBCL非特指型,伴有MYC和BCL-2和/或BCL-6易位(双重/三重打击)的高级别B细胞淋巴瘤(HGBL),或3B级滤泡性淋巴瘤(FL)],且ECOG PS为0-2、IPI评分为2-5的患者。所有患者均以21天为一周期(C)进行治疗,并接受6个周期的epcor + pola-R-CHP,随后进行2个周期的epcor单药治疗。在C1中使用剂量递增方式给予epcor,然后在C2-4使用全剂量(48 mg)QW、在C5-8使用48 mg Q3W。其他CRS缓解措施包括使用泼尼松(n=17)或地塞米松(n=20)。C1-6期间,多柔比星、环磷酰胺和pola给药后1~2天为患者使用G-CSF或聚乙二醇化G-CSF。允许进行中枢神经系统预防。关键研究终点包括剂量限制性毒性(DLT)、研究者评估的缓解(ORR/CR)、至缓解时间(TTR)和安全性。
研究结果
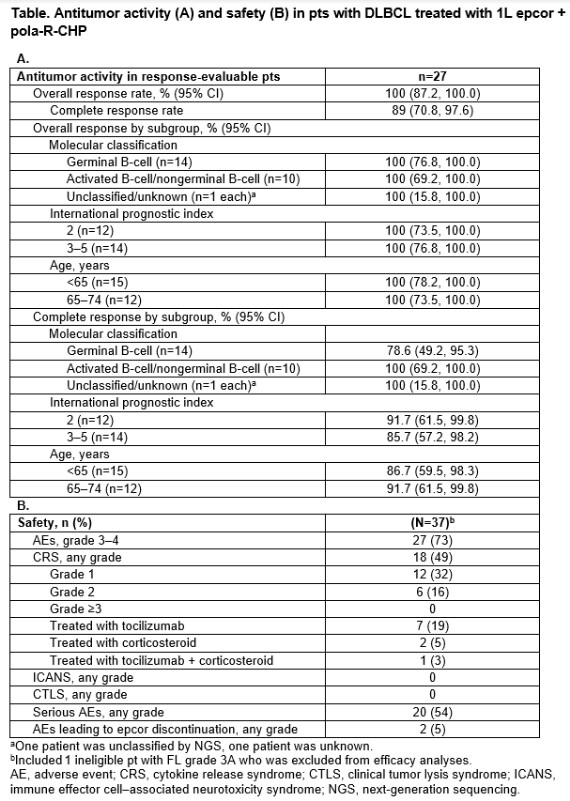
截至2023年11月28日,37例患者接受了epcor + pola-R-CHP。其中51%为女性;中位年龄64岁;DLBCL有34例;HGBL有1例;3B等级的FL有1例。未观察到DLT。在27例可评估患者中,ORR为100%,其中89%例达到CR(n=24;见表1)。
中位随访时间为5.8个月(95%CI:4.8-8.6)。中位TTR和CR时间分别为2.7个(1.3~3.3)月和2.8个(1.3~6.7)月。2例(5%)因不良反应(AE)停用epcor;3例(8%)因AE停用pola-R-CHP。最常见的3~4级AE是中性粒细胞减少症(65%)、贫血(14%)和白细胞减少症(11%)。1例患者发生致命的TEAE(感染性休克),但被认为与epcor无关。CRS为低级别(32% G1,16% G2),主要发生在第一次全剂量给药(C1D15)之后。CRS事件发生率分别为35%(6/17例;G2为3例)和60%例(12/20;G2为3例),分别接受了预防性地塞米松或泼尼松治疗。所有CRS均已治愈,中位至治愈时间为2(1~6)天。未观察到ICANS。1例出现4级噬血细胞性淋巴组织细胞增多症(HLH),HLH最终治愈且患者完成治疗。生物标志物分析显示epcor的药效学特征与其作用机制(MOA)相符,包括首次全剂量后细胞因子水平的可预测性升高(IFN-γ、IL-2、IL-6)。epcor的初步药代动力学特征和暴露特点与其他治疗方案及单药疗法相当。
研究结论
初治DLBCL使用epcor + pola-R-CHP在所有亚组中都显示出高ORR和CR率,安全性可控。疗效数据与单独使用pola-R-CHP和其他治疗方案相比具有优势。未来将提供包括MRD在内的其他数据。
表1. L epcor+pola+R-CHP治疗DLBCL患者的抗肿瘤活性和安全性
Abstract S226:EORTC-1537-COBRA:晚期霍奇金淋巴瘤的极早期FDG-PET-反应适应性靶向治疗:一项单臂II期研究
标题:EORTC-1537-COBRA: VERY EARLY FDG-PET-RESPONSE ADAPTED TARGETED THERAPY FOR ADVANCED HODGKIN LYMPHOMA: A SINGLE-ARM PHASE II STUDY.
作者:Martin Hutchings, et al.
研究背景
在常规多药化疗中加入维布妥昔单抗(BV)治疗经典霍奇金淋巴瘤(cHL),已被证实具有可控的安全性和更优的疗效。ECHELON-1研究中,试验组接受治疗的<60岁cHL患者,无论早期PET结果如何,皆接受了6个周期A-AVD,他们的3年PFS率在PET2阴性者中为87.2%、PET2阳性者中为69.2%(Strauss等人, Blood(2020)135(10): 735–742)。在晚期cHL的常规化疗中,早期FDG-PET反应适应性疗法已经是标准治疗手段。然而,它在新型靶向治疗方案中的价值尚不清楚。
研究目的
探究是否基于极早期的FDG-PET/CT的治疗调整可以提高疗效,同时最大限度地降低晚期cHL患者接受含维布妥昔单抗的方案(即维布妥昔单抗、多柔比星、长春新碱、达卡巴嗪[A-AVD]和维布妥昔单抗、依托泊苷、环磷酰胺、多柔比星、达卡巴嗪和地塞米松[BrECADD])治疗时的毒性。
研究方法
这是一项单臂II期研究,主要研究终点是治疗开始后2年的改良无进展生存(2y mPFS)率;PD或复发、治疗结束时未达CR而开始新治疗、死亡,均视为失败。所有患者均接受1个周期的A-AVD,随后进行早期PET/CT扫描(PET1)。多维尔评分4-5分为PET阳性。PET1阴性患者额外接受5个周期的A-AVD;PET1阳性患者转为接受6个周期的BrECADD。放疗仅适用于化疗结束时仍存在PET阳性的患者。该研究使用A'Hern设计,单侧I类错误为10%,在备选方案H1:2y mPFS=87%下,有82%的效能拒绝原假设H0:2y mPFS=80%,最终样本量为150例患者。
研究结果
共入组150例患者。中位年龄为32岁(18~60岁),其中54%为男性。Ann Arbor临床分期如下:ⅡB(15%)、ⅢA(11%)、ⅢB(15%)、ⅣA(23%)和ⅣB(37%)。给药A-AVD一个周期后,90例(60%)患者PET1阴性,60例(40%)患者PET1阳性;除4例患者外,其余均按照既定方案进行治疗。94%的患者完成了计划内的化疗。9例患者由于化疗结束时仍残留病灶而进行放疗。在治疗期间,所有患者均发生AE,63%发生3-4级AE,55%发生3-4级TEAE;30%发生严重AE;无5级AE发生。在145例疗效可评估患者中(即符合条件且在PET1后继续治疗的患者),治疗结束时的完全代谢缓解率(CMR)为91.0%(95%CI:85.2-95.1%)。16例患者达到mPFS;没有患者死亡。估计2年mPFS率为89.5%(80%双侧精确CI:85.7-92.4%)。PET1阴性患者的2年mPFS为88.3%,PET1阳性患者的2年mPFS为91.3%。
研究结论
COBRA试验的结果表明,基于极早期的FDG-PET/CT的治疗调整在接受含BV治疗的晚期初治HL患者中具有很好的疗效,且使大多数患者免于强化化疗。
Abstract S244:短疗程A+AVD随后纳武利尤单抗巩固治疗作为局限期霍奇金淋巴瘤患者的1L治疗
标题:AN ABBREVIATED COURSE OF A+AVD FOLLOWED BY NIVOLUMAB CONSOLIDATION FOR FRONTLINE THERAPY IN PATIENTS WITH LIMITED STAGE HODGKIN LYMPHOMA
作者:Steven Park, et al.
研究背景
霍奇金淋巴瘤(HL)是年轻人中最常见的恶性肿瘤之一,其治疗需要在提高疗效和最大限度减少长期毒性之间取得平衡。在局限期霍奇金淋巴瘤中,大多数患者经过1L治疗可治愈,但可能采用了放疗(RT)或化疗升级的方案。因此,局限期HL的治疗改进旨在减少对常规化疗和放疗的暴露,同时改善当前的标准治疗效果。基于BV和纳武利尤单抗(NVB)在HL中已被证实的确切疗效,研究人员假设短疗程A+AVD(BV、多柔比星、长春碱、达卡巴嗪)随后NVB巩固治疗,可以分别取代ABVD和RT,从而在局限期非大包块HL患者中改善PFS并降低过量治疗相关的死亡率或发病率。
研究目的
评估局限期HL患者接受A+AVD随后进行NVB巩固治疗后的3年PFS率。
研究方法
纳入初治局限期非大包块(肿块<10cm)经典HL患者,进行A+AVD治疗3个周期,随后接受最多8个周期的 NVB 巩固治疗(ACCRU-LY1601;NCT03233347)。所有接受A+AVD治疗的患者都给予了G-CSF的生长因子支持。A+AVD后PET阴性(Deauville评分1~3)的患者继续接受NVB巩固治疗(3 mg/kg,每2周一次)。A+AVD后PET阳性者在NVB巩固前接受4个周期的BV+NVB。在最后一次给药NVB后8周进行治疗结束(EOT)PET扫描。
研究结果
2018年7月至2022年7月期间,共83例患者纳入ACCRU-LY1601研究,3例患者在治疗前撤回知情同意。在获得可用临床数据的80例可评估患者中,中位年龄为31岁(19~60岁),50%患者为女性,89%为Ⅱ期HL,33%有B症状。与A+AVD诱导治疗相关的最常见≥3级AE包括中性粒细胞减少(32.5%)和恶心(6.3%)。30例(37.5%)在接受A+AVD治疗时出现周围感觉神经病变(PN),大部分(18例)为1级PN。NVB相关的≥3级AE包括脂肪酶升高(5.3%)和中性粒细胞减少(2.6%)。1例患者在NVB治疗期间出现4级糖尿病酮症酸中毒。在完成A+AVD诱导治疗且PET结果可评估的77例患者中,94.8%的患者PET为阴性,这部分患者大多数(87.7%)完成了8个周期的NVB巩固治疗。在A+AVD诱导治疗后PET呈阳性的4例患者中,3例接受了4个周期的BV+NVB,随后按照计划进行了NVB巩固治疗,所有患者均在EOT时达到CR。1例PET阳性患者因继发3级PN而退出研究,但在后续的非方案内放疗后,仍达到CR。中位随访时间为40.4个月,所有患者都发生了一次疾病进展事件,估计3年PFS率为98.5%(与PET结果无关)(图3)。
研究结论
在初治局限性期HL患者治疗中加入两种新型药物(BV和NVB)的背景下,ACCRU-LY160是迄今为止报道的规模最大、随访时间最长的研究,代表了一种旨在消除剂量递增化疗和放疗需求的新治疗策略。和预期结果一致,与使用长疗程(即6个周期)A+AVD相比,短疗程A+AVD似乎具有更可控的安全性。NVB巩固治疗总体耐受性良好,几乎所有患者都完成了计划疗程。大多数(94.8%)患者在3个周期的A+AVD后PET呈阴性。NVB巩固治疗后,98.5%的患者保持无进展,中位随访时间为40.4个月。基于BV和NVB的局限期HL治疗方案的未来发展方向可能包括进一步减少化疗剂量,以及在高风险大包块局限期HL患者中验证这种无放疗方案。
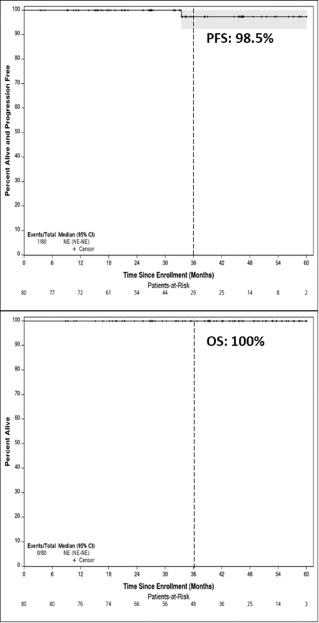
图3. PFS和OS
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


