浙江省肿瘤医院泌尿外科副主任医师,硕士研究生导师,医疗组带组医师
医学博士,毕业于北京大学八年制临床医学专业
浙江省医学会泌尿外科分会肿瘤学组委员
浙江省医学会泌尿外科分会青年委员
浙江省抗癌协会泌尿系统肿瘤专业委员会青年委员
浙江省医师协会泌尿系统肿瘤专业委员会微创学组委员
浙江省数理医学学会泌尿肿瘤专委会常委
最强挑战”前列腺癌诊治论坛全国总冠军
中国抗癌协会泌尿男生殖系统肿瘤专业委员会MDT卓越医师
第一作者或通讯作者发表SCI论文10余篇
主持、参与多项国家级、省厅级课题
作为PI参与多项国际/国内多中心临床试验。
ASCO2024解读文献
Abstract 4506
Circulating kidney injury molecule-1 (KIM-1) biomarker analysis in IMmo- tion010: A randomized phase 3 study of adjuvant (adj) atezolizumab (atezo) vs placebo (pbo) in patients (pts) with renal cell carcinoma (RCC) at in- creased risk of recurrence after resection
肾细胞癌切除术后高复发风险患者辅助阿替利珠单抗(ATEZO)与安慰剂(PBO)比较的随机III期研究(IMmotion010)中循环肾损伤分子-1(KIM-1)生物标记物分析
摘要
背景
在IMmotion010中,与安慰剂比较,辅助阿替利珠单抗治疗并没有延长研究者评估的肾癌患者术后无病生存期(DFS;主要终点) (HR:0.93,95%CI:0.75,1.15;P=0.50;Pal Lancet 2023)。这项对循环蛋白生物标志物的探索性分析被用来识别具有微小残留病灶(MRD)的高危患者,这些患者可能显示出辅助阿替利珠单抗治疗的不同获益情况。
方法
肾细胞癌伴透明细胞或肉瘤样成分且术后高复发风险的患者被随机分为阿替利珠单抗1200 mg或安慰剂静脉滴注,q3w,至疗程16周期或1年。采用基于亲和力的邻近延伸分析技术(PEA)对约3000个分析物进行回顾性蛋白质组学分析,以鉴定出匹配血清样本中具有不同丰度模式的循环蛋白(基线与复发时)。然后用高灵敏度的电化学发光(ECL)法检测基线和治疗后血清样本中的KIM-1水平。分析在基线水平处于高水平(≥86pg/ml)和低水平患者的结局。
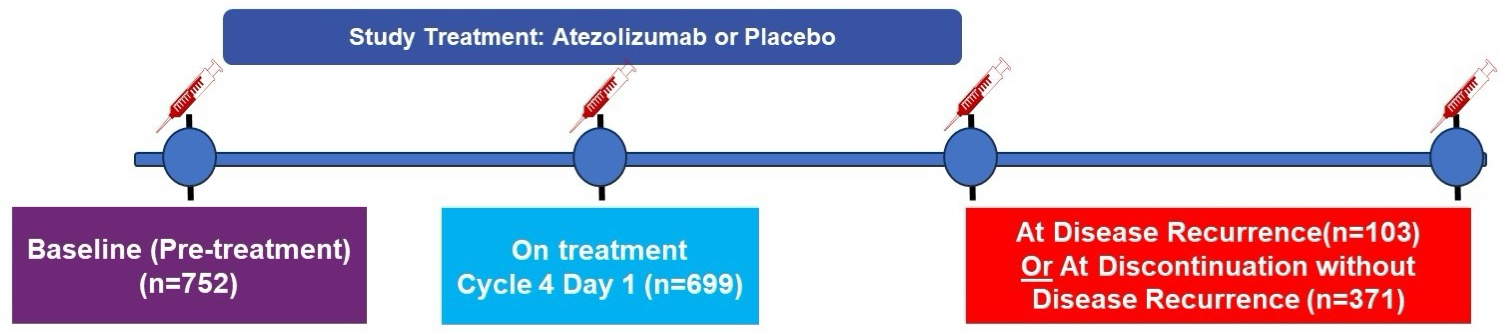
结果
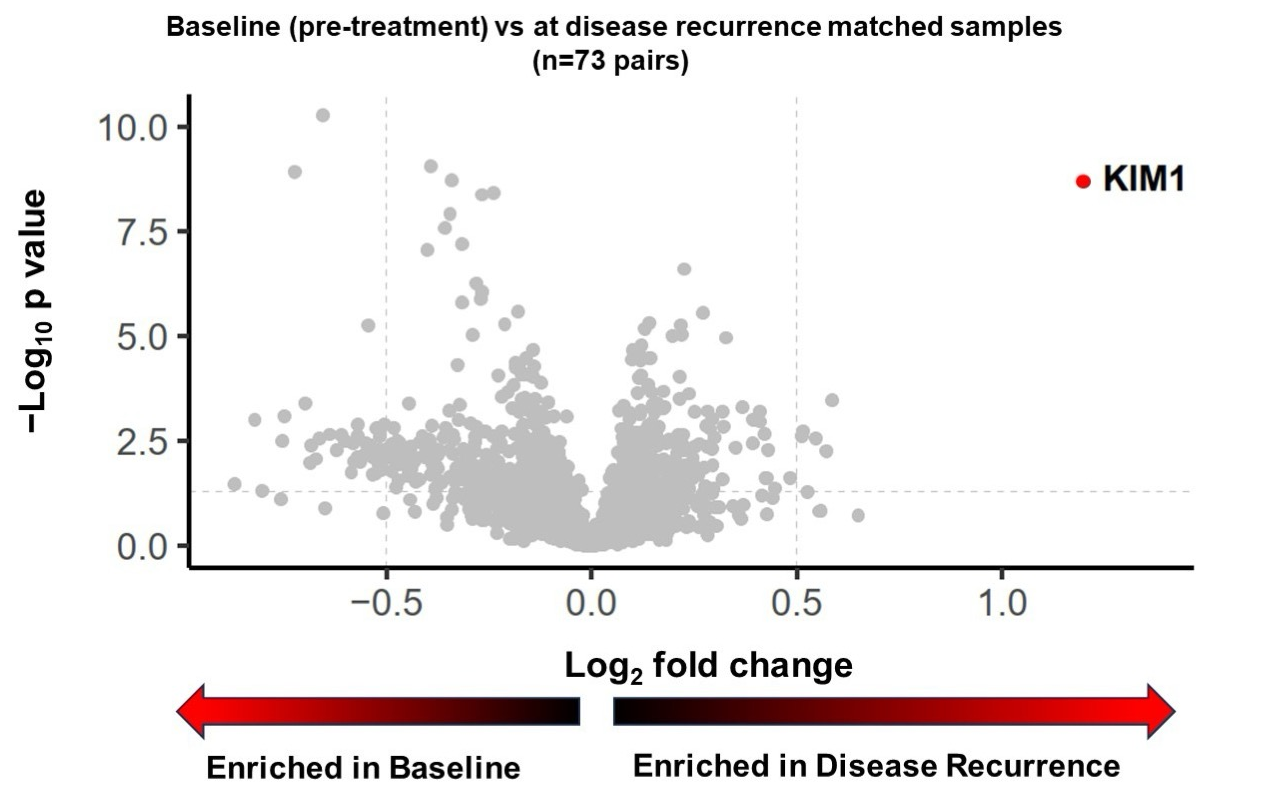
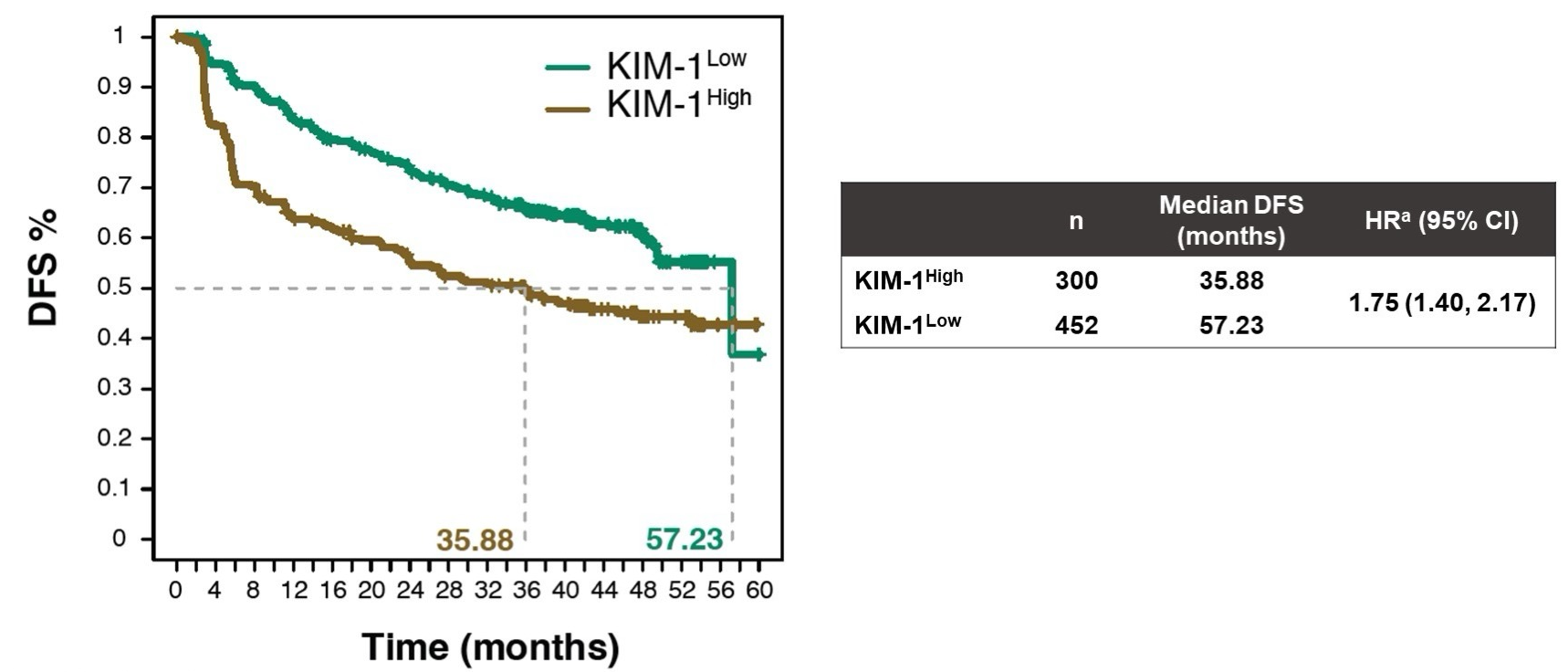
在匹配PEA样本的患者中(n=73),循环KIM-1被鉴定为在复发时与基线时相比表达差异最显著的蛋白。在参加IMmotion010的778名患者中,752名患者(97%)有KIM-1基线数据(表达高的有300人[40%],表达低的有452人[60%])。
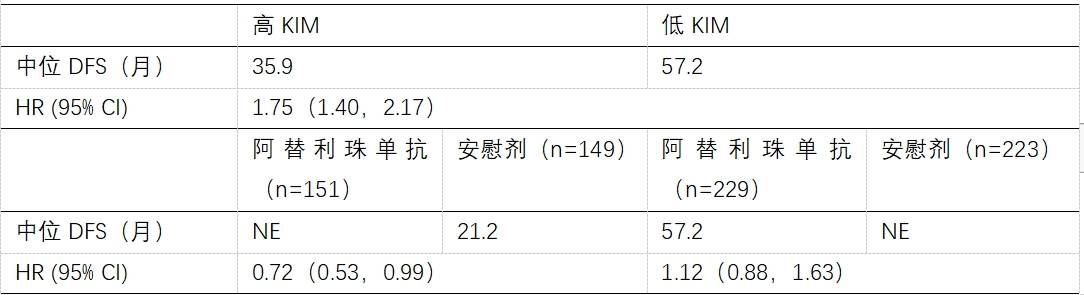
高KIM-1状态与DFS缩短相关。
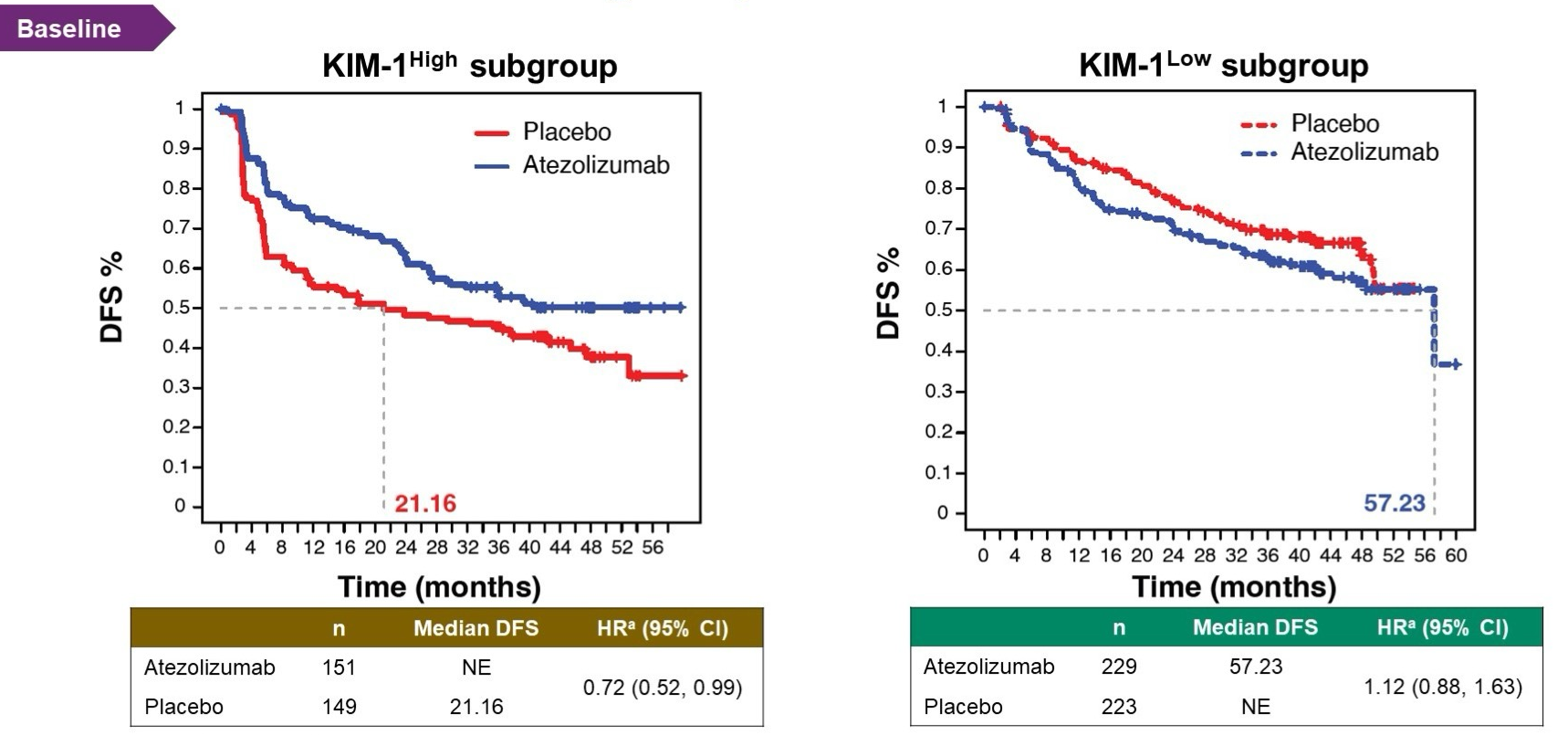
高KIM-1患者使用阿替利珠单抗相对于安慰剂有更好的DFS,而低KIM-1患者使用阿替利珠单抗相对于安慰剂并未显示出DFS获益。
配对样本的纵向分析显示,KIM-1高的患者使用阿替利珠单抗和安慰剂时,分别有9%(12/138)和26%(36/141)的患者在C4D1时其KIM-1水平比基线增加超过30%,而在KIM-1低的患者中,这两个比例分别为16%(34/213)和12%(25/207)。
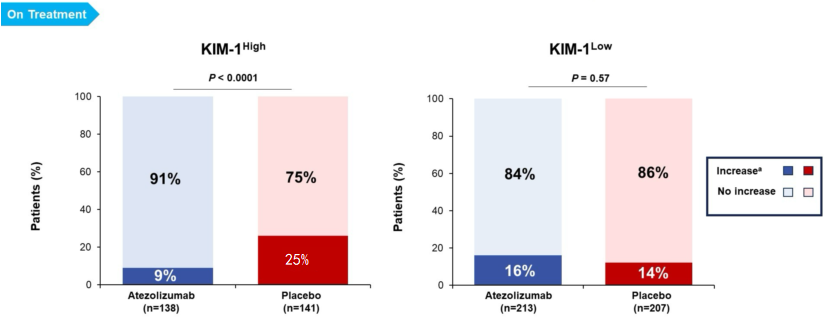
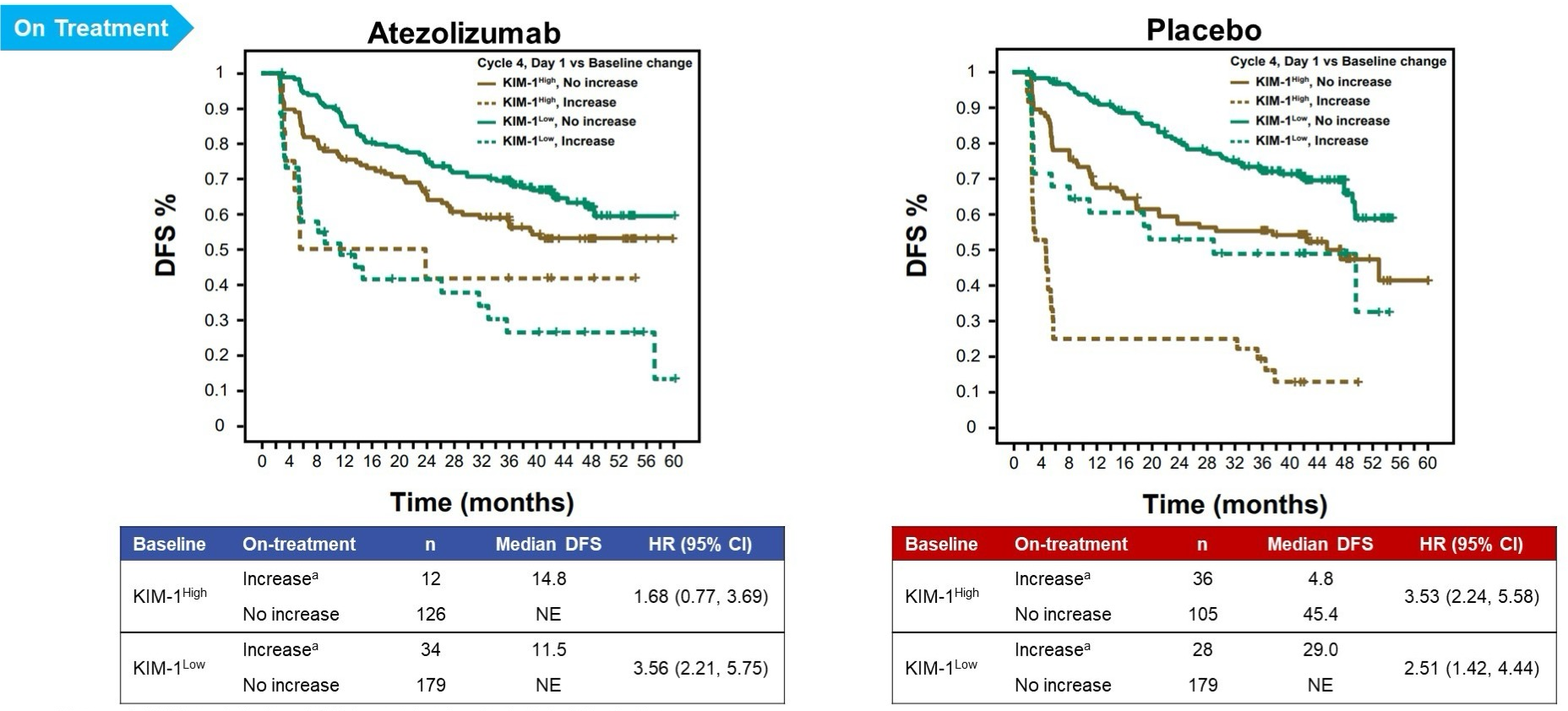
同时在KIM-1高和KIM-1低亚组中,KIM-1水平增加超过30%与DFS恶化相关。
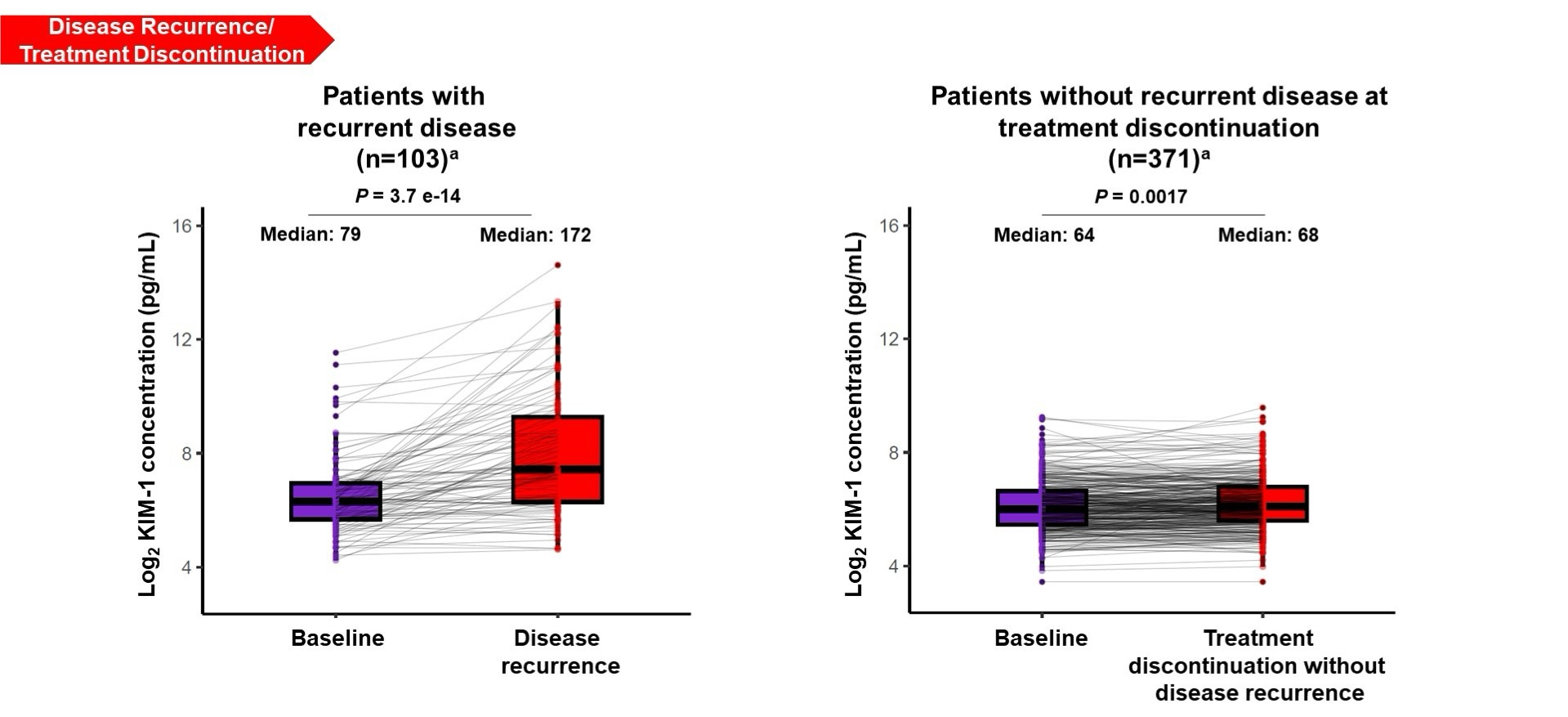
在有匹配ECL样本的患者中,复发时KIM-1中位数(172pg/ml)显著高于基线(79pg/ml)(P<0.001)。
结论
在IMmotion010研究中,高基线血清KIM-1水平与预后较差有关,但与应用阿替利珠单抗辅助治疗的临床疗效改善有关。辅助治疗后KIM-1水平升高与DFS恶化相关。这些数据表明,循环KIM-1可能是MRD和疾病复发的非侵入性标志物,并与肾癌患者辅助阿替利珠单抗治疗的疗效有关。因此有必要对KIM-1在肾癌辅助治疗中的价值进行进一步研究。
解读
肾癌是泌尿系统最常见的恶性肿瘤之一。随着体检的普及,大约80%的患者诊断时为局限性肾癌,其标准治疗方式为肾部分切除术或肾根治性切除术,然而,仍然有许多患者会经历术后复发,5年复发率从低风险患者的10%到高风险患者的68%不等[1]。因此,患者术后复发风险如何评估,什么样的患者能从辅助治疗中获益,仍然是临床需要解决的重要问题。
一、KIM-1是预测肾癌术后复发风险的有效分子标记物
在本项研究中,研究者应用IMmotion010研究的数据,通过对约3000个分析物进行蛋白质组学分析,鉴定出KIM-1是复发时与基线时相比表达差异最显著的蛋白。KIM-1是一种在透明细胞和乳头状RCC中过表达的膜糖蛋白,在血清和血浆中均可稳定保存,适合做外周血中循环分子标记物。既往研究显示,KIM-1可用于检测早期透明细胞性RCC或术后肿瘤残留,也可用于鉴别肾肿物良恶性[2, 3]。在ASSURE研究中,高水平的KIM-1与不良的DFS和OS相关[4]。本研究显示KIM-1水平与DFS成负相关,复发时KIM-1水平显著升高,提示KIM-1在肾癌术后复发风险预测及术后随访监测中的潜在价值。随后该研究进一步探索了KIM-1在术后辅助免疫治疗患者筛选中的作用。
二、KIM-1是筛选肾癌术后辅助免疫治疗获益人群的潜在标志物
尽管在过去几十年中晚期肾癌的治疗取得了较多进展,但对于中高风险的局限性肾细胞癌患者是否进行术后辅助治疗仍存在争议。在靶向治疗时代,S-TRAC试验显示舒尼替尼与安慰剂相比,虽然无病生存率有所提高,但是并未延长患者的总生存时间[5]。其他VEGFR-TKI或mTOR抑制剂辅助治疗试验同样是阴性结果[6]。因此靶向药物并未被推荐为高危肾癌患者术后辅助治疗的选择。在免疫治疗时代,Keynote-564试验证实了术后辅助pembrolizumab与安慰剂比较在DFS和OS上取得了阳性结果,并成功改写了肾癌患者术后辅助治疗的指南[7, 8]。该试验纳入的人群包括中危(pT2,4级或肉瘤样分化;或pT3)或高危(pT4或N+)或M1(在原发肿瘤加软组织转移完全切除<肾切除一年后没有疾病复发的证据)的患者。
借着Keynote-564试验成功的东风,其他免疫检查点抑制剂也进行了肾癌患者术后免疫治疗的探索,但是结果却并不尽如人意,比如IMmotion010研究以及CheckMate 914研究。IMmotion010研究旨在探索辅助阿替利珠单抗治疗对高复发风险肾癌患者DFS的影响[6]。高复发风险患者定义为:pT2,4级或肉瘤样分化;或pT3,3-4级;或pT3b/c/T4;或N1或M1在原发肿瘤加软组织转移完全切除后无肿瘤残留(NED)。在这一研究中,辅助阿替利珠单抗并未显示出更长的DFS,且所有探索性亚组(包括M1 NED亚组、肉瘤样分化亚组和PD-L1表达阳性亚组)均是阴性结果。在CheckMate 914研究中,肾癌患者术后辅助纳武单抗+伊匹单抗同样未延长总体患者DFS,但在肉瘤样分化亚组和PD-L1表达阳性亚组显示出获益[9]。
虽然以上研究均为术后辅助免疫治疗的III期RCT研究,但却得出了不同的结果,提示不同的患者亚群对于辅助免疫治疗可能存在不同的治疗反应。此外,免疫治疗相关不良反应有一定的发生率,这也要求通过筛选合适人群,避免过度治疗。但是,目前临床上对于术后辅助治疗人群的选择主要基于临床/病理特征,尚缺乏有效的分子标记物。因此,探索术后辅助免疫治疗获益人群的分子标记物具有极大应用价值。本项研究发现高KIM-1患者使用阿替利珠单抗辅助免疫治疗后有更好的DFS,治疗组中复发时KIM-1水平增加的患者比例相对于安慰剂组显著降低。在CheckMate914研究中同样显示,高KIM-1的患者辅助纳武单抗+伊匹单抗有获益趋势[9]。这些结果均提示KIM-1可用于筛选高危肾癌患者术后辅助免疫治疗的获益人群,是潜在的分子标记物。
但本研究也存在不足之处,包括:1、不同研究中KIM-1的检测方法存在差异,且表达“高”与“低”的界限并不清楚,因此未来需要更多研究去标准化KIM-1的检测方法和表达阈值。2、本研究并未区分手术方式(肾部分切除术/根治性肾切除术)对KIM-1表达的影响,可能干扰结果的判断。3、既往研究显示KIM-1在尿液中也有一定的浓度,可用于肾癌的检测[10],尿液是相对于血液更无创的液体活检标本,本研究并未研究尿液KIM-1对于肾癌术后辅助治疗的预测价值,需要未来去进一步探索。4、单个分子标记物的效力可能有限,KIM-1需要与其他分子标记物联合应用于术后辅助治疗患者的人群选择。因此,未来有更多的KIM-1相关的研究值得去进一步探索。
朱绍兴教授-福建医科大学附属协和医院
从研究内容方面来看,本研究为肾癌患者术后辅助免疫治疗合适人群的筛选提供了非常好的分子标记物,值得国内同道学习和进一步探索。从该研究的解读来看,陈锦超博士的解读十分到位,不仅包括了摘要的文字版内容,还包含了会议ppt上的详细图表,图文并茂,使人一目了然。该解读分为2个部分,分别对应研究的2个重要结果。在解读中通过查阅相关文献,简述了目前肾癌辅助治疗领域进展、不足和痛点,有效突出了本项研究的重要价值。此外,陈锦超博士还通过对研究的独立分析,指出了本研究的不足之处和未来的研究方向,值得读者深思和启发未来的研究探索。因此,这一解读具有非常好的科学性和启发性。
【温馨提示】:如果您觉得陈锦超医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. Lam JS, Leppert JT, Figlin RA, Belldegrun AS: Role of molecular markers in the diagnosis and therapy of renal cell carcinoma. Urology 2005, 66(5 Suppl):1-9.
2. Scelo G, Muller DC, Riboli E, Johansson M, Cross AJ, Vineis P, Tsilidis KK, Brennan P, Boeing H, Peeters PHM et al: KIM-1 as a Blood-Based Marker for Early Detection of Kidney Cancer: A Prospective Nested Case-Control Study. Clin Cancer Res 2018, 24(22):5594-5601.
3. Xu W, Gaborieau V, Niman SM, Mukeria A, Liu X, Maremanda KP, Takakura A, Zaridze D, Freedman ML, Xie W et al: Plasma Kidney Injury Molecule-1 for Preoperative Prediction of Renal Cell Carcinoma Versus Benign Renal Masses, and Association With Clinical Outcomes. J Clin Oncol 2024:Jco2300699.
4. Xu W, Puligandla M, Halbert B, Haas NB, Flaherty KT, Uzzo RG, Dutcher JP, DiPaola RS, Sabbisetti V, Bhatt RS: Plasma KIM-1 Is Associated with Recurrence Risk after Nephrectomy for Localized Renal Cell Carcinoma: A Trial of the ECOG-ACRIN Research Group (E2805). Clin Cancer Res 2021, 27(12):3397-3403.
5. Ravaud A, Motzer RJ, Pandha HS, George DJ, Pantuck AJ, Patel A, Chang YH, Escudier B, Donskov F, Magheli A et al: Adjuvant Sunitinib in High-Risk Renal-Cell Carcinoma after Nephrectomy. N Engl J Med 2016, 375(23):2246-2254.
6. Pal SK, Uzzo R, Karam JA, Master VA, Donskov F, Suarez C, Albiges L, Rini B, Tomita Y, Kann AG et al: Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2022, 400(10358):1103-1116.
7. Choueiri TK, Tomczak P, Park SH, Venugopal B, Ferguson T, Chang YH, Hajek J, Symeonides SN, Lee JL, Sarwar N et al: Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med 2021, 385(8):683-694.
8. Choueiri TK, Tomczak P, Park SH, Venugopal B, Ferguson T, Symeonides SN, Hajek J, Chang YH, Lee JL, Sarwar N et al: Overall Survival with Adjuvant Pembrolizumab in Renal-Cell Carcinoma. N Engl J Med 2024, 390(15):1359-1371.
9. Motzer RJ, Russo P, Grünwald V, Tomita Y, Zurawski B, Parikh O, Buti S, Barthélémy P, Goh JC, Ye D et al: Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet 2023, 401(10379):821-832.
10. Zhang KJ, Wilson GD, Kara S, Majeske A, Zhang PL, Hafron JM: Diagnostic role of kidney injury molecule-1 in renal cell carcinoma. Int Urol Nephrol 2019, 51(11):1893-1902.











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


