
1. 目前的临床研究表明,以奥拉帕利为代表的PARPi印证了乳腺癌精准治疗时代的到来,多项研究证实PARPi在携带BRCA突变乳腺癌中的确切疗效,且安全性良好。
2. OlympiA是目前唯一针对gBRCAm乳腺癌辅助治疗,且取得明确生存获益的三期临床研究,结果表明,奥拉帕利辅助治疗1年可以显著减少gBRCAm早期乳腺癌患者疾病复发与死亡的风险。
3.探索更优的药物组合及研发新型的PARP抑制剂当前正在进行中。
2024年第115届美国癌症研究协会年会(AACR)已于4月5日~10日在美国圣地亚哥举行。AACR是世界范围内历史悠久,备受瞩目的癌症大会之一,今年有超过2万名来自全世界各地的致力于肿瘤的研究的临床医生、科学家等医疗领域专业人士参会。今年大会的主题是“激励科学、推动进步、革新诊疗”。“合成致死(Synthetic lethality)”赛道是一直备受关注的领域,合成致死理论由来已久,通俗来讲,指两个非致死基因同时失活将导致细胞死亡的现象。PARP抑制剂(PARPi)是首款根据合成致死原理研发的抗癌药,自2014年奥拉帕利问世以来,全球已上市六款PARP抑制剂,深刻改变了卵巢癌、乳腺癌、胰腺癌和前列腺癌的治疗格局。结合本次AACR大会的进展,【肿瘤资讯】特邀中山大学肿瘤防治中心史艳侠教授就PARP抑制剂在乳腺癌治疗中的应用及研究进展方面进行综述,以期为乳腺癌患者的临床用药提供参考依据。
背景介绍
乳腺癌是女性最常见的恶性肿瘤[1]。研究表明,大约5%~10%乳腺癌是有遗传性的, 其中大多数与乳腺癌相关基因的遗传生殖系突变有关,其中最常见的是乳腺癌易感基因(BRCA),BRCA 患病率不仅因家族史而异,而且因乳腺癌亚型而异,与 HR 阳性疾病患者相比,BRCA突变在三阴性疾病患者中更常见,约14%的 TNBC 患者携带 BRCA 突变,HR 阳性疾病患者为6%[2]。BRCA1 和BRCA2 是DNA 同源重组修复(HRR)的关键肿瘤抑制基因,其编码的蛋白质在此过程中发挥重要作用。聚腺苷二磷酸核糖聚合酶(PARP)作为“DNA 断裂传感器”,在DNA损伤后被激活,识别并结合DNA 断裂位点,参与肿瘤细胞DNA 单链损伤的修复[3]。具有HRR 缺陷(HRD)(包括BRCA 等基因在内的HRR 相关基因的功能缺失突变或表观遗传修饰)的肿瘤自身DNA 双链断裂的修复机制不完全,若PARP 抑制剂在DNA 单链断裂修复中施加外源性阻断, 将加剧基因组不稳定性进而导致肿瘤细胞死亡[4-6]。研究表明:与非携带者相比,年轻的BRCA突变携带者在复发和生存率方面表现出较差的预后[7]。
临床研究布局
以奥拉帕利为代表的PARP抑制剂在不断探索对于携带BRCA突变的乳腺癌患者的最佳治疗时机和治疗模式。其中,奥拉帕利和他拉唑帕利已被批准用于治疗携带致病性种系BRCA 突变、HER2 阴性乳腺癌患者。
PARP抑制剂在晚期乳腺癌中的应用
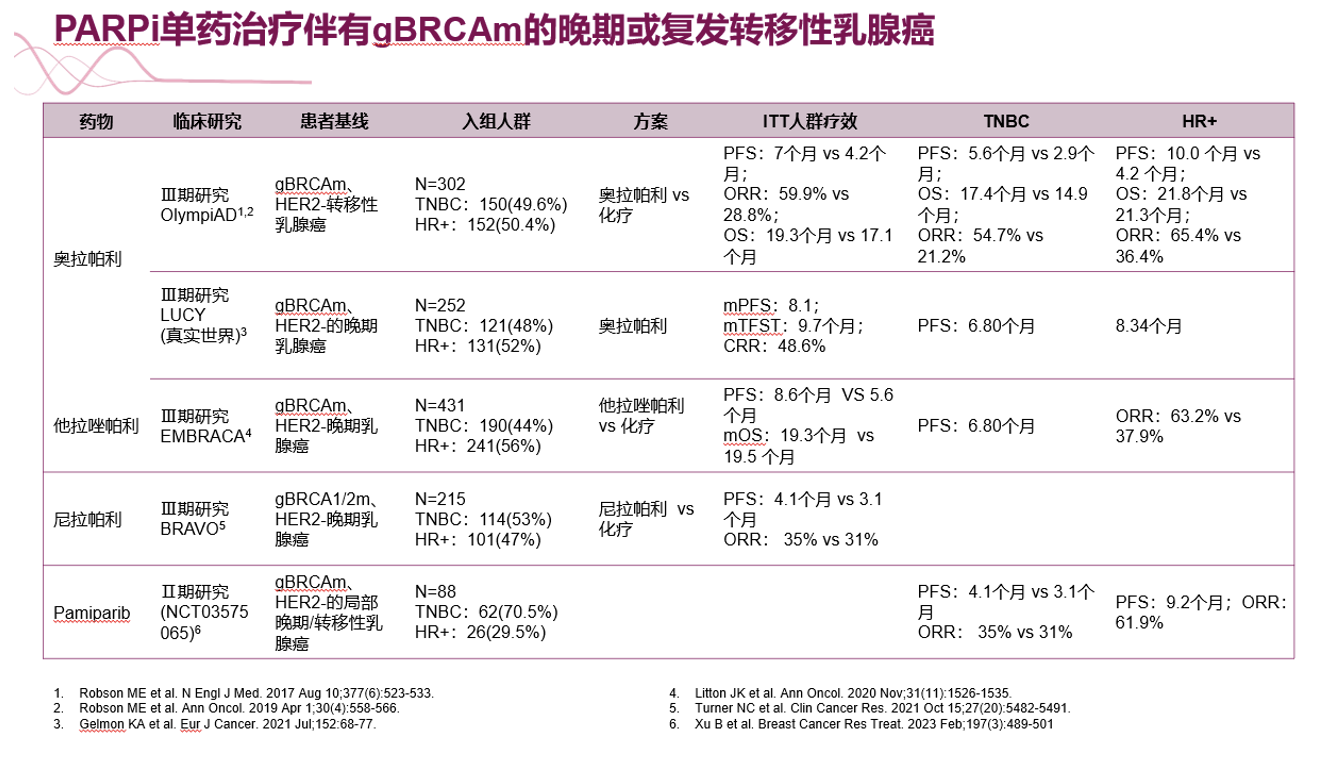
Ⅲ期试验OlympiAD评估了BRCA突变转移性HER2 阴性乳腺癌患者中奥拉帕利单药治疗与TPC 标准化疗(TPC:卡培他滨、艾立布林或长春瑞滨)之间的疗效差异。初步分析显示,奥拉帕利组的无进展生存期(PFS)和总体缓解率(ORR)显著性高于TPC 组(PFS:7 个月vs 4.2 个月, HR,0.58 [95%CI,0.43-0.80];P <0.001);ORR:60 %(95% CI, 52.0 to 67.4) vs 29%(95% CI, 18.3 to 41.3)),奥拉帕利vs TPC组总体人群中位OS增加2.5个月,既往未接受化疗人群的中位OS增加近8个月,提示当作为一线治疗时,奥拉帕利的获益更佳。在安全性方面,奥拉帕利组3 级以上不良事件发生率也较TPC 组明显减少(36.6% vs 50.5%)[8]。基于OlympiAD 试验的阳性结果,2018年奥拉帕利经FDA 批准用于转移性乳腺癌。

与OlympiAD研究结果类似,EMBRACA研究证实Talazoparib可以改善BRCA突变晚期患者的PFS。(PFS:8.6 个月vs 5.6 个月 HR, 0.54 [95%CI, 0.41-0.71]; P < 0.001),ORR:62.6% vs 27.2%,OR, 5.0; [95% CI, 2.9- 8.8]; P<0.001)。2018年,Talazoparib 经FDA批准用于局部晚期/转移性gBRCAm HER2-乳腺癌[9]。
PARP抑制剂在晚期或复发转移性乳腺癌的研究结果如下:
表1 PARP抑制剂单药在晚期阶段开展的临床研究
PARP 抑制剂在早期乳腺癌新辅助及辅助治疗中的探索
基于在转移性乳腺癌中取得的积极结果,PARP抑制剂被引入新辅助/辅助治疗中。与晚期肿瘤相比,早期肿瘤较少出现获得性耐药。将PARP 抑制剂应用于疾病的早期阶段有望取得进一步的治疗进展。
辅助阶段
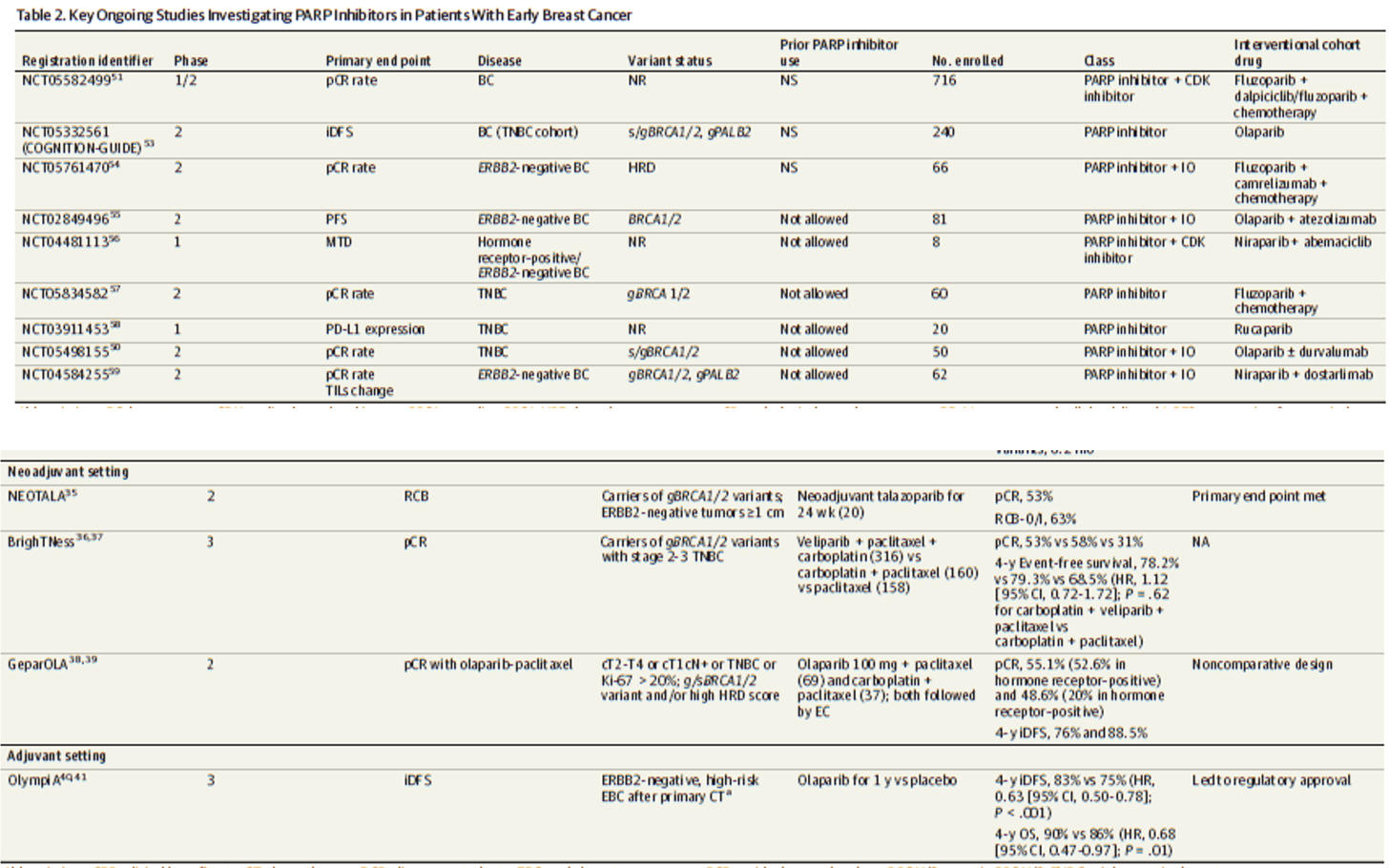
在辅助治疗方面,Ⅲ期OlympiA 试验评估了奥拉帕利作为早期高危乳腺癌患者辅助治疗的疗效与安全性。研究入组人群为,通过当地基因检测或研究期间中心筛选确认为胚系致病性BRCA1/2突变,HER2阴性(激素受体阳性或TNBC),其中TNBC为术后病理分期≥pT2/pN1或NACT后non-pCR,激素受体阳性为术后病理≥4枚淋巴结阳性或NACT后non-pCR且CPS+EG评分≥3。试验共纳入1836 例乳腺癌患者,结果显示,奥拉帕利组的4年无浸润性疾病生存率(iDFS)和4年远端无病生存率(DDFS)较安慰剂组有明显改善(iDFS: 82.7% vs75.4%,HR 0.63 [99.5%CI, 0.50-0.78]; DDFS:86.5% vs 79.1%, HR 0.61 [95%CI ,0.48‒0.77],与安慰剂相比,奥拉帕利也显示出显著的OS获益,死亡风险降低32% (4年OS率:89.8% vs 86.4%,HR 0.68,p=0.009)[10]。此研究结果提示,奥拉帕利辅助治疗可以减少疾病复发与死亡的风险。
目前在早期乳腺癌领域,CDK4/6抑制剂和免疫抑制剂显示出一定的疗效获益,但针对伴BRCA突变人群的研究仍较为匮乏。OlympiA是目前唯一针对BRCAm人群且OS获益的研究,奥拉帕利显著改善伴BRCA突变HER2-BC患者的OS率,可作为治疗伴BRCA突变HER2- BC的有效选择。
基于OlympiA 的积极结果,2022 年3 月FDA批准奥拉帕利作为既往接受过化疗且携带胚系BRCA 突变的高风险HER2 阴性早期乳腺癌患者的辅助治疗方案。各大国内外指南对于伴gBRCA突变HER2-患者,均推荐奥拉帕利辅助或新辅助治疗。

CACA CBCS指南推荐

新辅助阶段
PARP抑制剂在早期新辅助阶段也有研究正在开展。
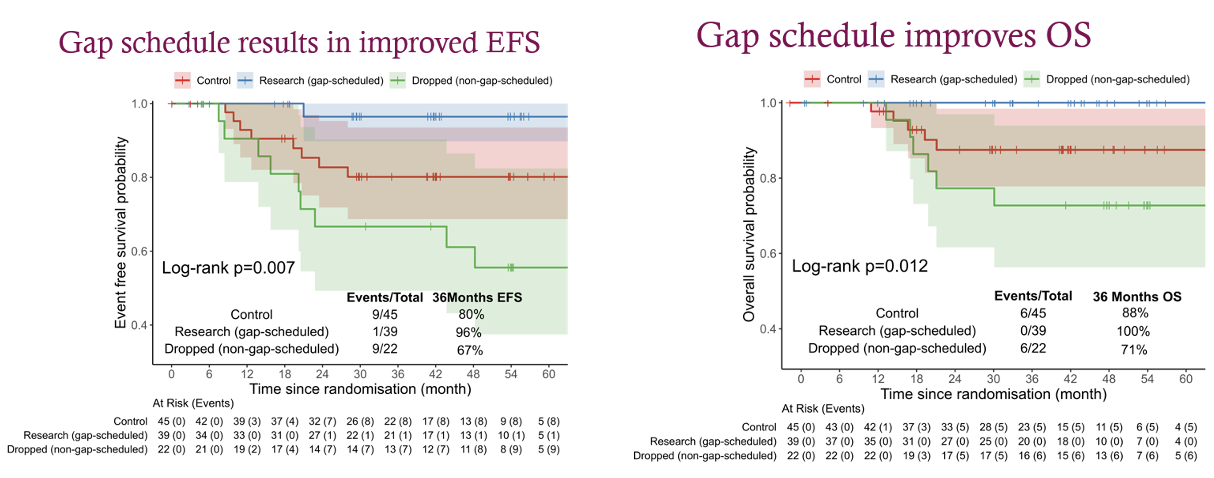
PARTNER研究是一项前瞻性II-III期随机对照临床试验,是第一项在铂类化疗基础上加用奥拉帕利的新辅助治疗研究,特别是采用了“间隔”给药策略,以期减少毒性并提高治疗效果。患者按1:1随机分配到新辅助卡铂联合紫杉醇+/-奥拉帕利,然后在手术前接受3个周期的蒽环类化疗。该试验分别由 gBRCAm 患者和gBRCA 野生型三阴性乳腺癌(TNBC (gRRCAwt))患者两个队列组成。
2024 AACR大会公布结果显示,在携带gBRCA突变(n=84)的乳腺癌患者中, 研究组和对照组的EFS分别为96%和80%。研究组无患者死亡(OS=100%),而对照组的OS为82.8%(log-rank p=0.042)。以上结果表明,奥拉帕利与卡铂/紫杉醇和蒽环类化疗采用48小时“间隔”给药方案(R2),无论pCR状态如何,都能显著改善所有生存终点。这些发现为gBRCA突变乳腺癌患者的治疗提供了新的希望,并为未来的研究提供了方向[11]。
PARP抑制剂在早期乳腺癌的研究汇总:
表2 PARP抑制剂在早期阶段的临床研究
未来治疗策略展望
长期单独应用PARP抑制剂, 患者不可避免地会出现耐药,相关的耐药机制,如HRR活性的恢复、PARP捕获的损伤、药物外排的增加等。克服PARP抑制剂相关的耐药问题,包括研发新型PARP抑制剂以及新型联合疗法等,相关临床研究正在进行中。
联合疗法
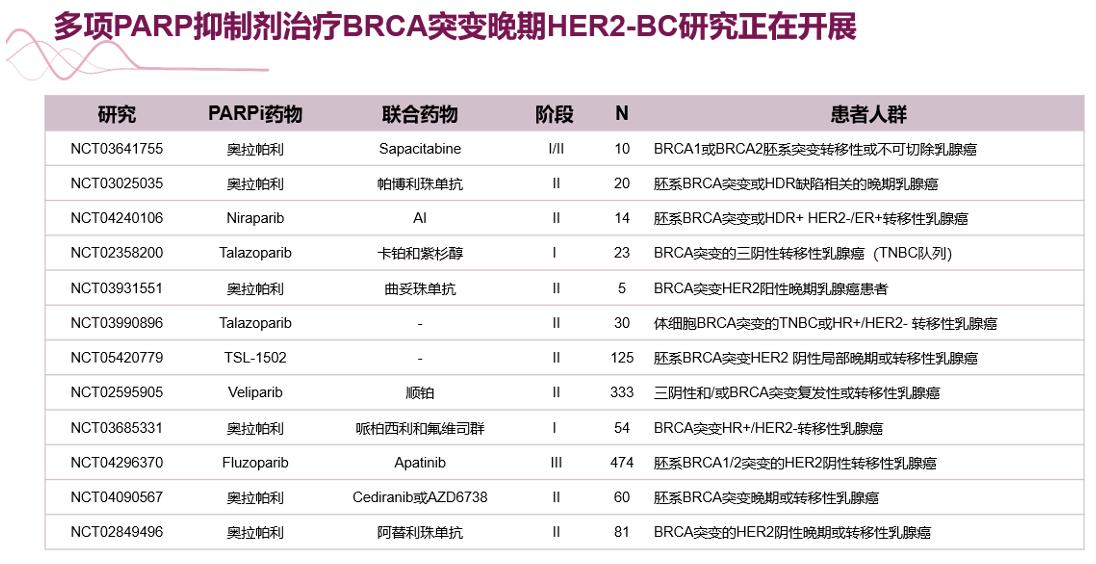
PARP 抑制导致的未修复 DNA 损伤会通过多种机制调节肿瘤免疫微环境,包括形成新抗原和诱导干扰素相关基因(如程序性细胞死亡配体-1)。在临床前模型中,PARP 抑制剂与免疫疗法联合使用可增强免疫反应并协同抑制肿瘤生长。 I-SPY2研究显示奥拉帕利联合PD-L1抑制剂(Durvalumab)和化疗的新辅助方案能够显著改善HER2阴性患者的pCR率(37% vs 20%)[12]。MEDIOLA证实Durvalumab联合奥拉帕利在BRCA突变晚期乳腺癌中具有一定的疗效。研究共入组18例晚期TNBC,结果显示中位PFS为4.9个月,中位OS为20.5个月,ORR超过50%[13]。当前也有很多相关临床研究正在开展。
PARP 抑制剂与其他药物联合治疗乳腺癌的研究也在不断进行,包括奥拉帕利联合曲妥珠单抗用于HER2 阳性乳腺癌的Ⅱ期临床研究(NCT03931551),以及奥拉帕利联合CDK4/6 抑制剂哌柏西利在HR阳 HER2阴转移性乳腺癌开展研究等(NCT03685331)。
新一代 PARP 抑制剂
贫血是当前PARPi最常见的严重不良反应,这主要与其抑制PARP2蛋白有关,但新型药物正试图克服这些局限性。Saruparib(AZD-5305)是高选择性靶向PARP 1的新一代口服抑制剂,有效避免因抑制PARP2导致的毒性反应。1/2 期PETRA试验评估了saruparib对携带 HRR 基因致病性改变的转移性肿瘤患者的治疗效果,该研究分为剂量递增part A和剂量扩展part B两部分,在剂量递增part A阶段,主要纳入晚期/转移性 HER2-乳腺癌、卵巢癌、胰腺癌或前列腺癌患者,允许既往使用≤1种PARP抑制剂;剂量扩展part B阶段,则主要纳入HER2阴性乳腺癌且对PARP抑制剂敏感的患者。2024年AACR大会公布了在HER2阴性乳腺癌上的结果[14],试验的B1部分, saruparib在20mg、60mg和90mg不同剂量水平下均产生肿瘤缓解。不同剂量水平的疗效数据和安全性如下表所示,与已获批准的PARP 抑制剂相比,Saruparib 具有更高的靶点覆盖率,安全性更好,其中所有级别贫血发生率为36%,三级及以上发生率为15%,远低于其他PARP抑制剂的贫血发生率;其中60mg每日一次表现出深度和持久的缓解,其客观缓解率(ORR)达48.4%,中位缓解持续时间(DOR)达7.3个月,中位无进展生存期(PFS)为9.1个月,并且在既往接受过多线治疗的患者人群也展示出较长的PFS,包括携带不同HRR突变的乳腺癌患者,基于这些结果,研究者确定了推荐的II期剂量为60mg。目前,Saruparib的三期临床研究正在规划中,期待未来更多临床数据。

本期特邀专家—史艳侠 教授
中山大学附属肿瘤医院大内科副主任
中国抗癌协会青年常务理事
中国老年保健协会乳腺癌专业委员会主委
中国抗癌协会少见病及原发灶不明肿瘤专委会副主委
中国抗癌协会临床化疗专业委员会秘书长,青委会常务副主委
中国临床肿瘤肿瘤协会(CSCO)理事
广东省医学会肿瘤内科分会秘书长兼青委会主委
广东省胸部肿瘤防治研究会乳腺癌分会副主任委员
广东省女医师协会乳腺癌分会副主任委员
总结与展望
目前的临床研究表明,PARP 抑制剂单药在BRCA 突变晚期乳腺癌解救治疗及早期乳腺癌的新辅助及辅助治疗中均取得了良好的疗效和耐受性。其中,OlympiAD研究表明,在晚期携带BRCA突变的HER2 阴性乳腺癌患者中,奥拉帕利单药治疗将患者的PFS由标准治疗组的4.2个月提升到7.0个月(HR,0.58 [95%CI,0.43-0.80];P <0.001),极大改善了患者预后。而在早期阶段开展的OlympiA研究结果则表明,奥拉帕利辅助治疗可以显著减少疾病复发与死亡的风险,奥拉帕利组的4年iDFS和4年DDFS较安慰剂组有明显改善(iDFS:82.7%vs75.4%, HR 0.63 [99.5%CI,0.50-0.78]; DDFS:86.5% vs 79.1%, HR 0.61 [95%CI ,0.48‒0.77])。
但长期单药应用所产生的PARP 耐药无法避免,因此,探索更优的药物组合及研发新型的PARP抑制剂刻不容缓。除此之外,合理应用人群的选择及预测性生物标志物的发现可能为PARP 抑制剂在乳腺癌治疗中的发展提供新思路。
[1] Sung H,Ferlay J,Siegel RL,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3): 209-249.
[2] Dorling L,Carvalho S,Allen J,et al. Breast cancer risk genes-association analysis in more than 113,000 women [J]. N Engl J Med,2021,384(5):428-439.
[3] Li H,Liu ZY,Wu N,et al. PARP inhibitor resistance: the underlying mechanisms and clinical implications[J]. Mol Cancer,2020,19(1):107.
[4] Miller RE,Leary A,Scott CL,et al. ESMO recommendations on predictive biomarker testing for homologous recombination deficiency and PARP inhibitor benefit in ovarian cancer[J]. Ann Oncol,2020,31(12):1606-1622.
[5] Yamamoto H,Hirasawa A. Homol recombination deficiencies and hereditary tumors[J]. Int J Mol Sci,2021,23(1):348.
[6] Herzog TJ,Vergote I,Gomella LG,et al. Testing for homologous recombination repair or homologous recombination deficiency for poly(ADP-ribose) polymerase inhibitors:a current perspective[J]. Eur J Cancer,2023,179:136-146.
[7] Tinterri C et al. Cancers (Basel). 2023 Aug 19;15(16):4177.
[8] Robson ME,Tung N,Conte P,et al. OlympiAD final overall survival and tolerability results: olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer[J]. Ann Oncol,2019,30(4):558-566.
[9] Litton JK,Hurvitz SA,Mina LA,et al. Talazoparib versus chemotherapy in patients with germline BRCA1/2-mutated HER2-negative advanced breast cancer: final overall survival results from the EMBRACA trial [J]. Ann Oncol,2020,31(11): 1526-1535.
[10] Tutt A,Garber JE,Kaufman B,et al. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer [J]. N Engl J Med,2021,384(25):2394-2405.
[11] Abraham JE, Pinilla K, Dayimu A, et al. The PARTNER trial of neoadjuvant olaparib in triple-negative breast cancer. Nature. Published online April 8, 2024. doi:10.1038/s41586-024-07384-2
[12] Pusztai L et al. Cancer Cell, 2021, 39(7): 989-998; e5.
[13] Domchek SM, Postel-Vinay S, Im SA, et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study. Lancet Oncol. 2020;21(9):1155-1164. doi:10.1016/S1470-2045(20)30324-7
[14] 2024 AACR , PETRA Module 1: a first-in-human, Phase 1/2a study of saruparib monotherapy (NCT04644068)
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


