由福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周四推出,带您用中文听原汁原味的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)研究。本期十邑论坛中,范德堡大学Jordan Berlin教授分享了神经内分泌肿瘤(NET)中进行的NETTER-2和KRAS G12C抑制剂Glecirasib治疗胰腺癌的表现,【肿瘤资讯】特邀泉州市第一医院洪燕妮教授进行相关研究解读。
泉州市第一医院 肿瘤内科副主任医师
福建省抗癌协会癌痛专委会委员
福建省抗癌协会中西医整合肿瘤专业委员会青年委员
福建省抗癌协会肿瘤营养与支持治疗专业委员会青年委员
泉州市抗癌协会免疫治疗专业委员会委员
NETTER-2研究
NETTER-1研究在肽受体放射性核素疗法(PRRT)还不普及的时代开展。研究入组局部晚期或转移性分化良好中肠NET患者,要求入组患者Ki-67<20%,生长抑素受体阳性,并在接受固定剂量长效(LAR)奥曲肽治疗后进展。患者随机接受PRRT+30 mg奥曲肽LAR或双倍剂量奥曲肽LAR治疗。主要研究终点无进展生存期(PFS)的HR值达到0.21,中期分析时次要终点总生存(OS)HR达到0.40。因此PRRT获得美国食品药品监督管理局(FDA)批准用于胃肠胰神经(GEP)NET患者的治疗。
NETTER-2研究评估了[177Lu]Lu-DOTA-TATE一线治疗初诊分化良好G2,G3胃肠胰NET患者的疗效。分化良好G3 NET占GEP NET的6%,但是目前获批疗法的疗效在此类患者中还不清楚。分化良好G2,G3 NET目前没有标准治疗方案。
NETTER-2是第一项评估放射性配体疗法(RLT)在实体瘤中一线应用的试验。研究纳入入组前6个月内新诊断为生长抑素受体阳性的高分化G2,G3,10%≤Ki-67≤55%的晚期胃肠胰NET患者。患者2:1随机接受4周期[177Lu]Lu-DOTA-TATE+30 mg奥曲肽LAR或大剂量奥曲肽LAR 60 mg治疗。主要终点是PFS(图1)。
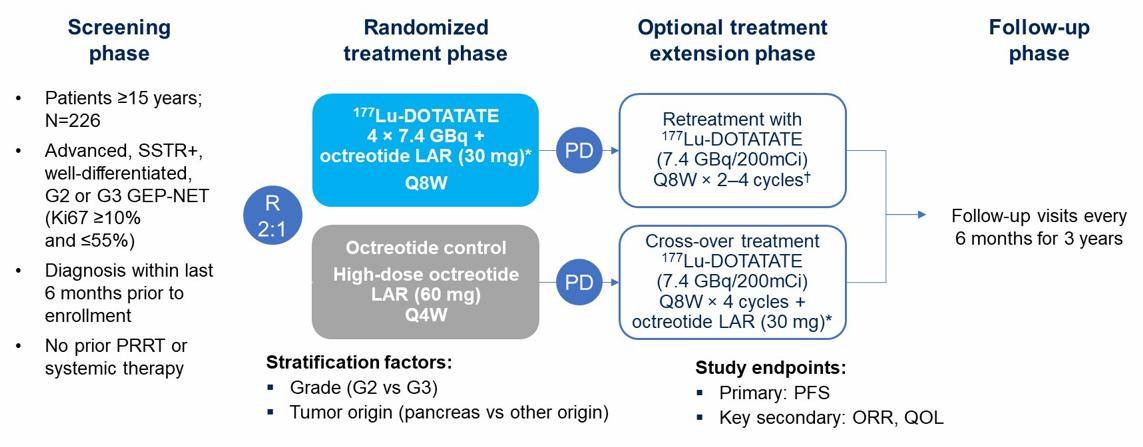
图1 NETTER-2研究设计
研究达到主要终点,两组中位PFS分别是22.8个月 vs 8.5个月(HR 0.276),试验组将疾病进展风险降低72%(图2)。
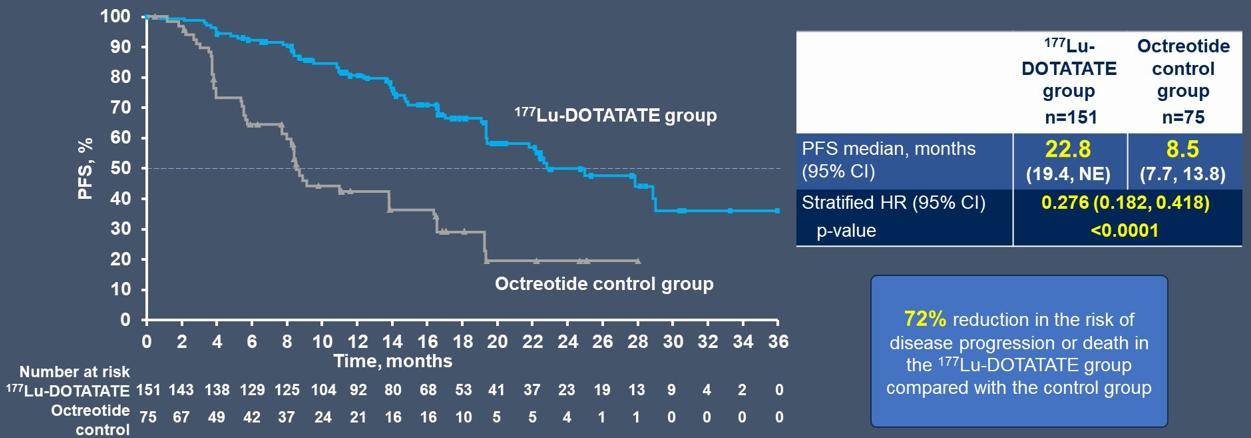
图2 NETTER-2研究PFS
两组都没有特殊毒性反应。试验组≥3级不良事件(AE)发生率更高,两组分别是16% vs 4%。但是两组生活质量恶化时间相似。
研究为交叉设计,OS不一定有显著差异。如果将PRRT作为一线治疗不影响OS,则初始治疗未必要从PRRT开始。因此OS依旧是需要考虑的重要指标。
研究打破了很多误解。首先既往认为NET对放射治疗不敏感,但是事实证明其对放射治疗敏感,NETTER-1,NETTER-2和美国加州大学旧金山学校的回顾性研究等均证实了这点,因此也需要重新思考如何利用局部放射治疗。第二是NET非常罕见,难以开展临床试验,事实证明不仅可以进行依维莫司和PRRT的研究,还可以在NET亚型中进行研究。第三是随机化研究应该按照1:1分组,但是ECOG - ACRIN GI委员会中更多人支持按2:1随机分组,因为能够给患者更多机会来进入试验组。高Ki-67增殖指数G2 NET患者不能从长效生长抑素类似物(SSA)治疗中受益,部分患者具有良好的无进展生存期(PFS),PROMID研究中对照组中位肿瘤进展时间(TTP)为14.3个月。部分患者得益于接受治疗的时间很长,部分患者肿瘤本身生长非常缓慢,目前仍然不能确定如何预测不接受治疗和接受治疗的患者中,哪组PFS最长。
NETTER-1研究具有OS获益,即使对于OS较长的肿瘤,OS依旧是重要参考指标。尽管PRRT毒性不大,但是风险依旧存在,长期可能存在骨髓增殖的问题。因此如果PRRT不能改善OS,未必需要作为初治治疗。另外需要对Ki-67等生物标志物进行前瞻性分析。
NETTER-1研究得出以下结论:第一,研究得出阳性结果,[177Lu]Lu-DOTA-TATE联合SSA可作为G2,G3 NET患者的治疗选择,但是如果没有生存数据或延迟生活质量恶化时间,不一定是一线治疗选择,应彻底讨论所有治疗选择。后续还需要明确肿瘤负荷的影响。NETTER-1研究中≥3 cm的肿瘤从PRRT中获益较小,因此对于肝转移灶较小、较低全身肿瘤负荷的患者可能会从SSA开始治疗,对于>3 cm的肿瘤则将SSA和PRRT作为初治治疗。如果担心肿瘤生长会增加腹膜后肿瘤负荷和PRRT治疗风险,也可以将PRRT作为初治治疗。
KRAS抑制剂研究
现在胰腺癌的5年OS率为13%,已经较既往具有很大进步。且随着研究发展,既往不可成药的KRAS靶点已经获得治疗突破。
Glecirasib是一种高选择性口服KRAS G12C抑制剂,已经在非小细胞肺癌和结直肠癌中表现出良好临床活性,然而在KRAS G12C突变胰腺癌或其他实体瘤中的疗效和安全性还不清楚。研究评估了Glecirasib治疗KRAS G12C突变和其他实体瘤的疗效。
约1%~3%的胰腺癌携带KRAS G12C突变。研究中胰腺癌患者入组较多,且具有良好反应性,客观反应率(ORR)达到54.8%,疾病控制率(DCR)达到93.5%。胆道癌的ORR达到71.4%,DCR达到100%(表1)。22.6%的胰腺癌患者肿瘤退缩超过了50%(图3)。
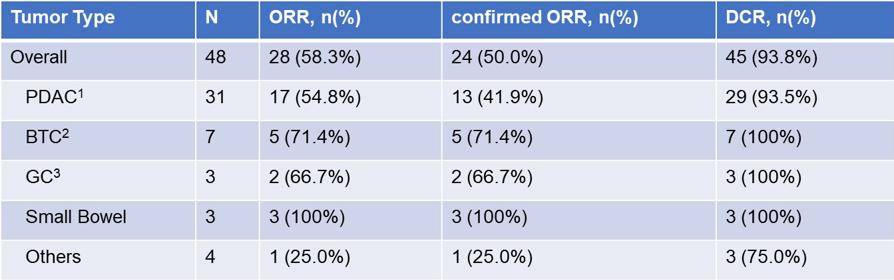
表1 不同瘤种中Glecirasib的反应率

图3 Glecirasib的肿瘤变化和治疗持续时间
数据截止时(2023年12月6日),41.9%的胰腺癌患者仍在接受治疗。Glecirasib在胰腺癌患者中的中位PFS是5.6个月,中位OS 10.7个月(图4)。Adagrasib在胰腺癌中的中位PFS是5.4个月,中位OS 8.0个月;Sotorasib的中位PFS 4.0个月,中位OS 6.9个月。3项研究数据相当,但是都是小型研究,还无法确定哪种药物是最优选择。
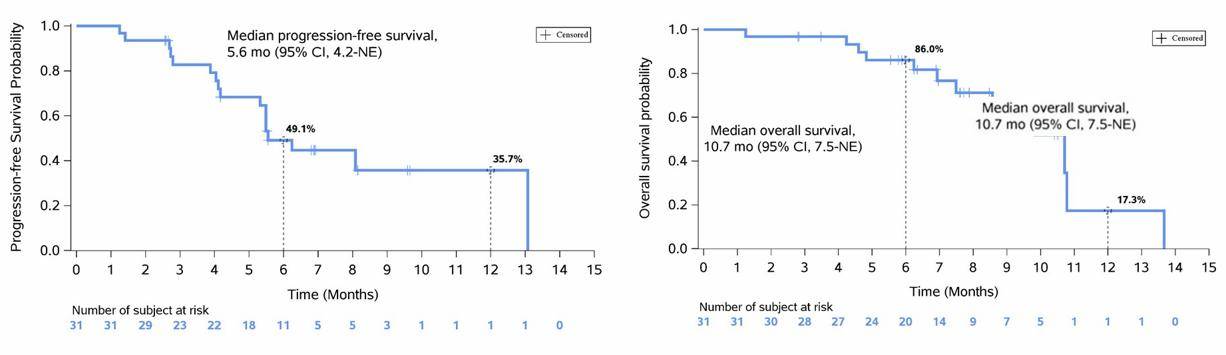
图4 Glecirasib治疗胰腺癌的PFS和OS
98%的患者发生了治疗出现AE(TEAE),其中92%和药物相关。治疗相关AE(TRAE)大多是1~2级,26%的患者发生≥3级TRAE,严重TRAE发生率仅为6%。10%的患者因TRAE减量,没有导致停药或死亡的TRAE报道。最常见的TRAE是贫血、胆红素升高和疲乏。但是长期用药基础上,低级别副作用也会导致生活质量的显著影响。
阻断RAS可能会抑制胰腺癌生长,但是难以完全杀灭胰腺癌。可以联合使用针对其他靶点的药物,如SHP2,MEK, EGFR,PI3K,AKT等。需要研究如何使用这些药物。针对KRAS G12D,G12V和泛RAS抑制剂等药物正在研发中。
有效的RAS抑制剂正处于起步阶段,阳性结果令人鼓舞,未来的联合治疗研究更具前途。RAS可以导致其他胃肠道肿瘤的发生,KRAS G12C抑制剂对于所有肿瘤均显示出有效性,包括胰腺癌,胆道肿瘤,结直肠癌和小肠肿瘤等。胰腺癌患者进行二代测序(NGS)具有重要临床意义,RAS,BRCA,其他DDR等均可能是可靶向靶点。转移性胰腺癌患者应进行NGS检测。
大家可以自行下载对应幻灯,再配合本音频听,效果更好。
排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


