在局部晚期或转移性三阴性乳腺癌(mTNBC)的治疗历程中,一度因缺乏靶点而依赖化疗,但疗效不尽人意。随着抗体偶联药物(ADC)技术日益成熟,我们已经进入了乳腺癌治疗的“ADC时代”。面对多种ADC药物,精准选择及布局ADC1-ADC2的续贯策略已成为精准治疗的关键。本期【肿瘤资讯】邀请西安交通大学第一附属医院杨谨教授,深入探讨mTNBC治疗策略的优化之道。
特邀嘉宾:杨谨教授
西安交通大学第一附属医院癌症中心主任
中国研究型医院学会乳腺癌专业委员会常委
国家肿瘤质控中心乳腺癌专业委员会委员
中国临床肿瘤学会(CSCO)乳腺癌专委会委员
中国抗癌协会乳腺癌专业委员会委员
中国女医师协会临床肿瘤专委会常委
中国医师协会肿瘤分会乳腺专业委员会委员
中国抗癌协会肿瘤标志物专委会乳腺学组副主任委员
中国研究型医院学会精准医学与肿瘤MDT专委会乳腺学组副组长
中国抗癌协会肿瘤整合心脏专委会委员
陕西省医学会肿瘤内科分会常务委员
陕西省抗癌协会抗癌药物专业委员会主任委员
陕西省抗癌协会生物治疗专业委员会侯任主委
西安市癌症康复协会肿瘤精准治疗专委会主任委员
美国马里兰大学Marlene and Stewart Greenbaum 肿瘤中心访问学者
陕西省五一巾帼标兵
发表论文50余篇,SCI收录47篇
主持国家自然科学基金面上项目4项
获得陕西省科技进步奖2项,高校科技进步奖2项
证据更新,洞悉新知
指南推荐更新:2024年NCCN乳腺癌指南(2024.V1)将SG列为mTNBC二线治疗全人群1类优选推荐,即SG可用于接受过至少一种既往治疗方案的mTNBC患者。如果二线治疗未使用SG,可以考虑用于后线治疗[1]。
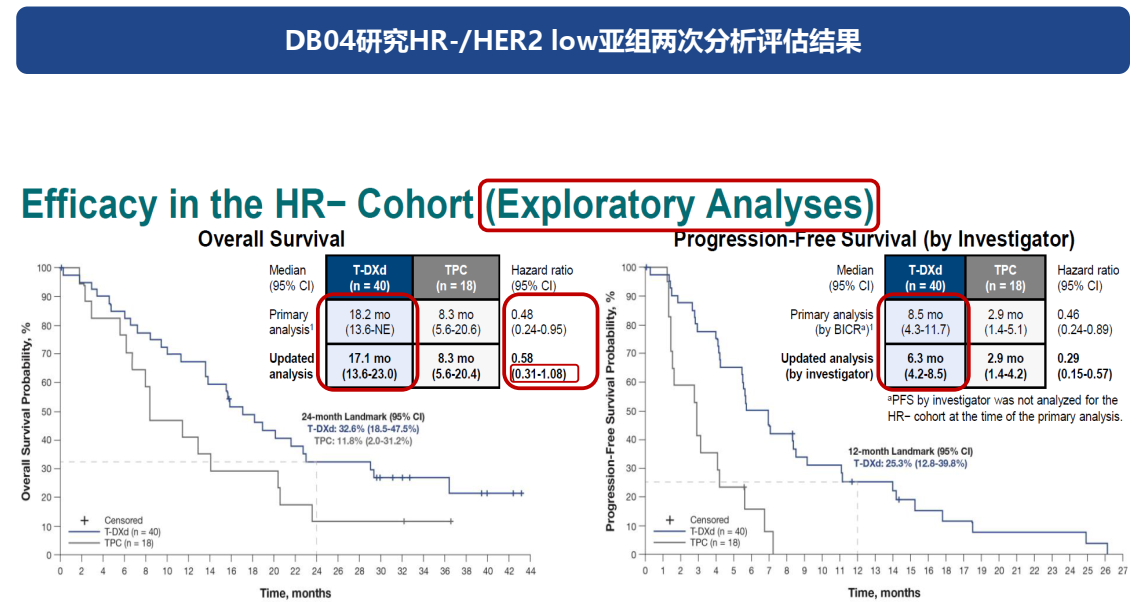
DESTINY-Breast04研究HR-/HER2低表达亚组探索性分析数据(非预设终点)更新:2023年ESMO年会公布研究者评估的数据显示,对于HR-/HER2低表达亚组探索性分析数据(该亚组未进行正式比较,未提供该分析的P值[2])T-DXd组和医生选择治疗(TPC)组的中位无进展生存期(mPFS)分别为6.3个月和2.9个月(HR=0.29,95%CI:0.15-0.57);中位总生存期(mOS)分别为17.1个月和8.3个月(HR=0.58,95%CI:0.31-1.08)(HR值由0.48更新为0.58,且置信区间跨1),OS的获益似乎有下降趋势。
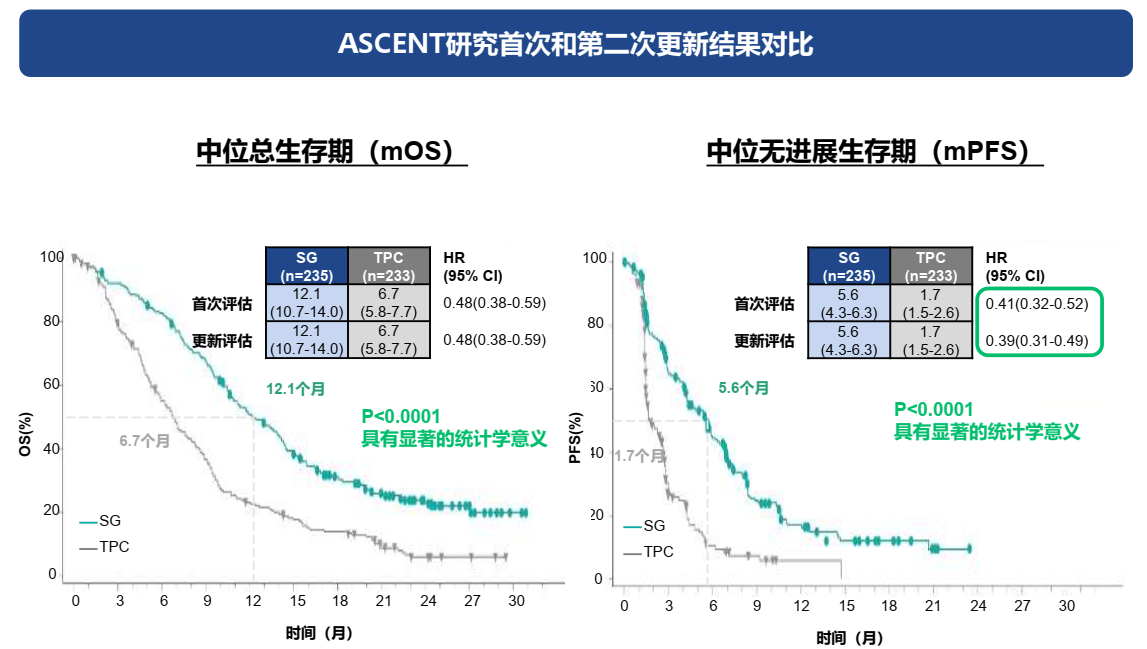
ASCENT研究数据更新:2022年ASCO年会ASCENT研究第二次评估结果显示,SG组与TPC组mPFS的HR值进一步降低至0.39(95%CI:0.31-0.49),mOS保持不变,同时,mPFS和mOS两项结果的统计学P值由0.001进一步下降至0.0001[3],多次更新的数据再次确认了ASCENT研究的获益稳健。
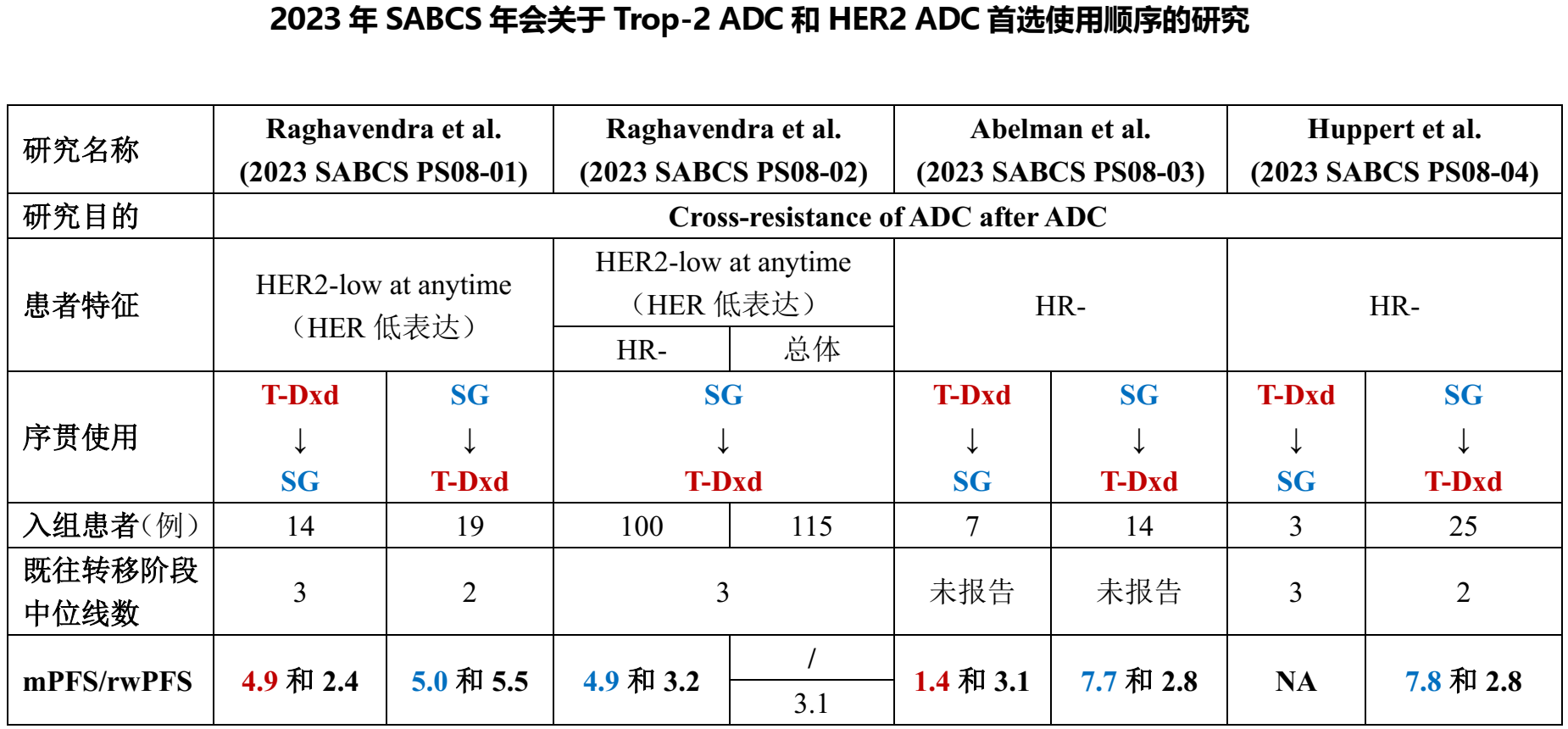
ADC1-ADC2的续贯治疗策略:2023年SABCS会议,专题讨论环节探讨了不同靶点ADC在TNBC治疗中的使用顺序。根据A3研究[4]等多项研究数据,将SG作为首次ADC治疗(ADC1)后序贯使用T-DXd作为第二种ADC治疗(ADC2)(ADC1和ADC2阶段mPFS分别为7.7个月和2.8个月),可能带来更佳的整体疗效。然而,这一结论仍需进一步研究来验证。
“破局者”ADC撬动mTNBC精准治疗新时代
TNBC是一种缺乏雌激素受体、孕激素受体和人表皮生长因子受体2表达的侵袭性乳腺癌,其特点是高复发率和低生存率。临床上mTNBC的一线治疗依赖于化疗,包括单药或联合化疗方案,但一线治疗失败后,二线化疗生存获益十分有限。随着兼具高特异性靶向和细胞毒性双重优势的ADC问世,突破了mTNBC系统治疗的瓶颈,打破了mTNBC的治疗困局。
SG是一款first-in-class 抗Trop-2 ADC,由人源化单克隆抗体hRS7 IgG1κ、拓扑异构酶抑制剂(SN-38)和可水解的连接子(CL2A)组成,药物/抗体比约为8。基于ASCENT 研究成果,SG于2020年获得了FDA的优先评审和加速审批,2021年完全批准,成为全球首款获批用于治疗晚期TNBC的Trop-2 ADC。2022年6月,基于ASCENT研究和中国桥接研究EVER-132-001的成果,SG在中国附条件获批,用于接受过至少2种系统治疗(其中至少1种为针对转移性疾病的治疗)的不可切除局部晚期或转移性TNBC成人患者,并于2024年3月完全批准其适应症。开辟了mTNBC ADC治疗的新路径。
德曲妥珠单抗是一种靶向HER2的ADC,由人源化抗HER2免疫球蛋白G1(IgG1) 单克隆抗体,通过可裂解四肽连接子与DXd(依喜替康衍生物、拓扑异构酶I抑制剂)共价连接而成,药物/抗体比约为8。基于DESTINY-Breast04研究(简称DB-04),T-DXd于2022年8月和2023年7月分别获得FDA和NMPA批准,用于HER2低表达(IHC 1+或IHC 2+/ISH-)乳腺癌,为HER2低表达mTNBC的治疗带来了新思路。
近期,两款获批药物有研究数据更新,为指导临床治疗决策带来了新启示。
疗效新证,ADC在mTNBC中的治疗获益
HER2低表达mTNBC:DB-04探索性亚组数据更新
DB-04研究[4]是一项关于T-DXd治疗 HER2 低表达晚期乳腺癌的Ⅲ期临床试验,纳入557例接受过1至2线化疗的HER2低表达患者(90%为HR+患者),2:1随机分配至T-DXd组(5.4 mg/kg,Q3W)或TPC组。
2022年ASCO年会,DB-04研究首次公布盲法独立中心审查(BICR)评估的HR-/HER2低表达(即HER2低表达mTNBC)探索性亚组数据(非预设终点)。结果显示,T-DXd组(n=40)与TPC组(n=18)的mOS分别为18.2个月和8.3个月(HR=0.48,95%CI:0.24-0.95),mPFS分别为8.5个月和2.9个月(HR=0.46,95%CI:0.24-0.89)[4]。随后,2023年ESMO年会,HR-/HER2低表达亚组数据更新(研究者评估)显示,T-DXd组和TPC组的mOS分别为17.1个月和8.3个月(HR=0.58,95%CI:0.31-1.08);mPFS分别为6.3个月和2.9个月(HR=0.29,95%CI:0.15-0.57),TPC组的mPFS和mOS数据保持不变[2]。
更新的数据分析表明,T-DXd组OS绝对值优于TPC组,尽管OS的改善趋势与初次公布的数据相比似乎有所减缓。然而,值得注意的是,这一探索性的亚组分析并未进行正式的统计比较,未获得相应的P值来支持这一结论。鉴于两次数据更新之间不可直接比较且HER2低表达亚组的样本量有限,其临床效益的确认仍需更大规模研究的验证。
mTNBC:ASCENT研究数据更新
ASCENT研究[5]是一项国际、多中心、随机、对照Ⅲ期临床试验,旨在比较SG与TPC在既往接受过至少二线化疗的mTNBC患者的疗效。研究纳入529 例患者,按照1:1随机分配至SG组(10mg/kg,第1天和第8天静脉注射,每21天一周期)或TPC组(卡培他滨、艾立布林、长春瑞滨或吉西他滨)直到疾病进展或出现不可耐受的毒性。
2021年4月,《新英格兰医学杂志》发表了ASCENT研究的初步结果,显示SG组与TPC组的mOS分别为12.1个月和6.7个月(HR=0.48,95%CI:0.38-0.59);mPFS分别为5.6个月和1.7个月(HR=0.41,95%CI:0.32-0.52)[5]。2022年ASCO年会ASCENT研究第二次评估结果显示,两组的mPFS的HR值进一步降低至0.39(95%CI:0.31-0.49),mOS保持不变,对照组TPC组mPFS和mOS保持不变[3]。在两次分析中,无论是mOS还是mPFS的获益均具有显著的统计学意义,并且在第二次分析中P值缩小10倍(P<0.001→0.0001),进一步说明SG治疗组对比TPC治疗组在OS和PFS中的统计学差异更为显著。
作为全球首个靶向Trop-2的ADC,SG在mTNBC治疗中的重要性不言而喻。研究表明,Trop-2在多种实体瘤中过表达,这一现象与多种恶性肿瘤的不良预后密切相关;在TNBC中,约80%-90%存在Trop-2过表达[6]。在ASCENT研究中,82%的患者呈现Trop-2中高表达,而SG无论在何种Trop-2表达水平下,其疗效均显著优于TPC[7]。基于这些发现,FDA批准SG用于mTNBC治疗时无需进行Trop-2检测。同时,从更新数据来看,随着ASCENT研究随访时间的延长,SG在治疗mTNBC方面的疗效保持稳定,这一结果进一步增强了临床医生对SG的信心。
指南推荐,ADC为mTNBC 2L治疗带来更多选择
随着SG和T-DXd循证医学证据的不断发展和完善,国内外权威指南也依据这些更新的循证数据,相应地调整并升级了治疗推荐。
●NCCN乳腺癌指南(2024.V1)将SG列为mTNBC二线治疗全人群1类优选推荐,即SG可用于接受过至少一种既往治疗方案的mTNBC患者。如果二线治疗未使用过SG,可以考虑用于后线治疗[1]。
●《ESMO HER2低表达乳腺癌定义、诊断和管理共识 2023》指出,对于HER2低表达mTNBC,现有证据更支持在T-DXd之前使用SG,因此应优先考虑SG,然后再考虑T-DXd(证据质量:中等,推荐意见强度:较强)[8]。
● 《中国临床肿瘤学会乳腺癌诊疗指南2023》(CSCO指南)明确将SG列为mTNBC的二线治疗药物,并给予Ⅱ级推荐 [9]。
●《中国抗癌协会乳腺癌诊治指南与规范(2024年版精要本)》建议,mTNBC患者的二线及后线治疗推荐SG,且通常无需检测Trop-2靶点;T-DXd则列入HER2低表达mTNBC患者的二线及后线治疗方案推荐,并指出其证据来源于小样本数据[10]。
各大指南的更新和推荐,进一步巩固了SG在mTNBC二线及后线治疗中的核心地位。
ADC时代,ADC1-ADC2的续贯治疗思考
在2023年SABCS会议上,专题讨论环节特别关注了ADC在TNBC治疗中的使用顺序。在A3研究[4]的TNBC亚组中, ADC1选择T-DXd时,mPFS仅为1.4个月,患者随后接受SG作为ADC2时,患者的mPFS为3.1个月。相比之下,当ADC1选择SG时,患者的mPFS达7.7个月,ADC2为T-DXd时,mPFS为2.8个月。从相关多项研究的数据来看,将SG作为ADC1后序贯使用T-DXd(ADC2)可能带来更好的整体疗效。但这些研究通常面临样本量有限、证据力度不足的问题。此外,患者基线特征的不匹配以及不同治疗组之间治疗线数的差异等因素都可能影响结果的解释。同时,立即序贯与延迟序贯的策略也需进一步考量。因此,关于ADC1和ADC2的最佳使用顺序,亟需更多深入研究来验证和明确。
小结
在“ADC时代”,随着对ADC耐药机制研究的深入,关于同一靶点及不同靶点ADC的序贯以及治疗顺序将逐渐明确。在未来TNBC的研发布局中,鉴于Trop-2和HER2在乳腺癌中的表达差异,靶向Trop-2的SG在TNBC的晚期一线、辅助治疗和新辅助治疗全线布局,并在HR+/HER2-晚期一线治疗中积极探索。而针对HER2靶点的T-DXd则主要针对HR+/HER2低表达和HER2过表达患者,对TNBC的研究覆盖较少。此外,新一代ADC药物的研发正如火如荼地进行,如靶向Trop-2的Datopotamab Deruxtecan(Dato-DXd,DS-1062)、SKB264(MK-2870)以及靶向CD166的Praluzatamab ravtansine(CX-2009)等,正在积极研发中,为mTNBC治疗带来新的可能性。随着更多基于证据的临床研究结果的发布,ADC有潜力成为mTNBC治疗的核心选择,为患者描绘出更加光明的未来。
[1] National Comprehensive Cancer Network® (NCCN®). NCCN Clinical Practice Guidelines in Oncology (Version 1.2024): Invasive Breast Cancer. January 25, 2024.
[2] Shanu Modi, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice(TPC)in patients(pts)with HER2-low unresectable and/or metastatic breast cancer(mBC):Updated survival results of the randomized, phase III DESTINY-Breast04 study.2023 ESMO Abstract#376O.
[3] Aditya Bardia, et al., Sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (pts) with previously treated, metastatic triple-negative breast cancer (mTNBC): Final results from the phase 3 ASCENT study.. JCO 40, 1071-1071(2022). DOI:10.1200/JCO.2022.40.16_suppl.1071.
[4] Modi S, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. doi: 10.1056/NEJMoa2203690.
[5] Bardia, A et al., Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541. doi: 10.1056/NEJMoa2028485.
[6] Goldenberg DM, et al.,The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target. Oncotarget. 2018 Jun 22;9(48):28989-29006. doi: 10.18632/oncotarget.25615.
[7] Aditya Bardia et al., Final Results From the Randomized Phase III ASCENT Clinical Trial in Metastatic Triple-Negative Breast Cancer and Association of Outcomes by Human Epidermal Growth Factor Receptor 2 and Trophoblast Cell Surface Antigen 2 Expression. JCO 0, JCO.23.01409 DOI:10.1200/JCO.23.01409.
[8] Tarantino P, Viale G, Press M F, et al. ESMO expert consensus statements (ECS) on the definition, diagnosis, and management of HER2-low breast cancer[J]. Annals of Oncology, 2023, 34(8): 645-659.
[9] 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南.2023/中国临床肿瘤学会指南工作委员会组织编写.-北京:人民卫生出版社,2023.4.
[10] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2024年精要版). 2023年12月.
[11] Rachel O. Abelman, et al. Sequencing Antibody-Drug Conjugate after Antibody-Drug Conjugate in Metastatic Breast Cancer (A3 study): MultiInstitution Experience and Biomarker Analysis. 2023 SABCS Abstract#PS08-03.
排版编辑:肿瘤资讯-老猫












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


