在癌症治疗的不断探索中,针对Trop-2的抗体药物偶联物(ADC)成为了新的研究焦点。近日,国际知名期刊International Journal of Molecular Sciences在线发表了一篇综述文章,由Tomas Koltai和Larry Fliegel合著,旨在探讨Trop-2在化疗耐药中的作用[1]。文章指出,Trop-2是一种在多种上皮肿瘤中过表达的跨膜糖蛋白,参与细胞增殖、迁移和侵袭等过程。尽管Trop-2在多药耐药中的角色尚未完全明确,但针对Trop-2的ADC药物已经在某些难治性肿瘤的治疗中显示出潜力。通讯作者Larry Fliegel来自加拿大艾伯塔大学生物化学系。

癌症治疗中的耐药性问题严重限制了治愈的可能性,使得除了姑息治疗外,医生往往束手无策[2]。自1958年以来,随着Burchenal和Holmberg对白血病治疗的研究,耐药性及其机制成为了癌症研究的重点[3]。耐药性的形成机制多样,包括细胞外酸性环境、低血管灌注、高间质压力等因素,这些都会影响药物的渗透性[4-6]。
在众多与耐药性相关的蛋白中,ATP结合盒家族的P-糖蛋白(P-gp)、多药相关耐药蛋白1(MRP1)和乳腺癌耐药蛋白(BCRP)因其药物外排作用而广为人知[7,8]。除此之外,Trop-2等其他跨膜蛋白也通过不同的机制参与化疗耐药性[9]。本文综述了Trop-2的结构特征、在癌症中的作用以及其在化疗耐药性中的潜在角色。
Trop-2的结构、功能及其在上皮肿瘤中的表达特征
Trop-2结构
Trop-2是一种由无内含子基因Tacstd2编码的跨膜糖蛋白,具有323个氨基酸,分为一个大的N端细胞外部分、一个单次跨膜部分以及一个短的C端部分(图1-2)。其细胞外区域包含四个糖基化位点,而细胞内部分则包含一个可被蛋白激酶C磷酸化的丝氨酸303位点。Trop-2的细胞外区域类似于表皮生长因子的结构,参与调节细胞-细胞粘附机制,同时也在细胞增殖、侵袭和干细胞特性等非粘附相关的细胞功能中发挥作用[10,11]。
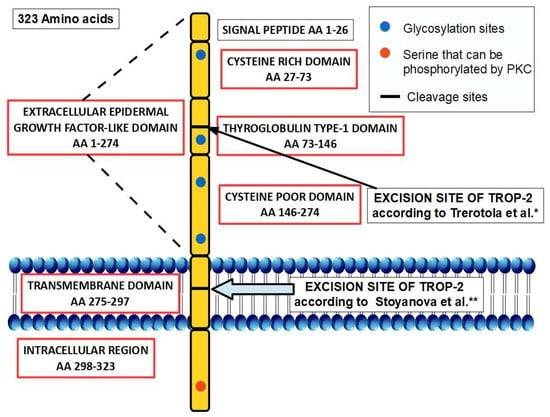
图1 Trop-2在细胞膜中的结构
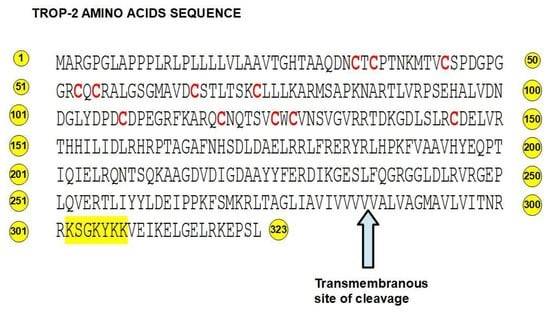
图2 Trop-2的氨基酸序列。红色为12个半胱氨酸。蛋白激酶 C磷酸化和 PIP2 结合区以黄色突出显示。箭头显示了跨膜区域的切割部位。
Trop-2的功能与表达
在正常成人上皮细胞中,Trop-2的表达量很少或完全不表达,但在多种上皮肿瘤中,如肺癌、胰腺癌、乳腺癌等,Trop-2过度表达,尤其在激素受体阳性/HER2阴性肿瘤和三阴性乳腺癌中表达水平更高[12]。这种在肿瘤细胞中的过度表达与患者的不良预后相关,包括生存率降低和肿瘤转移风险增加[13,14]。
Trop-2在耐药性中的双重作用
Trop-2在化疗耐药性中的作用是多方面的,包括其已知的促肿瘤活性,如通过调节离子钙等第二信使参与细胞增殖、迁移和侵袭的信号传导过程[15]。此外,Trop-2还可能通过特定的分子机制参与化疗耐药性的形成。例如,Sun等[16]的研究发现,Trop-2能够与IGF2R结合,这一结合激活了IGF2-IGF1R-AKT信号通路,从而增加了非小细胞肺癌(NSCLC)对吉非替尼的耐药性。这一发现揭示了Trop-2在耐药性中的一个新角色,即通过影响关键信号通路来调节肿瘤细胞对治疗的反应。
此外,Trop-2的表达水平与多种肿瘤细胞的耐药性密切相关。Varughese等[17]的研究显示,化疗耐药的卵巢癌细胞系中Trop-2表达显著增加,并且这些细胞对抗Trop-2单克隆抗体高度敏感。这表明Trop-2可能是一个潜在的治疗靶点,通过靶向Trop-2可能增强肿瘤细胞对化疗药物的敏感性。
尽管Trop-2主要被认为是促肿瘤因子,但Sin等[18]的研究提出了Trop-2的抗肿瘤潜力,发现它能够通过抑制IGF1R和ALK受体在宫颈癌中发挥肿瘤抑制作用。此外,头颈部鳞状细胞癌在对吉非替尼产生耐药性时失去了Trop-2的表达[19]。这种看似矛盾的作用提示Trop-2在化疗耐药性中的作用可能是组织或肿瘤特异性的,需要进一步的研究来阐明其在不同肿瘤类型中的具体作用。
特异性蛋白1(Sp1)作为转录因子,对Trop-2的表达具有调控作用。Sp1的激活促进Trop-2的表达,而Sp1的抑制则减少Trop-2的表达[20]。这一发现为通过药物干预Sp1活性来调节Trop-2表达提供了可能,从而影响肿瘤细胞的耐药性。托芬那酸、塞来昔布等非甾体抗炎药物已被报道可以降低化疗和放射治疗的耐药性[21],这可能与它们对Sp1的抑制作用有关。
综上所述,Trop-2在化疗耐药性中的作用复杂且多样,涉及多个信号通路和分子机制。未来的研究需要进一步探索Trop-2在不同肿瘤类型中的作用,以及如何利用这一靶点来克服癌症治疗中的耐药性问题。
材料由阿斯利康支持,仅供医疗卫生专业人士参考
1.Koltai, T.; Fliegel, L. The Relationship between Trop-2, Chemotherapeutic Drugs, and Chemoresistance. Int. J. Mol. Sci. 2024, 25, 87. https://doi.org/10.3390/ijms25010087
2.Vasan, N.; Baselga, J.; Hyman, D.M. A view on drug resistance in cancer. Nature 2019, 575, 299–309.
3.Burchenal, J.H.; Holmberg, E.A. The utility of resistant leukemias in screening for chemotherapeutic activity. Ann. N. Y. Acad. Sci. 1958, 76, 826–837.
4.Mansoori, B.; Mohammadi, A.; Davudian, S.; Shirjang, S.; Baradaran, B. The different mechanisms of cancer drug resistance: A brief review. Adv. Pharm. Bull. 2017, 7, 339.
5.Holohan, C.; Van Schaeybroeck, S.; Longley, D.B.; Johnston, P.G. Cancer drug resistance: An evolving paradigm. Nat. Rev. Cancer 2013, 13, 714–726.
6.Housman, G.; Byler, S.; Heerboth, S.; Lapinska, K.; Longacre, M.; Snyder, N.; Sarkar, S. Drug resistance in cancer: An overview. Cancers 2014, 6, 1769–1792.
7.Wang, J.Q.; Yang, Y.; Cai, C.Y.; Teng, Q.X.; Cui, Q.; Lin, J.; Assaraf, Y.G.; Chen, Z.S. Multidrug resistance proteins (MRPs): Structure, function and the overcoming of cancer multidrug resistance. Drug Resist. Updates 2021, 54, 100743.
8.Catalano, A.; Iacopetta, D.; Ceramella, J.; Scumaci, D.; Giuzio, F.; Saturnino, C.; Aquaro, S.; Rosano, C.; Sinicropi, M.S. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules 2022, 27, 616.
9.Calabrese, G.; Crescenzi, C.; Morizio, E.; Palka, G.; Guerra, E.; Alberti, S. Assignment of TACSTD1 (alias TROP1, M4S1) to human chromosome 2p21 and refinement of mapping of TACSTD2 (alias TROP2, M1S1) to human chromosome 1p32 by in situ hybridization. Cytogenet. Genome Res. 2001, 92, 164–165.
10.Guan, H.; Guo, Z.; Liang, W.; Li, H.; Wei, G.; Xu, L.; Xiao, H.; Li, Y. Trop2 enhances invasion of thyroid cancer by inducing MMP2 through ERK and JNK pathways. BMC Cancer 2017, 17, 486.
11.Wu, B.; Yu, C.; Zhou, B.; Huang, T.; Gao, L.; Liu, T.; Yang, X. Overexpression of TROP2 promotes proliferation and invasion of ovarian cancer cells. Exp. Ther. Med. 2017, 14, 1947–1952.
12.Shastry, M.; Jacob, S.; Rugo, H.S.; Hamilton, E. Antibody-drug conjugates targeting TROP-2: Clinical development in metastatic breast cancer. Breast 2022, 66, 169–177.
13.Bignotti, E.; Todeschini, P.; Calza, S.; Falchetti, M.; Ravanini, M.; Tassi, R.A.; Ravaggi, A.; Bandiera, E.; Romani, C.; Zanotti, L.; et al. Trop-2 overexpression as an independent marker for poor overall survival in ovarian carcinoma patients. Eur. J. Cancer 2010, 46, 944–953.
14.Guan, G.F.; Zhang, D.J.; Wen, L.J.; Yu, D.J.; Zhao, Y.; Zhu, L.; Guo, Y.Y.; Zheng, Y. Prognostic value of TROP2 in human nasopharyngeal carcinoma. Int. J. Clin. Exp. Pathol. 2015, 8, 10995.
15.Guerra, E.; Trerotola, M.; Aloisi, A.L.; Tripaldi, R.; Vacca, G.; La Sorda, R.; Lattanzio, R.; Piantelli, M.; Alberti, S. The Trop-2 signalling network in cancer growth. Oncogene 2013, 32, 1594–1600.
16.Sun, X.; Jia, L.; Wang, T.; Zhang, Y.; Zhao, W.; Wang, X.; Chen, H. Trop2 binding IGF2R induces gefitinib resistance in NSCLC by remodeling the tumor microenvironment. J. Cancer 2021, 12, 5310.
17.Varughese, J.; Cocco, E.; Bellone, S.; Bellone, M.; Todeschini, P.; Carrara, L.; Schwartz, P.E.; Rutherford, T.J.; Pecorelli, S.; Santin, A.D. High-grade, chemotherapy-resistant primary ovarian carcinoma cell lines overexpress human trophoblast cell-surface marker (Trop-2) and are highly sensitive to immunotherapy with hRS7, a humanized monoclonal anti-Trop-2 antibody. Gynecol. Oncol. 2011, 122, 171–177.
18.Sin, S.T.; Li, Y.; Liu, M.; Ma, S.; Guan, X.Y. TROP-2 exhibits tumor suppressive functions in cervical cancer by dual inhibition of IGF-1R and ALK signaling. Gynecol. Oncol. 2019, 152, 185–193.
19.Frederick, B.A.; Helfrich, B.A.; Coldren, C.D.; Zheng, D.; Chan, D.; Bunn, P.A., Jr.; Raben, D. Epithelial to mesenchymal transition predicts gefitinib resistance in cell lines of head and neck squamous cell carcinoma and non–small cell lung carcinoma. Mol. Cancer Ther. 2007, 6, 1683–1691.
20.Yamashita, T.; Mori, Y.; Alzaaqi, S.M.; Yashiro, M.; Sawada, T.; Hirakawa, K.; Nakada, H. Induction of Trop-2 expression through the binding of galectin-3 to MUC1. Biochem. Biophys. Res. Commun. 2019, 516, 44–49.
21.Pathi S., Li X., Safe S. Tolfenamic acid inhibits colon cancer cell and tumor growth and induces degradation of specificity protein (Sp) transcription factors. Mol. Carcinog. 2014;53((Suppl. 1)):E53–E61
审批编号:CN-132813
Expiration Date: 2025-4-1
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


