非小细胞肺癌(NSCLC)是全球癌症相关死亡的主要原因之一,其中约15%的高加索患者和近50%的亚洲NSCLC患者伴EGFR突变。三代EGFR-TKI奥希替尼已广泛用于EGFR突变阳性NSCLC,但不可避免会出现耐药。既往临床及临床前研究已经揭示了奥希替尼的多种耐药机制,其中包括EGFR依赖型(如EGFR C797S突变)和EGFR非依赖型如旁路活化或组织类型转化。然而,这些已知机制只是奥希替尼耐药机制的“冰山一角”,近50%患者的耐药机制仍然未知且对耐药后治疗应答不佳。因此,进一步探索三代EGFR-TKI耐药机制及其治疗策略,具有重要的科学意义和临床价值。
近期,中国人民解放军陆军特色医学中心何勇教授团队陆续发表了题为“Sialyltransferase ST3GAL4 confers osimertinib resistance and offers strategies to overcome resistance in non-small cell lung cancer”(Cancer-letters )[1]和“Brigatinib, a newly discovered AXL inhibitor, suppresses AXL-mediated acquired resistance to osimertinib in EGFR-mutated non-small cell lung cancer”(Acta Pharmacol Sin)[2]的两项研究,揭示了两种重要的奥希替尼获得性耐药机制,并探讨了奥希替尼与布格替尼联用治疗唾液酸转移酶ST3GAL4和酪氨酸激酶蛋白AXL过表达介导奥希替尼耐药的临床价值,本文带您一探究竟。

布格替尼可克服唾液酸转移酶ST3GAL4过表达导致的奥希替尼获得性耐药,为克服NSCLC耐药提供策略[1]
既往研究表明,唾液化异常升高可直接影响肿瘤细胞的粘附、运动和侵袭,从而促进肿瘤的生长和转移。最近的研究表明,ST3GAL 和 ST6GAL 家族与多种癌症的癌细胞增殖调控、唾液基转移酶(ST)表达的促致癌和促转移上调以及不良预后有关。同时,肿瘤细胞的高唾液酸化已被证明可促进几种肿瘤的化疗及靶向治疗耐药。然而,目前尚不清楚ST是否能够促进NSCLC中奥希替尼耐药的发生。本研究中,研究者对多组对奥希替尼耐药细胞系进行探索新的奥希替尼耐药机制。
本研究首先通过Western blotting分析发现,ST3GAL4在大多数耐药细胞中的表达显著上调,表明ST3GAL4可能与奥希替尼耐药密切相关(图1d)。研究者采用ELISA分析了ST3GAL家族在不同耐药细胞中的表达,结果显示,在耐药细胞中,仅ST3GAL4明显异常过量分泌(图1e)。值得注意的是,在PC-9GR和H1975细胞中,在单克隆奥希替尼耐药细胞系的建立过程中,随着奥希替尼暴露时间的延长,ST3GAL4表达水平也稳步上升(图1f)。与基线或最佳疗效相比,大多数患者在出现奥希替尼耐药后ST3GALA表达显著增加(图1h)。血清ST3GAL4水平与肿瘤大小呈正相关(r = -0.655,P=0.029;图1i)。对2例患者奥希替尼耐药前后的肿瘤进行免疫组化分析显示,耐药后ST3GAL4明显过表达(图1j)。
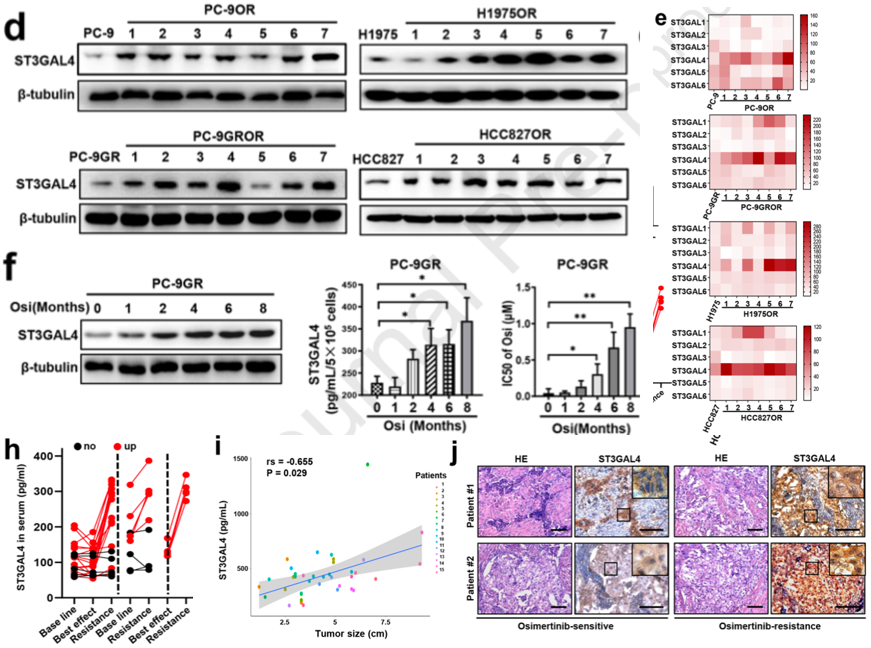 图1. 唾液转移酶ST3GAL4在奥希替尼耐药NSCLC细胞和患者中高表达
图1. 唾液转移酶ST3GAL4在奥希替尼耐药NSCLC细胞和患者中高表达
其次,该研究通过药物库筛选发现布格替尼降低了PC-9GROR、H1975OR、PC-9GROE、H1975OE和HCC827OR细胞的细胞活性,表明布格替尼可以使奥希替尼耐药细胞重新对奥希替尼敏感。Western blot分析显示,布格替尼联合奥希替尼可显著降低PC-9GROR、H1975OR、PC-9GROE、H1975OE和HCC827OR细胞中ST3GAL4、总MET和磷酸化MET/AKT/ERK水平(图2g)。同时布格替尼和MET抑制剂均能显著抑制MET、AKT和ERK的磷酸化水平。然而,无MET抑制剂可以抑制PC-9GROR细胞中ST3GAL4水平或MET的总表达(图2h)。此外,与低致死剂量的MET抑制剂(0.25 μ mol/L)相比,布格替尼显著降低了PC9GROR和H1975OR细胞的活性(图2i)。总之,布格替尼通过抑制ST3GAL4/MET通路使耐药细胞对奥希替尼重新敏感;此外,N785糖基化位点是布格替尼调节MET的关键位点。
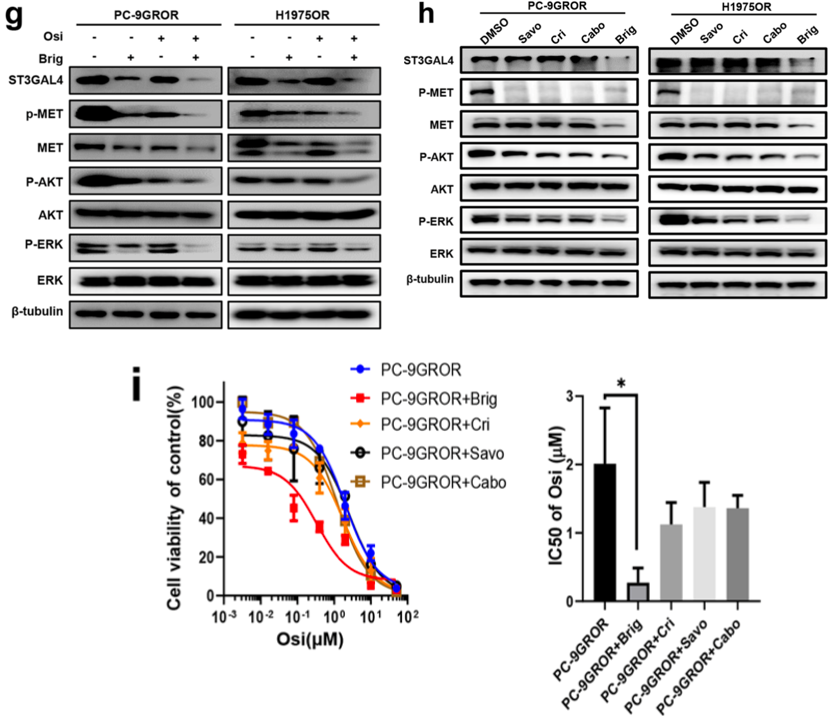 图2.布格替尼对体外奥希替尼耐药有增敏作用
图2.布格替尼对体外奥希替尼耐药有增敏作用
基于以上发现,该研究通过单独使用奥希替尼(5mg/kg)治疗PC-9GROR或H1975OR异种移植物对肿瘤大小影响不大。相比之下,布格替尼(25mg/kg)单药或与奥希替尼联合治疗均可显著缩小肿瘤,其中布格替尼与奥希替尼联合治疗的肿瘤缩小效果最为显著。在PDX模型中,布格替尼单独使用或与奥希替尼联合使用比奥希替尼单药的缩瘤效果更显著(图3a-c)。值得注意的是,该研究招募了两例奥希替尼耐药患者,经NGS检测,为未知奥希替尼耐药机制,但血清ST3GAL4水平显著升高。两例患者均接受布格替尼(90mg/天)和奥希替尼(80mg/天)治疗。治疗1个月后,患者1的肺部病变明显缩小。患者2的肺部病变无进一步进展,右侧胸腔积液消失(图3g)。与此同时,两例患者的ST3GAL4水平均降低(图3h)。
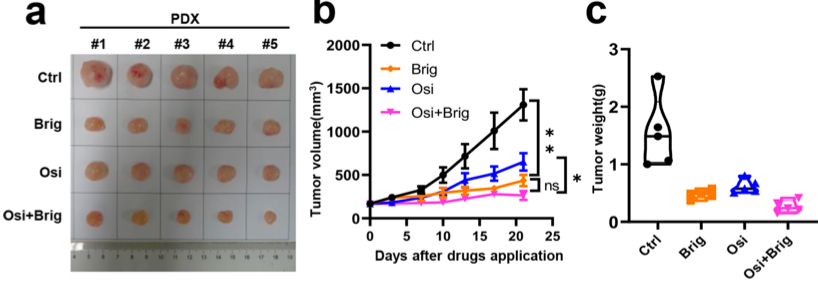
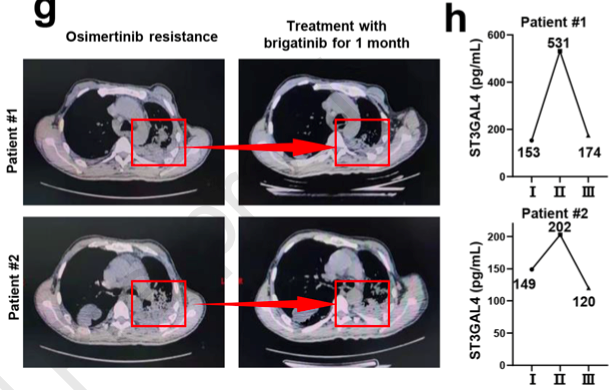 图3. 布格替尼可以克服高ST3GAL4水平NSCLC患者的奥希替尼耐药
图3. 布格替尼可以克服高ST3GAL4水平NSCLC患者的奥希替尼耐药
该研究首次证实布格替尼不仅是一种高效ALK抑制剂,对于伴EGFR突变NSCLC患者接受奥希替尼治疗后由于ST3GAL4过度激活或MET扩增而复发的患者,使用布格替尼联合奥希替尼可能是克服ST3GAL4过表达和MET扩增介导的奥希替尼耐药的有效策略。

布格替尼可靶向AXL进而克服奥希替尼耐药[2]
AXL是酪氨酸激酶的受体,已被证明可通过与EGFR和HER家族的其他成员结合,促进EMT或EGFR介导的信号传导,而导致EGFR-TKI的获得性耐药。相关研究表明,AXL表达上调是体外获得性奥希替尼耐药的主要机制之一;AXL高表达患者接受奥希替尼治疗后的中位无进展生存期(PFS)明显短于AXL低表达患者。因此,抑制AXL可能是克服奥希替尼原发或获得性耐药的关键。
本研究首先通过化合物筛选证实布格替尼是一种有效的非选择性AXL抑制剂。该该研究构建了AXL过表达的NSCLC细胞系(PC-9OE细胞系),并使用包含510种抗肿瘤药物的小分子药物文库进行高通量化合物筛选。降低细胞系AXL表达的前4位常见药物包括布格替尼、塞瑞替尼、阿霉素和柔红霉素,其中布格替尼抑制AXL表达的效果最为显著(图4c)。Western blot方法发现在PC-9OE细胞株和AXL高表达的奥希替尼耐药细胞株中,布格替尼存在时AXL的表达水平较低,且呈剂量依赖性(图4f)。
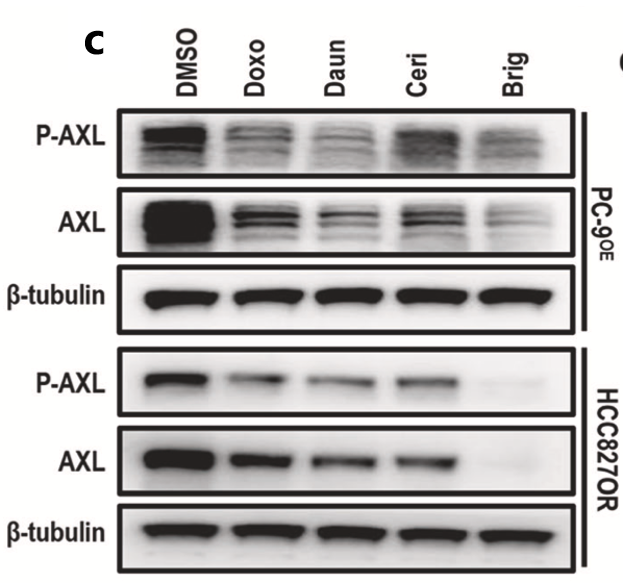
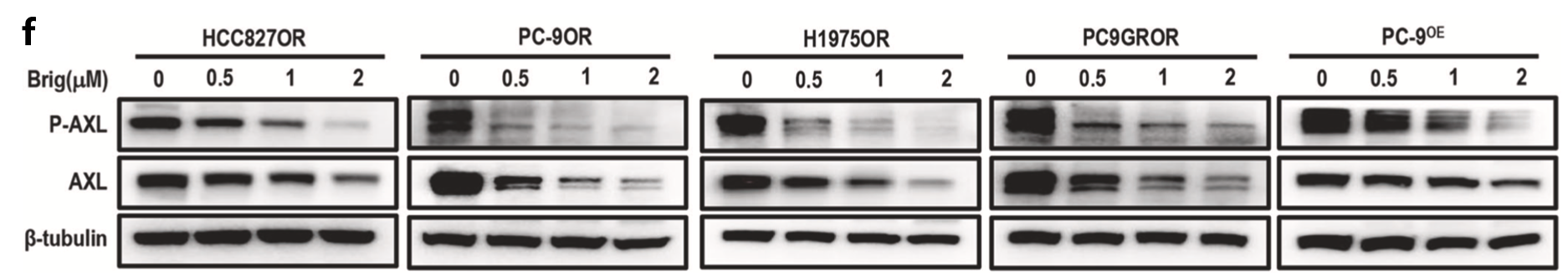 图4. 化合物筛选证实布格替尼是一种有效的AXL抑制剂
图4. 化合物筛选证实布格替尼是一种有效的AXL抑制剂
与此同时,该研究发现布格替尼通过促进AXL降解抑制AXL表达。布格替尼单用或布格替尼与奥希替尼联用后AXL mRNA水平无显著差异(图5a)。在Actinomycin D(Act D)存在的情况下,布格替尼仍能降低AXL的表达,表明布格替尼可能不是通过调节转录速率和mRNA丰度来发挥作用(图5b)。而在cycloheximide(CHX)存在的情况下,增加布格替尼也能加速奥希替尼耐药细胞AXL蛋白的降解(图5c)。布格替尼可能通过调节AXL泛素化和促进AXL降解来降低AXL的表达(图5d-g)。
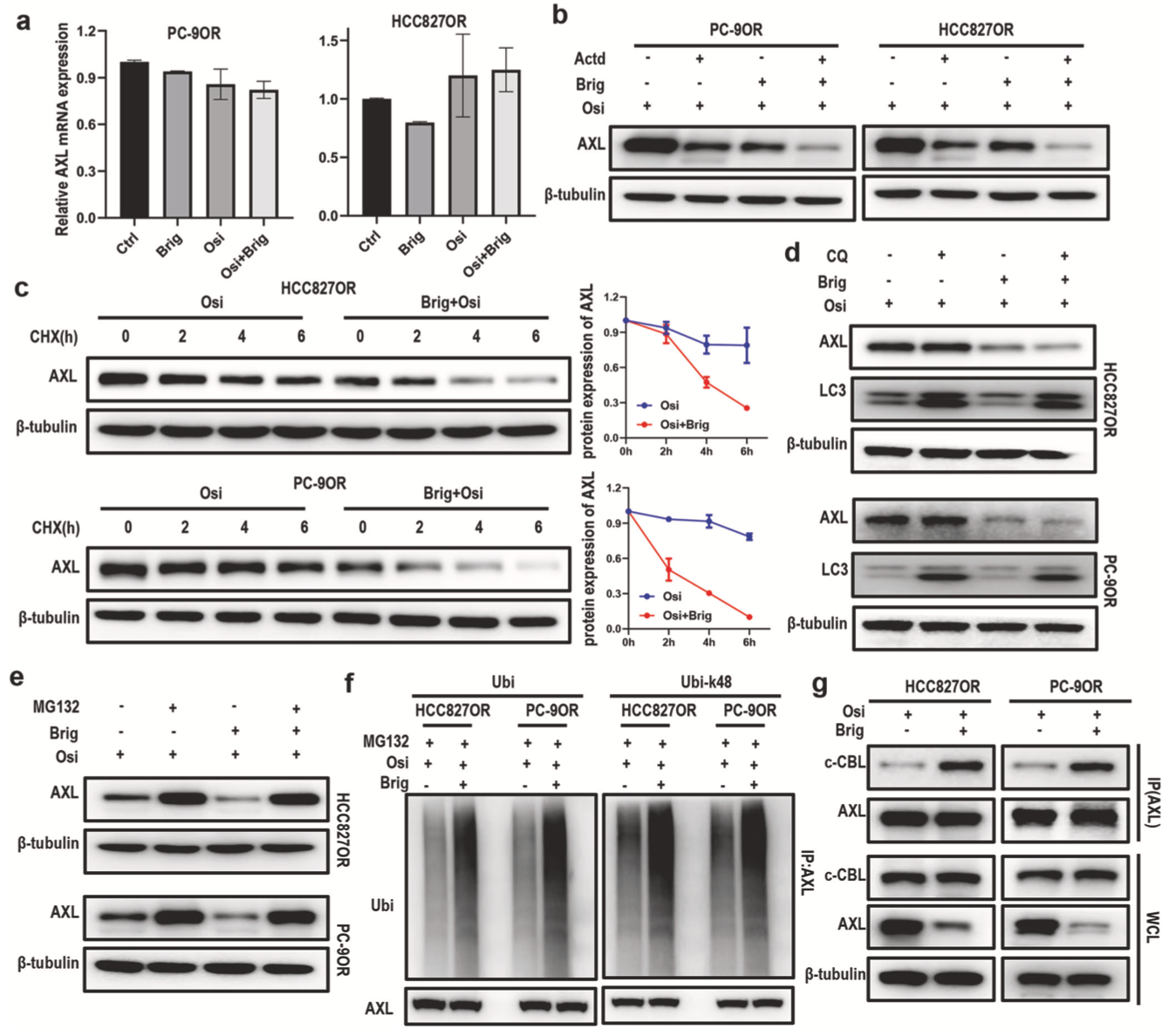 图5. 布格替尼和奥希替尼联合使用促进AXL降解
图5. 布格替尼和奥希替尼联合使用促进AXL降解
既往研究已经证实,在EGFR突变NSCLC细胞中,AXL表达上调是体外获得性奥希替尼耐药的重要机制。为此临床上开发了多种AXL抑制剂(AXL选择性及多靶点抑制剂)并在临床环境中进行了疗效验证,但绝大多数AXL抑制剂尚处于临床前阶段,距离临床应用仍“任重而道远”。该研究证实布格替尼能有效抑制 AXL的磷酸化及相关信号通路并通过调节AXL的泛素化和促进AXL降解来降低AXL的表达,其抑制AXL表达的能力甚至优于AXL抑制剂bemcentinib,同时奥希替尼和布格替尼联合治疗可抑制AXL高表达的奥希替尼耐药细胞衍生异种移植模型的肿瘤生长,这表明布格替尼作为一种抑制剂来增敏奥希替尼诱导的AXL过表达,具有广阔前景。
三代EGFR-TKI靶向治疗疗效显著,但耐药不可避免。然而,三代EGFR-TKI耐药机制复杂,仍有大比例耐药患者机制不明,严重影响三代EGFR-TKI耐药后患者的后线治疗疗效。因此,进一步探索三代EGFR-TKI耐药新机制,并提出可能的解决三代EGFR-TKI耐药瓶颈的治疗方案,具有非常重要的科学意义和临床价值。
上述两项研究进一步明确了奥希替尼耐药相关的两种重要的旁路激活机制,并提出了可能的解决策略,并通过细胞实验、动物实验以及小样本病例观察等方法得到进一步验证,对目前奥希替尼耐药不明机制的患者,具有重要的临床借鉴价值。上述研究表明,唾液酸转移酶ST3GAL4可以诱导MET及其信号通路活化介导奥希替尼的获得性耐药,与酪氨酸激酶蛋白AXL介导的奥希替尼获得性耐药相同的是,上述两种重要的奥希替尼旁路活化耐药机制均可以使用布格替尼与奥希替尼的联合治疗方案,该联合用药方案可以很好的控制或逆转因ST3GAL4和AXL介导的三代EGFR-TKI奥希替尼获得性耐药。二代ALK-TKI布格替尼作为多靶点抑制剂,除已知EML4-ALK融合基因靶点外,它还对EGFR、MET、AXL和ST3GAL4等靶点有很好的抑制作用。未来有望在三代EGFR-TKI耐药后治疗领域发挥更大的作用。我们团队也将继续深耕三代EGFR-TKI耐药机制及其逆转策略研究,期待能够和大家一起开展更多、更大样本量的前瞻性临床研究,以充分验证布格替尼在奥希替尼等三代EGFR-TKI耐药后治疗领域的应用价值,进而造福广大EGFR驱动基因阳性的晚期NSCLC患者。
陆军特色医学中心(大坪医院)
呼吸与危重症医学科主任,主任医师、教授,博士研究生导师,美国MD Anderson癌症中心访问学者。
重庆市学术技术带头人,陆军军医大学“教学明星”、优秀研究生导师、科技工作先进个人。担任中国医师协会呼吸医师分会委员、中华医学会呼吸医师分会肺癌学组委员、重庆市医学会呼吸分会副主任委员等学术任职,中国呼吸领域、肺癌领域高学术影响力学者,多个指南、专家共识编写专家。获评全国优秀呼吸医师、重庆市优秀呼吸医师、重庆市民心医师和金口碑医师等。擅长肺癌、气胸、慢性阻塞性肺疾病的诊治。熟悉肺部疾病的外科和内科治疗,擅于运用多学科诊治的思维为患者合理制定个体化诊疗方案。尤其对肺小结节良恶性判断及处置;肺癌的围手术期治疗、靶向治疗、免疫治疗,耐药处置和全程管理有深厚的造诣,在肺癌精准治疗领域和患者群中享有声誉。
主要研究方向是肺癌的基础和临床研究。主持7项国家自然科学基金在内的多项科研课题,作为第一作者或通讯作者在Journal of Thoracic Oncology、Clinical Cancer Research等国际权威期刊发表SCI论文60余篇,单篇最高影响因子15.6,总影响因子280。重庆市科技进步二等奖1项,获国家发明专利6项。
陆军特色医学中心苗圃人才
中华医学会呼吸病学分会肺癌学组青年协作组委员
海峡两岸医药卫生交流协会肺癌学组委员
北京科创医学发展基金会肺癌专业委员会常务委员
中国抗癌协会肿瘤呼吸分会重庆组委员
重庆肺癌防治联盟青委委员
以第一或通讯作者在《Clinical Cancer Research》等SCI杂志发表论著10余篇
主持并参与国家自然科学基金6项,主持重庆市自然科学基金等省部级课题2项
重庆市科技进步二等奖1项(排名第4),参编专著1部
[1] Rui Han,et al. Sialyltransferase ST3GAL4 confers osimertinib resistance and offers strategies to overcome resistance in non-small cell lung cancer. Cancer Lett. 2024 Feb 24:216762.
[2] Rui Han,et al. Brigatinib, a newly discovered AXL inhibitor, suppresses AXL-mediated acquired resistance to osimertinib in EGFR-mutated non-small cell lung cancer. Acta Pharmacologica Sinica (2024) 0:1–12
仅供医疗专业人士参考
责任编辑:肿瘤资讯-Yuno
排版编辑:肿瘤资讯-Krystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


