骨髓纤维化(MF)是一种费城染色体阴性的骨髓增殖性肿瘤(MPN),临床表现具有高度异质性,通常可分为原发性骨髓纤维化(PMF),或继发于原发性血小板增多症或真性红细胞增多症(继发性骨髓纤维化,SMF)。目前,异基因造血干细胞移植(allo-HSCT)仍是MF患者唯一的治愈性疗法,且每年接受allo-HSCT的MF患者数量稳步增加。
近日,American Journal of Hematology杂志发表一篇综述,回顾了接受allo-HSCT的MF患者预后改善方面的最新进展。文章详细从13个不同层面讨论了allo-HSCT治疗MF的诊疗更新和变化情况,包括患者选择、预后评分系统、脾肿大管理、预处理方案、移植结局预测、干细胞来源、干细胞供体、移植物抗宿主病(GvHD)预防、急变期患者、造血重建、疾病标志物、供体嵌合以及复发患者的治疗。【肿瘤资讯】现将重点内容荟萃如下,以飨读者。为方便阅读,分为上、下两篇,本文为下篇。

7. 预测移植结局
最近报告了MIPSS70在预测HSCT结局方面的实用性。与高危患者相比,中危患者的OS更好(HR, 0.49;P=0.039)。同样,HSCT前MIPSS70+ v2.0中危患者的OS(HR=0.29)也优于高危患者,而VHR的OS明显低于HR患者(HR=5.05)。针对接受HSCT的MF患者,有一种结合临床-分子特征的风险评分,将MF患者分层为4个风险组:低危(评分0-2分),中危(评分3-4分),高危(评分5分)和极高危(评分>5分),5年OS分别为83%、64%、37%、22%。
最近,一项CIBMTR /EBMT联合研究提出了一种基于患者年龄、贫血和供者类型的MF异基因移植的简单预后评分:年龄>50和相合无关供者(与相合同胞供者相比)得1分;Hb<10和不相合无关供者得2分;低、中、高危患者的总生存、NRM、DFS差异均有统计学意义。值得注意的是,283例DIPSS中危-1患者中有高达92例根据该评分为低危。
8. 干细胞来源和干细胞供者
根据CIBMTR/EBMT最近提出的简单移植评分,相合同胞供者(MSD)的疗效明显优于其他供者类型:在CIBMTR对233例接受HSCT的PMF患者进行的研究中,MSD、相合非亲缘供者(MUD)和不相合非亲缘供者(mMUD)的5年OS率分别为 56%、48% 和 34%。对于没有合适的HLA相合供者的MF患者,目前也正在评估单倍体相合移植,但移植失败和NRM高于MSD移植。因此,如果有条件,MSD仍是最佳选择,其次是匹配度较高的MUD。对于MF中的mMUD和HAPLO移植,可能需要更好地预防GvHD,或许可以联合使用抗胸腺细胞球蛋白(ATG)和后置环磷酰胺(PTCY)。
大多数报告HSCT结局的研究主要采用PBSC作为干细胞来源。目前还没有直接比较骨髓移植与PBSC结局的研究。
9. GvHD预防
对于非去T细胞干细胞移植,标准的GvHD预防措施是钙调神经磷酸酶(CNI)联合甲氨蝶呤或西罗莫司。CNI+MTX平台可辅以ATG,这在替代供者移植中很常见,可降低急性和慢性GvHD的发生率。另一种变化是在CNI+MTX+ATG方案的基础上,在围移植期给予芦可替尼,以进一步减少疾病的炎性成分和异基因反应性T细胞的输入。一项试验探索了在他克莫司+西罗莫司方案基础上添加两种剂量水平的芦可替尼(5mg和10mg,每日两次);所有患者都进行了移植,GvHD Ⅲ-Ⅳ为11%;存在一定程度的中度/重度慢性GvHD(24%)。一项德国的研究采用了四药预防疗法(ATG + CNI+ MTX + 芦可替尼)。
鉴于骨髓纤维化的炎症性质,预计在未来几年中还会针对这种疾病开发出其他GvHD预防方案。事实上,PTCY联合CNI和吗替麦考酚酯(MMF)是另一种广泛应用的方案,最初设计用于单倍体移植,最近也用于HLA相合移植。有报告称,在MF患者中,以PTCY为基础的预防性治疗适用于单倍体相合移植,也适用于相合移植:对于后者,虽然可能会以降低移植物抗白血病(GvL)为代价,但预计会更好地控制GvHD,从而使单倍体相合移植和HLA相合移植的总生存期相当。最近的一份报告指出,也可以使用剂量较低的PTCY,其早期效果非常令人鼓舞,NRM率为7%。
体外T细胞耗竭是预防GvHD的另一种方法:纪念斯隆-凯特琳癌症中心使用CD34作为干细胞来源,随后白消安、氟达拉滨美法仑预处理和ATG预防排斥反应,结果显示27例患者无移植失败,急性和慢性GvHD发生率低,3年生存率为88%。虽然患者数量不多,但在移植后未进行免疫抑制治疗的情况下取得了这些初步结果,仍具有意义。
allo-HSCT的成功取决于我们是否有能力在不降低GvL效应的情况下减轻GvHD:这就是为什么移植平台,包括预处理方案、干细胞来源和GvHD预防措施都需要考虑在内。MF患者年龄较大,适当预防GvHD应是当务之急。
10. 急变期和加速期MF
如果原始细胞比例增加至10%~19%,慢性期MF可进展为加速期MF,导致生存率降低、AML转化风险增加。在这类患者中,RIC移植显示出与慢性期MF相当的良好疾病控制能力。因此,如果有合适供者且患者适合HSCT,那么进行HSCT是合理的。对于急变期患者,HSCT前通常需要进行MF诱导治疗以控制病情。可选择以HMA为基础的治疗方案,或者如果患者适合强化诱导治疗,则先进行强化诱导,然后再进行移植。诱导治疗后的ORR为39%~59%,HSCT后3年的OS率为18%~33%。
11. 造血重建和移植失败(GF)
MF患者在allo-HSCT后的细胞减少有三种不同形式,致命性感染的风险不断增加。第一种是血液学恢复延迟,但患者最终摆脱输血依赖。第二种是完全供者嵌合,初始粒细胞恢复,但持续依赖红细胞和血小板输注,也称为移植物功能衰竭(PGF)。第三种也是最令人担忧的情况是原发性GF,患者没有表现出粒细胞恢复的迹象,也没有表现出供者嵌合的迹象。一项关于GF的研究发现,骨髓纤维化诊断和替代供者是风险因素:具有0、1和2个风险因素患者的GF发生率分别为0%、9%和24%。因此,在接受替代供者移植物的MF患者中,可以预计有多达25%的患者会出现一种或另一种形式的移植后GF。
根据供者嵌合的程度不同,治疗方法也不同:如果患者表现为混合供者或仅宿主来源细胞,则说明移植物已完全失败,唯一的解决办法是尽早进行第二次移植:在一项关于第二次早期半相合移植物的研究中,74%的患者痊愈,4/19 例原发性GF的患者为MF患者。在一项大型登记研究中,三分之一的MF患者因GF而接受了第二次移植:因GF而尽早进行第二次移植与高NRM(47%)相关。但另一方面,如果存在完全供者嵌合,那么在没有预处理方案的情况下,CD34阳性细胞增强可挽救超过70%的患者。对于完全供者嵌合的患者,另一种选择是使用促血小板生成素模拟药物,使用romiplostin或eltrombopag可在超过50%的PGF患者中诱导三系恢复。
12. HSCT后的疾病标志物和嵌合
移植后的疾病反应评估不同于常规治疗,因为其目标是根除恶性克隆。驱动基因突变(JAK2、MPL或CALR)可用于评估allo-HSCT后微小残留病灶(MRD),并可能与供者嵌合相关,成为可以在外周血或骨髓中被检测到的另一种标志物。预处理方案似乎在确定供者嵌合程度,进而决定MF复发风险方面起着重要作用:在一项随机研究中,比较白消安-氟达拉滨方案 (BU-FLU) 与塞替派-氟达拉滨(THIO-FLU)方案。BU-FLU方案在+100天时获得完全供者嵌合的患者比例为24%,THIO-FLU方案为68%。总体累积复发率分别为36%(BU-FLU)和 24%(THIO-FLU)。因此,氟达拉滨联合一种烷化剂具有较低程度的完全供者嵌合和较高的复发率。最近一项关于BU-FLU方案的研究证实,MF患者的混合嵌合率很高(43%),同时复发率也很高(40%)。相反,使用两种烷化剂(塞替派-白消安或 BU-FLU-美法仑),完全供体嵌合率高(超过 90%),但复发风险低(<20%)。对于年龄较大或体质较弱的患者,减少这两种烷化剂的剂量非常重要:根据经验将白消安的剂量减少到一天,在老年患者中仍可保持良好的根除效果。
因此,监测供者嵌合和驱动突变对评估植入程度和复发风险至关重要:完全供者嵌合和复发强烈依赖于预处理方案的类型;显然,两种烷化剂的联合使用似乎在控制潜在疾病方面具有优势,也可能在生存方面具有优势。
13. 复发的治疗
原发疾病的复发对任何患者来说都是一个负面事件。欧洲血液和骨髓移植小组(EBMT)最近的一项研究显示,在过去二十年中,复发的风险明显降低,这可能是由于移植前更多地使用了芦可替尼。
应将分子学复发与血液学复发区分开来:前者见于再次出现驱动基因突变的患者,伴或不伴供体嵌合下降,但血细胞计数正常,骨髓活检也可能正常。血液学复发患者的分子标志物呈阳性,同时伴有血液学异常(白细胞-血小板增多)或全血细胞减少,伴或不伴循环原始细胞,脾脏增大,骨髓活检有纤维化。不幸的是,MF的这些血液学症状在移植后1个月仍不会消失,脾脏肿大或骨髓纤维化可能会持续数月或数年。因此,有必要将分子标志物与血液学特征结合起来,以评估患者是分子学复发还是血液学复发。
图1概述了对于分子标记持续存在或再次出现的MF患者可以考虑的方法。allo-HSCT后,患者通常会出现驱动基因突变消失和完全供者嵌合(FDC)(最左侧),然后进行随访。然而,有些患者(中间)的驱动基因突变清除缓慢,同时伴或不伴混合供者嵌合(MDC):如果患者仍在接受免疫抑制治疗(IST),则应停止这种治疗。如果其导致分子标志物和FDC阴性,患者将接受随访。如果患者已停用IST,且无cGvHD,则可选择试用低甲基化药物或DLI。HMA采用地西他滨20mg/m2,连用5天,或阿扎胞苷75mg/m2,连用5天,每28天一次或根据耐受情况而定,同时每月监测嵌合率。如果嵌合率有所改善,则完成6个周期,然后进行观察。有时可能会出现cGVHD,在这种情况下,可根据临床需要恢复IST。对于DLI,初始剂量可能取决于HLA相合程度。对于HAPLO不相合和无关不相合移植,保守的起始剂量为1×105 CD3/kg;对于HLA相合亲缘和无关移植,保守的起始剂量为1×106 CD3/kg。在没有出现GvHD的情况下,剂量应每21~28天增加一次。应每月评估供者嵌合度。如果患者再次FDC且驱动标志物呈阴性,则应进行随访。如果患者不能转为FDC,可考虑进行清淋(通常是FLU-CY)或清淋加骨髓消融(一剂量美法仑),然后再次进行DLI。如果所有这些方法都失败了,而且患者出现血液学复发,那么第二次移植是唯一可能的治疗方法。应结合临床状况和患者年龄考虑二次移植的优势。根据供者可用性和供者检索结果,使用的供者可以是相同的,也可以是不同的。
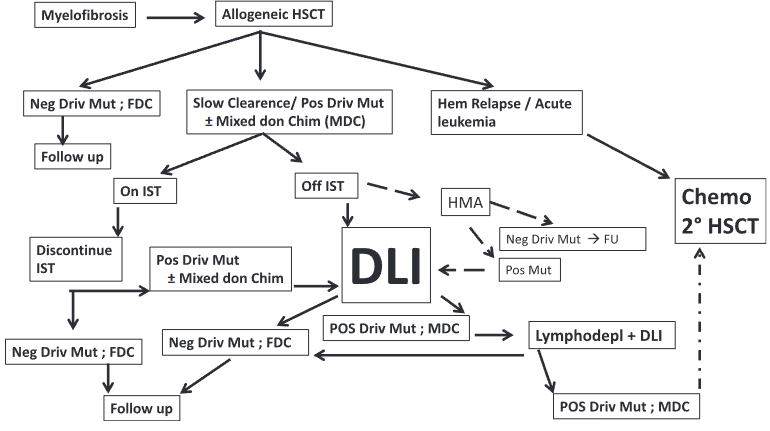 图1. allo-HSCT后MF患者复发的治疗选择
图1. allo-HSCT后MF患者复发的治疗选择
结论
尽管有多种新的JAK抑制剂可用于MF的治疗,但其仍无法被完全治愈,allo-HSCT仍然是唯一的治愈性疗法。由于多种疾病特异性特征,如脾大、骨髓环境不利伴纤维化、输血负担通常很重以及患者年龄较大,MF有其自身的细微差别。由于采用了新的移植策略,HSCT在MF患者中变得越来越安全,甚至在老年患者中也有所应用。MF患者尽早考虑HSCT是移植成功的关键。
Haris Ali, Andrea Bacigalupo; 2024 update on allogeneic hematopoietic stem cell transplant for myelofibrosis: A review of current data and applications on risk stratification and management;Am J Hematol.2024;1‐8.doi:10.1002/AJH.27274.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


