浆母细胞淋巴瘤(PBL)是一种罕见而侵袭性极强的非霍奇金淋巴瘤,多发生在HIV感染的免疫缺陷患者。在病理形态学上,PBL与浆细胞瘤(PCM)有许多相似之处,有时难以鉴别。2023年9月,IJCRI Oncology杂志报告了一例HIV阴性、免疫功能正常的老年男性患者,经病理检查证实为PBL,且该PBL病灶旁同时发现了成熟的浆细胞肿瘤。这一病例为我们进一步认识PBL的发病机制、与PCM的关系等提供了重要线索。

病例介绍:非同寻常的骨痛,揭开一位老人身上罕见淋巴瘤的面纱
患者,男,66岁。既往有2型糖尿病和近期十二指肠溃疡病史,否认其他特殊疾病史。主因右侧髋部疼痛伴活动受限1月余入院。
患者1个月前无明显诱因出现右髋部疼痛,疼痛逐渐加重并向右下肢放射,伴右下肢无力和感觉减退,直立、行走困难。并伴有轻度盗汗,体重减轻(具体不详)。查体可见右侧髂骨区压痛明显,右下肢近端肌力3级,右髂腰肌紧张。
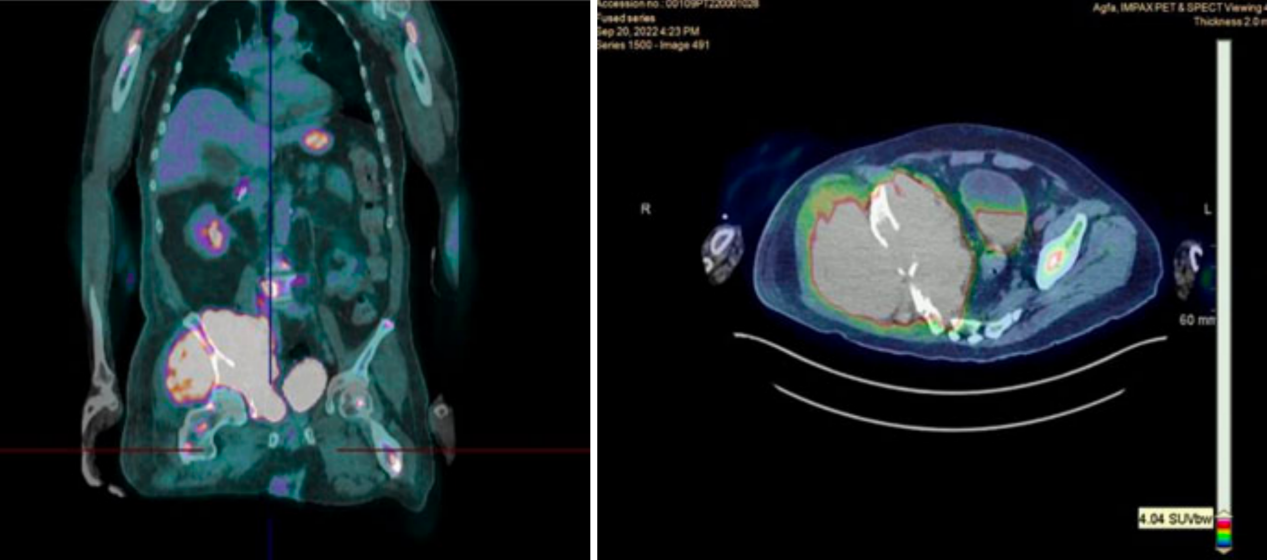
图1:PET-CT影像
初始影像学检查提示右侧髂骨区可见占位性病变。PET-CT显示:右髂骨区可见一高代谢溶骨性肿块,局部骨质破坏,肿瘤组织突破骨皮质侵犯邻近软组织,并伴盆腔淋巴结肿大。全身骨骼广泛可见多发溶骨性转移灶,涉及颅骨、头颅底、颈2椎板、左骶骨及两侧股骨近端等。腹主动脉旁淋巴结可疑受累。
血清免疫球蛋白检查示M蛋白条带0.57g/dL。HIV抗原抗体检测阴性,HHV-8 PCR阴性。外周血CD4+T淋巴细胞计数正常(1052/μL)。EBV-DNA拷贝数>67,000 copies/mL。
临床初步考虑为转移性肉瘤或多发性骨髓瘤的侵袭性浆细胞瘤。
诊疗经过:一场与时间赛跑的生死之战
入院后在影像引导下行右侧髂骨病变穿刺活检。病理形态学检查见大量未成熟的浆细胞和免疫母细胞样肿瘤细胞弥漫性浸润骨髓组织。免疫组化示:瘤细胞CD38、CD138、MUM-1和EBV强阳性,Ki-67阳性率>99%,提示为增殖活性极高的PBL。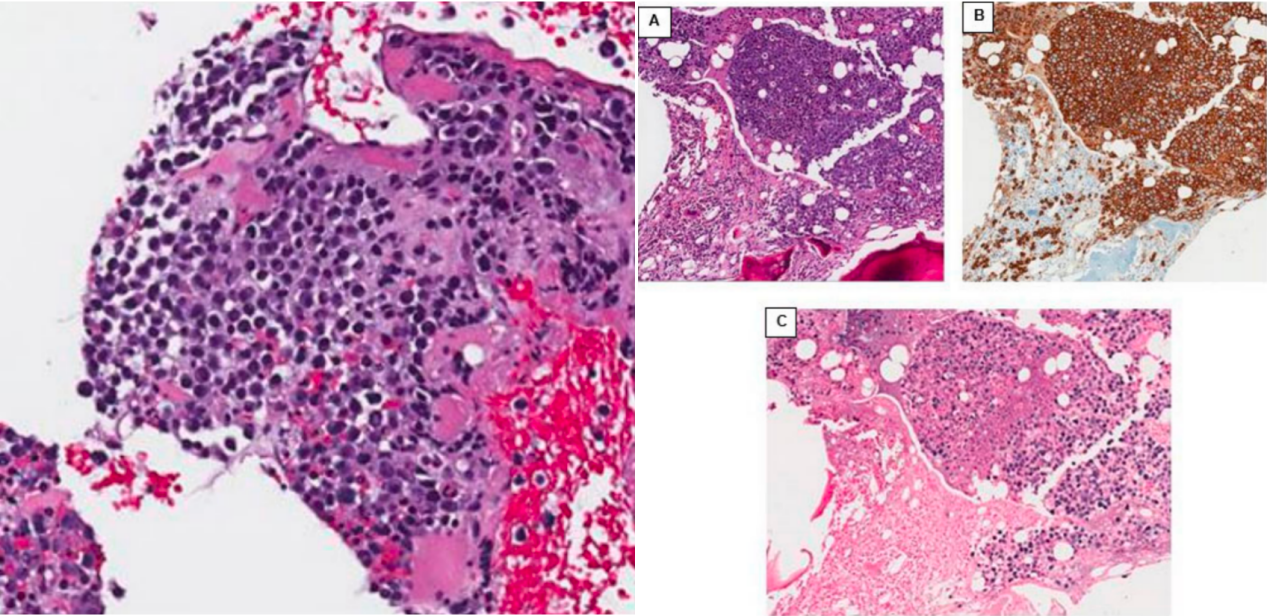
图2:右侧髂骨病变穿刺活检的病例和免疫组化结果提示为增殖活性极高的PBL
而取自同侧髂骨嵴的另一块骨髓活检组织内可见15%~20%的浆细胞,形态成熟,CD138阳性,EBV阴性,提示为一般性浆细胞增多。该部位骨髓未见PBL表现。进一步的骨髓浆细胞免疫分型和基因检测发现一个TP53基因缺失和免疫球蛋白重链(IGH)基因重排的克隆,FISH未发现MYC和BCL2/BCL6的重排,但可见MYC的扩增。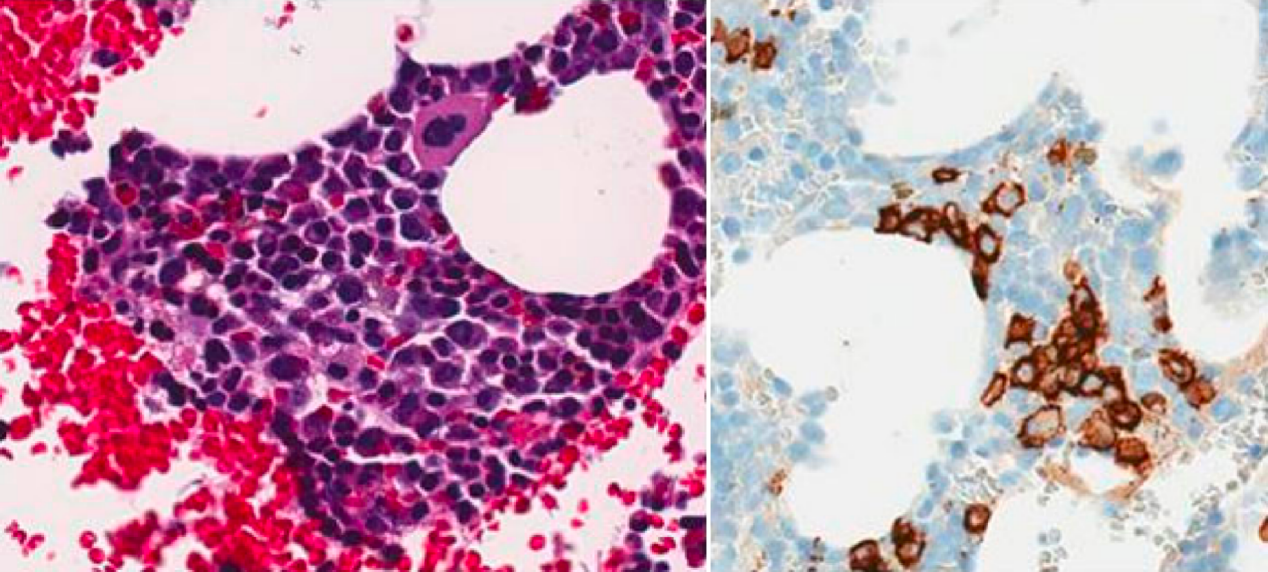
图3:取自同侧髂骨嵴的另一块骨髓活检未见PBL表现
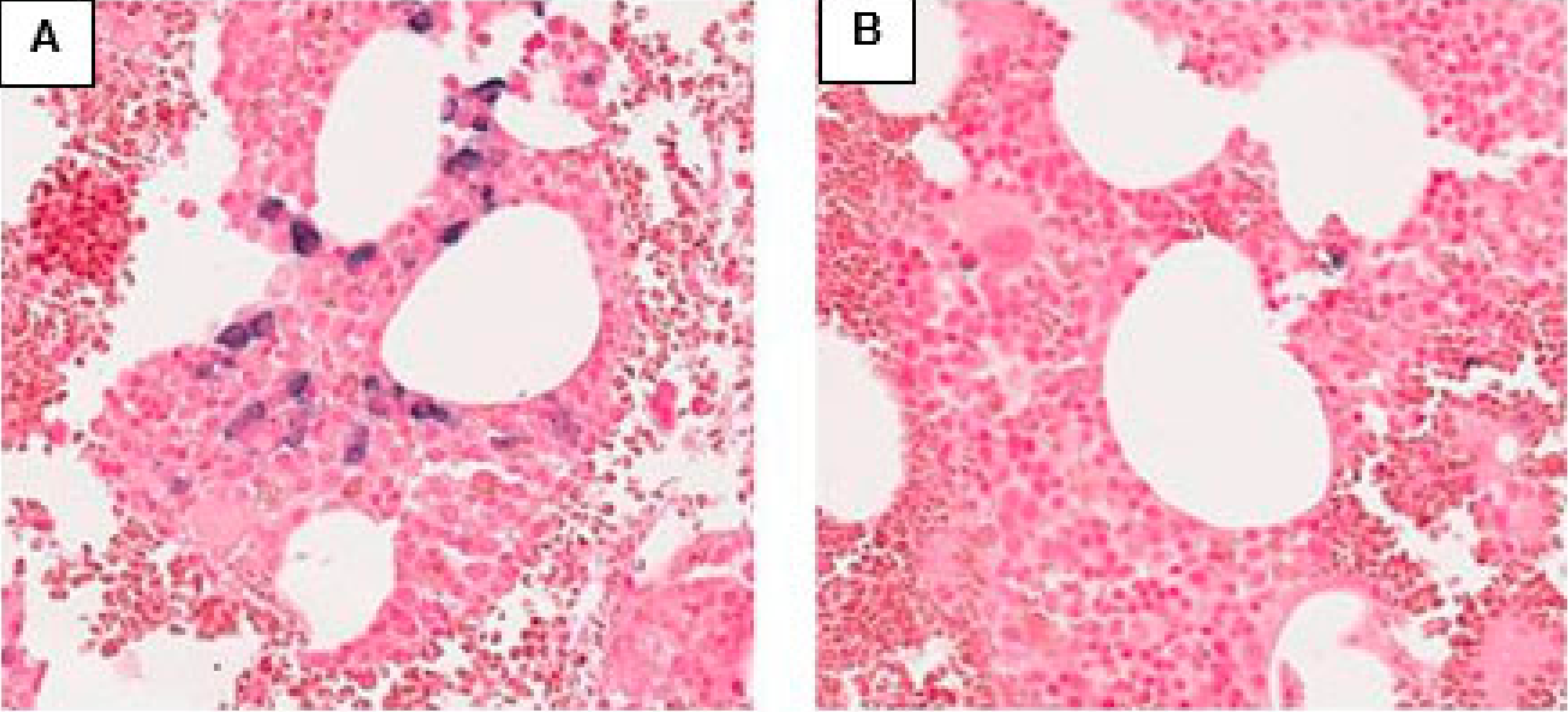
图4:取自同侧髂骨嵴的另一块骨髓活检Kappa ISH染色提示EBV阴性
综合临床表现和病理结果,诊断为PBL(Ann Arbor IV期,NCCN-IPI评分高危),伴骨髓侵犯,并同时合并另一个独立的浆细胞瘤。
入院后立即启动EPOCH(依托泊苷、长春新碱、多柔比星、环磷酰胺、泼尼松)和达雷妥尤单抗为基础的多药联合化疗。化疗中常规应用预防性抗感染、促造血、保肝、护胃等支持治疗。
图5:EPOCH+达雷妥尤单抗治疗方案
化疗后第1天复查血常规示一般情况尚可,第8天患者病情稳定,自行转入康复科继续康复功能锻炼。但数日后患者病情突然恶化,出现发热、神志改变、低血压等多脏器功能衰竭表现,再次转入ICU。此时血培养提示多重耐药菌感染。尽管给予了强力抗感染、呼吸机辅助通气等积极治疗,患者最终因感染性休克、DIC等并发症死亡。
寻根溯源:解密浆母细胞淋巴瘤恶性克隆的起源与演变
PBL是一种少见的非霍奇金淋巴瘤的亚型。据统计仅占所有HIV相关淋巴瘤的2%左右。PBL多见于HIV感染者,尤其是HIV阳性男性。在HIV阴性人群中的发病率则更低。有研究统计,在260例PBL患者中,HIV阳性男性占75%,HIV阴性仅占25%。而在所有HIV阴性PBL患者中,女性的比例高达66%。提示即使在HIV阴性人群中,PBL发病也有明显的性别差异。此外,HIV阳性PBL更易表现为晚期(Ann Arbor分期III/IV期),预后也更差。因此,本例HIV阴性、免疫功能正常的老年男性PBL病例是不多见的。
PBL的常见起病部位为口腔,其次是皮肤、软组织、骨骼、乳腺、纵隔、心脏和肺等。本例患者主要表现为溶骨性骨质破坏,且病变广泛,提示其肿瘤负荷高,恶性程度高。后来的病理检查证实Ki-67指数高达99%,也佐证了这一点。但在本例同时检出的EBV阴性、Ki-67指数低的浆细胞克隆性增殖病变,提示患者同时合并了一个相对惰性的、成熟的浆细胞肿瘤。PBL是否来源于这个浆细胞肿瘤的恶性转化,目前尚无明确定论。过去有少数个案报告 PBL 可由慢性淋巴细胞白血病或滤泡淋巴瘤转化而来,但尚未见浆细胞瘤向PBL转化的报道。这可能与二者在细胞起源和分化阶段等方面的差异有关。
关于PBL的发病机制,目前认为与EBV感染和MYC基因异常表达有关。PBL通常EBV阳性(EBER阳性),在一项对HIV阳性PBL患者的研究中,EBV阳性率高达70%。本例EBV定量也高度阳性(拷贝数>67,000/ml)。此外,本例基因检测发现MYC扩增,这可能与该克隆获得高度增殖活性有关。在免疫功能低下时,EBV感染B细胞后可通过LMP1等病毒蛋白抑制细胞凋亡并上调MYC表达,从而导致淋巴细胞恶性增殖失控。本例患者年龄偏大,免疫功能可能存在一定的衰退,EBV感染可能成为PBL发生的诱因之一。
关于PBL的预后,一般认为HIV阳性、疾病分期晚、Ki-67和EBV滴度高等是预后不良因素。本例以上因素均阳性,且疾病负荷极高,预后属高危组。在治疗上,尽管目前尚无标准的一线方案,但普遍认为应选用较强烈的化疗方案如EPOCH,以期获得较好的疗效。另外,PBL细胞表面高表达CD38,因此抗CD38单抗达雷妥尤单抗可能是一种有前景的新型治疗选择。本例即在常规EPOCH方案的基础上联合了达雷妥尤单抗,但患者骨髓抑制严重,最终因重症感染死亡。对于此类高危、预后差的PBL,如何权衡化疗强度与不良反应,值得进一步的探讨。
小结:前路漫漫,任重道远,PBL诊疗思路仍需继续探索
综上所述,本文报道了一例罕见的HIV阴性老年男性PBL,经病理证实其旁同时并存一个相对低度恶性的浆细胞肿瘤。这是首次在PBL旁发现独立的浆细胞肿瘤,提示二者在发病机制上可能存在一定的相关性。该肿瘤EBV滴度和Ki-67指数高,提示预后不良。尽管给予了EPOCH+达雷妥尤单抗等强化疗方案,患者最终仍因感染性并发症死亡。这提示对于高度恶性和晚期的PBL,现有治疗手段仍难以达到满意的疗效,尚有待进一步的研究。
一例60多岁的男性多发性骨髓瘤患者,在接受伊沙佐米、来那度胺、地塞米松方案化疗后出现发热、颈部和躯干疼痛性皮疹。皮疹表现为散在的环状红斑斑块,中心为紫红色,并有结痂。右胸部皮损呈“两色环状”:中心为紫癜,外周为红斑及水肿性边缘。
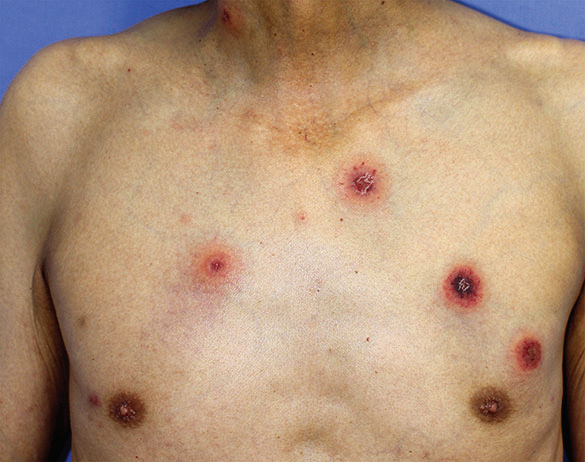
该患者最可能的诊断是什么?
A、多发性骨髓瘤的皮肤侵犯
B、多形性红斑
C、皮肤隐球菌病
D、Sweet综合征
E、环状肉芽肿
Pinto MP, Thorneloe NS, Brown MR, et al. The devolution of a mature plasma cell dyscrasia into a fatal plasmablastic lymphoma. J Case Rep Images Oncology. 2023;9(2):7-14. doi:10.5348/100124Z10MP2023CR.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


