2024年3月4日,由中山大学肿瘤防治中心徐瑞华教授、王峰教授牵头开展的CAPability-01研究荣登全球顶尖学术期刊Nature Medicine(IF=82.9)[1],作为Nature旗下最具含金量的子刊之一,Nature Medicine的发表体现了学术权威对于CAPability-01研究的认可。
该研究表明,对于微卫星稳定/错配修复功能完整(MSS/pMMR)型转移性结直肠癌(mCRC)患者,三药方案西达本胺+信迪利单抗+贝伐珠单抗进行三线及以上治疗,18周PFS率达64.0%,ORR达44.0%,中位PFS达7.3个月,被认为是MSS/pMMR晚期CRC患者极具前景的治疗选择。
西达本胺是由微芯生物自主研发的全球首个口服亚型选择性HDAC抑制剂,目前在国内已获批外周 T 细胞淋巴瘤(PTCL)和HR+/Her2-晚期乳腺癌适应症,并且在多种实体瘤的临床研究中显示出巨大潜力。在这一重要的历史性时刻,CAPability-01研究再次提示了西达本胺领衔的三药方案在mCRC治疗中极具竞争力的应用前景。

图1. CAPability-01研究在线发表于Nature Medicine
专家简介
中山大学附属肿瘤医院院长
华南恶性肿瘤防治全国重点实验室主任
中国医学科学院学部委员
中国临床肿瘤学会理事长
中国抗癌协会副理事长
中国临床肿瘤学会肠癌专业委员会主任委员
中国抗癌协会肿瘤靶向治疗专委会首任主任委员
中国抗癌协会肿瘤临床化疗专委会候任主任委员Cancer Communications IF 16.2主编
以第一完成人获得国家科技进步二等奖2项、全国创新争先奖1项、省部级一等奖6项、何梁何利基金科学与技术奖、吴阶平医药创新奖、谈家桢临床医学奖及CSCO年度成就奖
入选国家百千万人才工程、全国先进工作者、国务院特殊津贴专家、南粤百杰人才培养工程、国家卫生计生突出贡献中青年专家等人才项目
以第一和/或通讯作者在SCI收录期刊共发表论文200余篇,有多篇文章发表在国际权威的学术期刊上。如JAMA、Nature Materials、Nature Medicine、Lancet Oncology、JCO、Cancer Cell、Hepatology、Annals of Oncology等
中山大学肿瘤防治中心院长助理/内科主任
MD Anderson肿瘤中心博士
中国抗癌协会青年理事会副理事长
中国抗癌协会肿瘤靶向治疗专业委员会青委副主任委员
广东省抗癌协会肿瘤靶向治疗专业委员会青委主任委员
广东省抗癌协会多原发和不明原发肿瘤专业委员会 副主任委员
中国临床肿瘤学会理事
中国临床肿瘤学会青委会常委
主攻消化道肿瘤的内科治疗,主持国家自然科学基金国际(地区)合作与交流项目、面上项目在内的省部级基金8项,参与863计划、国家重点研发计划等重大项目研究
作为第一或通讯作者在JAMA Oncology、Cell Research、Annals of Oncology、Cancer Cell等杂志发表论文55篇,荣获国家科技进步奖二等奖、中华医学科技一等奖、教育部科技进步奖一等奖等省部级奖项。曾多次获邀在美国肿瘤研究协会年会、中国临床肿瘤学会年会等会议做口头报告
山穷水尽,另辟“西”径
西达本胺联合抗血管+免疫勇闯MSS/pMMR晚期肠癌治疗“无人区”
CRC作为全球第3大恶性肿瘤,每年全球新发病例超190万例[2],免疫检查点抑制剂(ICI)的出现有效改善了微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)表型患者的预后,但对MSS/pMMR患者,ICI单药治疗的疗效欠佳,被认为是当前免疫治疗的“无人区”,而这部分患者在晚期CRC患者中占比超过了90%[3,4]。
研究表明,MSS/pMMR型CRC表现出免疫抑制微环境,具有低肿瘤突变负荷(TMB)、肿瘤微环境中效应T细胞浸润有限及免疫抑制细胞高度浸润的特点点。鉴于此,研究者尝试联合策略来打破免疫抑制微环境,如与抗血管生成药物的联合。I期REGONIVO研究采取该模式便观察到了免疫与抗血管的协同效应[5],但这一结果却并未能在后续的同类研究中重复[6-9]。
为了尝试解决这一难题,徐瑞华教授与王峰教授决定另辟“西”径。CAPability-01研究选择了组蛋白去乙酰化酶(HDAC)抑制剂西达本胺,该药物此前被证实可通过抑制相关HDAC亚型,增加染色质组蛋白的乙酰化水平,引发染色质重塑,使多条信号转导通路的表观遗传改变,发挥抑制肿瘤细胞周期,诱导肿瘤细胞凋亡的效果[10-14]。在临床研究中,HDAC抑制剂联合ICI也已经在NK/T细胞淋巴瘤、非小细胞肺癌、乳腺癌等恶性肿瘤中展示出良好的疗效和可控的安全性[15-20]。基于此前研究结果,徐瑞华教授与王峰教授大胆假设HDAC抑制剂与ICI的联合也可具有协同增效作用,并可尝试通过与抗血管生成药物的联合进一步探索三联方案的应用可能性。完成了研究设计之后,CAPability-01研究正式提上日程,西达本胺联合免疫+抗血管,携手“勇闯无人区”。
协同增效,成绩斐然
表观遗传修饰助力MSS/pMMR CRC由“冷”变“热”, 改变晚期结直肠癌的治疗格局
CAPability-01是一项随机、开放、多中心、双臂设计的II期临床研究,纳入无法切除的化疗难治性局部晚期或转移性MSS/pMMR CRC患者,旨在初步探索信迪利单抗+西达本胺联合或不联合贝伐珠单抗治疗的疗效与安全性。研究在2021年3月至2022年4月期间,在全国四家研究中心(中山大学肿瘤防治中心、浙江大学医学院附属第一医院、广西医科大学第一附属医院、哈尔滨医科大学附属肿瘤医院)共纳入48例患者,按1:1被随机分为两组,分别接受西达本胺+信迪利单抗+贝伐珠单抗(三药组,n=25)和西达本胺+信迪利单抗(两药组,n=23)治疗。研究的主要研究终点为18周PFS率,次要终点包括OS、PFS、ORR、DCR、DOR和安全性,关键的探索性终点包括临床疗效或毒性相关生物标志物(循环肿瘤DNA及其他)。
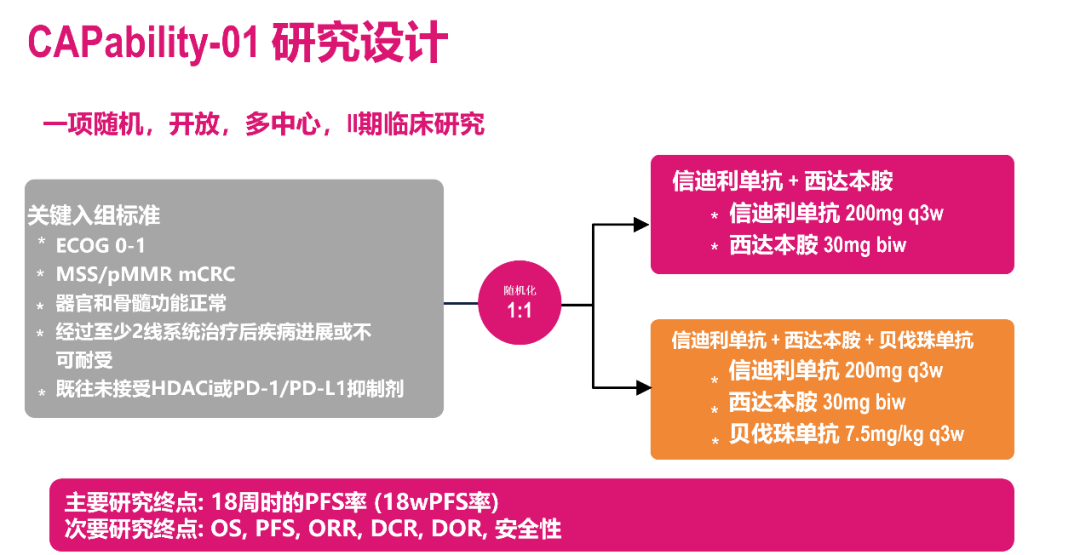
图2. CAPability-01研究设计
研究纳入的48例患者中位年龄55岁,其中男性32例(66.7%),37例(77.1%)患者ECOG PS为1分,其余均为0分。癌症原发部位为右半结肠13例(27.1%),左半结肠和直肠35例(72.9%)。入组时26例(54.2%)伴肝转移,33例(68.8%)伴肺转移;在基因突变方面,RAS/BRAFV600E野生型、RAS突变及BRAFV600E突变分别有24例(50.0%)、20例(41.7%)和1例(2.1%)。所有患者中,25例(52.1%)接受了不到三线的系统治疗,23例(47.9%)患者接受过三线以上治疗。除双药组有更多患者曾接受过贝伐珠单抗治疗,两组在其他人口统计学和基线疾病特征方面均衡可比。
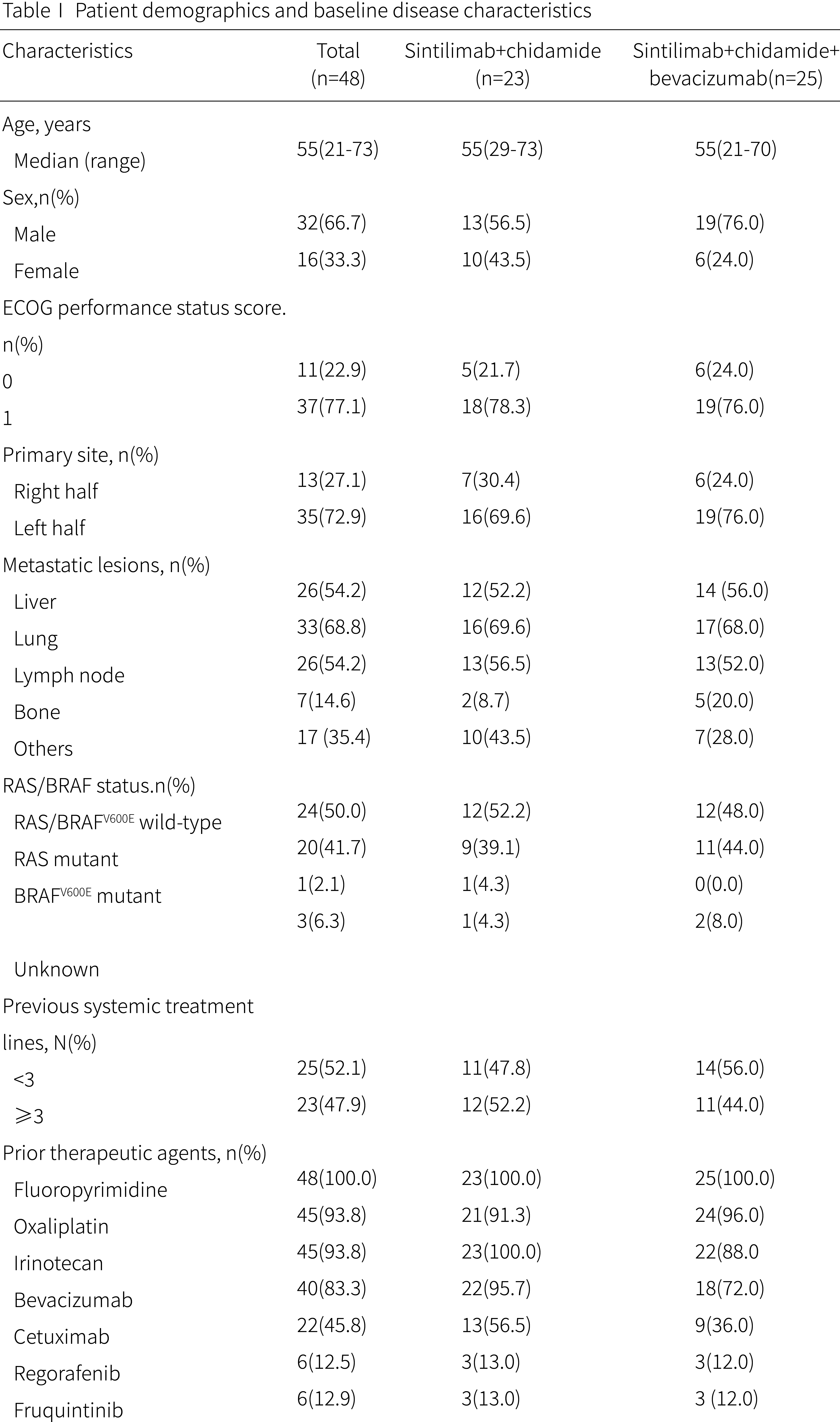
图3. 患者基线状态
截至2023年5月26日,三药组和两药组的中位随访时间分别为19.1个月和17.9个月。所有意向治疗(ITT)人群的18周PFS率达43.8%,中位OS尚未成熟,中位PFS 3.7个月,ORR、DCR和中位DOR分别为29.2%、56.3%和12.0个月。
与两药组相比,三药组取得了显著更优的疗效表现,18周PFS率达64.0%(vs. 21.7%,P=0.003),中位PFS达7.3个月(vs. 1.5月,HR=0.43,P=0.006)(图4),ORR 44.0%(vs. 13.0%,P=0.027),DCR 72.0%(vs.39.1%,P=0.041)。三药组25例患者中,PR者11例(44.0%),SD者7例(28.0%)(图5)。
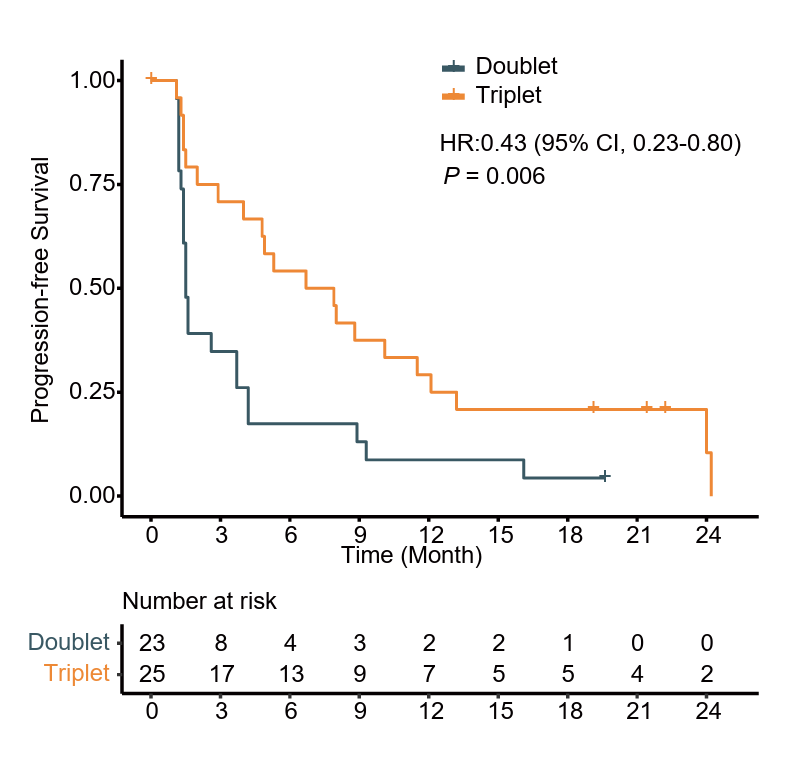
图4. 两药组与三药组的PFS K-M曲线
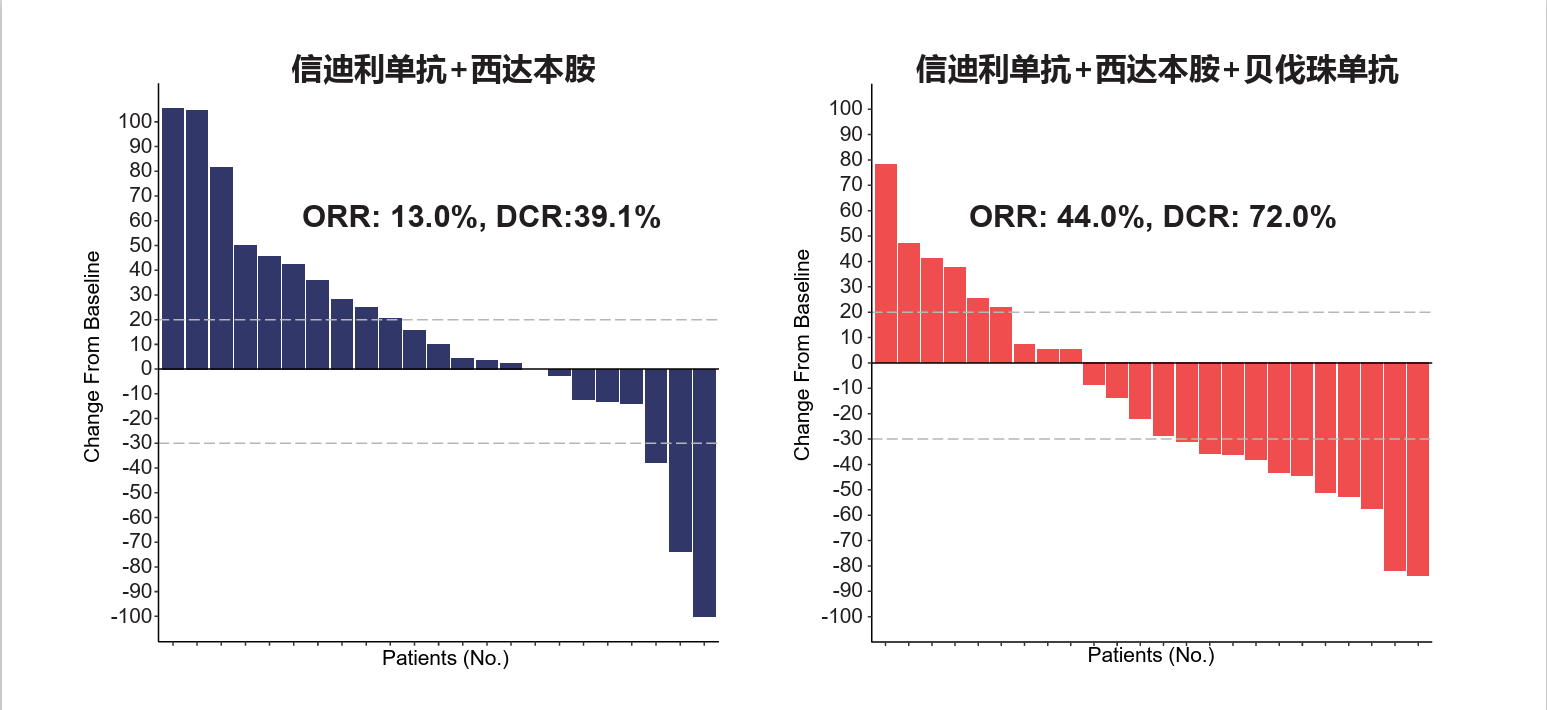
图5. 两药组和三药组的肿瘤缓解表现
在研究的预设亚组分析中,PFS的HR均倾向于三药组。其中,在26例肝转移患者中,三药组(n=14)的18周PFS率(64.3% vs. 8.3%)、中位PFS(7.3个月 vs. 1.4个月,P=0.001,图6)、ORR(50.0% vs. 8.3%)、DCR(71.4% vs. 8.3%)都较两药组(n=12)更为出色。而在三药组内部,肝转移患者(n=14)对比无肝转移患者(n=11)的疗效接近(18wPFS率:64.3% vs. 63.6%;mPFS 7.3m vs. 6.7m;ORR 50.0% vs. 36.4%; DCR 71.4% vs. 72.7%),表明西达本胺+信迪利单抗+贝伐珠单抗三药组方案可有效改善肝转移患者治疗结局。
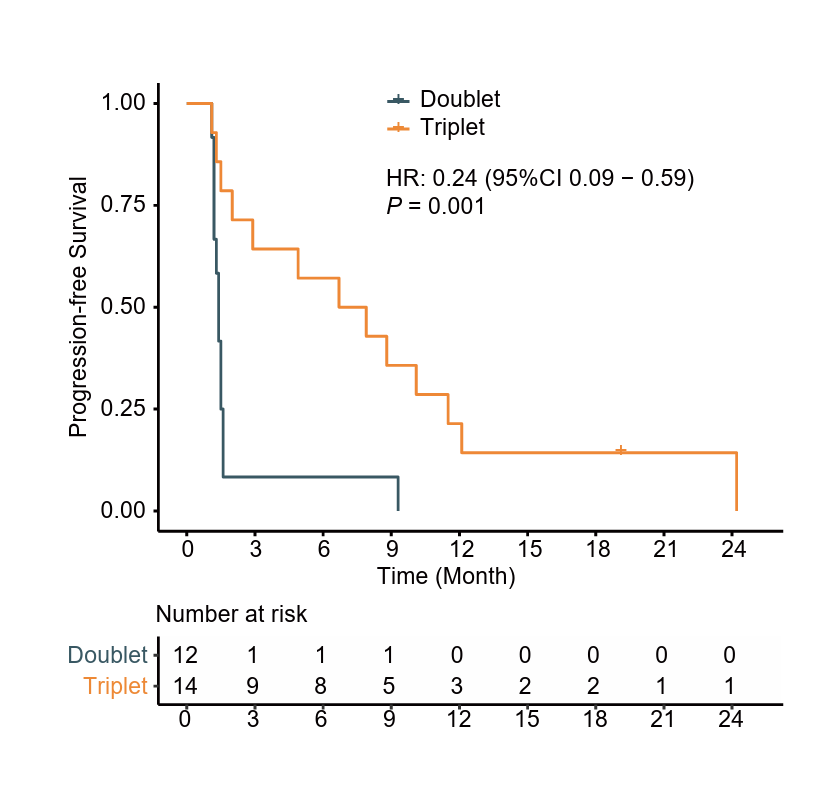
图6. 肝转移亚组中两药组与三药组的PFS K-M曲线
在安全性方面,两组观察到的最常见的治疗期间不良事件包括蛋白尿、血小板减少、中性粒细胞减少、贫血、白细胞减少和腹泻。三药组和两药组≥3级治疗期间不良事件(TEAE)的发生率分别为60.0%和30.4%,最常见的≥3级TEAEs分别为血小板减少症(16.0% vs. 8.7%)和中性粒细胞减少症(28.0% vs. 0.0%)。
研究对生物标志物的探索性分析为解释三药组疗效更佳带来了有益提示。RNA测序数据分析表明,三药组中与未应答患者(SD或PD)相比,对治疗应答者(CR或PR)治疗后肿瘤内CD8+T细胞、细胞毒性淋巴细胞和单核细胞谱系增加,同时肿瘤内B细胞谱系、内皮细胞和成纤维细胞减少。然而,类似的结果却未在三药组/两药组未应答患者中观察到。基因集富集分析则显示,三药组患者治疗后的“干扰素- γ反应”、“同种异体移植排斥反应”、“炎症反应”和“干扰素- α反应”等多种免疫相关途径上调; 同时,基因集变异分析(GSVA)也提示,在从抗原呈递到效应细胞杀伤的整个过程中,三药组的治疗应答者均表现出了更强的抗肿瘤免疫应答(图7)。
由此可见,在ICI+抗血管生成治疗基础上,西达本胺的加入起到了画龙点睛的效果,使MSS/pMMR型mCRC患者的肿瘤成功由“冷”变“热“,实现“1+1+1>3”的疗效,使这片治疗“无人区”大显“生机”。
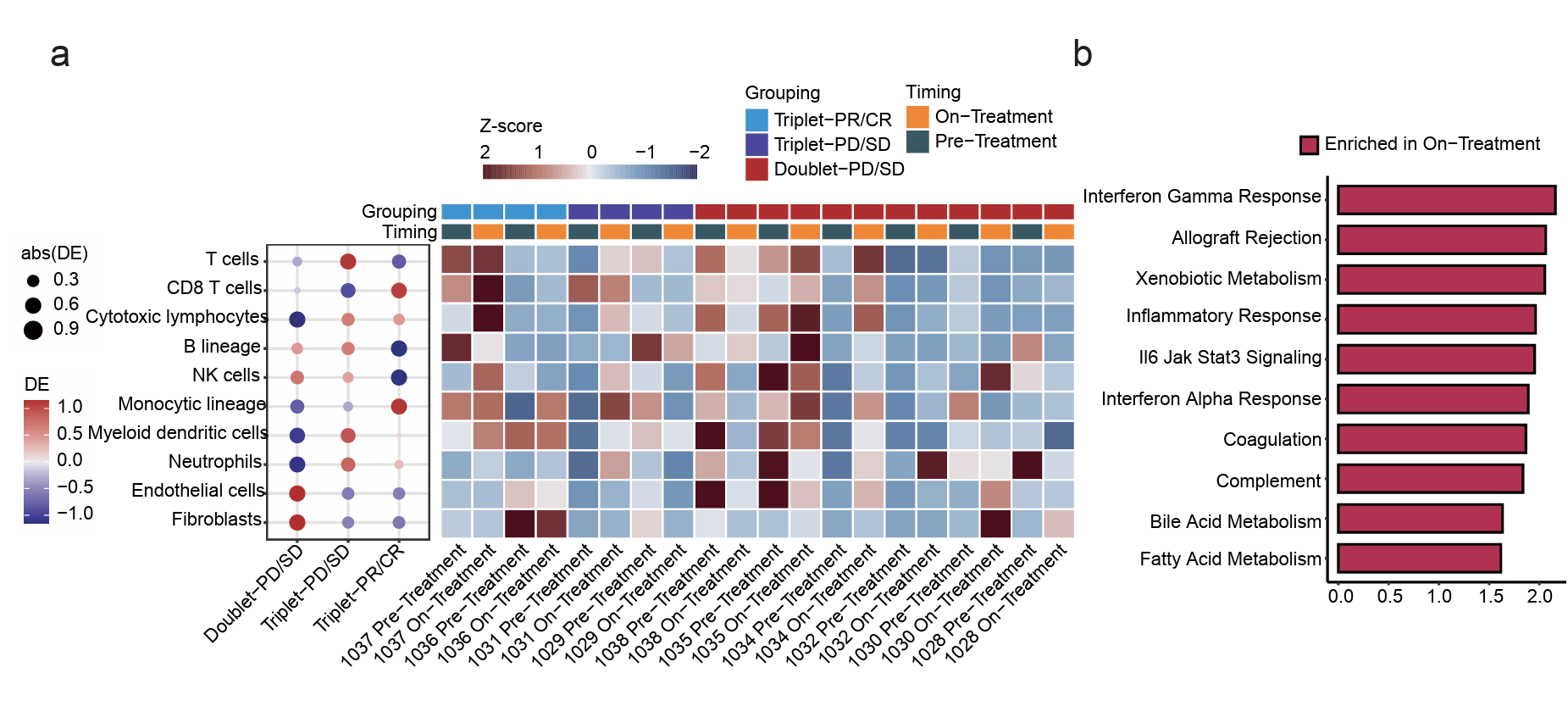
图7. 三药方案增强了肿瘤的免疫应答
进无止境,探索不止
西达本胺领衔CAPability模式挑战MSS/pMMR CRC二线标准治疗,未来可期
综上所述, CAPability-01研究的成功无疑为mCRC的后线治疗提供了一种极具希望的全新选择,研究继2023 ESMO大会上进行口头报告后,登顶国际顶尖学术期刊Nature Medicine,代表着全球领域内同行对这一开创性研究的高度认可,这也激励着研究者循着这一方向开展更多有意义的临床探索,为更多患者带来福音。
全国、多中心CAPability-02研究(NCT05768503)即是其中之一,研究者将尝试把CAPability模式由三线及以上提前至二线,即在一线奥沙利铂治疗失败后的MSS/pMMR患者中,探索西达本胺+免疫+抗血管的三药治疗模式对比标准二线治疗方案FOLFIRI+贝伐珠单抗的疗效与安全性,结果值得期待。同时,该模式也将在其他瘤种中开展探索(NCT05163483)。此外,CAPability-01研究Leading PI中山大学肿瘤防治中心徐瑞华教授此前还表示,未来将进一步开展基础研究,以探索三药联合方案的作用机制。我们也期待未来这一模式可以拓展至更多实体瘤类型,为更多患者带来获益。
[1] Wang, F., Jin, Y., Wang, M. et al. Combined anti-PD-1, HDAC inhibitor and anti-VEGF for MSS/pMMR colorectal cancer: a randomized phase 2 trial. Nat Med (2024).
[2] https://www.who.int/news/item/01-02-2024-global-cancer-burden-growing--amidst-mounting-need-for-services
[3] Wang, F. et al. Expert opinions on immunotherapy for patients with colorectal cancer. Cancer Commun (Lond) 40, 467-472 (2020). https://doi.org:10.1002/cac2.12095
[4] Zhou, C. et al. Outcomes and toxicities of immune checkpoint inhibitors in colorectal cancer: a real-world retrospective analysis. Cancer Commun (Lond) 41, 921-924 (2021). https://doi.org:10.1002/cac2.12199
[5] Fukuoka, S. et al. Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial (REGONIVO, EPOC1603). J Clin Oncol 38, 2053-2061 (2020). https://doi.org:10.1200/JCO.19.03296
[6] Fakih, M. et al. Regorafenib plus nivolumab in patients with mismatch repair-proficient/microsatellite stable metastatic colorectal cancer: a single-arm, open-label, multicentre phase 2 study. EClinicalMedicine 58, 101917 (2023). https://doi.org:10.1016/j.eclinm.2023.101917
[7] Kim, R. D. et al. A phase I/Ib study of regorafenib and nivolumab in mismatch repair proficient advanced refractory colorectal cancer. Eur J Cancer 169, 93-102 (2022). https://doi.org:10.1016/j.ejca.2022.03.026
[8] Wang, F. et al. Regorafenib plus toripalimab in patients with metastatic colorectal cancer: a phase Ib/II clinical trial and gut microbiome analysis. Cell Rep Med 2, 100383 (2021). https://doi.org:10.1016/j.xcrm.2021.100383
[9] Cousin, S. et al. Regorafenib-Avelumab Combination in Patients with Microsatellite Stable Colorectal Cancer (REGOMUNE): A Single-arm, Open-label, Phase II Trial. Clin Cancer Res 27, 2139-2147 (2021). https://doi.org:10.1158/1078-0432.ccr-20-3416
[10] Gameiro, S. R., Malamas, A. S., Tsang, K. Y., Ferrone, S. & Hodge, J. W. Inhibitors of histone deacetylase 1 reverse the immune evasion phenotype to enhance T-cell mediated lysis of prostate and breast carcinoma cells. Oncotarget 7, 7390-7402 (2016). https://doi.org:10.18632/oncotarget.7180
[11] Gomez, S., Tabernacki, T., Kobyra, J., Roberts, P. & Chiappinelli, K. B. Combining epigenetic and immune therapy to overcome cancer resistance. Semin Cancer Biol 65, 99-113 (2020). https://doi.org:10.1016/j.semcancer.2019.12.019
[12] Borcoman, E. et al. HDAC Inhibition to Prime Immune Checkpoint Inhibitors. Cancers (Basel) 14 (2021). https://doi.org:10.3390/cancers14010066
[13] Wang, X. et al. HDAC inhibitors overcome immunotherapy resistance in B-cell lymphoma. Protein Cell 11, 472-482 (2020). https://doi.org:10.1007/s13238-020-00694-x
[14] Sen, D. R. et al. The epigenetic landscape of T cell exhaustion. Science 354, 1165-1169 (2016). https://doi.org:10.1126/science.aae0491
[15] Azad, N. S. et al. ENCORE 601: A phase 2 study of entinostat in combination with pembrolizumab in patients with microsatellite stable metastatic colorectal cancer. Journal of Clinical Oncology 36, 3557-3557 (2018). https://doi.org:10.1200/JCO.2018.36.15_suppl.3557
[16] Hellmann, M. D. et al. Entinostat plus Pembrolizumab in Patients with Metastatic NSCLC Previously Treated with Anti-PD-(L)1 Therapy. Clin Cancer Res 27, 1019-1028 (2021). https://doi.org:10.1158/1078-0432.CCR-20-3305
[17] Sullivan, R. J. et al. Abstract CT072: Efficacy and safety of entinostat (ENT) and pembrolizumab (PEMBRO) in patients with melanoma previously treated with anti-PD1 therapy. Cancer Research 79, CT072-CT072 (2019). https://doi.org:10.1158/1538-7445.am2019-ct072
[18] Gao, Y. et al. Anti-PD-1 Antibody (Sintilimab) Plus Histone Deacetylase Inhibitor (Chidamide) for the Treatment of Refractory or Relapsed Extranodal Natural Killer/T Cell Lymphoma, Nasal Type (r/r-ENKTL): Preliminary Results from a Prospective, Multicenter, Single-Arm, Phase Ib/II Trial (SCENT). Blood 136, 39-40 (2020). https://doi.org:10.1182/blood-2020-134665
[19] Gray, J. E. et al. Phase I/Ib Study of Pembrolizumab Plus Vorinostat in Advanced/Metastatic Non-Small Cell Lung Cancer. Clin Cancer Res 25, 6623-6632 (2019). https://doi.org:10.1158/1078-0432.CCR-19-1305
[20] Sonnenblick, A. et al. 267P Phase Ib/II open-label, randomized evaluation of second- or third-line (2L/3L) atezolizumab (atezo) + entinostat (entino) in MORPHEUS-HR+ breast cancer (M-HR+BC). Annals of Oncology 32, S479 (2021). https://doi.org:10.1016/j.annonc.2021.08.550
排版编辑:肿瘤资讯-Tracy











 苏公网安备32059002004080号
苏公网安备32059002004080号


