关注专题,查看全系列精要解读
在【肿瘤资讯】重磅栏目之“食管癌年终盘点”上,中国医科大学附属第一医院曲秀娟教授系统地梳理了2023年晚期食管癌二线及以上治疗重要研究进展,重点介绍和剖析了免疫检查点抑制剂(ICI)治疗耐药机制、耐药后给药策略以及耐药预测因子。【肿瘤资讯】特此整理精要内容,以飨读者。
中国医科大学附属第一医院肿瘤内科主任
肿瘤学教研室副主任
CSCO 理事
CSCO智慧医疗专家委员会副主任委员
CSCO胃癌专家委员会常委
中国医师协会结直肠癌专委会常委
中国老年医学会肿瘤学分会总干事
中华医学会肿瘤学分会胃癌学组委员
CSCO免疫治疗、抗肿瘤药物安全、临床研究专委会委员
辽宁省医学会肿瘤学分会候任主任委员
辽宁省免疫学会肿瘤学分会候任主任委员
辽宁省抗癌协会肿瘤标志物专委会候任主任委员
主持科技重大专项1项,国自然6项,省科技进步一等奖2项
在JCO等杂志发表第一或通讯作者SCI论文100余篇
目前PD-1抑制剂联合化疗已成为晚期食管鳞癌一线治疗标准。从《2023 CSCO食管癌诊疗指南》可发现,已有一系列PD-1单抗联合化疗方案被纳入食管癌一线治疗的I级专家推荐中(1A类证据)。因此晚期食管鳞癌的一线治疗策略已完全改变。在《2023 CSCO食管癌诊疗指南》中,既往未接受过免疫检查点抑制剂治疗的患者二线治疗推荐使用化疗、免疫单药、靶向治疗等。
免疫联合化疗已成为食管鳞癌一线标准方案,耐药进展后,二线治疗该如何选择?目前没有标准答案。基于此需要解决三大问题:第一,耐药机制是什么?第二,二线治疗应该采取何种策略?是联合还是直接换药,换成靶向药物还是换成单纯化疗?第三,有无更好的预测因子从而帮助选择治疗方案。
ICI耐药机制
免疫检查点抑制剂(ICI)耐药模式可分为以下几类:第一类为肿瘤初始对免疫治疗无应答;第二类为肿瘤初始免疫应答激活后又关闭,临床表现为初始治疗无效状态。第三类为初始治疗有效,后进展(部分耐药克隆被筛选扩增);第四类为初始治疗有效,后进展(免疫敏感克隆突变转变为耐药型)。
在时间点上,免疫治疗耐药分成原发耐药和继发耐药。原发耐药的药物暴露时间≥6周,最佳应答是疾病进展(PD)或疾病稳定(SD)<6个月。继发耐药的暴露时间≥6个月,最佳应答是完全缓解(CR)、部分缓解(PR)或SD>6个月。
ICI治疗失败的三大原因:一是生成的杀伤性T细胞(CTLs)不足;二是产生的CTLs杀伤功能异常;三是效应记忆T细胞的形成受阻。
耐药后策略
目前针对不同的ICI耐药机制,多种克服ICI耐药的研究正在开展中,涌现出多种潜在方案。例如,ICI联合化疗、放疗、ICI、抗VEGF抗体、酪氨酸激酶抑制剂(TKI)、MARP抑制剂和抗EGFR抗体等。
ICI联合TKI:卡瑞利珠单抗联合阿帕替尼治疗40例既往接受过免疫、化疗的晚期食管鳞癌患者的CAP02研究,设计了2个队列,其中队列1纳入的是一线化疗失败的患者;队列2纳入的是一线免疫+化疗治疗失败的患者。2023 ASCO GI大会上公布了新数据。截至2022年9月,初步数据显示,ORR达41%,DCR达94.1%。从研究结果看,在一线免疫治疗进展后,采用抗血管生成联合PD-1抑制剂,可为食管癌患者带来进一步获益(图1)。
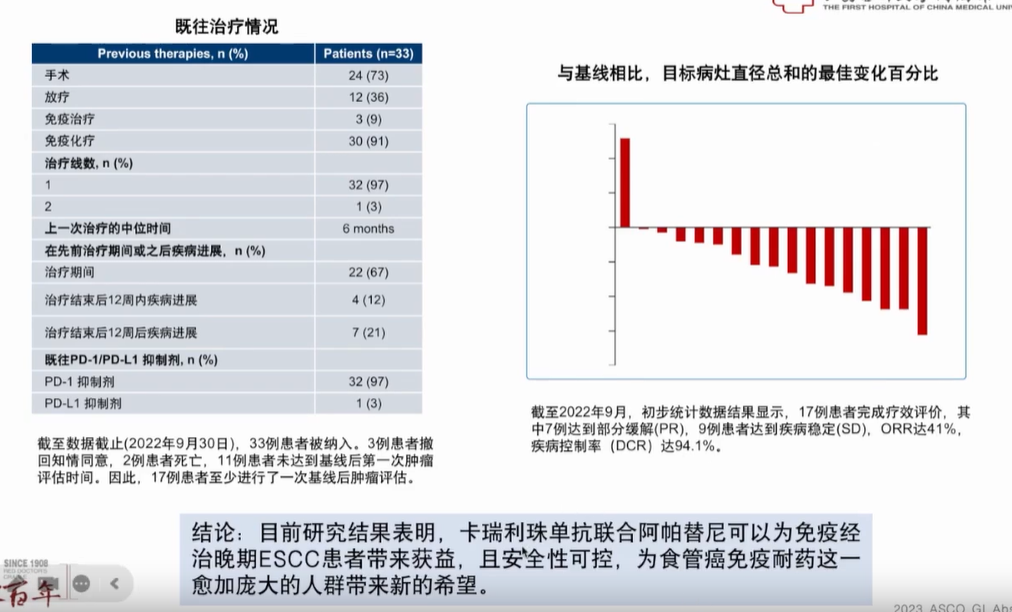
图1 CAP02研究
ICI联合TKI:纳武利尤单抗联合瑞戈非尼治疗复发或转移性实体瘤患者的II期研究食管鳞癌(ESCC)队列的初步数据显示,瑞戈非尼联合纳武利尤单抗在经治ESCC 患者中具有良好的疗效,具体而言,在接受治疗的30例ESCC患者中,29例患者的应答可评价,ORR为43%,其中3例患者达到CR,10例患者达到PR(图2)。
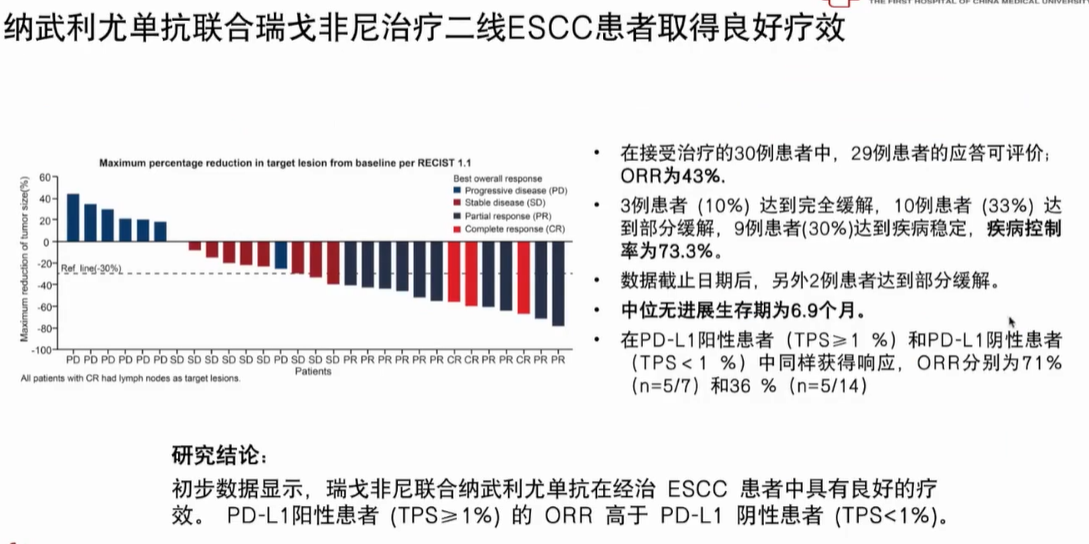
图2 纳武利尤单抗联合瑞戈非尼二线治疗食管鳞癌(ESCC)研究
ICI联合抗EGFR抗体:EGFR单抗HLX07单药或联合ICI治疗晚期食管癌的研究,A组纳入了既往未接受过抗肿瘤治疗的患者,B组纳入了一线免疫联合化疗治疗失败或至少两种其他系统性抗肿瘤治疗失败的患者。结果显示,B组的ORR为23.1%,DCR为38.5%(图3)。这提示经过一线化免联合治疗的食管癌患者,二线采用EGFR单抗治疗能够带来一定获益。
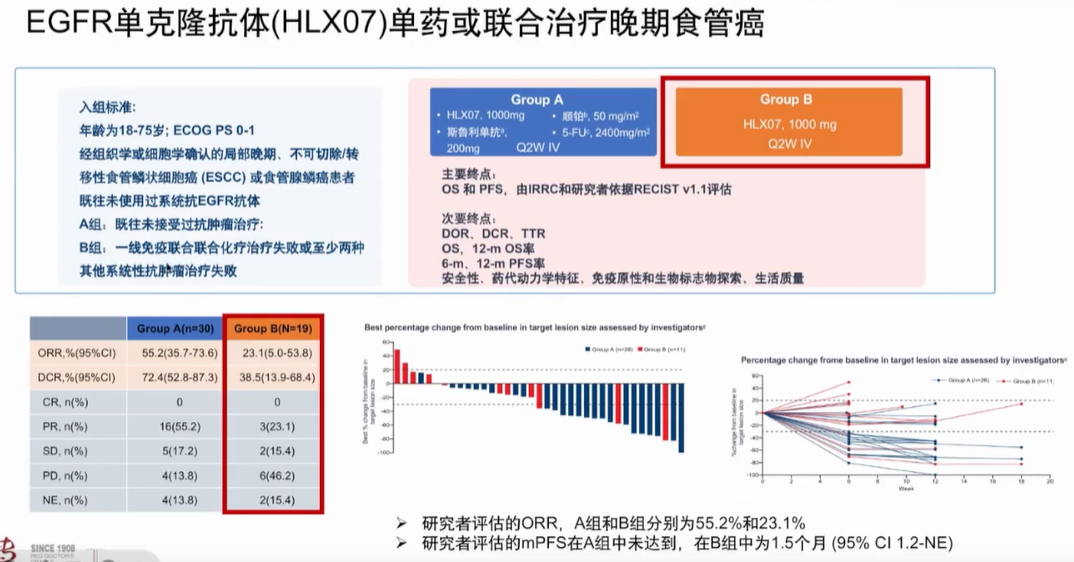
图3 HLX07单药或联合治疗晚期食管癌的研究
ICI联合FGFR抑制剂:FGFR抑制剂呋喹替尼联合帕博利珠单抗治疗晚期或转移性实体瘤患者的开放标签、多中心、Ib期研究,分为两个阶段,一阶段为可行性研究阶段,入组晚期/进展期实体瘤患者;二阶段为扩展阶段,入组食管癌患者,并根据之前ICI的治疗情况分为A和B两个队列。结果显示,ICI难治性食管癌患者(B队列)的ORR为20%,DCR为60%。
免疫协同放化疗二线治疗寡转移食管鳞癌的研究结果显示,一线免疫联合铂类治疗后进展的患者,接受卡瑞利珠单抗+放疗+伊立替康治疗,ORR达40.8%,DCR达75.5%,mPFS 为6.93个月,OS为12.8个月(图4)。
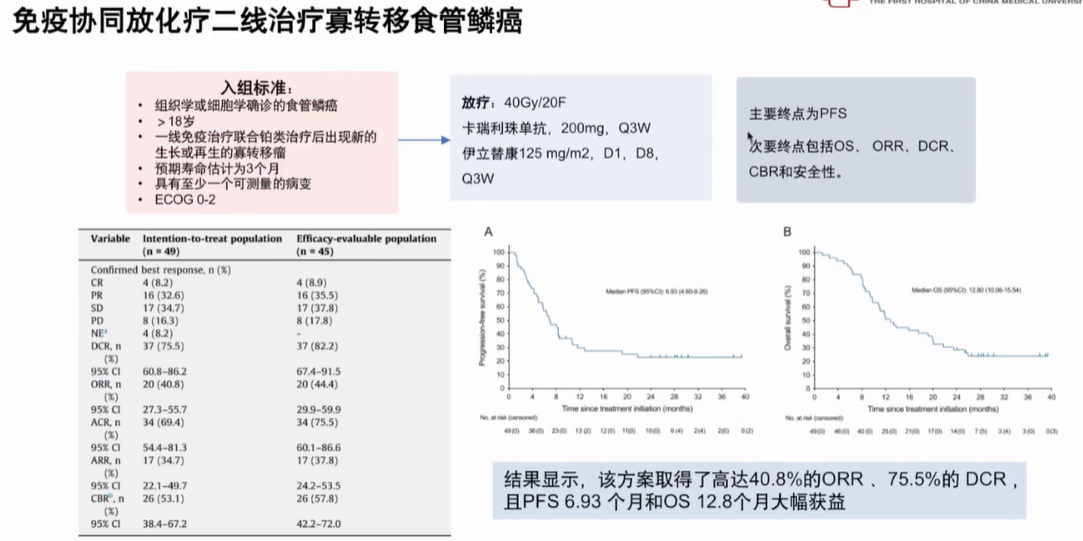
图4 免疫协同放化疗二线治疗寡转移食管鳞癌研究
ICI联合抗TIGIT抗体:2023 ESMO年会上公布了多中心、随机双盲、安慰剂对照II期AdvanTlG-203研究结果(图5)。相较于安慰剂+替雷利珠单抗,Ociperlimab(OCl)+替雷利珠单抗二线治疗一线化疗后进展的PD-L1阳性不可切除、局部晚期复发/转移性ESCC患者,在ORR数值上有所增加(30.6% vs 20.6%,P=0.2114),两种方案的PFS相似,OS数据尚未成熟。安全性方面,替雷利珠单抗基础上加用Ociperlimab(OCl)总体耐受性良好,毒性可管理。尽管该研究未纳入一线免疫联合治疗的患者,但研究结果为未来的研究提供了新方向。
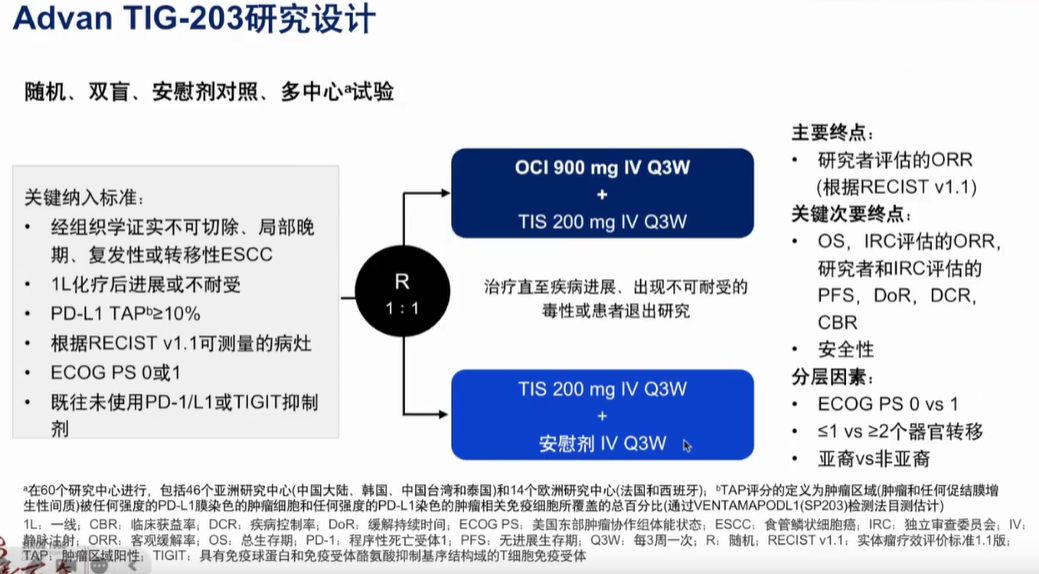
图5 AdvanTlG-203研究
DNA损伤修复基因即DDR基因,与肿瘤的发生、发展和肿瘤免疫微环境都密切相关。2023年发表在Cancer Cell上的一项研究,对155例食管鳞癌患者肿瘤组织的转录组数据进行了分析。通过单因素Cox回归结果看出6个DDR通路中有4个DDR通路与较好的生存显著相关。根据这4个DDR通路基因表达谱对155例食管鳞癌患者进行聚类分析,发现了与患者预后生存显著相关的DDR聚类:DDR-active和DDR-silent,其中DDR-silent患者预后较差。进一步研究发现,GITR和BTLA是DDR-silent组食管鳞癌患者的潜在免疫治疗联合靶点,可以增强PD-1抗体和化疗的疗效(图6)。

图6 基于DDR分型的肿瘤免疫微环境特征鉴定局部食管鳞癌免疫治疗靶点
免疫耐药预测因子
ICI治疗ESCC的生物标志物包括PD-L1表达、肿瘤突变负荷(TMB)、MSI-H/dMMR、拷贝数变化、T细胞克隆性变化、T细胞炎症微环境等,联合不同机制的生物标志物可能增加预测能力。
有研究团队对多个生物学因素(TMB、拷贝数变化评分、HLA-1进化差异、HLA-1杂合性缺失、MSI、BMI、性别、NLR、肿瘤分期、免疫治疗药物、年龄、肿瘤类型、免疫治疗前化疗以及白蛋白、血小板和血红蛋白等血液指标)进行综合,构建了构建RF16模型以提高预测ICI疗效的能力。RF16模型被证明可预测ICI治疗的疗效,具有较高的灵敏度和特异性。2023ESMO大会上有研究通过多因素COX回归分析构建了由STC2、APLN、GPER1、FMO1、SNRPB、FABP3等6个基因组成的预后模型,该预后模型预测性能良好,发现免疫和代谢相关基因与食管癌患者的预后显著相关。该联合预测模型的建立有助于食管癌患者临床诊断和治疗,为探索食管癌的分子机制提供了新视角
小结
首先,转移性食管癌患者的预后通常较差,5年生存率低于5%。目前指南推荐一线化疗联合免疫治疗,然而,对于一线化疗联合免疫治疗进展的食管癌患者尚无公认的二线治疗标准。其次,食管癌二线免疫治疗方面,选择合适的ICI联合疗法(如TKI、EGFR单抗、FGFR抑制剂)或者应用其他新型ICI克服耐药是未来重点探索方向。最后,未来应该以精准治疗为导向,但单一生物标志物不太可能准确预测 ICI的疗效,简洁、微创或无创Biomaker模型的建立指导治疗,可使患者获益最大、损伤最低。
排版编辑:樊雅琦











 苏公网安备32059002004080号
苏公网安备32059002004080号


