乳腺癌(breast cancer)是全世界女性中最普遍的恶性肿瘤。近几十年来,尽管发现内分泌治疗 (endocrine therapy,ET)、化疗、免疫治疗和联合治疗可改善乳腺癌的预后,但乳腺癌异质性和复杂性的特点,对改善乳腺癌的临床生存期提出了挑战。
一般来讲,细胞死亡分为意外细胞死亡(accidental cell death,ACD)和调节性细胞死亡(regulatory cell death,RCD)。ACD 是一个不可控的生物学过程, 而 RCD 具有精确的分子机制和复杂的信号调节途径。目前已有数十种RCD,其中细胞凋亡、焦亡、 自噬、铁死亡和坏死已被广泛研究。通过诱导癌细胞死亡是癌症治疗的常见策略。铜死亡作为一种新型细胞死亡方式,是铜诱导的线粒体细胞死亡方式,参与肿瘤的增殖与转移,在乳腺癌治疗中具有重要作用[1]。笔者现就铜死亡及其衍生物在肿瘤进 展中的机制及其在乳腺癌中的相关研究进行综述。

任黎蕾,赵小波,高砚春等.铜死亡与乳腺癌相关性的研究进展[J/OL].中国普外基础与临床杂志,1-7[2024-01-26].
铜死亡概述
铜在铜死亡中的作用
铜是介导细胞功能的酶的重要辅助因子。铜稳态是维持细胞基本功能的保证,体内铜转运涉及多种铜分子伴侣和铜转运体。金属还原酶将细胞外 Cu2+还原为 Cu+ ,铜转运蛋白 1(copper transportprotein,CTR1)将 Cu+从细胞外转移到细胞内,进入细胞内的铜离子通过铜分子伴侣转运。研究[2]表明,CTR1 在黑色素瘤、肝癌、前列腺癌和其他人类癌细胞系中高度表达。2014 年 Brady 等[3]证实了CTR1 调控的铜间接调节丝氨酸-苏氨酸激酶(serine/threonine-protein kinase B-raf,BRAF)/丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)/细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)信号通路,最终抑制肿瘤生长。
铜转运蛋白质α链抗体(ATPase copper transporting alpha polypeptide,ATP7A)和铜转运蛋白质 β 链抗体(ATPase copper transporting beta polypeptide,ATP7B)是 P 型铜输出 ATP 酶 P1B 亚家族的两个成员。研究[4]表明,应用 CRISPR/Cas9 沉默 ATP7A 后,赖氨酸氧化酶的活性在乳腺癌和肺癌细胞系中受到抑制,进一步抑制肿瘤细胞的生长和迁移。此外,靶向 ATP7A 或 ATP7B 在克服肿瘤细胞对铂类药物的耐药性方面具有广阔的应用空间[5]。
铜诱导程序性细胞死亡的机制一直备受人们的关注,早在 20 世纪 80 年代学者就发现铜会导致细胞死亡,但确切的机制未得到证实[ 6 ]。直到 Tsvetkov 等[7]的研究显示,在人类细胞中铜依赖性受控细胞死亡是一种不同于已知细胞死亡机制的由铜介导的新型细胞死亡方式,它是通过铜离子与线粒体呼吸中的三羧酸循环(tricarboxylic acid cycle,TCA)中的脂酰化成分直接结合而发生的,导致脂酰化蛋白质聚集和随后的铁硫簇蛋白表达下调,进而发生蛋白质毒性应激并导致细胞死亡,该团队将这种死亡方式命名为铜死亡,但该研究中铜死亡的细胞形态学变化尚未明确,缺乏有效评估铜死亡的方法。细胞中 Cu 的积累可能通过铁氧还蛋白 1(ferredoxin one,FDX1)介导 Cu2+还原成 Cu+ ,Fe-s 簇蛋白的降解、脂酰化,二氢硫辛酰胺S-乙酰转移酶(dihydrolipoamide S-acetyltransferase, DLAT)的聚焦来诱导铜死亡[7, 8]。
铜在乳腺癌中的作用
铜是人生命活动中必不可少的微量元素[9]。研究[10-12]发现,与健康人相比,多种癌症患者的血清和肿瘤组织中的铜含量显著改变,其在癌症的发生发展中起到关键作用。铜已被证明能促进癌症进展和转移过程中至关重要的血管生成,可以激活血管生成因子,如血管生成素、血管内皮生长因子、成纤维细胞生长因子 1、白细胞介素 1 等。乳腺癌的发生与体内微量元素(如 Cu、Zn、Se)异常相关[13],微量元素的检测可能有助于乳腺癌的早期预防和预后[14]。铜也是自噬激酶驱动肺腺癌的重要调节因子[15],且是一种具有高度氧化还原活性的元素,铜的失调会导致活性氧(reaticve oxygen species,ROS)的过量产生。这些过量的 ROS 可以作为肿瘤转化发展和转移形成的前体。Bengtsson 等[16]针对1 998 例新诊断乳腺癌患者的前瞻性队列研究是第一项检查血清铜水平和铜/锌比值与乳腺癌存活率之间关系的研究,结果发现较高的血清铜/锌比值与乳腺癌诊断后较差的总体生存率相关。但 Jouybari 等[17]的荟萃分析不支持铜水平与乳腺癌之间存在关联,但同时也指出由于原始研究结果的高度异质性,需要设计良好的前瞻性研究来证实这一结论。
铜死亡的发生机制
铜是诸多生物过程的基础元素,包括线粒体呼吸、铁吸收、抗氧化、解毒等过程,铜通常在哺乳动物细胞内维持极低的水平,细胞内铜离子浓度超过维持稳态机制的阈值时,同样会表现出细胞毒性。在人类细胞中,依赖于铜的受调节的细胞死亡不同于已知的死亡机制,并且铜死亡依赖于线粒体呼吸。之前关于铜诱导的细胞死亡的研究中,大多数学者将铜死亡归因于铜对线粒体的作用导致 ROS 的产生[18]。线粒体呼吸可调节铜离子载体诱导的细胞死亡,依赖线粒体呼吸的细胞对铜离子诱导剂的敏感度是依赖糖酵解细胞的 1 000 倍左右,用线粒体抗氧化剂、脂肪酸和线粒体功能抑制剂处理都会明显改变细胞对铜离子的敏感性。线粒体解偶联剂对铜毒性没有影响,这表明铜诱导的细胞死亡需要线粒体呼吸,而不是三磷酸腺苷(adenosine triphosphate, ATP)。代谢组学研究发现,对铜离子敏感细胞的代谢组学中,与 TCA 相关的代谢物明显增多,表明铜诱导的细胞死亡和线粒体代谢紧密相关[7]。总之铜死亡的主要过程依赖于细胞内铜离子的积累,铜离子与 TCA 的脂酰化成分直接结合导致脂酰化蛋白质聚集,铁硫簇蛋白质失调,进而引发蛋白质毒性应激,并最终导致细胞死亡。
FDX1 和脂酰化蛋白的丰度与多种人类肿瘤高度相关,具有高水平脂酰化蛋白的细胞系被证实对铜死亡更加敏感。研究人员[ 7 ]进行了全基因组
CRISPR-Cas9 功能丧失筛选,确定了参与铜离子载体诱导死亡的基因,发现敲除 FDX1 基因以及 6 个脂酰化蛋白基因(LIPT1、DLD、LIAS、DLAT、PDHA1、PDHB)可以挽救铜离子对细胞的杀伤作用,认为 FDX1 是铜离子载体诱导细胞死亡的关键介质。FDX1 是蛋白质脂酰化的上游调节因子,其缺失导致了蛋白质脂酰化功能的完全丧失,以及细胞内丙酮酸、α-酮戊二酸的积累与琥珀酸的消耗,阻断了 TCA 的进行。铜与脂酰化 TCA 循环蛋白的结合导致 DLAT 的脂酰化依赖性寡聚化。铜诱导的死亡机制与铜稳态失调的遗传模型相同 ,
Jiang 等[19]经生物信息学方法分析了人 FDX1 基因的核酸结构,预测了潜在的生物学功能,并探讨了乳腺癌铜死亡相关预后特征和调控轴。FDX1、
LIAS、DLAT被命名为铜死亡相关基因(Cu death
related gene,CRG),在调节铜死亡机制方面发挥重要作用,且铜转运蛋白 CTR1,以及铜转运酶
ATP7A 和 ATP7B 主要参与调节铜浓度的动态平衡,因此 CRG 和铜转运蛋白将成为未来癌症研究的重点,为肿瘤的诊断和治疗提供理论支持和参
考,其机制见图 1。
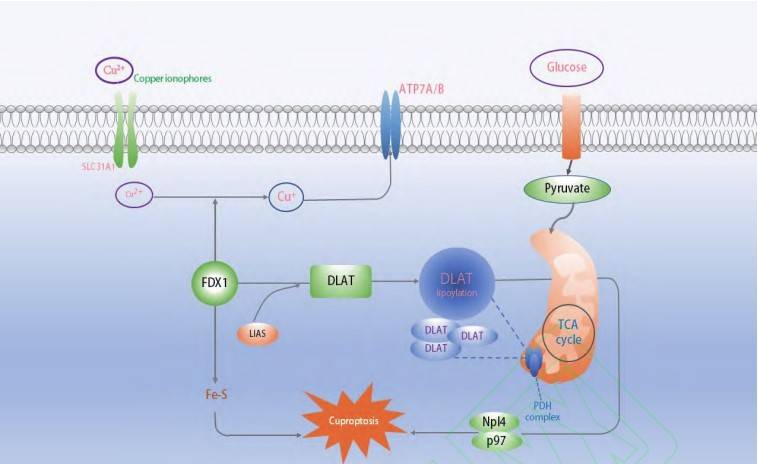
图 1 示铜死亡机制图
铜死亡基因与乳腺癌的相关性
大多数癌症治疗的目的是通过杀死癌细胞或阻止癌细胞迁移来减少癌细胞,实现癌细胞减少的最根本途径是诱导癌细胞死亡,因此,任何类型的细胞死亡对癌症研究人员都具有重要意义。最近发现的铜死亡将成为癌细胞死亡研究的下一个热点,探索铜死亡相关调节机制在肿瘤中的作用可增强对肿瘤的认识与治疗。
CRG 是乳腺癌的预后指标
溶质载体家族 31 成员 1(solute carrier family 31,SLC31A1)是最近发现的铜死亡基因,作为铜转运蛋白家族基因的一员,SLC31A1 与众多肿瘤发生和预后相关,可能是一种潜在的癌症关键生物标志物和治疗靶点[20]。Li 等[21]发现 CRG SLC31A1 是预测乳腺癌诊断、预后和治疗反应的潜在指标。刘以原[22]发现 SLC31A1 在包括乳腺浸润性癌在内的多种人类肿瘤中呈高水平表达,并且与乳腺浸润性癌的不良预后呈正相关。
另一研究[23]则证明了丙酮酸脱氢酶 E1α 亚基(pyruvate dehydrogenase E1 alpha subunit,PDHA1)可作为乳腺癌独立的预后生物标志物和免疫治疗的潜在靶点。Sha 等[24]分析发现 5 个铜死亡基因差异表达与三阴性乳腺癌(triple negative breast cancer, TNBC)预后显著相关,其中 ATP7A、二氢硫胺 S-琥珀酰基转移酶(dihydrolipoamide S-Succinyltransferase, DLST)、LIAS 高表达提示总生存期较差,LIPT1、 PDHA 1 高表达提示预后较好 , 并发现下调 ATP7A 的表达水平可显著抑制 TNBC 细胞的迁移和增殖能力。此外研究[25]发现,细胞周期蛋白依赖性激酶抑制因子 2A(cyclin-dependent kinase inhibitor 2A,CDKN2A)可作为 TNBC 的预后指标,这为 TNBC 的免疫治疗提供了理论基础,并为通过诱导铁死亡和铜死亡来开发新的抗癌治疗策略提供了依据,从而为肿瘤治疗提供新的方向。
CRG 调控乳腺癌细胞对药物的敏感性
铜通过抑制肿瘤细胞周期、下调信号通路、克服化疗耐药、抗氧化等诱导细胞死亡,阻断铜离子流出,使线粒体内铜不断积累。铜不仅能够通过诱导铜死亡导致肿瘤细胞死亡,还能克服肿瘤细胞对铂类药物耐药[26]。
肿瘤的特征之一是细胞代谢紊乱。FDX1 作为 调节铜死亡的相关基因,在调节铜死亡和肿瘤进展中发挥重要作用。在大多数癌症中 FDX1 的 mRNA 和蛋白表达均降低,如乳腺癌、结肠腺癌、肺腺癌、甲状腺癌等;此外,FDX1 的表达与抗肿瘤药物敏感性和耐药性相关,基因富集分析显示 FDX1 与免疫相关通路、免疫细胞浸润密切相关[27]。FDX1 有望成为未来癌症治疗的潜在靶点和评估预后的生物标志物。SLC31A1 最可能的上游非编码 RNA 调控机制为 LINC00511/miR-29c-3p/SLC31A1 调控轴,且 SLC31A1 的表达水平与免疫细胞浸润、免疫细胞生物标志物以及免疫检查点表达水平呈显著正相关,表明 SLC31A1 的表达水平可以作为某类药物敏感性的判断标准[22]。
铜死亡与乳腺癌综合性治疗的相关性
参与免疫治疗
铜稳态与癌症发展之间的关系仍不够确切,需要进一步探索验证其复杂性。Liu 等[28]利用肿瘤基因组图谱计划(TCGA)数据集经泛癌分析发现, CRG 与乳腺癌有关,且乳腺癌样本的免疫浸润特征与其他癌症有显著差异;LASSO-Cox 回归显示 CRG ATP7B 和 DLAT 富集在细胞周期通路中; CRG 得分较低组的免疫激活水平更高,存活概率更高,富含丙酮酸代谢和细胞凋亡相关通路,对化疗药物的敏感性更高;免疫组织化学染色显示,乳腺癌样本中 ATP7B 和 DLAT 蛋白表达较高。该研究[28]揭示了铜相关基因对乳腺癌的总体生存率、免疫浸润、药物敏感性和代谢谱的潜在影响,这些影响可以预测患者的生存率。这些发现可能有助于拓展乳腺癌治疗的深入研究[28]。
有研究[29]揭示了 CRG 风险模型具有指导 TNBC 免疫治疗的潜在应用前景,认为 LIAS 是铜死亡的关键基因,与肿瘤的发病机制和免疫应答有显著关系,通过生物信息学平台探索发现其在乳腺癌中表 达下调,而 LIAS 高表达的乳腺癌患者具有更好的总生存期、无远处转移生存期、进展后生存期和无复发生存期。此外 LIAS 的表达水平与 M1 巨噬细胞数量呈负相关[30]。Zhang 等[31]初步发现了铜死亡相关长链非编码 RNAs(long noncoding RNAs, LncRNAs)与抗肿瘤免疫之间的联系,发现受体激 酶酪氨酸、信号转导和转录激活因子(Janus signal transducer and activator of transcription,JAK-STAT)信号通路是参与免疫调节的重要通路,但预后模型需要更多的前瞻性、多中心、真实数据进一步验 证。Zhou 等[ 32 ]基于 NLRP3、LIPT1、PDHA1 和 DLST 的表达构建列线图模型,将患者分为高风险和低风险亚组,结果发现高风险组与癌基因突变相关,更容易发生免疫逃逸,预后较差。Zhu 等[29]建立了铜死亡基因相关的风险模型,包含 6 种预后生物标志物:PTPRN2、SCARB1、SLC37A2、YES1、 LY6D、NOTCH3,该研究揭示了铜死亡在 TNBC 免 疫微环境中的重要作用,可能有助于指导个性化免疫治疗。
Li 等[1]分析公共数据库后发现,铜死亡评分高的乳腺癌患者生存状态差,对免疫检查点抑制剂治 疗敏感。Li 等[33]基于 TCGA 数据库收集了乳腺癌患者的资料,使用共聚类方法确定了两种预后不同的簇,开发了铜死亡相关的预后特征和列线图,指示了肿瘤微环境对免疫治疗的反应。
Cheng 等[25]全面分析了 CDKN2A 在乳腺癌中的生物学作用和预后价值,发现 CDKN2A 在乳腺癌中过表达,其上调与 DNA 的超甲基化显著相关,此外基因与表观遗传改变都参与了乳腺癌的发展,提示调节 CDKN2A 相关基因的通路或设计新型金属抗癌药物诱导铜死亡可能会指导我们为乳腺癌开发新的抗癌治疗策略。该研究[25]进一步分析发现 CDKN2A 的过表达与免疫细胞的增加、趋化因子升高相关,CDKN2A 高表达的 TNBC 患者获益于免疫治疗,并且 CDKN2A 可能是预测 TNBC 抗表皮生长因子治疗效果的有前景的预测性生物标志物。Guo 等[34]的研究建立由 9 个与铜死亡相关的 LncRNAs 构建的风险模型,建立了 LncRNAs-mRNA 共表达网络,发现 ARHGAP28-AS1、LINC01711、LRRC8C-DT、PCAT18 和 SIAH2-AS1 是乳腺癌患者的保护因素,而 TDRKH-AS1、SAMMSON、WDFY3-AS2和 LINC00393 是危险因素;风险评分较低的乳腺癌患者 CD8+ T 细胞浸润率更高,能获益于免疫治疗。Huang 等[23]的研究综合分析了 CRG 在乳腺癌中的表达谱和分期特征,发现 CDKN2A、PDHA1 和 LIPT1 的表达与乳腺癌的病理分级相关,其中上调的 PDHA1 与乳腺癌中较低的总生存期和无复发生存期相关,与乳腺癌中的 CD4+记忆 T 细胞、巨噬细胞和肥大细胞数量密切相关,为进一步研究 PDHA1 作为乳腺癌的潜在靶点提供了思路。
Song 等[35]全面分析了 CRGs 在肿瘤微环境和免疫治疗中的作用,构建与铜死亡相关的基因特征 (PGK1、SLC52A2、SEC14L2、RAD23B、SLC16A6、CCL5 和 MAL2)和评分系统,以预测乳腺癌的总生存期和对免疫治疗的反应,发现 RAD23B 上调的患者对靶向程序性死亡受体 1(programmed death receptor 1,PD-1)/细胞程序性死亡-配体 1(programmed death receptor 1,PD-L1)轴的免疫检查点阻断疗法更敏感,为乳腺癌患者的个性化免疫治疗提供了参考。
参与内分泌耐药性
雌激素受体(estrogen receptor,ER)阳性乳腺癌约占临床乳腺癌患者的 80%[36],对 ER 阳性乳腺 癌患者 ET 至关重要。他莫昔芬(tamoxifen,TAM)是主要的 ET 药物,但仍有患者因 TAM 耐药导致疾病复发和转移[37]。发现 ET 新的耐药机制和确定新的治疗靶点一直是近年来乳腺癌研究的重点。 很少有研究关注铜稳态和 ET 的反应,因此阐明铜死亡在 ET 耐药中的潜在作用机制可能会为乳腺癌提供新的治疗途径。Zhang 等[38]调查了 ER 阳性乳腺癌中铜死亡和 ET 耐药的潜在关联,构建了由 DLD、DBT、DLAT 和 ATP7A 组成的 CRG 风险评分,其中 DLD 对铜死亡至关重要。DLD 不仅与 ER 阳性乳腺癌患者的预后显著相关,而且对 TAM 和氟维司群双重耐药的 LCC9 细胞系和对 ET 敏感的 MCF-7 细胞系的 miRNA 表达也存在显著差异,因此推测 DLD 高水平的表达可能导致铜稳态的失衡。该研究进一步分析了治疗靶点,建立了由 C6orf99/ hsa-miR-370-3p 和 hsa-miR-432-5p/DLD 组成的 ceRNA 网络,并确定了一个铜代谢 ET 耐药轴,这为深入研究乳腺癌内分泌耐药的预防和逆转提供了潜在的靶点[38]。
协同化疗药物的耐药性
铜稳态相关基因和化疗耐药性相关。癌症中铜死亡基因的表达与癌细胞对多种化学物质的敏感性有关,具体耐药机制因药物而异。因此,需要进一步探索铜代谢相关细胞死亡在不同耐药性中的机制。Li 等[21]发现 SLC31A1 拷贝数变异、G2E3-AS1/let-7a-5p 轴、CDKN2B-AS1/let-7b-5p通路可能是导致 SLC31A1 在乳腺癌中过表达的另一种机制,SLC31A1 在化疗无反应组中明显上调,可以预测化疗药物的敏感性。此外,Li 等[39]使用癌症免疫图谱和 TCGA 数据库发现 SLC31A1 与紫杉醇药物不良反应相关,可能是克服乳腺癌耐药的新型治疗靶点。
铜衍生物在乳腺癌治疗中的应用
铜死亡机制的发现为未来药物的研究提供了方向,铜离子载体和铜螯合剂已被用于抗癌治疗[40-42]。Cu 离子载体的作用方式多种多样,包括 DNA 相互作用、蛋白酶体抑制和 ROS 生成[43]。口服铜螯合剂四硫钼酸盐(tetrathiomolybdate,TM)经铜耗竭机制、通过抑制复合体Ⅳ的失活和减少线粒体氧化三 磷酸腺苷的生成来阻止 TNBC 的转移[44]。铜还通过促进肿瘤细胞增殖和血管生成而促进癌症的发展。因此,铜鳌合剂已在临床试验中应用于抑制肿瘤转移[45]。将铜离子与铜离子载体结合的纳米药物目前正在广泛研究中,它可以通过铜诱导细胞死亡实现靶向肿瘤的精准治疗[46, 47]。铜离子载体可能对线粒体代谢水平较高的肿瘤更有效,其他药物联合铜离子载体诱导肿瘤高线粒体呼吸状态也是一个潜在的治疗方向[18]。Cui 等 [48]开发了一种安全的、 靶向线粒体的铜消耗纳米颗粒(copper depletion nanoparticles,CDN),并在 TNBC 中进行了测试, 结果发现 CDN 可减少耗氧量和氧化磷酸化,导致代谢转换为糖酵解,并减少 TNBC 细胞中 ATP 的 产生。CDN 的毒性低于现有的铜螯合剂,有利于剥夺癌细胞线粒体中的铜,而不是全身耗竭,在乳腺癌小鼠模型中,CDN 给药可抑制肿瘤生长并显著提高存活率[48]。CDN 的有效性和安全性表明这种方法具有潜在的临床相关性。
铜死亡途径为肿瘤治疗带来新的机遇,而在肿瘤中高效、靶向诱导铜死亡仍然面临挑战。双硫仑(disulfiram,DSF)已被证明能够诱导铜死亡[7]。 DSF 与铜离子结合时,增加细胞内铜离子浓度,导 致 Wnt 通路中两个重要分子 β-catenin 和 C-myc 的表达水平降低,从而抑制肿瘤生长。DSF 在多种癌症中具有抗肿瘤活性[49]。临床研究[50, 51]表明,DSF 联合 Cu 可特异性靶向醛脱氢酶(aldehyde dehydrogenase, ALDH ) , 降低肿瘤复发风险 。 L i u 等[ 52 ] 将 DSF/Cu2+负载的 MXene 纳米片涂覆在 PD-1 过度表达的 T 细胞膜上,生成 CuX-P 系统,该系统能识别表达 PD-L1 的肿瘤细胞并黏附,从而促进肿瘤细胞对 CuX-P 和 PD-L1 的内吞。DSF/Cu2+内化并在细胞质中释放后,PD-L1 的表达就会上调。由于肿瘤微环境中存在 CuX-P,肿瘤表面补充的 PD-L1 又会再次与 CuX-P 结合进行内化。这种反馈循环不断阻断和消耗肿瘤表面的 PD-L1,促进肿瘤中 CuX-P 的富集,诱导铜死亡。在 TNBC 小鼠模型中,给予激光照射 CuX-P 治疗后,激发了强烈的抗肿瘤免疫反应[52]。因此,该研究开发了一种肿瘤靶向生物仿生系统,可同时对小鼠进行杀伤铜死亡、光热疗法和免疫疗法[52]。
铜死亡联合治疗
盐酸小檗碱在多种类型的癌细胞中具备化疗疗效,与铜死亡的结合可能会提高抗癌潜力[53, 54]。
P53 可以抑制糖酵解途径和促进线粒体呼吸,导致细胞从糖酵解到氧化磷酸化的转变,提供更多的能量,协调铁硫簇、铜螯合剂谷胱甘肽(glutathione, GSH)合成的水平,进一步通过提高代谢水平来增加对铜死亡的敏感性,与此同时 GSH 的氧化还原作用促进了细胞内铜的释放[55]。
Shen 等[56]发现 PTEN 敲除后 SL31A1 的表达上调,而 TFAM 敲除后 ATP7A 水平升高,ATF2 敲低后 LIPT1 被抑制;这表明铜死亡和铁死亡之间存在较强的相关性,因此推测在癌症中,铜死亡和铁死亡调节因子之间存在着相互作用和生物学调控。
小结与展望
乳腺癌是一种常见的恶性肿瘤,发病率在女性中居高不下。尽管目前已经了解到很多与乳腺癌发生有关的因素,它仍然是一种具有挑战性的疾病。随着医学技术和研究的不断进展,我们对于乳腺癌的认识和治疗手段也在不断地提高和完善,对患者生存质量的愈加重视并提供个体化干预措施[57]。随着铜死亡概念的引入,以及铜通过靶向蛋白脂酰化修饰来影响细胞命运的机制的不断阐明,为开发新的抗肿瘤药物提供了新思路。铜可能成为具有潜力的抑制癌症发生的靶点,且既往研究为探索铜死亡和肿瘤的关系提供了充分的依据。铜金属结合化合物在治疗癌症方面具有巨大潜力,能够选择性靶向癌细胞的新型铜结合化合物备受关注。铜离子载体和铜螯合剂都被认为是抗癌剂,在多种肿瘤中已进行临床前及临床研究。铜死亡在乳腺癌治疗中的作用也有所突破。尽管铜离子载体目前尚未在临床中广泛应用,但铜螯合剂 TM、AmphinexTM (ATN-224)在乳腺癌领域已经进入Ⅱ期临床试验。
大部分理论研究表明铜离子载体利用氧化应激引起癌细胞的易感性,因此靶向铜死亡可以治疗乳腺癌,下一代选择性铜离子载体应该利用仅能被特定受体识别的靶向单元。然而这些受体仅存在于特定类型的癌细胞中,应该预先评估可能受益的患者群体,比如筛选对于具有较高线粒体代谢、肿瘤干细胞特性及某些药物耐药的癌症患者,拓展乳腺癌精准治疗。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


