非小细胞肺癌(NSCLC)是精准治疗的典范代表,其中,针对ALK融合突变的靶向治疗为患者带来显著获益,使其被称为“钻石靶点”。然而并非所有的ALK突变形式都有望从ALK-TKI的治疗中取得令人满意的反应,且ALK突变也并非单独发生,还可能与其他基因产生共突变,不同的ALK变体与共突变的发生都可能为临床诊疗带来难题。本期【显微镜下看ALK】特邀中国医学科学院肿瘤医院王燕教授,与我们共同回顾探讨ALK变体及共突变的应对策略。
点击观看王燕教授完整采访视频
不同ALK重排变体可能影响疗效,V3变体患者预后更差
王燕教授:ALK融合被视为NSCLC中的“钻石”靶点,因为ALK阳性患者接受ALK-TKI的治疗可以取得非常好的疗效。但也有一部分患者可能无法得到理想的疗效,这可能与ALK融合的不同变体有关。
ALK的常见重排形式为与EML4的融合突变,EML4-ALK融合突变在NSCLC的ALK重排中占到85%[1],与不同的融合伴侣结合目前并未观察到对靶向药物疗效的影响。但是,EML4-ALK存在约20种突变亚型,不同的突变亚型对于不同ALK-TKI的敏感性存在差异,其中V3变体就是预后较差的一类亚型,与转移扩散加速、早期治疗失败和更短的总生存期(OS)有关。
2018年一项由Petros Christopoulos等人发表于International Journal of Cancer的回顾性分析尝试寻找该中心不同变体患者接受ALK-TKI治疗的疗效差异[2]。该研究指出,V3变体是EML4-ALK最常见的变体(51%),且V3变体患者较V1、V2变体患者在确诊时可能有更多的转移灶(1.9 vs. 1.6 vs. 3.3,P=0.005),V3变体对比非V3变体,在接受第一代/第二代ALK-TKI时更容易早期治疗失败(中位无进展生存期mPFS:7.3个月 vs. 39.3个月,P=0.01),总OS也更短(39.8个月 vs. 59.6个月,P=0.017)。
这些数据提示我们,不同的ALK重排变体对于患者的预后,以及肿瘤对于靶向治疗的反应,都会产生不同的影响。
共突变可能影响TKI疗效,临床实践需重视基因检测
王燕教授:除了ALK融合基因的不同变体之外,共突变也同样会影响到靶向治疗的疗效。在包括ALK在内的各类驱动基因中,TP53都是常见的共突变基因。TP53的共突变可能导致细胞本身的肿瘤原性增加,提高肿瘤的转移、侵袭或对治疗的耐受能力。在ALK阳性患者中,如果伴随TP53共突变,可能会导致患者接受ALK-TKI的疗效差异,在一代、二代或三代ALK-TKI的治疗中,都可以观察到这种差异。
2018年发表于Cancer Medicine的一项研究对64例接受一代ALK TKI治疗的ALK重排患者进行了NGS检测[3],结果发现TP53共突变发生率可达到23.4%,而合并TP53共突变的患者对比TP53野生型患者,客观缓解率更低(ORR:40.0% vs. 73.3%;P=0.003),中位PFS更短(HR 1.96;95%CI 1.02~3.80;P=0.045)。
2022年ESMO大会中公布的一项针对CRWON研究的耐药机制ctDNA分析中指出[4],对于存在TP53突变的V3变体患者,接受三代TKI一线治疗的中位PFS仅为14.8个月,远低于总体人群的PFS。
这些结果都提示我们,在临床实践中选择一线ALK-TKI时,一定要注意患者的共突变情况。
2023年共突变相关研究回顾,多角度个体化寻找“破局之法”
王燕教授:近年来,很多研究开始关注到共突变对于驱动基因阳性患者的影响,以TP53为代表,共突变开始受到更多关注。在2023年的各大学术会议中,包括ALK在内,研究者探索了多种驱动基因中TP53共突变对于治疗疗效的影响。
2023年的ASCO大会中报告了一项真实世界研究[5],研究者评估了EML4-ALK融合变异体和TP53突变状态对患者使用二代/三代ALK-TKI进行一线治疗的ALK+NSCLC患者停药时间(TTD)的影响,总计纳入了164例使用二代/三代ALK-TKI且在治疗前接受了ctDNA检测的患者。结果在所有预设亚组中,V3变体+TP53共突变患者的中位TTD最短,仅为8.7个月,V1变体+TP53野生型患者的中位TTD则达到19.5个月。此外,TP53突变型患者较TP53野生型患者的中位TTD也要更短(17.1个月 vs. 21.9个月)。我们可以看到,真实世界中共突变同样是导致患者预后更差、治疗时间更短的风险因素。
在其他通路中,2023年ELCC大会中报告了一项随机II期临床研究ETOP-BOOSTER的血浆样本ct-DNA分析[6],研究者发现63%的患者基线外周血可检测到TP53突变,研究者指出基线携带TP53突变是患者较差OS的独立预后因素。
由于TP53的发生率最高,因此研究者也在尝试克服TP53共突变对疗效的负面影响。2023年WCLC中报告了一项探索TP53突变患者的治疗方案的研究[7]。研究者针对TP53突变根据肿瘤 Surfaceome mRNA 非负矩阵分解(NMF)将NSCLC分为6个类型,并发现其中 C5 亚型的 TP53 突变 NSCLC 患者的肿瘤组织中存在活化的免疫微环境,这可能提示该部分患者是免疫治疗的潜在获益人群。研究者还结合临床研究指出,TP53 合并 PTPRD 突变对免疫治疗敏感。与其他亚型相比,TP53 合并 PTPRD 突变亚组具有免疫应答相关通路富集、肿瘤突变负荷和拷贝数变异负荷比值较高的特征。这为后续的治疗方案探索提供了思路,例如对于合并TP53突变的驱动基因阳性患者,是否可尝试在进一步明确亚型后,采取免疫联合靶向治疗的思路。
有趣的是,在针对KRAS G12c靶点的CodeBreak 200研究中 [8],2023年ASCO大会报告了生物标志物分析结果,分析显示,最常见的KRAS G12C共突变为TP53(57.1%)、STK11(37.5%)和KEAP1(25.9%),但值得关注的是,在多个预设亚组(包括STK11、KEAP1、TP53突变)中,sotorasib都显示出较多西他赛更好的临床获益,但在KRAS G12C共突变与疗效的相关性分析中,KRAS G12C和NOTCH1共突变患者接受多西他赛治疗的获益更多,有更长的中位PFS(7.5个月 vs. 2.8个月)。这项研究显示,不同的共突变似乎并不一定导致靶向治疗的疗效变差,也可能使得肿瘤对于靶向治疗有较化疗更好的反应,这也更加体现出在对共突变的研究中,需要更深入了解它对信号通路以及肿瘤微环境的影响,根据具体情况来选择对应的措施。
临床实践可考虑对变体、共突变疗效更好的ALK-TKI,未来联合方案也可尝试进行探索
王燕教授:无论在真实世界研究还是前瞻性研究中,我们都看到了V3变体或TP53共突变是ALK-TKI疗效不佳的负性因素,而如何克服这一问题,目前尚无标准答案,但可以从两个方面进行探索。
首先,可以通过回顾性分析或真实世界研究找寻对于V3变体或TP53共突变疗效更好的药物,在当下的临床实践中对于这类患者优先使用这一类TKI。例如在布格替尼的一线治疗临床研究ALTA-1L中[9],对比克唑替尼,布格替尼治疗治疗V3变体患者,ORR可以达到83%(vs. 67%),中位PFS达到16.0个月(vs. 7.4个月),可以降低68%的疾病进展或死亡风险。针对TP53共突变患者,布格替尼对比克唑替尼,ORR可以达到77%(vs. 61%),中位PFS达到18.0个月(vs. 7.4个月),可以降低52%的疾病进展或死亡风险。三代ALK-TKI洛拉替尼在CROWN研究中,针对V3变体也显示出对比克唑替尼的疗效优势。
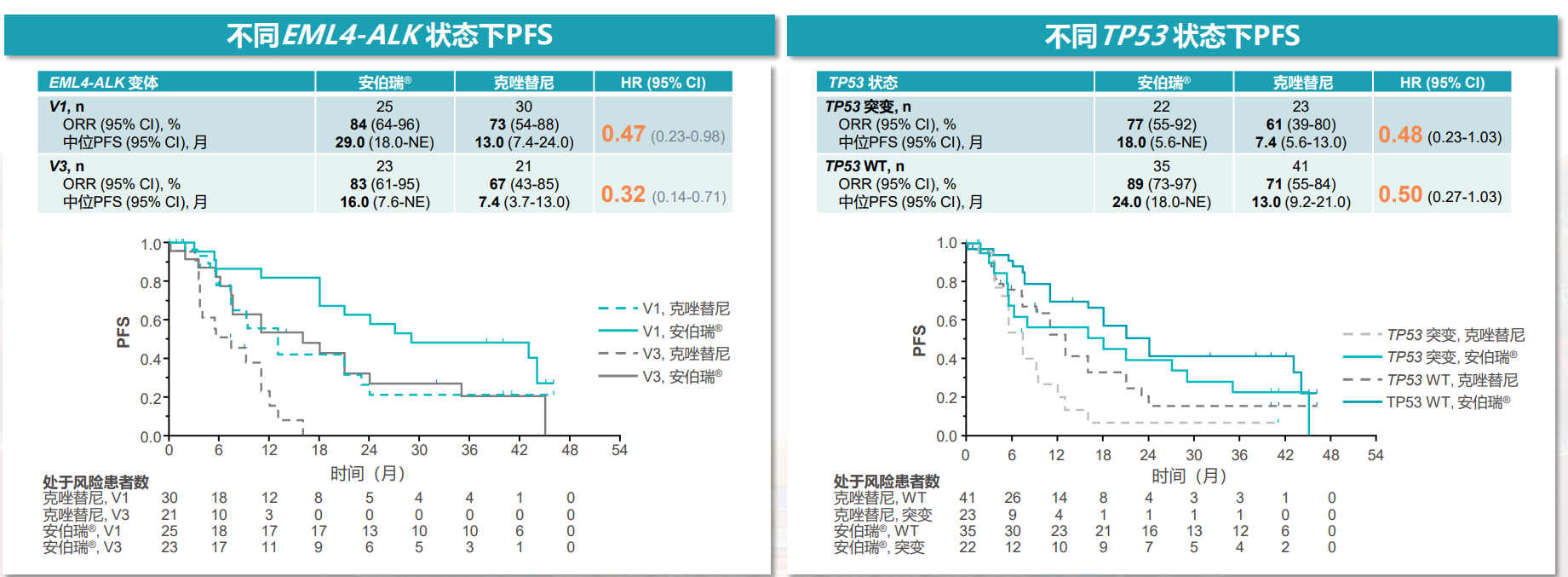
当然,未来在ALK阳性的患者中,我们还需要进一步开展前瞻性研究,针对V3变体或TP53突变患者进行随机对照研究,以便更精细地选择人群进行精准治疗。
另一方面,也可以考虑联合治疗策略,一些研究已经在探索ALK-TKI联合抗血管生成药物或化疗的方案,尝试克服V3变体或TP53等导致疗效不佳的因素。总之,我们期待更好的治疗模式为这部分患者带来更好的疗效,更长的生存。
仅供医疗卫生专业人士使用
审批编号:C-APROM/CN/ALUN/0453
审批时间 :2024.1
![]()
[1] Zhang S S, Nagasaka M, Zhu V W, et al. Going beneath the tip of the iceberg. Identifying and understanding EML4-ALK variants and TP53 mutations to optimize treatment of ALK fusion positive (ALK+) NSCLC[J]. Lung Cancer, 2021, 158: 126-136.
[2] Christopoulos P, et al. EML4-ALK fusion variant V3 is a high-risk feature conferring accelerated metastatic spread, early treatment failure and worse overall survival in ALK+ non-small cell lung cancer. Int J Cancer. 2018 Jun 15;142(12):2589-2598.
[3] Song P, Zhang F, Li Y, et al. Concomitant TP53 mutations with response to crizotinib treatment in patients with ALK‐rearranged non‐small‐cell lung cancer[J]. Cancer Medicine, 2019, 8(4): 1551-1557.
[4] Felip E, Martini J F, Mazieres J, et al. 1008P Resistance mechanisms to lorlatinib or crizotinib in treatment-naive patients (pts) with ALK+ advanced non-small cell lung cancer (NSCLC)[J]. Annals of Oncology, 2022, 33: S1014.
[5] Parikh K, Dimou A, Leventakos K, et al. Impact of EML4-ALK fusion variant and co-occurring TP53 mutation on treatment duration of first-line next-generation ALK TKIs in ALK fusion+ NSCLC[J]. 2023.
[6] Soo R A, Dafni U, Han J Y, et al. 16MO Clinical impact of plasma EGFR analysis: Results from the ETOP-BOOSTER randomized phase II trial[J]. Journal of Thoracic Oncology, 2023, 18(4): S49-S50.
[7] Cai X, Ma S, Han D, et al. OA18. 03 Surfaceome of TP53-Mutant NSCLC Reveals a Distinct Subtype with Immunotherapy Vulnerability, Characterized by Co-occurring PTPRD Mutant[J]. Journal of Thoracic Oncology, 2023, 18(11): S85-S86.
[8] Skoulidis F, De Langen A, Paz-Ares L G, et al. Biomarker subgroup analyses of CodeBreaK 200, a phase 3 trial of sotorasib versus (vs) docetaxel in patients (pts) with pretreated KRAS G12C-mutated advanced non-small cell lung cancer (NSCLC)[J]. 2023.
[9] Camidge D R, Kim H R, Ahn M J, et al. Brigatinib versus crizotinib in ALK inhibitor–naive advanced ALK-positive NSCLC: final results of phase 3 ALTA-1L trial[J]. Journal of Thoracic Oncology, 2021, 16(12): 2091-2108.
排版编辑:肿瘤资讯-Tracy











 苏公网安备32059002004080号
苏公网安备32059002004080号


