乳腺癌是中国目前发病率最高的肿瘤,2020年GLOBOCAN数据显示,中国乳腺癌年龄标准化发病率高达39.10/10万人[1]。其中,约70%乳腺癌患者呈激素受体阳性(HR+)[2],内分泌治疗则是HR+乳腺癌患者最主要治疗方案之一[3]。CSCO指南推荐HR+乳腺癌患者初始辅助内分泌治疗至少为5年[4],复发风险是乳腺癌内分泌治疗中备受关注的热点问题。
对于早期乳腺癌患者,治疗开始后的前5年是复发高峰期[5]。5年内分泌辅助治疗能够降低复发风险,而雌激素受体阳性(ER+)乳腺癌患者完成5年内分泌辅助治疗后复发风险会持续[6]。其中早期复发的高风险因素包括淋巴结阳性和肿瘤直径>2 cm[5,7]。研究显示:N0患者远期复发比例超过20%,N1-3患者远期复发比例超过30%,N4以上患者远期复发的比例超过50%[8]。
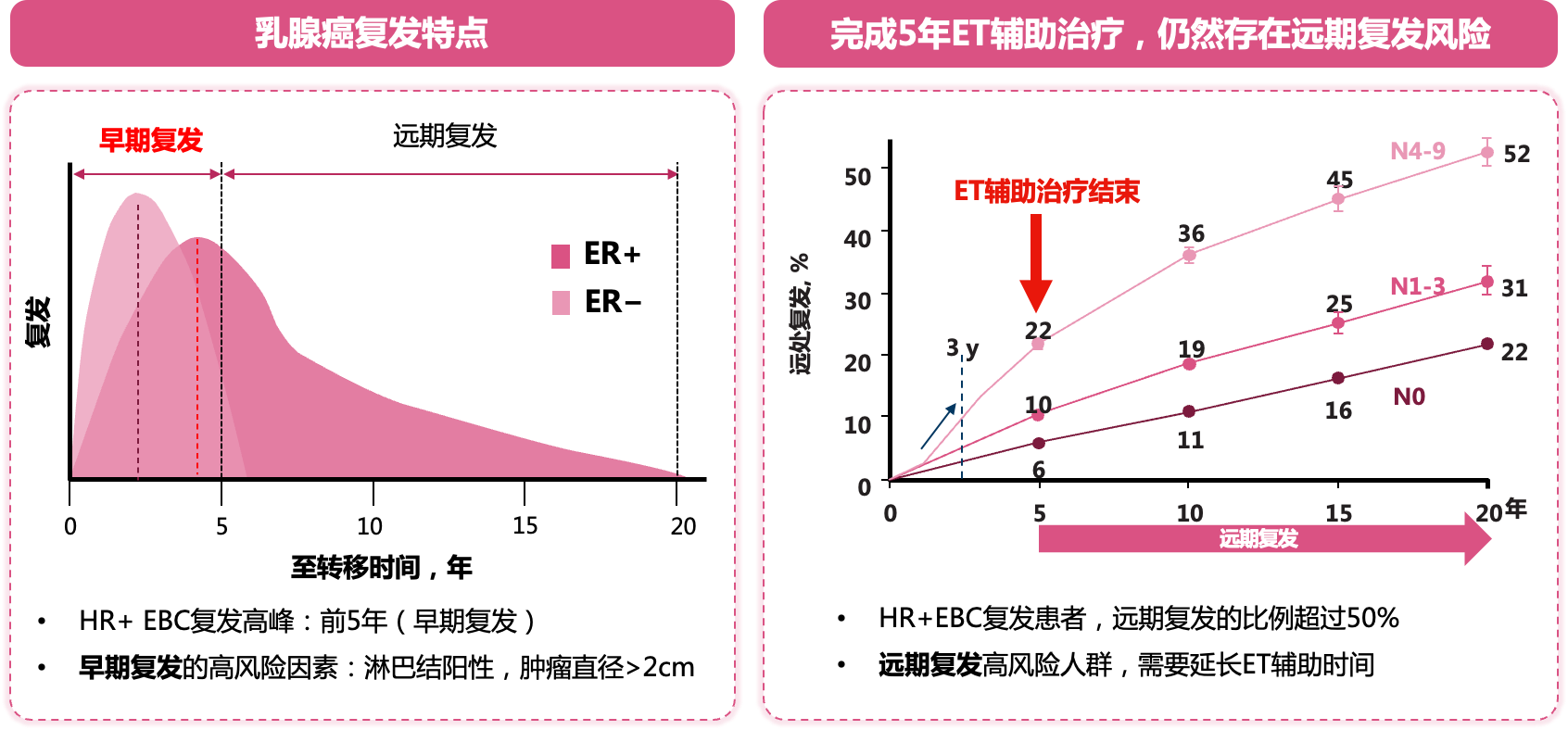
图1 乳腺癌复发特点及风险因素
对于远期复发的高风险人群,如何科学合理地选择治疗周期以及内分泌治疗方案?对此,2023年初的St. Gallen到年尾的SABCS大会中一系列研究的更新做出了解答。
浙江省肿瘤医院院乳腺内科主任医师、教授
浙江省免疫学会副理事长
浙江省肿瘤智能诊断和分子技术研究中心副主任
浙江省肿瘤诊治质控中心副主任兼乳腺癌质控专家委员会主任委员
中国临床肿瘤学会(CSCO)乳腺癌专家委员会副主任委员
中国抗癌协会乳腺癌专业委员会常委、医学伦理委员会常委
中华医学会心血管病分会肿瘤心脏病学组委员
浙江省医学会肿瘤内科分会主任委员
浙江省抗癌协会乳腺癌专业委员会主任委员、肿瘤内科专委会前任主委、肿瘤心脏病学专委会(筹)牵头人
浙江省转化医学学会副会长兼精准医学分会会长
一、乳腺癌内分泌治疗策略热点
1. 内分泌治疗周期的选择:
NSABP-B14等多项研究已证实,延长内分泌治疗可降低HR+乳腺癌患者复发风险,或带来生存获益。[10]
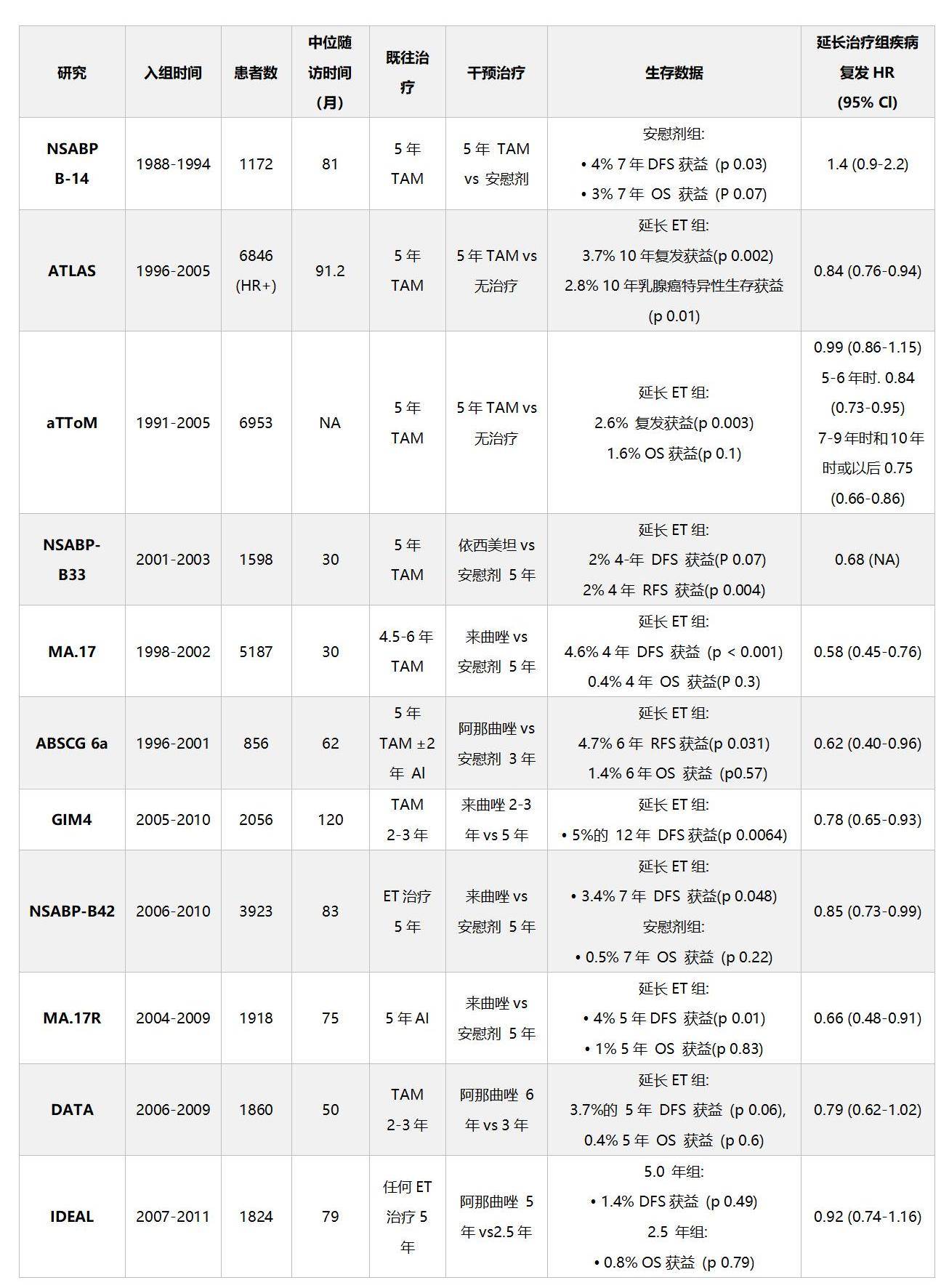
ET:内分泌治疗,TAM:他莫昔芬,DFS:无病生存期,RFS:无复发生存期,OS:总生存期
图2 延长内分泌治疗研究获益情况[10]
2023 St. Gallen专家投票中,对于II期ER+、HER2-乳腺癌患者中呈淋巴结阳性的“高复发风险”人群,仅有8%的专家仍赞成“5年”的内分泌治疗疗程;大部分专家倾向于延长内分泌治疗周期,赞成“7-8年”、“10年”的专家分别达68%和24%。而对于III期ER+、HER2-乳腺癌患者,赞成“5年”内分泌治疗疗程的专家比例更低,仅占3.92%,赞成“7-8年”、“10年”的专家分别达25.49%和68.63%[9] ,约94%的专家认为应延长内分泌治疗周期。
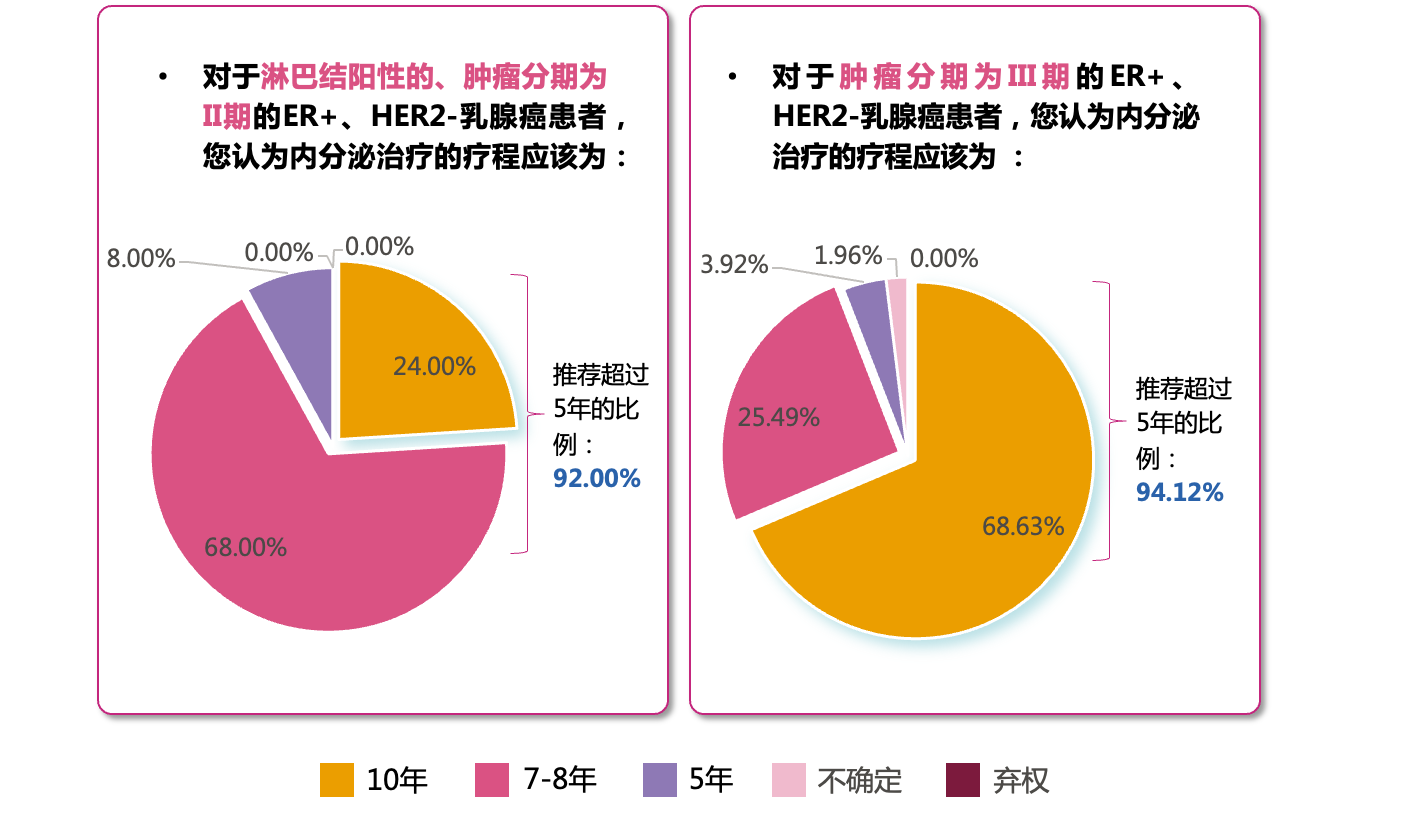
图3 内分泌治疗周期投票结果
2. 探索内分泌治疗药物最佳搭档:
2.1 细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i)
在HR+早期乳腺癌内分泌治疗中,CDK4/6i强化辅助治疗可降低患者复发风险。MonarchE研究证实,在内分泌治疗基础上联合阿贝西利可显著改善早期乳腺癌患者的无浸润性疾病生存期(iDFS)和无远处复发生存期(DRFS):3年iDFS 绝对获益5.4%(HR=0.70,P<0.0001);3年DRFI绝对获益4.2%(HR=0.69,P<0.0001)[11-13]。NATALEE研究将强化辅助治疗探索人群扩大至淋巴结阴性(LN-),最新数据显示:与内分泌治疗相比,瑞波西利联合内分泌治疗显著改善了患者的3年iDFS(90.7% vs 87.6%,HR=0.749,P=0.0006)和3年无远处疾病生存期(DDFS)(92.9% vs 90.2%,HR=0.749,P=0.0010)[14-17]。
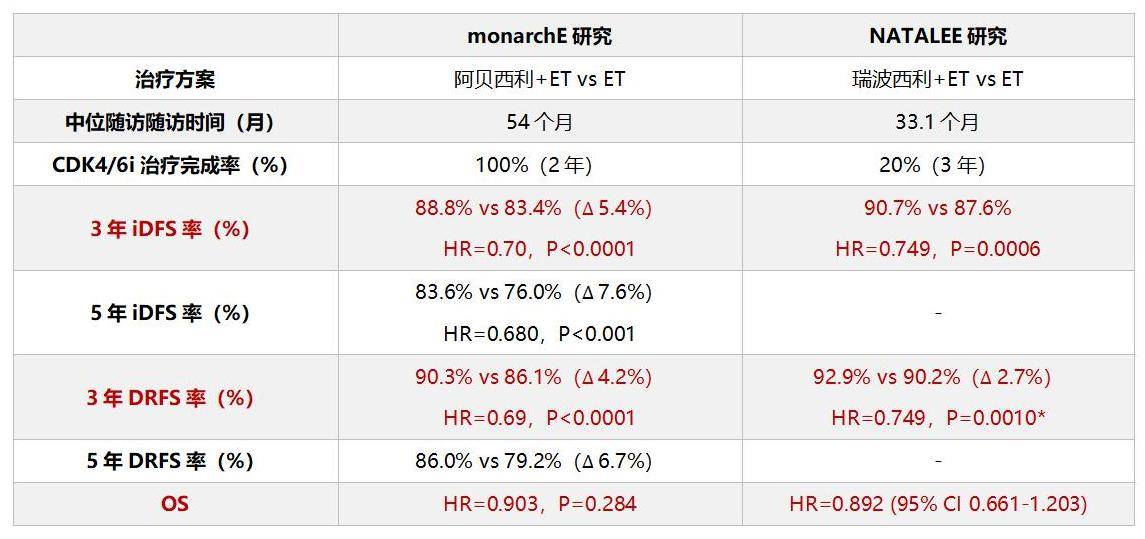
*3年DDFS率
图4 CDK4/6i强化辅助治疗monarchE研究与NATALEE研究的最新疗效数据比较
2.2 绝经前患者,OFS联合治疗的最佳拍档
EBCTCG研究对四项临床随机试验(ABCSG XII、SOFT、TEXT和HOBOE试验)的7030例患者进行分析,旨在研究接受卵巢抑制治疗的绝经前妇女能否从AI中获益。研究发现,对于ER+乳腺癌绝经前患者,相较于OFS+TAM,OFS+AI可使患者10年复发风险降低2.8%(95%CI 0.6-5.0,p=0.0005)[18]。该研究证实:较OFS联合TAM方案,OFS联合AI治疗在降低患者复发风险上带来显著获益。SOFT & TEXT联合分析比较了4690例HR+早期乳腺癌绝经前患者接受5年OFS+TAM或OFS+AI内分泌治疗方案的生存结果。中位随访13年后,与OFS+TAM相比,OFS+AI显著改善了无病生存期(DFS)和远期无复发间隔(DRFI):12年DFS 绝对获益4.6%(HR=0.79,95%CI 0.70-0.90,p<0.001);DRFI绝对获益1.8%(HR=0.83,95%CI 0.70-0.98,P=0.03)。其中HER2-患者(占总人群86%)接受OFS+AI较OFS+TAM方案12年总生存期(OS)绝对获益2.0%(HR=0.85,95%CI 0.70-1.04)[19]。
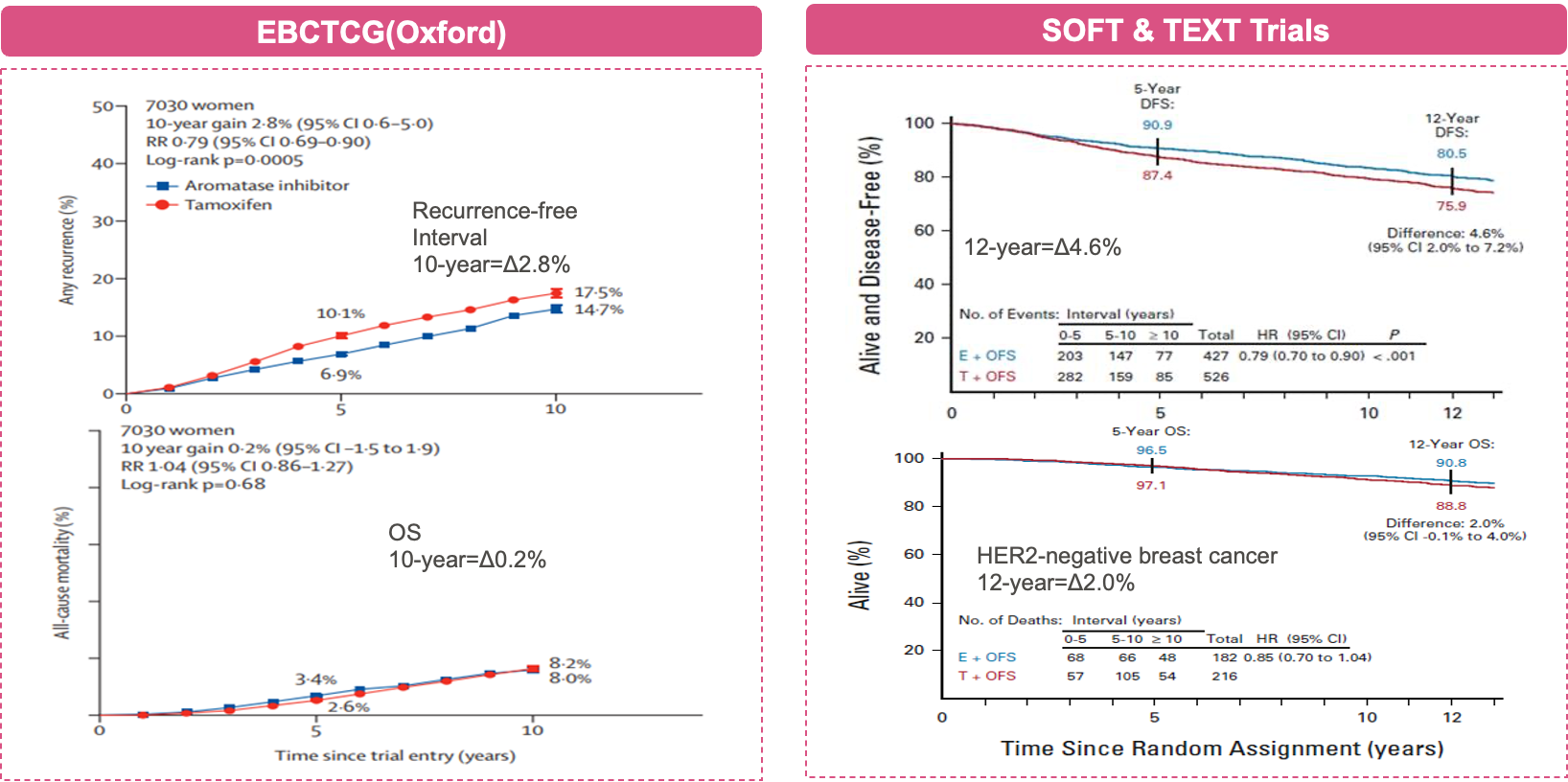
图5 两项研究证实OFS+AI治疗方案降低患者复发风险[18,19]
针对HR+,HER2-乳腺癌绝经前患者的治疗方案,约四至五成St. Gallen专家组成员推荐临床高危、基因中低危患者应用卵巢去势(OFS),其中OFS+芳香化酶抑制剂(AI)方案推荐比例均高于OFS+他莫昔芬(TAM)[9]。
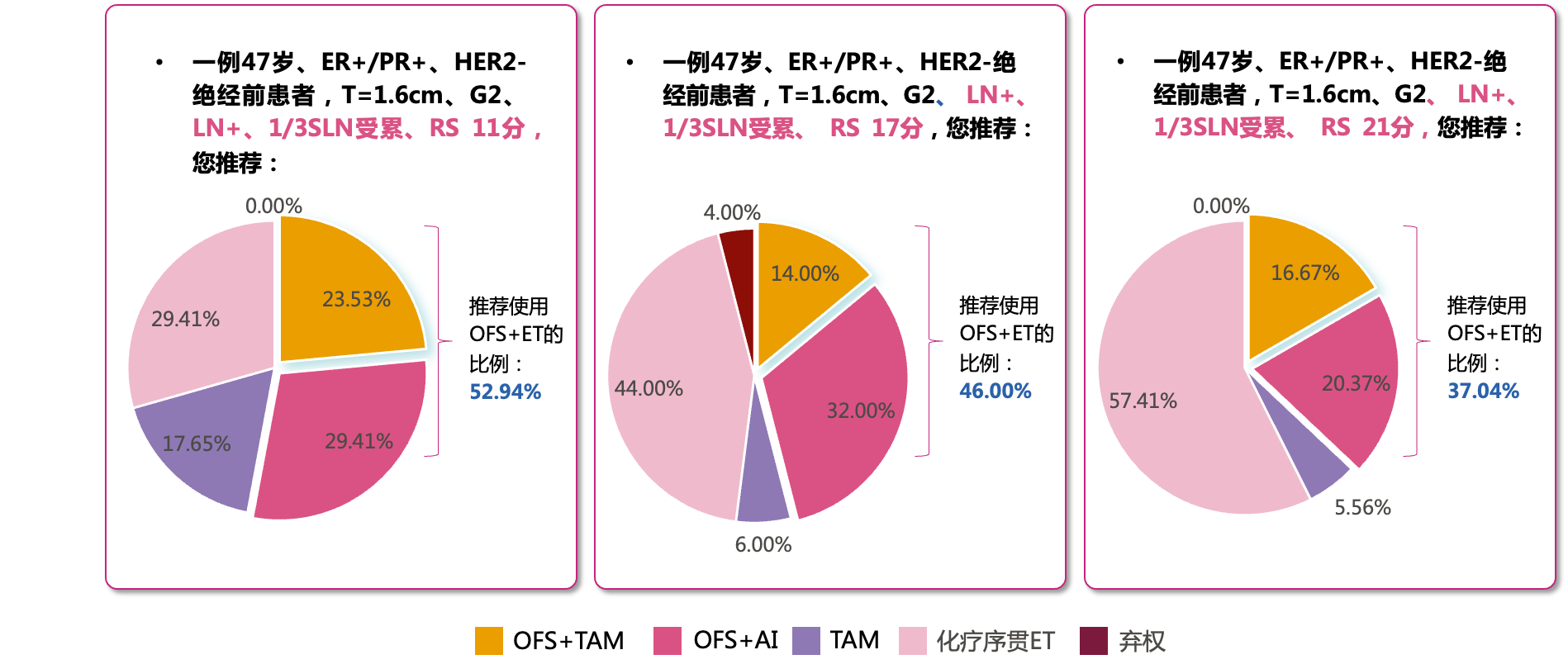
图6 内分泌治疗方案投票结果
2022 ESMO大会公布的一项研究探索了不同方案内分泌应答率的差异:ADAPT伞式研究及其衍生的ADAPT cycle研究入组HR+早期乳腺癌患者,借助复发(RS)评分和内分泌治疗应答(诱导内分泌治疗3±1周后,Ki-67≤10%)对HR+/HER2-早期乳腺癌患者进行分层,从而决策是否豁免化疗。
研究发现:与单药治疗相比, AI或TAM联合OFS治疗可提高≤50岁人群内分泌治疗应答率(如图7):ADAPT研究显示在≤50岁的人群中, OFS+AI比TAM单药治疗内分泌应答率高(60% vs 40.1%),ADAPT cycle研究同样显示≤50岁人群中OFS+TAM治疗的内分泌应答率高于 TAM单药(57.3% vs 32.0%),绝经前人群OFS+AI和绝经后人群接受AI单药内分泌应答率相当(76.9% vs 77.9%)[20] 。
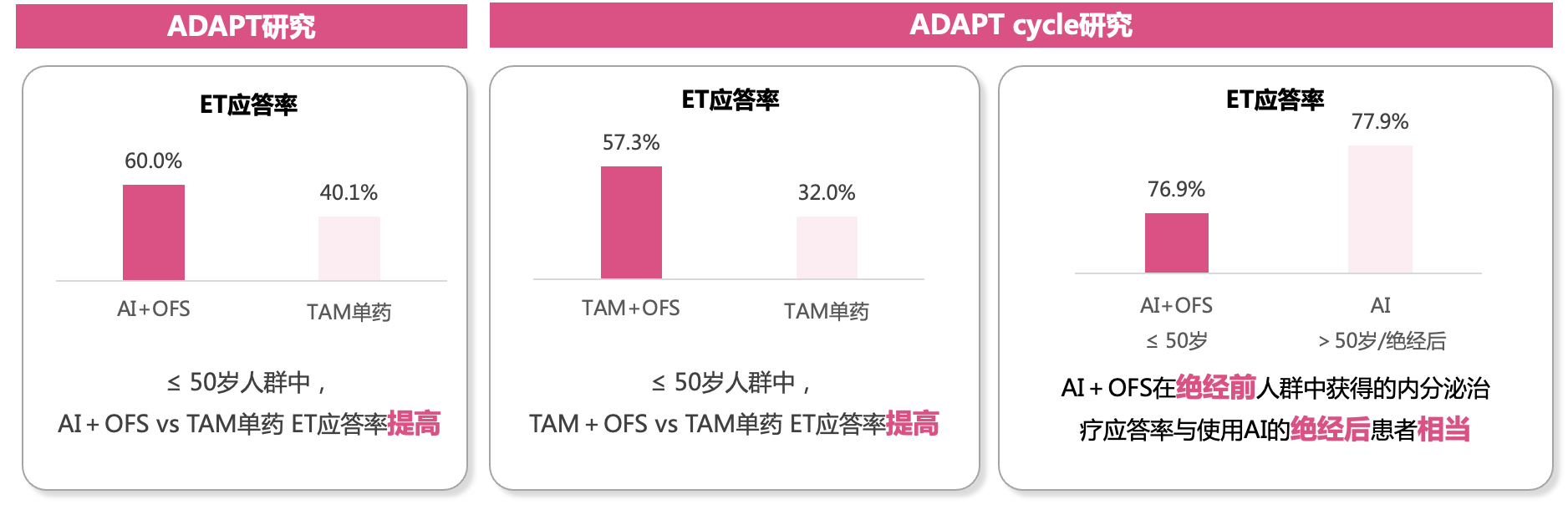
图7 AI/TAM联合OFS提高患者内分泌治疗(ET)应答率[20]
2023 SABCS大会公布了3期ADAPT cycle研究最新结果:研究发现,无论RS评分,AI+OFS均可使绝经前患者获得最佳内分泌治疗应答。对于年龄≤50岁或绝经前患者,不论RS评分是否高于25,AI+OFS均可使绝经前患者获得最佳内分泌治疗应答。对于年龄>50岁或绝经后患者,AI治疗能获得更高的内分泌治疗应答率,且RS评分0-25人群AI治疗获益更多;RS评分26-100人群中,AI治疗同样能获得较高的内分泌治疗应答率(55.6%)。在极年轻亚组(年龄≤40岁),AI+OFS 内分泌治疗应答率进一步提高。与年龄≤50岁的亚组相比,极年轻者,其RS评分为0-25时,AI+OFS组的内分泌治疗应答率高达93.5%[21] 。
二、关注患者净获益,推进HR+乳腺癌全程管理,提高患者生存质量
随着乳腺癌治疗技术的进步,患者生存率逐渐提高,承受治疗带来的不良影响是乳腺癌幸存者面临的新问题[22]。“净获益”即平衡治疗获益与治疗不良影响,是贯穿乳腺癌治疗方法面面的重要理念。早期乳腺癌治疗中,手术治疗的净获益理念目前集中在提高保乳率,其具体体现为腋窝手术呈“降阶梯”模式[23],在最大化疗效的同时均衡患者生活质量。内分泌辅助治疗的净获益理念则集中在对长期治疗不良反应的关注:选择副作用较小的药物,增加高治疗获益人群的总体净获益。净获益这一理念的贯彻有助于改善患者生活质量,实现更为全面、长期的获益。
HR+乳腺癌内分泌治疗策略需关注治疗获益与患者获益的平衡。从患者获益角度出发,关注依从性管理和不良反应管理有助于提高患者长期净获益。
1. 依从性差影响患者预后
2023 SABCS公布了一项关于依从性不佳是否影响HR+乳腺癌患者复发和死亡风险的研究:该研究纳入1990年1月1日至2018年1月1日四川大学华西医院诊断为HR+的I-III期乳腺癌患者,旨在探究内分泌治疗停药和中断治疗对早期HR+乳腺癌患者的影响,为临床医生提供临床决策的循证医学证据。研究使用X-Tile模型,根据截断值(691天)将患者分为低危组和高危组,结果显示,高危组患者内分泌辅助治疗时间小于23个月,所有乳腺癌事件发生率显著增加(p<0.0001)[24] 。
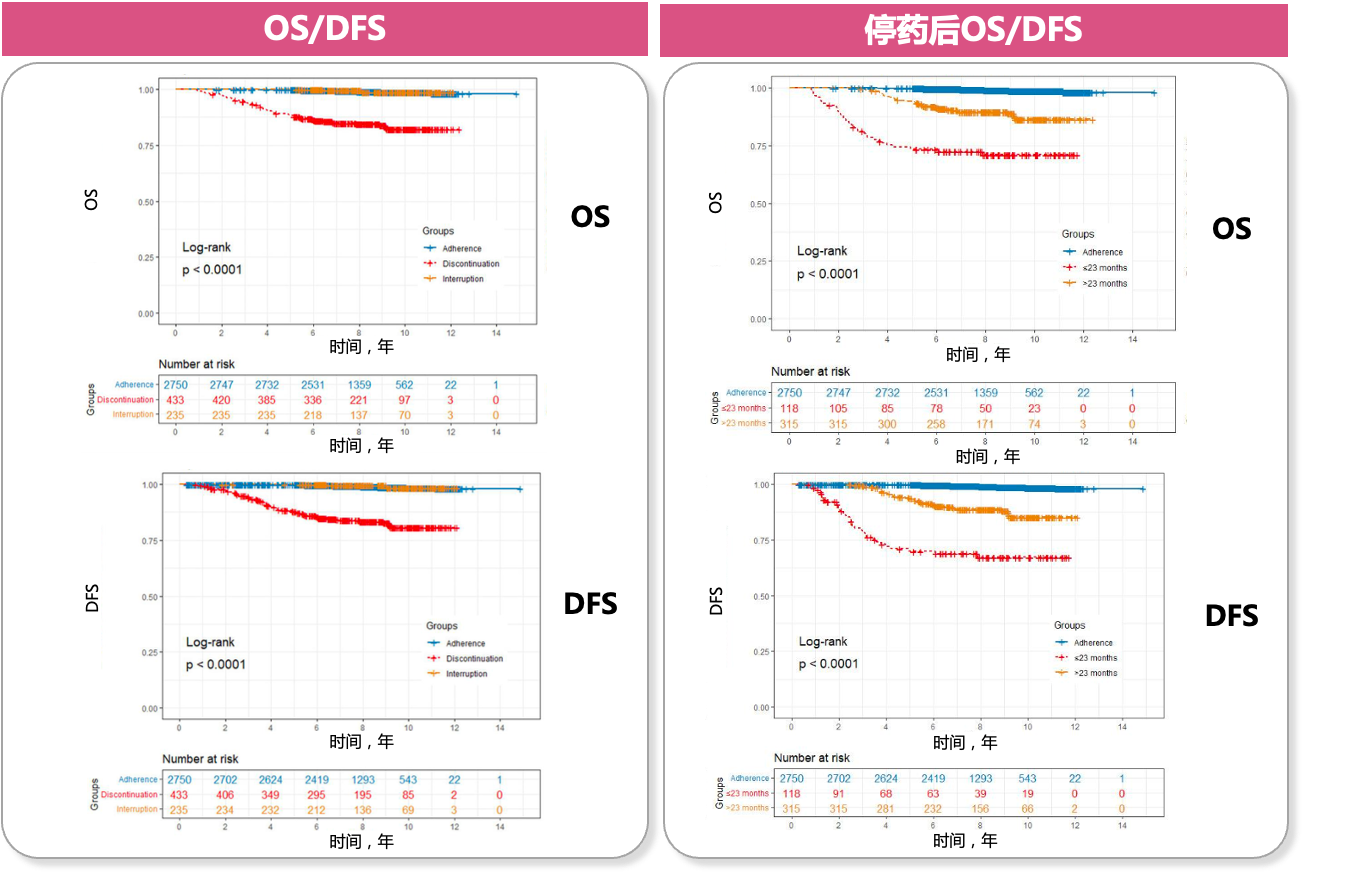
图8 长期停药增加HR+乳腺癌患者复发和死亡风险[24]
依从性不佳导致乳腺癌患者复发和死亡的风险升高,而在长期治疗中,患者依从性不断下降。一项探究乳腺癌患者辅助内分泌治疗依从性的系统性分析[25]发现,从治疗第1年至第5年,患者依从性平均共下降25.5%。其中,不良反应是患者依从性下降的原因之一,合理管理不良反应可能改善患者依从性。
2. 从不良反应管理角度进行依从性管理
HR+乳腺癌患者在接受基于TAM、AI的内分泌治疗中,常见骨骼肌肉症状、潮热、性功能障碍、外阴阴道症状等不良反应[26]。此时,转换内分泌用药、使用缓解不良反应症状的药物、或进行认知行为疗法等非药物治疗,有助于提高患者依从性,提高生存质量。
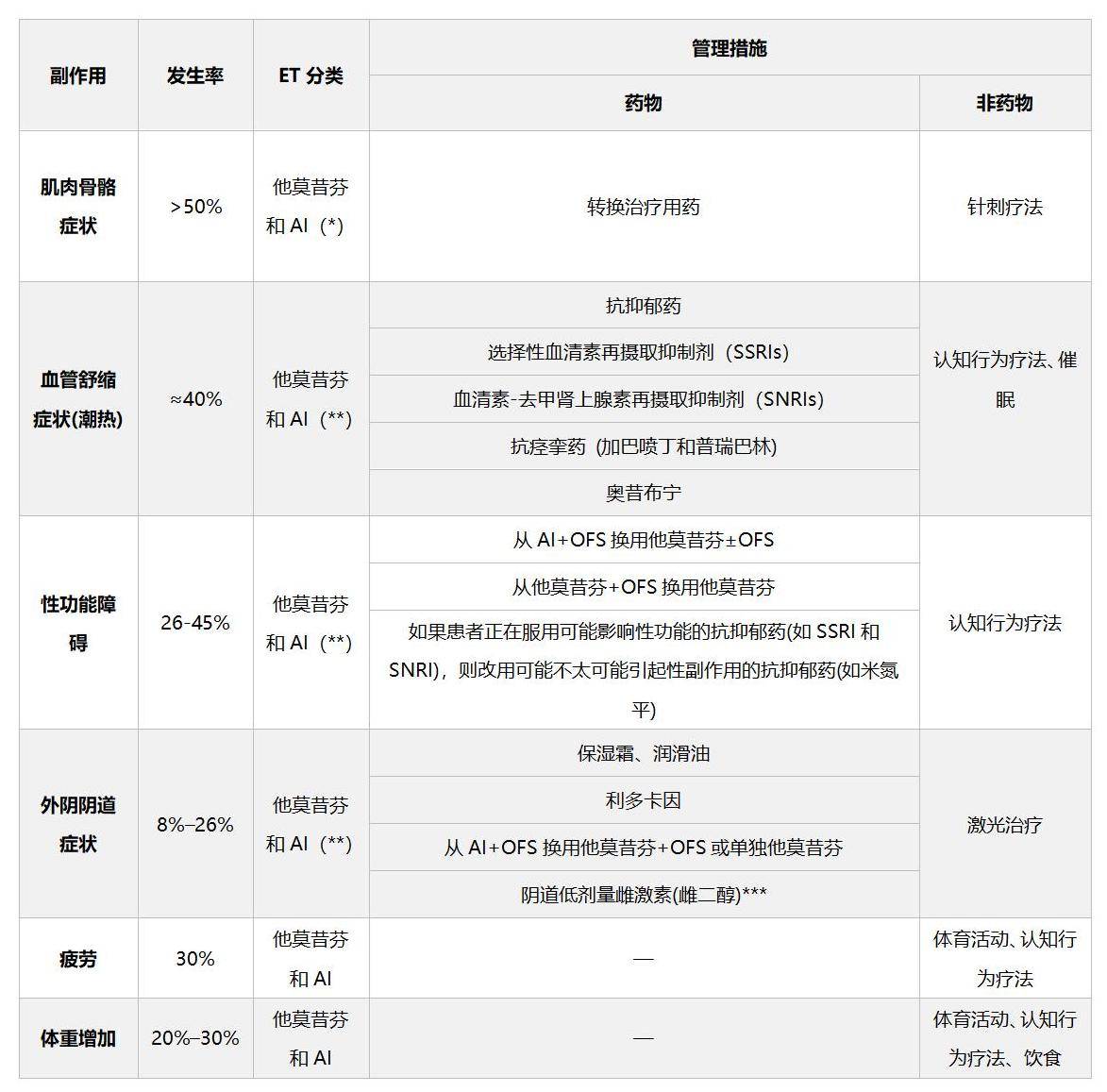
*表明该事件在特定类型治疗谱中更为典型
**联合卵巢功能抑制尤其增加发生率和严重副作用
***使用阴道低剂量雌激素并没有得到普遍认可
图9 内分泌治疗的不良反应和管理措施[26]
2023 SABCS大会中,一项对ASTRRA研究的回顾性分析,提示联合OFS也可能导致患者骨密度受损加剧[27]。对此,标准化不良反应管理有助于优化长期内分泌治疗,最新的绝经前和绝经后早期乳腺癌妇女癌症治疗骨丢失(CTIBL)管理指南[28]为此提供了标准化管理方案。
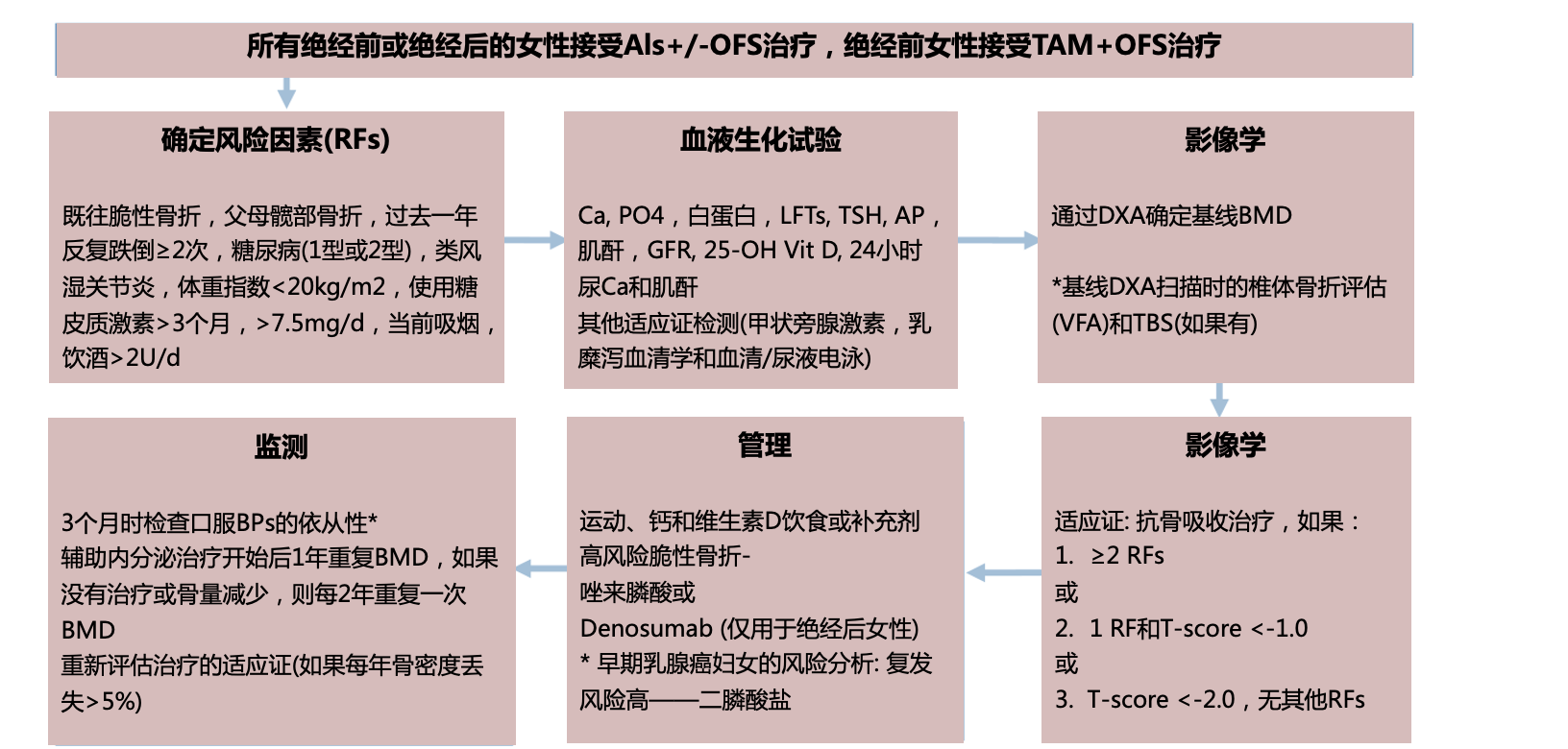
BMI:身体质量指数,Ca:钙,LFTs:肝功能检查,RFTs:肾功能检查,TSH:促甲状腺激素,TBS:骨小梁评分。FRAX不适用于40岁以下的女性。
*单纯接受TAM治疗的绝经前女性是例外,她们需要进行基线评估,包括危险因素识别和DXA测量骨密度。如果z评分为S-2.0 SD,或者当z评分在-1.0 ~ -2.0之间并且存在脆性骨折时,则适用抗骨吸收治疗。*临床决策中应考虑Denosumab停药后的二膦酸盐序贯治疗; 这一方法近来建议用来缓解骨转换中的“反弹现象”。
图10 乳腺癌妇女癌症治疗骨丢失管理流程[28]
3. 从多学科行动计划和线上平台角度进行依从性管理
2023 SABCS展示了改善乳腺癌护理的多学科行动计划:
在开始口服药物治疗前,促进患者与肿瘤医生沟通;
对护理团队进行获批新药、治疗序贯和分子检测方面的培训;
关于新型乳腺癌治疗的不良反应,促进患者与医生之间的沟通;
通过结合口服依从性小工具、支持小组及随访,使患者能够坚持新型口服疗法;
聘请护理人员为患者提供教育和指导,以提高患者对治疗目标的理解[29]。
多学科行动计划在循证治疗个体化、乳腺癌治疗依从性、AE监测/管理、支持治疗服务方面都取得了进展。多学科行动计划取得的进展提示改善社区肿瘤管理的关键机会,可有效提高口服肿瘤药物的患者依从性及整体HR+/HER2-乳腺癌的护理。除此之外,乳腺癌治疗依从性进展中52%的患者报告使用应用程序/工具可提高依从性[29]。
线上平台提供了数字化随访的可能性。随着手机和可穿戴设备的的普及,线上平台能够收集患者的生理数据,实现对肿瘤患者症状负担、生活质量和不良风险的监测,[30]远程随访有望促进肿瘤患者的依从性管理,带来更多获益。
4. 关注剂型优势-患者依从性获益
HR+乳腺癌内分泌治疗中,OFS是绝经前患者的重要治疗方式,而长效剂型药物能降低患者用药频率,更具提升患者依从性的优势。
而在疗效上,一项中国人群GnRHa去势疗效分析研究证明亮丙瑞林3月剂型、亮丙瑞林1月剂型、戈舍瑞林1月剂型去势疗效相当:治疗1年期间,患者雌激素和卵泡刺激素中位水平均处于绝经后,组间无统计学差异;去势逃逸率也无统计学差异[31]。
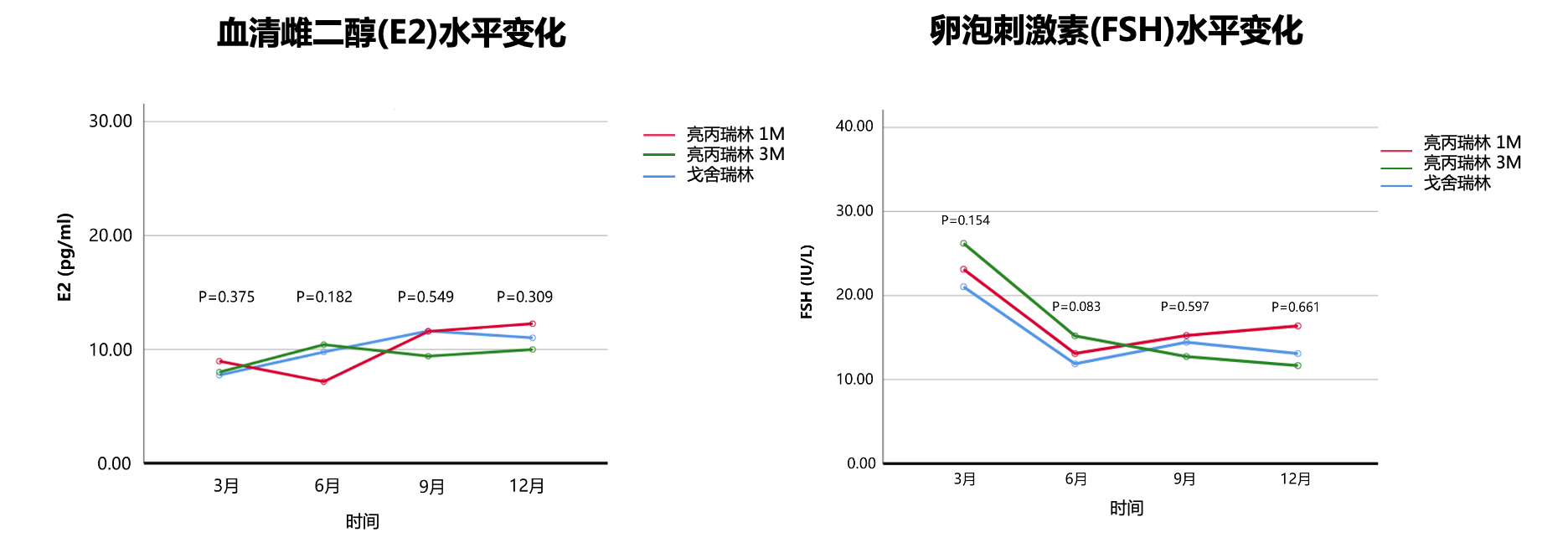
图11 亮丙瑞林3月 & 1月剂型vs戈舍瑞林治疗1年期间E2、FSH水平对比
此外,GnRHa 3月剂型与1月剂型均可改善绝经前早期乳腺癌患者的长期预后,亮丙瑞林3月剂型联合他莫昔芬治疗5年DFS可达 90.4%;另一项研究中,戈舍瑞林1月剂型联合他莫昔芬治疗5年DFS 为89.8%[32,33]。一项头对头试验证实,亮丙瑞林3月剂型与1月剂型均具有良好安全性,潮热、头痛等不良反应发生率相似[34]。
在疗效、长期预后和安全性与1月剂型相当的基础上,3月剂型更加契合《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》建议乳腺癌患者的随访频率:“参考术后2年内每3个月随访一次,术后3-5年每6个月随访一次”。[35]真实世界模型中,纳入各年用药持续性数据,亮丙瑞林3月剂型和戈舍瑞林1月剂型5年累计注射次数分别为14次和42次,3月剂型较1月剂型5年累计平均减少28次门诊随访/GnRHa注射[36]。
综上, 3月剂型与1月剂型临床疗效相似,而且3月剂型可节约患者的直接非医疗成本(交通费、食宿费)和间接成本(患者劳动力损失、家属/陪护者劳动力损失),减少注射次数和就诊次数。因此,GnRHa 3月长效剂型是有利于提高患者治疗依从性的一种合理选择。
总结
在HR+乳腺癌治疗领域,如何提高患者净获益是备受关注的热点问题。从St. Gallen投票到SABCS会议,领域专家着眼于内分泌治疗疗程延长与策略优化。而长效剂型、线上平台为高效管理患者依从性提供助力。总体而言,在净获益理念的引领下,HR+乳腺癌患者有望通过精准治疗策略和依从性管理,在内分泌治疗中获得更佳的疗效的同时,获取更高的生活质量。
[1] Qiu H, Cao S, Xu R. Cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020[J]. Cancer Commun (Lond), 2021, 41(10): 1037-1048.https://doi.org/10.1002/cac2.12197
[2] 中国临床肿瘤学会乳腺癌专家委员会 中, 中华医学会外科学分会乳腺外科学组. 中国年轻乳腺癌诊疗专家共识(2022)[J]. 中华医学杂志, 2023, 103(06): 387-403.
[3] 张少华, 王晓稼, 江泽飞. 乳腺癌内分泌治疗专家共识(2023版)[J]. 中华医学杂志, 2023(38): 2993-3001.
[4] 中国临床肿瘤学会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023[J], 2023.
[5] Wangchinda P, Ithimakin S. Factors that predict recurrence later than 5 years after initial treatment in operable breast cancer[J]. World J Surg Oncol, 2016, 14(1): 223.https://doi.org/10.1186/s12957-016-0988-0
[6] Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years[J]. N Engl J Med, 2017, 377(19): 1836-1846.https://doi.org/10.1056/NEJMoa1701830
[7] 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)[J]. 中国癌症杂志, 2022, 32(02): 177-190.https://doi.org/10.19401/j.cnki.1007-3639.2022.02.010
[8] Foldi J, O'meara T, Marczyk M, et al. Defining Risk of Late Recurrence in Early-Stage Estrogen Receptor-Positive Breast Cancer: Clinical Versus Molecular Tools[J]. J Clin Oncol, 2019, 37(16): 1365-1369.https://doi.org/10.1200/jco.18.01933
[9] 2023 St. Gallen共识投票.
[10] Battisti N M L, Smith I E. Preventing late recurrence in hormone receptor-positive early breast cancer: a review[J]. Eur J Cancer, 2022, 172: 53-64.https://doi.org/10.1016/j.ejca.2022.05.028
[11] 2022 SABCS. GS1-09.
[12] 2023 ESMO. LBA17.
[13] Harbeck N, Rastogi P, Martin M, et al. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: updated efficacy and Ki-67 analysis from the monarchE study[J]. Ann Oncol, 2021, 32(12): 1571-1581.https://doi.org/10.1016/j.annonc.2021.09.015
[14] 2023 ASCO. LBA500.
[15] 2023 ESMO. LBA23.
[16] 2023 ESMO LBA17, 18 and 19.
[17] 2023 SABCS. GS03-03.
[18] Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials[J]. Lancet Oncol, 2022, 23(3): 382-392.https://doi.org/10.1016/s1470-2045(21)00758-0
[19] Pagani O, Walley B A, Fleming G F, et al. Adjuvant Exemestane With Ovarian Suppression in Premenopausal Breast Cancer: Long-Term Follow-Up of the Combined TEXT and SOFT Trials[J]. J Clin Oncol, 2023, 41(7): 1376-1382.https://doi.org/10.1200/jco.22.01064
[20] 2022 ESMO. LBA14.
[21] 2023 SABCS. LBO1-05.
[22] 潘锋. 乳腺癌已迈入慢病化管理时代[J]. 中国医药导报, 2022, 19(19): 1-4.
[23] 毕钊, 王永胜. 1~2枚前哨淋巴结阳性早期乳腺癌患者治疗策略降阶梯新理念[J]. 中国癌症杂志, 2023, 33(06): 560-565.https://doi.org/10.19401/j.cnki.1007-3639.2023.06.002
[24] 2023 SABCS. PO 4-01-13.
[25] Yussof I, Mohd Tahir N A, Hatah E, et al. Factors influencing five-year adherence to adjuvant endocrine therapy in breast cancer patients: A systematic review[J]. Breast, 2022, 62: 22-35.https://doi.org/10.1016/j.breast.2022.01.012
[26] Vaz-Luis I, Francis P A, Di Meglio A, et al. Challenges in Adjuvant Therapy for Premenopausal Women Diagnosed With Luminal Breast Cancers[J]. Am Soc Clin Oncol Educ Book, 2021, 41: 1-15.https://doi.org/10.1200/edbk_320595
[27] 2023 SABCS. PO 2-12-06.
[28] Waqas K, Lima Ferreira J, Tsourdi E, et al. Updated guidance on the management of cancer treatment-induced bone loss (CTIBL) in pre- and postmenopausal women with early-stage breast cancer[J]. J Bone Oncol, 2021, 28: 100355.https://doi.org/10.1016/j.jbo.2021.100355
[29] 2023 SABCS. PO5-05-04.
[30] Low C A. Harnessing consumer smartphone and wearable sensors for clinical cancer research[J]. npj Digital Medicine, 2020, 3(1): 140.https://doi.org/10.1038/s41746-020-00351-x
[31] 陈祎霏, 严颖, 姜晗昉, et al. 促性腺激素释放激素激动剂对绝经前激素受体阳性乳腺癌患者去势效果分析——真实世界研究[J]. 军事医学, 2021, 45(05): 373-379.
[32] Shiba E, Yamashita H, Kurebayashi J, et al. A randomized controlled study evaluating safety and efficacy of leuprorelin acetate every-3-months depot for 2 versus 3 or more years with tamoxifen for 5 years as adjuvant treatment in premenopausal patients with endocrine-responsive breast cancer[J]. Breast Cancer, 2016, 23(3): 499-509.https://doi.org/10.1007/s12282-015-0593-z
[33] Kim H A, Lee J W, Nam S J, et al. Adding Ovarian Suppression to Tamoxifen for Premenopausal Breast Cancer: A Randomized Phase III Trial[J]. J Clin Oncol, 2020, 38(5): 434-443.https://doi.org/10.1200/jco.19.00126
[34] Boccardo F, Rubagotti A, Amoroso D, et al. Endocrinological and clinical evaluation of two depot formulations of leuprolide acetate in pre- and perimenopausal breast cancer patients[J]. Cancer Chemother Pharmacol, 1999, 43(6): 461-6.https://doi.org/10.1007/s002800050924
[35] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040.https://doi.org/10.19401/j.cnki.1007-3639.2021.10.013
[36] 范蕾, Yu-Chen Y, 杜芬, et al. 中国绝经前激素受体阳性乳腺癌辅助内分泌治疗最小成本分析[J]. 中国药物经济学, 2020, 15(04): 5-10.
排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


