
我国消化道肿瘤呈现“高发病率”、“高病死率”的特点。数据显示,在我国新发病例数及死亡人数前十的癌种中,消化道肿瘤的新发病例数及死亡人数占比近半[1],严重威胁我国人民的健康。在神经营养酪氨酸受体激酶(NTRK)基因融合的患者中,消化道肿瘤的发病率也同样居于高位,而且由于我国人口基数庞大,即使总发病率小于1%的罕见靶点,其病患总数仍不容小觑。因此,NTRK基因融合消化道肿瘤的检测与治疗,是近年来备受关注的医学热点。
在今年的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO-GI)上,一项关于“拉罗替尼在TRK融合胃肠道肿瘤中的有效性和安全性”的临床研究更新了数据。本文特邀北京肿瘤医院齐长松教授,就最新数据进行解读,以飨读者。
北京肿瘤医院一期临床病区 副主任医师
主要从事实体瘤细胞免疫治疗、消化系统肿瘤的规范化诊疗和个体化治疗。
北京市医管局“青苗”人才
北京大学优秀青年医师、临床科学家
中国临床肿瘤学会(CSCO)胃肠间质瘤专委会委员、秘书
中国临床肿瘤学会(CSCO)青年专家委员会委员
北京癌症防治学会胃癌防治专委会秘书长
中国老年医学学会肿瘤学分会委员
中国医促会胃肠外科学分会委员
《肿瘤综合治疗电子杂志》编委
《Health Care Science》青年编委
NTRK基因融合消化道肿瘤:健康威胁渐重,治疗尚未满足
根据《2020年全球最新癌症负担数据》显示,我国消化系统肿瘤在新发病例数和死亡人数前十的癌种中占比超过40%,其中结直肠癌、胃癌、肝癌居于我国肿瘤新发病例数和死亡人数前五位[1]。
NTRK基因融合在各种肿瘤类型中的发生频率各不相同,在CRC中约为0.2%~0.4%[2]。虽然在CRC中NTRK基因融合的发生率较低,但在MSI-H CRC患者中更常见(1%~5%)[3]。此外,研究者们还发现NTRK基因融合可在包含MSH2/MLH1突变的CRC中富集,尤其按MSI状态分层时,NTRK基因融合的发生率在MSI-H CRC中显著增加(MSI-H 5% vs. MSS 0.4%)[3-8]。因此,NTRK基因融合消化道肿瘤尚有未被满足的治疗需求,未来尚有待进一步探索,以明确NTRK基因融合在消化道肿瘤中的发生情况。
拉罗替尼再显实力:2024 ASCO GI数据更新,CRC患者ORR高达44%
拉罗替尼是一种高选择性的TRK抑制剂,已获批用于治疗患有NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者,是首个不限瘤种的实体瘤精准靶向药物。在2024 ASCO GI大会上,一项关于“拉罗替尼在TRK融合胃肠道肿瘤中的有效性和安全性”的临床研究更新了数据,进一步证实了拉罗替尼的实力。
研究方法
该研究纳入在II期篮子试验(NAVIGATE [NCT02576431])中接受拉罗替尼治疗的转移性TRK融合胃肠道肿瘤患者,主要终点为IRC依据RECIST v1.1评估的总体缓解率(ORR),次要终点为缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)和安全性。
研究结果
本研究共纳入44例TRK融合胃肠道肿瘤患者(表1),所有患者均在当地通过NGS技术进行了NTRK基因融合检测,一共检测出19种融合伴侣,其中TPM3::NTRK1最常见(34%,图1)。
表1 患者基线数据
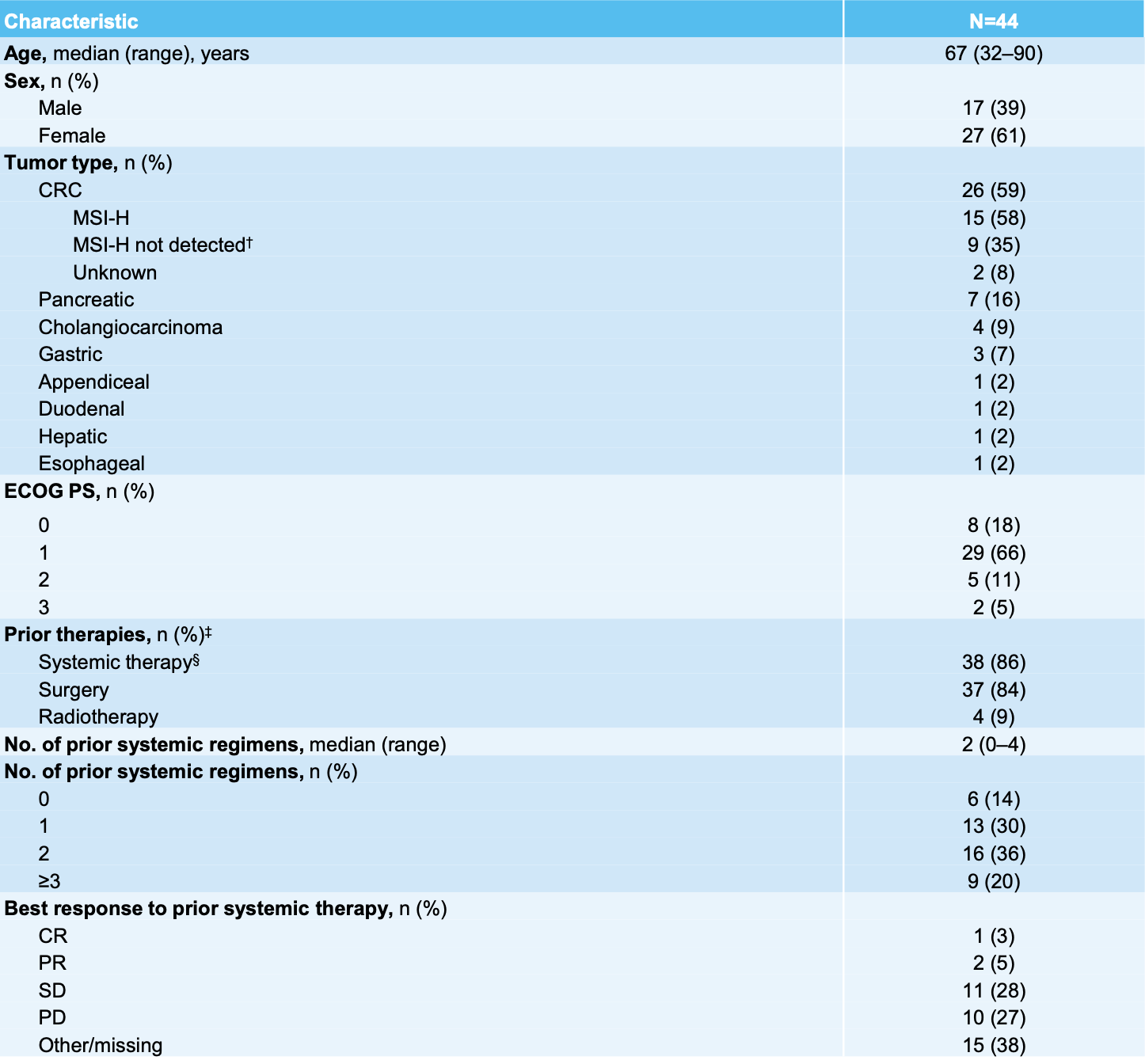
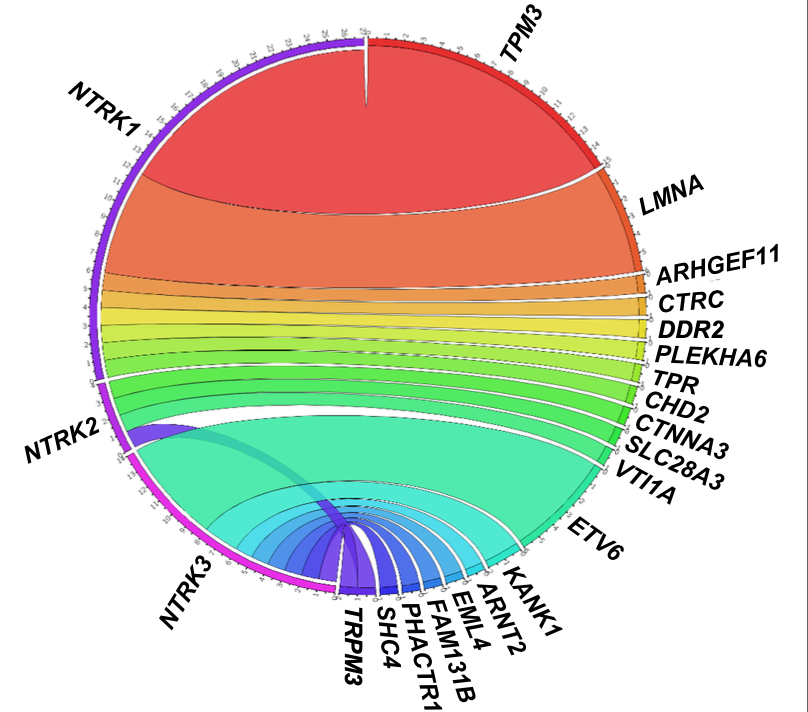
图1 NTRK基因融合伴侣
在主要终点方面(图2),所有患者的ORR为28%(95%CI:15~44)、24周疾病控制率(DCR)为47%(95%CI:31~62),其中CRC患者的ORR为44%(95%CI:24~63)、24周DCR为56%(95%CI:35~76)。中位至缓解时间为1.8个月(范围:1.7~11.1个月),治疗持续时间从0个月到56+个月不等。
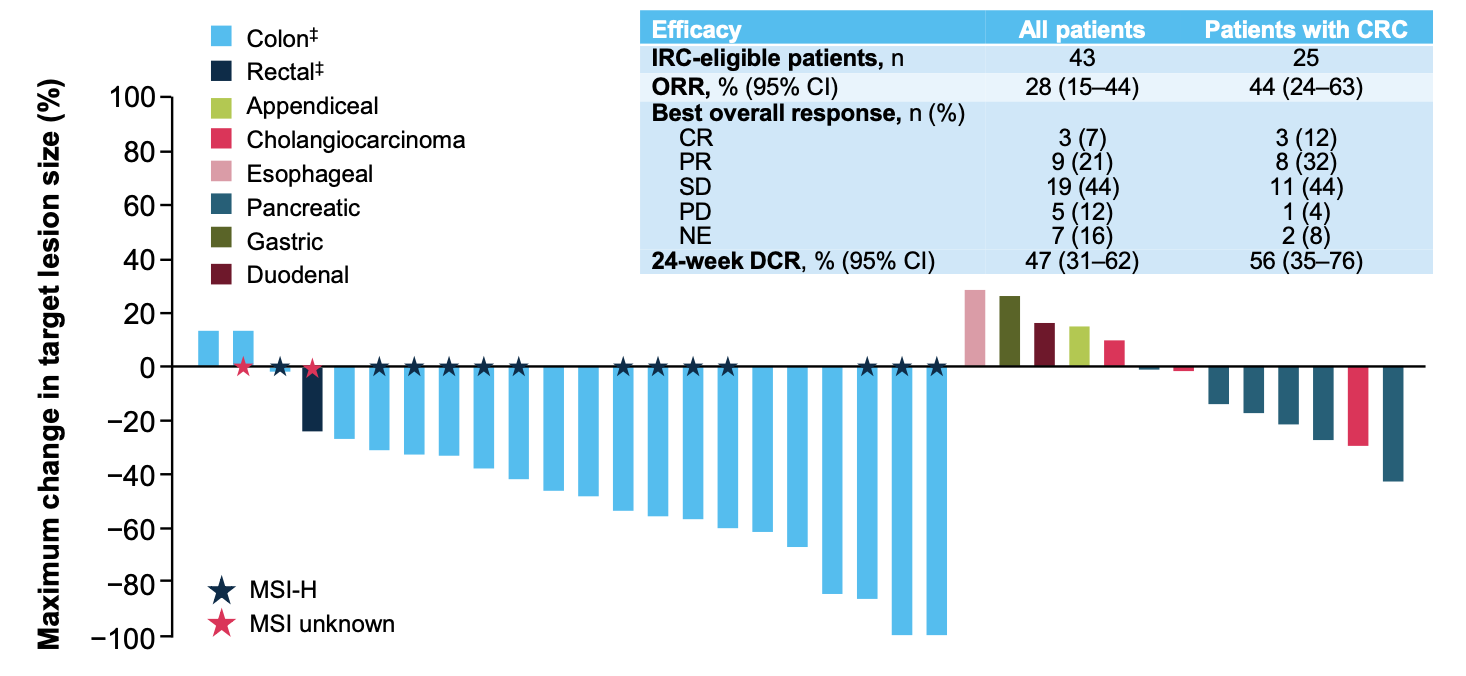
图2 ORR及24周DCR数据
在次要终点方面(图3、4、5),所有患者和CRC患者的中位DoR均为27.3个月(95%CI:5.6~NE);中位PFS分别为6.1个月(95%CI:4.8~9.2)和7.4个月(95%CI:5.5~NE);中位OS分别为12.5个月(95%CI:6.8~29.4)和29.4个月(95%CI:6.8~NE)。值得注意的是,DoR、PFS和OS数据均在MSI-H患者中更优(图3、4、5)。截至数据截点,共有28例患者(64%)在治疗中进展,其中8例(18%)经研究者评估后持续进行进展后治疗。整体治疗过程中,没有患者因TRAE而中断治疗,大多数不良反应轻微且可控。
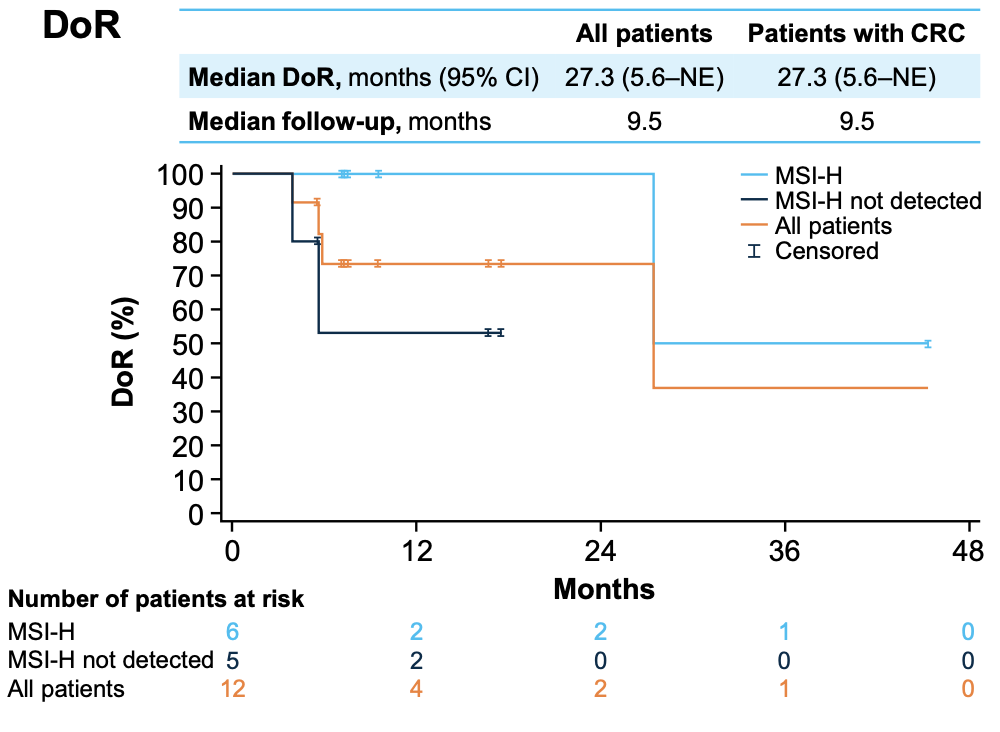
图3 DoR数据
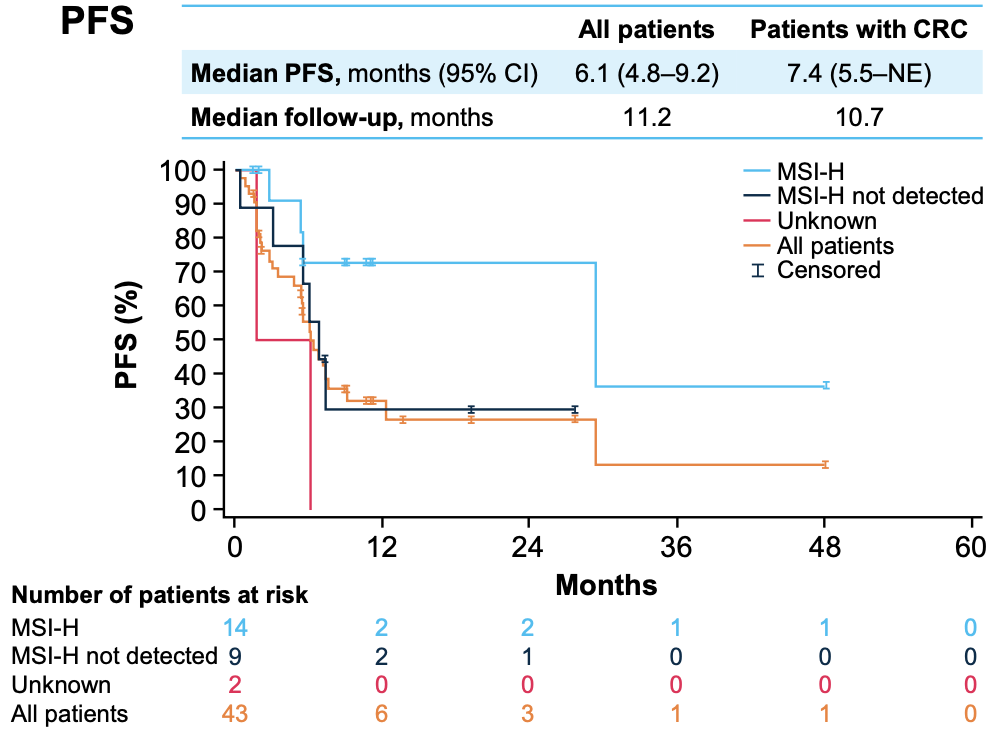
图4 PFS数据
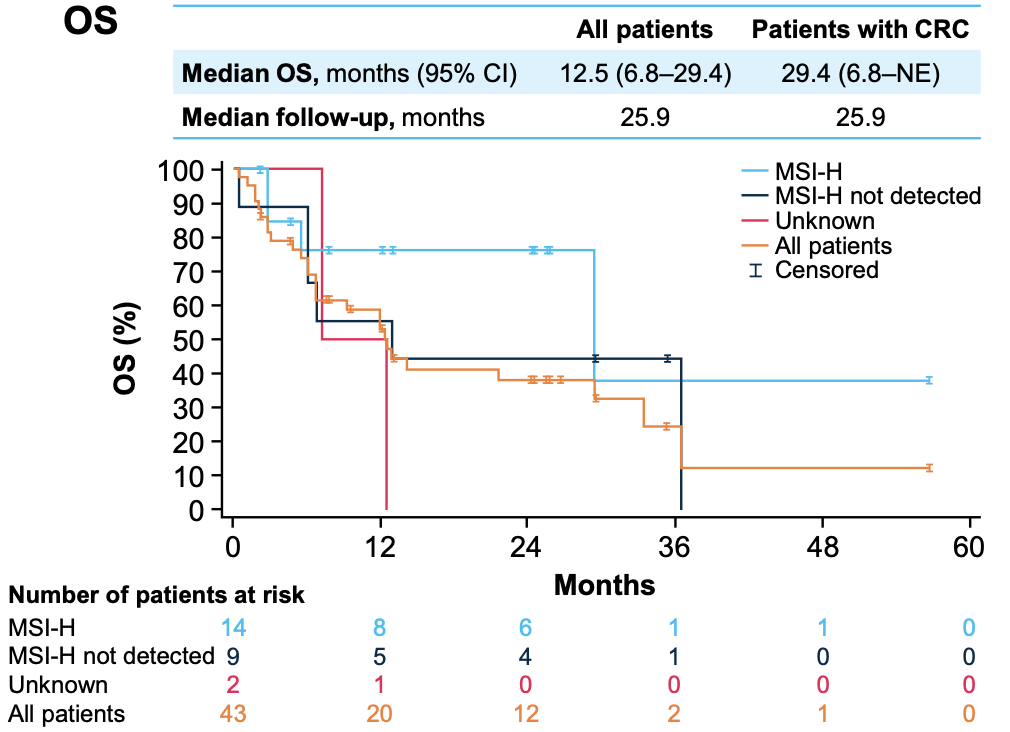
图5 OS数据
在免疫治疗进展后早期应用的临床实践方面,拉罗替尼同样展现出强劲实力。一项Case Report显示[9],拉罗替尼用于免疫治疗进展后错配修复缺陷TRK融合阳性转移性结肠癌,拥有显著且持久的疗效。在该报告的描述中,这位NTRK基因融合MSI-H CRC患者在2019年6月开始使用帕博利珠单抗治疗4个周期后疾病进展,后改用伊匹木单抗联合纳武利尤单抗治疗2个周期再次疾病进展。2019年11月,患者开始服用拉罗替尼,一周内即有明显的症状改善。截至2020年2月,患者仍在服用拉罗替尼,且得益于各项临床指标的改善,患者成功接受了肿瘤根治性切除术。截止该报告发布前(约治疗后26个月),患者的NGS ctDNA(包括血浆MSI)检测和肿瘤相关MRD ctDNA检测仍为阴性。
综上所述,该报告强调了CRC患者分子检测的重要性,反映了拉罗替尼起效迅速、疗效深入且持久的特点,揭示了拉罗替尼在患者病程早期应用的潜力,为对比靶向与免疫治疗的选择提供了更多参考。
国内外权威指南推荐:拉罗替尼为NTRK基因融合消化道肿瘤带来获益
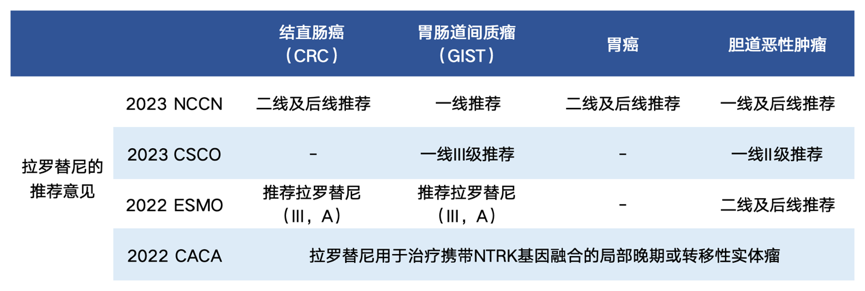
拉罗替尼在TRK融合CRC患者中(尤其是MSI-H患者中)表现出持久的缓解、较长的生存期和良好的安全性,此外,有近50%的患者表现出6个月的疾病控制,且不限肿瘤类型。总体而言,拉罗替尼具有良好的安全性,是TRK融合胃肠道肿瘤患者快速有效的治疗方案。基于拉罗替尼在消化道肿瘤中展现出的优异有效性和良好安全性,国内外指南也对NTRK基因融合消化道肿瘤患者的用药作出了相应推荐(表2)。
表2 国内外指南对于拉罗替尼在消化道肿瘤中应用的推荐意见
NTRK基因融合检测:NGS为首选,规范流程是关键
对NTRK基因融合患者进行检测,对于早期识别拉罗替尼受益患者非常重要。但是,中国患者进行NTRK基因融合检测的比例仅为1.3%,远远低于全球其他国家[10],因此需要规范检测流程、加强医患教育,来造福更多NTRK基因融合患者。
本研究中,所有患者均经过NGS来进行NTRK基因融合检测。在2021新加坡工作组发布的共识中,对CRC NTRK基因融合的检测流程给出了明确建议(图6),对于诊断为转移性或局部晚期CRC,如果NGS可及,一线治疗前就推荐使用NGS检测NTRK;反之,如果NGS不可及,一线治疗前推荐检测KRAS、NRAS、BRAF、MMR/MSI,在标准治疗失败后(尤其是RAS野生型、BRAF野生型和MSI-H患者),推荐使用NGS检测[11]。此外,首部《中国实体瘤NTRK基因融合临床诊疗专家共识》中,对于需要判断是否适合参加二代TRK抑制剂治疗或者临床试验的NTRK基因融合基因耐药患者,也推荐使用NGS检测发现耐药突变。
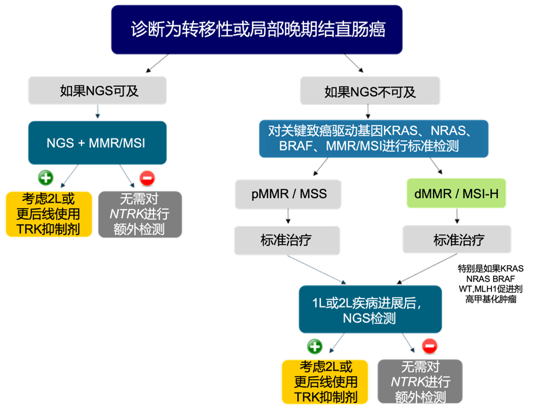
图6 2021新加坡工作组共识推荐
由此可见,NGS作为一种新兴的检测技术,以其较高的灵敏度和特异性,以及可以检测新型融合伴侣、同时可以检测多个靶点的优点,被认为是NTRK基因融合检测的首选手段。不过,NGS报销受限,在技术上付出的成本也比较高昂,在未来仍有诸多困难需要克服,相信随着政策的不断完善和流程的不断规范,将有越来越多的NTRK基因融合患者从中获益。
专家解读及总结
拉罗替尼作为一款高选择性的NTRK基因融合肿瘤治疗药物,在国内外都得到了广泛的认可和应用。在消化道肿瘤领域,更是获得了包括CSCO、CACA、ESMO、NCCN在内的多部国内外权威指南推荐。此次公布于2024 ASCO GI的最新数据——经治的CRC患者中高达44%的ORR,更是进一步证实了拉罗替尼在消化道肿瘤方面的实力。在临床实践方面,一项 Case Report 也揭示了拉罗替尼在CRC患者免疫治疗进展后早期应用的潜力。
与此同时,精准基因检测对于筛选拉罗替尼等优效药物的潜在获益人群具有重要的临床意义,新兴的NGS技术已成为NTRK基因融合检测的首选方法。相信随着拉罗替尼越来越多的数据涌现以及国内基因检测技术的不断研发和规范,未来中国临床学者对NTRK基因融合的认知和重视程度能够不断提升,使得这类罕见靶点的病患能够尽早获得精准诊疗,提高生存获益,提升生活质量。
[1] Jacques Ferlay, et al. Cancer statistics for the year 2020: An overview. Int J Cancer. 2021 Apr 5.
[2] O’Haire S et al. Systematic review of NTRK 1/2/3 fusion prevalence pan-cancer and across solid tumours. Sci Rep. 2023 Mar 13;13(1):4116.
[3] Schraa SJ et al. Comparison of NTRK fusion detection methods in microsatellite-instability-high metastatic colorectal cancer. Virchows Arch . 2023 Jun;482(6):983-992.
[4] Chou A, et al. NTRK gene rearrangements are highly enriched in MLH1/PMS2 deficient, BRAF wild-type colorectal carcinomas-a study of 4569 cases. Mod Pathol. 2020 May;33(5):924-932.
[5] Cocco E, et al. Colorectal Carcinomas Containing Hypermethylated MLH1 Promoter and Wild-Type BRAF/KRAS Are Enriched for Targetable Kinase Fusions. Cancer Res. 2019 Mar 15;79(6):1047-1053.
[6] Deihimi S, et al. BRCA2, EGFR, and NTRK mutations in mismatch repair-deficient colorectal cancers with MSH2 or MLH1 mutations. Oncotarget. 2017 Jun 20;8(25):39945-39962.
[7] Pietrantonio F, et al. ALK, ROS1, and NTRK Rearrangements in Metastatic Colorectal Cancer. Natl Cancer Inst. 2017 Dec 1;109(12).
[8] Marchiò C, et al. ESMO recommendations on the standard methods to detect NTRK fusions in daily practice and clinical research. Ann Oncol. 2019 Sep 1;30(9):1417-1427.
[9] Pashtoon M Kasi, et al. Larotrectinib in Mismatch-Repair-Deficient TRK Fusion-Positive Metastatic Colon Cancer After Progression on Immunotherapy. Cureus. 2022 Jul 7;14(7):e26648.
[10] Kriti Jindal, et al. NTRK test usage practices in Europe and Asia: Findings from a real-world study. 2021 ESMO. abstract 102P.
[11] Kiat Hon Tony Lim et al. Recommended testing algorithms for NTRK gene fusions in pediatric and selected adult cancers: Consensus of a Singapore Task Force. Asia-Pac J Clin Oncol. 2022 Aug;18(4):394-403.











 苏公网安备32059002004080号
苏公网安备32059002004080号


