新年的到来总会让大家感到心情愉悦,因为无论在过去一年中经历的是痛苦还是欢乐,大家都可以在新年起始选择重新起航!如果痛苦多一些,那就让痛苦结束在2023,用笑容迎接2024;如果快乐多一些,那就在2024多去帮助身边的人,让更多的人一起去感受快乐!在这里,月评小组全体成员祝各位老师、同道、患者朋友们新年快乐、诸事顺意!此外,获悉基石团队由于进行战略调整,一些老朋友可能在2024告别GIST领域,月评小组在此向基石GIST团队在过去的时间里给与医生和患者提供的巨大帮助表示诚挚的谢意,并祝福基石GIST团队的每一位好朋友在2024年一切顺利!江湖不远,有缘再见!
本期GIST月评检索了来自Pubmed 2023.11.25-2023.12.26的GIST相关文献,排除仅发表英文摘要与非英文的论文,共33篇,中国学者发表论文9篇,其中,复旦大学中山医院沈坤堂教授/侯英勇教授团队发表两篇重要基础研究,其中GIST蛋白组学研究发表在胃肠疾病顶刊Gastroenterology,同时国际与国内两项平行前瞻性研究CS3007与NAVIGATOR 研究中的阿伐替尼治疗kit基因外显子17突变数据的合并分析发表在Clinical Cancer Research,在此一起表示祝贺,并感谢基石医学团队王美凝女士在本文数据收集、分析、发表中提供的巨大支持!本期选取8篇论文进行解读,25篇进行列表,除上述国内学者发表论著外,Gastroenterology同期发表一篇关于内镜全层切除的重磅述评,此外,两篇与伊马替尼治疗敏感性及耐药相关的机制研究、GIST影像组学研究及日本最新获批治疗GIST的新药Pimitespib(TAS-116)数据综述,相信均对GIST科研与临床实践具有很好的学习价值。同时,2023.11在爱尔兰都柏林的CTOS年会中,多篇中国研究摘要入选会议,本期月评邀请复旦大学肿瘤医院周烨教授对CTOS2023重要研究进行精彩点评!
本期文献月评检索与文字排版得到了范雯霏女士的大力帮助,同时感谢再鼎医学GI团队协助进行论文标题首页的排版与编辑,以及CTOS GIST研究内容的检索与整理,最后感谢刘丹博士的校审!

CTOS会议GIST重要研究分享


复旦大学肿瘤医院胃外科
周烨教授
2023年CTOS会议于11月1日至4日在爱尔兰都柏林召开,会议中有17篇关于GIST的报道,其中药物相关的有13篇,基因检测相关2篇,其他相关的有2篇,其中9项研究来自于中国,应该说今年是中国GIST研究的大年,但是也需看到新药研究的报道还是来自于欧美,因而希望随着中国Biotech公司的增多,也能致力于GIST治疗领域的研发。
这次所报道的新药临床研究有以下几项:
1. CGT9486联合舒尼替尼对照舒尼替尼治疗GIST的Peak研究。此研究就是常说的I型TKI抑制剂联合II型TKI抑制剂,CGT9487主要针对原发KIT(外显子9和11)和活化环(外显子17和18)突变具有抑制性,与TKI 毒性(包括水肿、高血压和胸腔积液)相关受体没有显著抑制作用,使其成为与TKI互补(特别是舒尼替尼)的理想联合用药。第1部分研究提示CGT9486 300 mg 或600 mg联合舒尼替尼 37.5 mg(n=40),ORR为20%;而对于6例二线治疗者,ORR为33.3%,大多数患者治疗时间超过12个月。TEAE绝大多数为低级且可逆,仅3例发生与研究药物相关的SAE。最终确定III期研究为CGT 9486 600 mg联合舒尼替尼 37.5 mg对照舒尼替尼 37.5 mg对二线患者进行1:1随机,主要研究终点为PFS,次要终点包括OS,ORR,安全性,DCR,DOR,QoL。同时检测治疗前及进展时ctDNA进行探索性研究。目前正在全球100多家中心积极招募和入组患者,看了一下主要还是在北美,拉美,西欧,澳大利亚,韩国,中国台湾及香港地区开展。这项研究选择了舒尼替尼37.5mg连续口服作为对照组及联合用药的方案,虽然现在并没有舒尼替尼 50 mg 4/2方案和连续服用的头对头比较来评价哪种治疗方案更优,但是37.5 mg连续方案也是临床实践中为了降低AE而做的改良,回顾性研究提示37.5mg的疗效似类似于50 mg的4/2方案。对于没有选用标准的治疗方案作为对照组而设计的临床研究,最终试验结果是否会被FDA接受值得注目。若最终的研究提示对照组的mPFS优于现有前瞻性研究中舒尼替尼在intrigue研究中所取得最好成绩8.3个月,则可能会说服FDA。
2. IDRX-42治疗既往治疗耐药的GIST的早期结果。IDRX-42是一种强效、高选择性、口服KIT酪氨酸激酶多种突变体(包括c kit 外显子9、11、13和17)抑制剂,在各种移植瘤模型中,其抗肿瘤活性优于标准的一线或二线药物。33例患者接受治疗,28例患者可评价,现爬坡至800 mg,尚未达到MTD,临床获益率(PR+SD≥16周)为67.9%。在所有KIT突变中均观察到肿瘤缩小SD或PR,包括原发性和继发性耐药突变(c kit 外显子9,11,13和17),在最低120 mg剂量组中也观察到有患者出现PR。ctDNA分析提示治疗后KIT所有已知的突变外显子均显著减少,同时18FDG-PET显示SUV下降。大多数AE的严重程度为1级,最常见的≥3级为腹泻(6%)。又看到了一款集安全性和疗效性于一体的广谱TKI抑制剂,希望能早日进行III期临床研究,給GIST患者带来新的希望。
3. 另外有二项针对SDH突变或缺陷型GIST的药物研究报道。一项是应用化疗药物替莫唑胺,入组了23例患者,研究设置的主要研究终点为6个月的ORR,最终其为8.7%,而随着随访时间延长,最佳疗效的ORR可达到17.4%,DCR为78.3%。而对于突变类型和疗效之间分析发现2例SDHB突变者均达到PR,而12例SDHA突变者主要疗效为SD。从数据中可以看到该类人群的肿瘤退缩非常缓慢,某些有效的患者可能在治疗6个月后肿瘤体积才缩小30%。
4. 由于SDH缺陷可导致DNA超甲基化和染色质拓扑结构改变,使得FGF3及FGF4上调,通过此信号传导失调导致肿瘤发生,因而另一项研究为应用FGFR1-4抑制剂Rogaratinib (BAY 1163877),在23例可评估患者中,有7例患者出现PR,14例SD,特别值得关注的AE为视网膜疾病。同时进行肿瘤和血液的全外显子组测序,肿瘤的RNA测序进行探索性研究。希望未来有更多的新药关注于此类罕见突变类型的GIST。
对于瑞派替尼在GIST治疗的真实世界研究也是今年CTOS会议的一个亮点,主要集中于一些瑞派替尼治疗讨论的热点。
5. Intrigue研究提示瑞派替尼在二线治疗中对于c kit外显子11患者似乎更有优势,欧洲的一项EAP项目则回顾性分析了非c kit 外显子 11原发性突变的患者应用瑞派替尼的疗效,共入组35例,85.7%为四线及以上患者,DCR为51.4%,其中4例患者为PR(1例c kit 外显子 9突变, 2例c kit外显子17突变,1例SDH缺陷型),mPFS1为 4.3个月。6例患者因PD加量至300 mg,DCR为66.7%,mPFS2为4.9个月。尽管这组患者的mPFS和DCR率都要较INVICTUS研究所报道的整体人群要低,但是对于2例原发性外显子17的患者均出现了PR,在其他突变类型中瑞派替尼治疗也有一定的获益,因而对于此类患者后线还是可以考虑使用瑞派替尼的。但是对于未明确突变类型的患者,从泳道图上看此3例患者的PFS都低于4个月,可能对于非SDH突变型的野生型患者瑞派替尼疗效并不尽如人意。
6. 对于瑞派替尼疗效和继发性基因突变的关系,江苏省人民医院徐皓教授的多中心回顾性研究提示对于c kit 外显子11(n=15)继发c kit 外显子17突变的患者mPFS为17.7个月,而继发外显子13突变(n=13)者仅为5.9个月。Intrigue研究对于继发性突变和药物疗效之间相关性分析也提示继发c kit 外显子17者瑞派替尼的mPFS 为14.2个月,舒尼替尼为1.5个月,而c kit 外显子13突变者瑞派替尼为4.0个月而舒尼替尼可达到15个月。若出现外显子 13/14伴有17/18的复杂突变时前者为8.1个月而后者可达到10.9个月。在伊马替尼耐药后,由于继发突变高度异质性,现有的多种靶向药物是否还应按线布局值得商榷,或许GIST基于基因分型的精准治疗应从一线治疗推广至后线治疗,未来二线药物的临床研究也需把继发突变类型纳入入排标准中。正在西方开展的insight研究正在开启GIST临床研究的新时代,通过ctDNA检测来确定继发突变类型,筛选合适患者,期待该研究能尽快完成入组。也希望ctDNA在各方努力下提高检测的敏感性。
7. 随着阿伐替尼或瑞派替尼在临床应用的积累,也遇到了越来越多的耐药患者,北肿李健教授应用ctDNA技术分析发现:对比基线阿伐替尼进展者KIT 外显子9重复突变的检出率明显增加。同时,在进展样本中检测到基线时没有的新的突变类型:KIT 外显子13/14/16 错义突变、外显子13插入突变和外显子8缺失突变;RTK-RAS,p53和MYC通路显著增加。对比基线,瑞派替尼进展时检出率明显增加的突变类型包括外显子11错义突变,外显子14错义突变以及外显子11缺失插入突变;p53、NOTCH和 PI3K-Akt 通路改变显著增加。这些可能和耐药机制相关。通过这些耐药机制的研究,可为未来耐药后药物研发提供方向。
8. 另外有二项涉及晚期GIST的局部治疗。邵逸夫医院的钱浩然教授分析了41例一线治疗失败且接受减瘤术的GIST患者,应用NGS检测KIT基因继发突变。发现75.6%为c kit外显子 11突变,其继发突变率为83.9%,多发生于活化环突变(64.3%);而外显子9突变者占24.4%,继发性突变率仅为20%。单灶性进展患者mPFS(20.0个月)长于多灶性进展者(7.5个月,p<0.05),术后舒尼替尼组的mPFS优于伊马替尼组(9.5 vs 5.5个月,p<0.05)。达到NED患者的mOS显著优于AWD患者(NR vs 34.0个月,p<0.05)。多因素分析提示,减瘤术后疾病状态是独立风险因素。
9. 对于伴有肝转移的GIST患者,中山一附院的张信华教授团队分析了238例患者,单纯伊马替尼组的OS为132.6个月,IM联合肝切除(HR)或IM联合射频消融(RFA)/经动脉化疗栓塞术(TACE)者则均未达到。IM联合HR组的10年OS(91.9%)显著优于单药(61.1%)或IM+RFA/TACE组(55.2%)。多因素分析提示年龄<60岁及IM+HR是更优OS的独立因素。通过手术治疗使患者达到NED可显著延长OS,肝特异性PFS和PFS。
因而以上二项研究提示对于晚期GIST在靶向治疗中若有机会接受外科治疗,且能达到NED者,可延长患者生存时间。

GIST重量级

1.蛋白质组学特征鉴定胃肠间质瘤的临床相关亚组
Proteomic Characterization Identifies Clinically Relevant Subgroups of Gastrointestinal Stromal Tumors ★★★★★

【摘要】:
背景与目的:胃肠间质瘤(GIST)是胃肠道最常见的间质肿瘤,具有较高的转移率和复发率。我们的目的是描述GIST的蛋白质组学特征,进一步认识GIST的生物学过程和治疗脆弱性。
方法:对193例GIST进行定量蛋白质组学和磷酸化蛋白质组学分析,以揭示GIST的生物学特征。通过GIST细胞系和异种移植小鼠模型进行功能实验,验证数据驱动的假设。
结果:蛋白质组学分析显示不同部位、不同组织学分级GIST的分子特征存在差异。MAPK7被鉴定并在功能上证实与GIST肿瘤细胞增殖相关。综合分析显示SQSTM1表达上调抑制了患者对甲磺酸伊马替尼的反应。蛋白质组学分型鉴定出4组具有不同临床和分子特征的亚组。功能实验证实SRSF3促进肿瘤细胞增殖,导致预后不良。
结论:我们的研究提供了有价值的数据资源,并强调了GIST的潜在治疗方法。
复旦大学附属肿瘤医院
病理科 喻林副主任医师
【简评】:
“Proteomic Characterization Identifies Clinically Relevant Subgroups of Gastrointestinal Stromal Tumors(蛋白质组学特征鉴定胃肠间质瘤的临床相关亚组)”是中国GIST原创研究的又一重磅力作,本研究发表于《Gastroenterology》,影响因子高达29.4分。12月初关于本研究的相关推文和报道刷爆微信朋友圈和多个自媒体平台,为2023年度国内GIST研究领域增添了一抹亮丽的色彩。
本研究由复旦大学贺福初院士、丁琛、侯英勇及沈坤堂教授领衔,并联合中国科学技术大学、中国医学科学院、中国科学院和北京蛋白质组研究中心多家国内重点实验室共同操刀,是GIST临床研究和基础研究领域倾力合作的完美产物。
本研究的最大亮点是在国际上开辟了GIST蛋白质组学研究的先河,精心绘制了GIST蛋白质组学和磷酸化蛋白质组学的综合图谱。本研究对193个GIST肿瘤和127对非肿瘤邻近组织(NATs)进行了蛋质组学和磷蛋白质组学分析,确定了基于蛋白表达的4个分子亚型(C1~4),并发现不同亚型患者PFS存在显著差异(P < 0.01 ),C1和C2患者预后较差。进一步分层分析显示蛋白质组学分型与高危患者的预后密切相关,支持蛋白质组学分型策略具有可靠的预后预测价值,也表明该策略可能有助于进一步细化GIST患者复发的风险分层。
本研究另一个重要发现是参与葡萄糖代谢重编程的SQSTM1高表达与GIST患者的药物敏感性相关,SQSTM1表达上调抑制了GIST对甲磺酸伊马替尼的反应,可能有助于临床预测GIST患者对甲磺酸伊马替尼的治疗反应,并有助于临床进行准确的治疗决策和随访评估。此外,该研究团队还深入探讨了GIST的免疫微环境,基于xCell算法的细胞反卷积揭示不同部位GIST具有不同的免疫浸润模式,根据免疫微环境可将GIST分为4个具有预后差异的免疫亚型,以T细胞为特征的免疫亚型预后较好。当然,本研究也存在些许不足,蛋白质组学定量主要针对GIST肿瘤和NATs,未充分考虑肿瘤内部异质性的影响。未来整合单细胞和空间组学测序将有助于进一步探索GIST的进展机制。
总而言之,本研究不拘泥于GIST的传统基因分型,开创了GIST蛋白质组学和免疫分型与临床结局、治疗反应和生物学特征相关联的新范式,在国际上首次开展了基于GIST大宗病例随访,并联合运用蛋白质组学、磷酸化蛋白质组学、免疫分型和功能实验等多种分子平台的整合型研究,揭开了GIST蛋白质组学图谱的神秘面纱,进一步拓展了GIST研究领域的深度和广度,可为未来GIST研究提供宝贵的资源和广阔的空间,也为挖掘GIST潜在的靶向或免疫治疗指明了方向。
2. 美国胃肠病学会内镜下全层切除治疗胃肠道上皮下病变的临床实践更新★★★★★
AGA Clinical Practice Update on Endoscopic Full-Thickness Resection for the Management of Gastrointestinal Subepithelial Lesions: Commentary

【摘要】:
简述:胃肠道上皮下病变在常规内镜检查中并不罕见。内镜下上皮下病变切除术(包括全层切除术)的发展取得了显著进展。美国胃肠病学会(AGA)临床实践更新(CPU)的目的是阐述了内镜下全层切除术的各种技术,并促进其在上皮下病变管理中的适当应用。
方法:该临床实践更新由AGA临床实践更新委员会(CPUC)和AGA理事会委托并批准,就对AGA成员具有高度临床重要性的主题提供及时指导,并通过胃肠病学标准程序接受CPUC的内部同行评审和外部同行评审。
北京大学人民医院胃肠外科
高志冬主任医师
【简评】:
随着内镜技术的普及,上皮下肿物的发现率临床中并不少见,而对于这类病变,过去因为其切除时很高的穿孔率,一度这类疾病被认为是内镜切除的禁忌。但随着内镜技术创面关闭技术的成熟,乃至计划性全层切除技术的普及,目前上皮下肿物内镜切除已经在很多有经验的中心常规开展。随着内镜下全层切除技术的开展,又发现存在切除后再关闭创面有肠内容物溢出污染腹腔、肿瘤被吹入腹腔种植、气体进入腹腔造成消化腔内气压不足操作空间减少等不足,因此近些年来又出现了无暴露内镜下全层切除技术(黏膜下隧道切除STER、经口内镜下隧道切除术PEOT、设备辅助下内镜全层切除术等(如使用耙状金属夹闭合系统(over-the-scope-clip system,OTSC)吻合夹使肠壁全层折叠并固定,再切除夹子上方的肠壁。或者FTRD 系统(Ovesco,德国)将改良的OTSC吻合夹与圈套器相结合,将病变拉入切除帽,闭合圈套器并切除组织。)本文结合最新的研究进展对内镜下切除上皮下肿物的临床实践指南进行了更新阐述,主要的亮点可以汇总成如下表格,以便同道学习理解。
3.阿伐替尼治疗KIT突变型胃肠间质瘤的临床获益:I期NAVIGATOR和I/II期CS3007-001研究的事后分析
Clinical Benefit of Avapritinib in KIT-Mutant Gastrointestinal Stromal Tumors: A Post Hoc Analysis of the Phase I NAVIGATOR and Phase I/II CS3007-001 Studies ★★★★★

【摘要】:
目的:在I期NAVIGATOR和I/II期CS3007-001(国内桥接)试验的非PDGFRA突变胃肠间质瘤(GISTs)患者中探讨选择性KIT/PDGFRA抑制剂阿伐替尼(300毫克,每日一次)的疗效。
患者和方法:这项事后分析纳入了患有不可切除/转移性、仅KIT突变GIST并在≥1 种酪氨酸激酶抑制剂 (TKI) 治疗后进展的成人患者。基线突变状态由组织和血浆确定。主要终点是根据修改后的 RECIST v1.1 通过盲法独立放射学审查得出的 KIT 活化环突变(KIT 17或 18号外显子)且无ATP结合口袋突变(KIT外显子13或14;ALposABPneg)患者以及其他KIT突变(OTHERS)的患者的客观反应率 (ORR) 和无进展生存期 (PFS)。
结果:纳入了60例KIT ALposABPneg和100例KIT OTHERS,主要是重度前序治疗患者(61.3%既往接受过≥3次TKIs治疗)。KIT ALposABPneg患者的ORR明显高于KIT OTHERS患者(未调整:26.7% vs. 12.0%,P=0.0852;调整后:31.4% vs. 12.1%,P=0.0047). 与KIT OTHERS患者相比,KIT ALposABPneg患者的中位生存期明显更长(未经调整:9.1个月 vs. 3.5个月,P=0.0002;调整后:9.1个月 vs. 3.4个月,P<0.0001),二线患者的疗效比后线患者更长(19.3 个月比 5.6-10.6 个月)。在四线或以上的治疗中,KIT外显子9突变患者可观察到阿伐替尼的疗效(中位PFS:5.6个月和3.7个月)。
结论:阿伐替尼对携带KIT ALposABPneg突变的GIST患者较携带KIT OTHERS的GIST患者具有更强的抗肿瘤活性,可考虑用于前者。KIT外显子9突变患者也可从4线以上治疗中获益。
中山大学一附院胃肠外科
张信华教授
【简评】:
这篇文章的意义在于一定程度上在临床中验证了阿伐替尼体外研究证实的KIT活化环抑制效应;最大限度发掘阿伐替尼的临床数据,一定程度上提示:KIT突变的耐药GIST,继发突变仍然是耐药克隆的主要驱动形式,并且对选择性抑制剂存在治疗反应。研究提示对于仅有KIT活化环突变的耐药GIST,阿伐替尼有效且持久,越早使用瘤控时间可能越久。由于VOYAGER试验(阿伐替尼对比瑞戈非尼三线治疗)失败,导致阿伐替尼的原研企业不再投入到有关GIST的相关研发。这篇文章是对阿伐替尼在适应证以外的GIST相关结果的为数不多的事后分析。阿伐替尼是I型TKI,主要机制在于结合活化环突变后的I型RTK活化构象。体外试验已经证实其对于PDGFRA和KIT活化环突变同时有效。只是PDGFRA D842V突变由于氢键的作用,较其他活化环突变更能导致RTK几乎稳定于活化构象,而被阿伐替尼高效结合并抑制。而且D842V是原发突变,缺少旁路和下游通路耐药突变,一定程度上解释了阿伐替尼对D842V突变GIST的高效持久治疗效应。作为一个窄靶点的药物,对于KIT耐药GIST,单药使用可能需要精确选择以避免靶点未能覆盖而出现短期进展。联合治疗可能更适合多线耐药GIST。但阿伐替尼本身标准剂量的副反应不小,联合治疗需要小心调整剂量和处理不良反应。2024年1月1日开始,阿伐替尼进入医保,并且较前大幅降价,无论如何,对于选择有限的GIST患者来说,都是提高药品可及性的好消息。我们仍会持续关注此药,至少在当前,可选的GIST有效的治疗药物还是太少,不能轻易放弃一个潜在有效的药物。

基础研究版块

1.揭示缺乏继发性KIT突变的伊马替尼耐药胃肠道间质瘤(GIST)对抗FGF治疗的敏感性机制★★★★
Unraveling the Mechanisms of Sensitivity to Anti-FGF Therapies in Imatinib-Resistant Gastrointestinal Stromal Tumors (GIST) Lacking Secondary KIT Mutations

【摘要】:
我们之前表明,尽管没有继发性KIT突变,但GIST中KIT信号的抑制激活了FGFR信号通路,使癌症细胞对受体酪氨酸激酶抑制剂甲磺酸伊马替尼产生耐药性,从而说明了联合(例如KIT和FGFR靶向)治疗的基本原理。我们在这里表明,用IM长期培养IM抗性GIST(GIST-R1)可显著下调 KIT 表达并诱导 FGFR 信号级联反应的激活,这可以通过 FGFR1 和 2、FGF-2 和 FRS-2 的总表达和磷酸化形式的表达增加来证明,这些蛋白是众所周知的FRGF信号级联反应的接头蛋白。这导致mRNA和蛋白质水平上显示的AKT和MAPK信号通路的激活,并使癌细胞对泛FGFR抑制剂(BGJ 398、AZD 4547和TAS-120)高度敏感。事实上,我们观察到GIST亚克隆(GIST-R2)中BGJ 398的IC50值显着降低,该亚克隆来源于GIST-R1细胞,连续用IM处理长达12个月。异种移植模型还显示GIST-R2细胞对FGFR抑制的敏感性增加,表明当用这种泛FGFR抑制剂处理时,BGJ 398处理的动物的肿瘤大小显着减小(>70%)。同样,在治疗的第5天,通过免疫组织化学(IHC)染色检测到裂解的caspase-3的肿瘤内细胞凋亡增加。正如预期的那样,单独使用的BGJ 398和IM都缺乏对GIST-R1异种移植物的促凋亡和生长抑制活性,从而揭示了单独使用时它们对这些TKIs的耐药性。重要的是,FGFR2的敲除以及含量少得多的FGF-2消除了 BGJ 398在体外和体内对GIST-R2细胞的活性,从而说明了IM抗性GIST中的FGF-2/FGFR2信号传导轴作为该RTKi的主要分子靶标。总的来说,我们的数据表明,在缺乏继发性KIT突变的IM耐药GIST中持续抑制KIT信号转导诱导了GIST的克隆异质性,并导致过表达FGF-2和FGFR1/2的癌细胞积累,从而导致FGFR信号转导的激活。这反过来又使这些细胞对与IM联合使用甚至单独使用的泛FGFR抑制剂极为敏感,并提出了重新评估FGFR抑制剂有效性的基本原理,以改善GIST患者特定亚组的二线治疗策略(例如,IM耐药性GIST缺乏继发性KIT突变并表现出FGFR信号通路的激活)。
中山大学肿瘤医院胃肠外科
邱海波副主任医师
【简评】:
在缺乏KIT继发突变的GIST细胞出现了对伊马替尼的耐药,临床上较为少见,但也时有发生,具体机制是什么,业内比较关注,笔者也曾对这个问题进行探讨,还因此获得过一次国自然青年项目的资助和发表一篇Cancer Res的文章。现在俄罗斯课题组发现KIT基因下调和随之而来的FGFR信号通路的激活,从而使GIST对泛FGFR抑制剂表现出更高的敏感性。然而笔者也有几个疑问:(1)细胞系的可靠性:从Fig 10A来看,形态学上判断GIST T1似乎不是真正的T1细胞(T1是长梭型细胞),由其培养出来的R1和R2形态学又发生了改变,后续得出的一系列的结果和结论似乎都要打个问号。(2)KIT表达丢失:Fig 8A中R1细胞还存在着KIT的表达,但是R2已经完全不见total KIT的表达,这应该是一类KIT loss导致(该论文解释为细胞的异质性)对伊马替尼的耐药,而这种情况主要是因为IGF的异常高表达,而不是FGFR,这已经在2018年Cancer Res阐释,但该篇研究未提及IGF。总之,文章试验数据不少,但总是感觉有用的信息不太够。
2.伊马替尼通过促进STUB1介导的GPX4泛素化诱导GIST铁死亡 ★★ ★★
Imatinib induces ferroptosis in gastrointestinal stromal tumors by promoting STUB1-mediated GPX4 ubiquitination

【摘要】:
伊马替尼(Imatinib, IM)显著改善了GIST患者预后,但仍有部分患者对IM原发耐药,并且约半数患者在治疗两年内出现继发耐药,探索新的治疗策略势在必行。靶向铁死亡是一种新兴的引人瞩目的肿瘤治疗方法,但在GIST中关于铁死亡的研究较少,且其潜在机制不清。该研究中我们发现,IM可以增加GIST细胞中脂质活性氧和细胞内Fe2+水平,降低谷胱甘肽水平,这些效应可被铁死亡抑制剂ferrostatin-1部分抑制。并且,敲降STUB1和过表达GPX4可逆转IM诱导的铁死亡。此外,经过鉴定,STUB1是GPX4的一种E3泛素连接酶,可促进GPX4 K191位点的泛素化。在体内外实验中,GPX4抑制剂RSL3与IM联合可协同诱导铁死亡,从而抑制GIST增殖。此外,STUB1和GPX4表达可作为GIST的独立预后因素。总之,本研究首次证实IM通过促进STUB1介导的GPX4泛素化诱导GIST铁死亡,RSL3联合IM有望成为有前景的GIST治疗策略。
原单位:北京大学肿瘤医院;
现单位:北京大学深圳医院
高静研究员
【简评】:
不容易,中国学者在GIST基础研究领域又向前迈进了一步,并且是基于最近几年研究比较火热的铁死亡方向。众所周知,随着基础研究水平的大力提高,已证实的细胞死亡方式越来越多,从曾经大多研究围绕的细胞凋亡到如今研究很火热的细胞焦亡、细胞自噬、铁死亡、铜死亡等,基础研究的越透彻,临床转化研究的方向便越明朗,对于疾病的诊疗就越有利,因此,在如今临床试验开展如火如荼的时代,切不要忘记作为根的基础研究。该研究通过各种体外研究手段,得出的结论及调控机制简述为:IM可能通过某种机制上调STUB1表达→STUB1作为GPX4的泛素连接酶,促进GPX4 K191位点泛素化,引起GPX4降解→GPX4作为一种抗氧化酶,是铁死亡经典通路中的关键分子,负性调控铁死亡→细胞铁死亡增加→以此提出联合应用GPX4抑制剂RSL3和IM治疗GIST的可行性。对于该研究,或者说对于大部分与IM联合展示出一定体外治疗前景的研究来讲,可能我们都会考虑的问题是,在IM单药占据GIST治疗核心地位的时代,业内有多大的勇气在患者中开展联合用药方案的研究?尤其对于那些对IM治疗敏感的一线患者,联合的可能性更少。当然对于IM耐药的患者,或许会有机会,但该研究用的模型均是IM敏感细胞,并未在IM耐药模型中探索,或许也是该研究的一点缺陷,也可能是团队未来继续深入探索的方向,毕竟作者是基于“很多患者对IM原发或继发耐药,新型治疗策略探索是必要”这一问题为引子。
3.FBXW7通过靶向MCL1调节伊马替尼对胃肠间质瘤的敏感性★★★★
FBXW7 regulates the sensitivity of imatinib in gastrointestinal stromal tumors by targeting MCL1

【摘要】:
伊马替尼的使用能够改善晚期或不可切除的胃肠道间质瘤的预后,但由于耐药性和药物的毒性,其治疗效果受到限制,因此迫切需要探索伊马替尼疗效预测标志物,从而进一步推动患者治疗获益。在这项研究中,研究者开展了体内外实验,证明了FBXW7-MCL1调控轴与伊马替尼治疗耐药之间的关联,并在140名高危GIST患者中检测了FBXW7作为伊马替尼治疗效果预测标志物的效价。研究者通过开展5年无复发生存(RFS)率分析和多因素分析确定了FBXW7预测高危伊马替尼辅助治疗GIST患者效果的能力。在GIST-T1细胞中,FBXW7通过调控凋亡影响伊马替尼的敏感性,FBXW7下调MCL1表达,后者抑制GIST-T1细胞凋亡,由此预测了伊马替尼治疗的效果。
北京大学肿瘤医院
消化肿瘤内科 章程副研究员
【简评】:
FBXW7属于F-box蛋白家族成员,属于Skp1-Cullin-F-box(SCF)泛素连接酶复合物的一个组成部分,其F-box结构域与Skp1结合、促进对底物的识别,从而起到泛素连接酶的作用,负责对特定蛋白质的泛素化标记和蛋白酶体途径降解。作为泛素连接酶,FBXW7靶向调控多种重要蛋白的泛素化降解,包括c-Myc、Cyclin E、Notch和c-Jun等关键的原癌基因和细胞周期调控蛋白,由此维持细胞的正常功能、避免异常增殖。因此FBXW7被认为是重要的抑癌基因,也是最常发生突变的肿瘤抑制因子之一,其变异或缺失已被报道与对多种抗肿瘤疗法的耐药有关,但目前FBXW7对胃肠间质瘤伊马替尼耐药的影响和具体的机制仍然有待研究探索。本研究选用了较大队列的患者进行检测,并通过实验发现了FBXW7能够下调MCL1的表达,而敲低MCL1引起了GIST细胞凋亡和伊马替尼敏感性降低,提出了FBXW7这一常见抑癌基因与胃肠间质瘤的初步关联。
但本工作存在较多缺陷。首先,研究指出FBXW7和MCL1与伊马替尼对GIST的敏感性有关,但并未指明是否与伊马替尼获得性耐药有关联。其次,对EBXW7是否通过MCL1执行抑癌功能的探索过于简单,仅证实了FBXW7下调MCL1的蛋白表达水平,并未证明FBXW7是否通过其泛素连接酶功能执行对MCL1的泛素化来引起MCL1蛋白水平改变,也缺乏MCL1相关逆转实验的证明、以及对MCL1进行抑制的动物水平实验,机制方面证据不够充分。此外,整个工作中只使用了GIST-T1这一种肿瘤细胞系来进行细胞和CDX动物实验,过于简单,缺乏更多细胞系乃至PDO/PDX模型的证据,因而暂不足以对未来GIST治疗手段的改进提供指导。
综上,本文指出了FBXW7及MCL1与胃肠间质瘤伊马替尼疗效的关联,具有一定的创新性。但该现象具体的功能、机制和临床意义尚未充分探讨,还有待更多深入的研究加以证实。

影像版块

1.常规CT征象及直方图纹理分析参数联合作为影像学生物标志物术前预测胃部高风险GIST★★ ★★
Possibility of Using Conventional Computed Tomography Features and Histogram Texture Analysis Parameters as Imaging Biomarkers for Preoperative Prediction of High-Risk Gastrointestinal Stromal Tumors of the Stomach

【概述】:
胃肠间质瘤是最常见的间叶源性肿瘤,可能具有恶性特征。通过切除肿瘤的病理学和免疫组化分析可获得确切诊断。术前通过无创性影像学手段对转移风险的术前分层,对于筛选高风险患者及新辅助靶向治疗的选择有重要意义。新辅助治疗可以缩小肿瘤,避免多器官切除,及降低肿瘤破裂的风险;还可以通过优化手术切除和疾病的系统控制,提供更好的长期预后,包括提高总生存率。通过CT检查获得的肿瘤形态特征以及肿瘤组织纹理分析的直方图参数评估可以提高术前对GIST转移风险的预测。纹理分析是影像组学领域不断发展的一部分,迄今已对肿瘤学做出了重要贡献。
【摘要】:
背景:本研究目标是确定肿瘤的CT形态学特征和纹理分析参数,探索其作为术前预测高危胃肠间质瘤(HR GIST)的有效诊断工具。
方法:前瞻性队列研究,纳入2019年至2022年间79名接受CT检查、纹理分析、GIST病变切除以及病理组织学和免疫组化分析的患者。
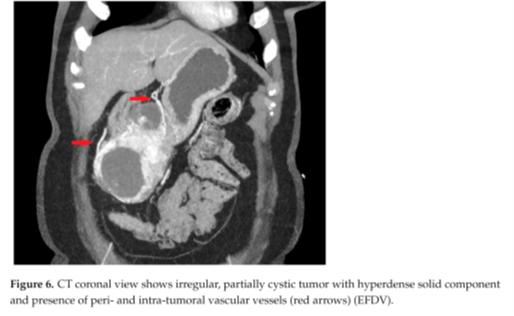
结果:纹理分析特征发现min norm(p = 0.032)作为直方图参数,在高危和低危GIST之间存在显著差异,而min norm(p = 0.007)、偏度(p = 0.035)和峰度(p = 0.003)在高分级和低分级肿瘤之间显示出显著差异。单因素分析确定肿瘤直径、边缘外观、生长模式、病变形状、结构、黏膜连续性、瘤周/瘤内的滋养/引流血管扩张(EFDV)以及max norm可作为高危 GIST的重要预测因子。多变量回归分析显示,黏膜中断(p < 0.001)和存在EFDV(p < 0.001)是高风险GIST的独立预测因素,AUC为0.878(CI:0.797-0.959),敏感性94%,特异性77%,准确率为88%。
结论:结果表明, CT形态学特征在GIST术前无创性转移风险预测中具有重要意义。将纹理分析纳入传统成像可能进一步改善术前风险分层评估。
北京大学肿瘤医院
医学 影像科 唐磊教授
【简评】:
一篇GIST风险度影像评估的研究,看似联合影像组学和常规CT征象特征,但实际纹理特征部分只纳入了以直方图分布为主的简单一阶纹理特征(最大值,最小值,均值,峰度,偏度等),通过单因素和多因素层层分析,最后独立预测因素只留下了黏膜连续性和瘤周/瘤内的滋养/引流血管扩张(EFDV)两个传统形态学特征,这两个特征也是目前研究较多的主观影像征象,尤其肿瘤相关血管征象,经历了从新生血管(angiogenesis 2017),到血管增粗(enlarged vessels 2019),再到EVFDM、EFDV、AVT等众多称谓的演变;征象特征也越来越细分,从综合评估到区分瘤内、瘤周血管,发现瘤内血管对风险度预测能力更强(参见今年9月份月评推介文章),为GIST风险度影像学评价征象不断添砖加瓦。希望未来更多高质量研究关注这一领域,早日构建出广泛认可和采用的、能够真正落地指导临床应用的评估模型。
下为文章给出的EFDV阳性征象病例图:

药物版块

1.匹米替比治疗晚期胃肠间质瘤和其他肿瘤 ★★ ★★
Pimitespib for the treatment of advanced gastrointestinal stromal tumors and other tumors
【摘要】:
匹米替比(Pimitespib, TAS-116)是日本批准上市的第一款热休克蛋白90(HSP90)抑制剂,适用于治疗伊马替尼、舒尼替尼和瑞戈非尼治疗后进展的胃肠间质瘤(GIST)。这篇综述介绍了匹米替比的临床前和临床研究,包括其作用机制、药代动力学、临床抗肿瘤活性和安全性。在一项III期研究中,与安慰剂相比,匹米替比显著延长了无进展生存期(中位2.8个月vs 1.4个月;危险比0.51;95%CI 0.30-0.87;p=0.006)。常见的治疗相关不良事件包括腹泻、食欲下降、血清肌酐升高、虚弱、恶心和眼部疾病。匹米替比在其他肿瘤类型以及与其他抗癌疗法联合使用的疗效和安全性正在研究中。
上海交通大学医学院附属
仁济医院胃肠外科 汪明教授
【简评】:
首先,先搬运一下作者自己用简明的语言归纳的摘要:
这篇文章是关于什么的?这篇文章提供了关于匹米替比的信息,匹米替比是一种最近在日本上市的用于治疗晚期GIST的药物。GIST是一种在胃肠道发现的恶性肿瘤,那些被认为“晚期”的GIST已经停止了对其他治疗的反应,并扩散到了身体的其他部位。
研究显示了什么?匹米替比的作用方式不同于其他治疗癌症的药物——它抑制一种叫做热休克蛋白90的蛋白质,从而阻止癌症细胞的发育和生长。匹米替比是一种口服药物。对日本晚期GIST患者的研究表明,与未接受药物治疗的患者相比,接受匹米替比治疗的患者疾病进展所需的时间和存活时间都有所增加。这些研究还发现,尽管腹泻发生率高,但匹米替比治疗一般无严重副作用。一些患者出现了眼部疾病,但可以通过中断或停止匹米替布治疗来控制。匹米替比也正在被研究单独使用或与其他抗癌药物联合使用用于治疗其他癌症。
从这些研究中可以得出什么结论?目前可用于晚期GIST患者的治疗方法很少,因此,匹米替比是日本此类患者的一个重要新选择。如果正在进行的研究取得阳性结果,匹米替比可能在未来成为更广泛的癌症患者的治疗选择。
其次,谈谈我对这个药物的看法:
一个月前,我有幸参加了匹米替比(商品名Jeselhy)在博鳌乐城海南瑞金医院的落地仪式,也借此机会了解了该药物的相关研究数据及研究进展,结合本篇综述,我认为这个药物的问世应该是重度TKI治疗患者的一个福音。匹米替比获批其治疗GIST的适应症(虽然目前仅局限在日本)是GIST药物治疗史一件里程碑式的事件,之前所有获批的药物都是靶向KIT/PDGFRA的TKI药物,而匹米替比这种HSP90抑制剂是唯一的一个非TKI药物,这种新疗法的出现可能对于未来GIST药物治疗格局产生深远的影响。目前TKI治疗GIST的难点和痛点包括野生型的耐药、广泛继发突变导致的耐药以及继发突变不明确的耐药等,从匹米替比在I期、II期和III期研究中的一些表现可以让我们看到在这些方面有突破的希望:比如I期研究中I期研究中1例野生型患者获得PR,II期研究中BRAF突变GIST获得10个月的SD,III期研究中药物基因组学分析发现匹米替比的疗效与KIT突变状态无关。但是另一方面,靶向KIT/PDGFRA的TKI在GIST治疗中的地位是不容置疑,因此抛开TKI的匹米替比单药治疗晚期GIST的疗效注定有其局限性,虽然III期RCT研究取得的阳性结果可以确立匹米替比单药治疗在日本获得四线治疗适应症,但是不得不说2.8个月对照安慰剂的1.4个月的PFS获益远远逊色于瑞派替尼的6.3个月对照安慰剂的1.0个月。如何突破疗效的瓶颈?出路必然是联合治疗。作者在本综述中一笔带过的一项研究CHAPTER-GIST-101 study (NCT05245968)其实非常值得我们关注,这是一项旨在探索匹米替比联合伊马替尼治疗伊马替尼难治性GIST的I期研究,今年的ESMO上曾公布该研究的部分初步数据,12例患者中的7例(58.3%)疾病稳定超过6个月,ORR率8.3%,DCR率91.7%,疗效数据及安全性数据均优于标准的二线治疗舒尼替尼的历史数据。目前该研究已进入剂量拓展阶段正开展全球招募,期待该研究能够早日取得阳性结果,并开展后续的III期RCT研究。目前,匹米替比正在多个瘤种(包括实体肿瘤和血液系统肿瘤)中开展单药和联合治疗的临床研究,其中值得关注的是匹米替比联合免疫检查点抑制剂治疗可能发挥协同增效的效果。有理由相信,匹米替比给GIST药物治疗领域所带来的应该远远不止是一个PFS 2.8个月的四线药物,而是带来一种新的治疗理念和模式,在这种新的模式下有非常多的新的疗法值得探索:匹米替比+伊马替尼、匹米替比+舒尼替尼、匹米替比+瑞戈非尼、匹米替比+瑞派替尼、匹米替比+阿伐替尼、匹米替比+TKI+免疫检查点抑制剂。。。。。。未来可期!
1. Drugs Aging. 2023 Dec 20.
doi: 10.1007/s40266-023-01084-8. Online ahead of print.
Individualized Dosing Patterns in the Treatment of Older Patients with Gastrointestinal Stromal Tumors: Results of a Registry-Based Observational National Cohort Study Including 871 Patients
Roos F Bleckman, K Esther Broekman, Evelyne Roets, et al.
University of Groningen, University Medical Center Groningen, Groningen, The Netherlands. r.f.bleckman@umcg.nl.
2. Hosp Pract (1995). 2023 Dec 19:1-13.
doi: 10.1080/21548331.2023.2277682. Online ahead of print.
Gastrointestinal stromal tumor in North Africa and the middle east: updates in presentation and management from an 11-year retrospective cohort
Fadi Farhat, Marwa Hussein, Eman Sbaity, et al.
Department of Onco-Hematology, Mount Lebanon Hospital University Medical Center, Balamand University, Beirut, Hazmieh, Lebanon.
3. Surg Endosc. 2023 Dec 18.
doi: 10.1007/s00464-023-10583-z. Online ahead of print.
Single-port intragastric wedge resection using the tunnel method: a novel surgical approach for treating endophytic gastric subepithelial tumors
Eunju Lee, Donghyun Lim, So Hyun Kang, et al.
Department of Surgery, Chung-Ang University Gwangmyeong Hospital, Gwangmyeong, Republic of Korea.
4. Onco Targets Ther. 2023 Dec 12:16:1043-1049.
doi: 10.2147/OTT.S444532. eCollection 2023.
Epithelioid Subtype Gastrointestinal Stromal Tumors of Stomach in an Endoscopic Biopsy: A Potential Diagnostic Pitfall
Wenfeng Xu, Hao Tang, Ying Chen, et al.
Department of Pathology, Guiqian International General Hospital, Guiyang City, Guizhou Province, People's Republic of China.
5. Clin Transl Oncol. 2023 Dec 16.
doi: 10.1007/s12094-023-03354-8. Online ahead of print.
MicroRNA-128 acts as a suppressor in the progression of gastrointestinal stromal tumor by targeting B-lymphoma Mo-MLV insertion region 1
Jinbao Wu, Changjuan Wang, Xia Cui, et al.
Inner Mongolia Institute of Digestive Diseases, The Second Affiliated Hospital of Baotou Medical College, Inner Mongolia University of Science and Technology, No. 30, Hudemulin Street, Qingshan District, Baotou, 014030, Inner Mongolia Autonomous Region, People's Republic of China.
6. Cancer Imaging. 2023 Dec 15;23(1):122.
doi: 10.1186/s40644-023-00646-8.
Comparing endoscopic ultrasonography and double contrast-enhanced ultrasonography in the preoperative diagnosis of gastric stromal tumor
Huiliao He, Tingting Tang, Xiaohua Wang, et al.
Department of Ultrasound, The Second Affiliated Hospital and Yuying Children's Hospital of Wenzhou Medical University, No. 109 West Xueyuan Road, Wenzhou, Zhejiang, 325027, China.
7. Cureus. 2023 Nov 14;15(11):e48773.
doi: 10.7759/cureus.48773. eCollection 2023 Nov.
Giant Exophytic Gastrointestinal Stromal Tumor (GIST) Arising From the Antral Stomach: A Surgical Case Report
Simran Chauhan, Raju K Shinde, Yashraj Jain
General Surgery, Jawaharlal Nehru Medical College, Datta Meghe Institute of Higher Education and Research, Wardha, IND.
8. J Med Case Rep. 2023 Dec 15;17(1):546.
doi: 10.1186/s13256-023-04262-9.
Multifocal gastrointestinal stromal tumor with osseous metaplasia: a case report
Maryam Abdullah Al Saleem, Nida Mirzaman Khan, Tarek Mohammad ElSharkawy
Department of Pathology, King Fahd Hospital of University, College of Medicine, Imam Abdulrahman Bin Faisal University, Khobar, Saudi Arabia. masaleem@iau.edu.sa.
9. Surgery. 2023 Dec 13:S0039-6060(23)00804-8.
doi: 10.1016/j.surg.2023.10.009. Online ahead of print.
Utility and costs of surveillance imaging for low- and very low-risk gastrointestinal stromal tumors
Mariam Khan, Caitlin Urban, Austin Vanwyk, et al.
General Surgery Residency, Corewell Health - Grand Rapids/Michigan State University, Grand Rapids, MI. Electronic address: mariam.khan@corewellhealth.org.
10. Int J Surg Case Rep. 2023 Dec 11:114:109142.
doi: 10.1016/j.ijscr.2023.109142. Online ahead of print.
A giant gastrointestinal stromal tumor revealed by a life-threatening hematemesis: A case report of a rare entity and a challenging management
Anis Hasnaoui, Racem Trigui, Mohamed Ben Hassine, et al.
Department of General Surgery, Menzel Bourguiba Hospital, Rue Djebel Lakhdar, 1006 Tunis, Tunisia; Faculty of Medicine of Tunis, Tunis El Manar University, Tunisia.
11. Langenbecks Arch Surg. 2023 Dec 13;409(1):3.
doi: 10.1007/s00423-023-03203-w.
Classification of GIST and other benign gastric tumors based on minimally invasive surgical strategy
Salvador Morales-Conde, María Socas, Isaias Alarcón, et al.
Unit of Innovation in Minimally Invasive Surgery, Department of General and Digestive Surgery, University Hospital "Virgen del Rocio", Seville, Spain.
12. Int J Surg Case Rep. 2023 Dec 11:114:109155.
doi: 10.1016/j.ijscr.2023.109155. Online ahead of print.
Surgical management of a locally advanced jejunal stromal tumor: A case report of a challenging condition
Anis Hasnaoui, Racem Trigui, Nizar Khedhiri, et al.
Faculty of Medicine of Tunis, Tunis El Manar University, Rue Djebal Lakhdar, 1006 Tunis, Tunisia; Department of General Surgery, Menzel Bourguiba Hospital, Tunisia. Electronic address: anis.hasnaoui@fmt.utm.tn.
13. Case Rep Gastroenterol. 2023 Dec 8;17(1):356-361.
doi: 10.1159/000534643. eCollection 2023 Jan-Dec.
Gastric Glomus Tumors: The Roles of Endoscopic Ultrasound and Shared Decision-Making
Alexander Malik, Muhammad Nadeem Yousaf, Sami Samiullah, et al.
Department of Medicine, Summa Health System, Akron, OH, USA.
World J Clin Cases. 2023 Nov 6;11(31):7629-7634.
doi: 10.12998/wjcc.v11.i31.7629.
Sunitinib-induced hyperammonemic encephalopathy in metastatic gastrointestinal stromal tumors: A case report
Takaoki Hayakawa, Shinsuke Funakoshi, Yasuo Hamamoto, et al.
Department of Internal Medicine, Division of Gastroenterology and Hepatology, Keio University School of Medicine, Shinjuku-ku 160-8582, Tokyo, Japan.
14. ACG Case Rep J. 2023 Dec 4;10(12):e01219.
doi: 10.14309/crj.0000000000001219. eCollection 2023 Dec.
Asymptomatic Duodenal Gastrointestinal Stromal Tumor Abscess
Muhammed Yaman Swied, Yahia Al Turk, Abdul Swied, et al.
Alfaisal University, Riyadh, Saudi Arabia.
15. BMJ Case Rep. 2023 Nov 30;16(11):e256244.
doi: 10.1136/bcr-2023-256244.
Gastrointestinal stromal tumour: presenting as an ovarian cystadenoma
Sneha Jawalkar, Rachana Karajagi, Surekha Ulhas Arakeri
Pathology, BLDE(Deemed to be University) Shri B M Patil Medical college, Hospital and Research centre, Vijayapura, Karnataka, India sneha.jawalkar@bldedu.ac.in.
16. Sensors (Basel). 2023 Dec 9;23(24):9723.
doi: 10.3390/s23249723.
A Small Intestinal Stromal Tumor Detection Method Based on an Attention Balance Feature Pyramid
Fei Xie, Jianguo Ju, Tongtong Zhang, et al.
Xi'an Key Laboratory of Human-Machine Integration and Control Technology for Intelligent Rehabilitation, Xijing University, Xi'an 710123, China.
17. Cir Esp (Engl Ed). 2023 Dec 20:S2173-5077(23)00252-1.
doi: 10.1016/j.cireng.2023.11.014. Online ahead of print.
Characteristics of gastrointestinal stromal tumors associated to other tumors: Características de los tumores del estroma gastrointestinal asociados a otras neoplasias
Roberto Martí-Obiol, Rosa Martí-Fernández, Maria Carmen Fernández-Moreno, et al.
Upper Gastrointestinal Surgery Unit, Hospital Clínico Universitario, Valencia, Spain.
18. Endoscopy. 2023 Dec;55(S 01):E1262-E1263.
doi: 10.1055/a-2218-2416. Epub 2023 Dec 21.
Omental patch-assisted endoscopic closure of the transmural defect after endoscopic removal of a 40-mm gastric gastrointestinal stromal tumor
Renato Medas, Julia L Gauci, Clarence Kerrison, et al.
Department of Gastroenterology and Hepatology, Westmead Hospital, Westmead, Australia.
19. Cureus. 2023 Nov 27;15(11):e49469.
doi: 10.7759/cureus.49469. eCollection 2023 Nov.
Gastrointestinal Stromal Tumor: A Clinicopathological Study and Management
Aditya Patil, Shriya Haval, Prabhat Nichkaode, et al.
General Surgery, Dr. DY Patil Vidyapeeth, Pune, IND.
20. Front Oncol. 2023 Nov 9:13:1260706.
doi: 10.3389/fonc.2023.1260706. eCollection 2023.
A novel TP53 mutation in a patient with quadruple wild-type gastrointestinal stromal tumor
Yuhong Chen, Junyong Chen, Liansheng Long, et al.
Department of General Surgery, the General Hospital of Southern Theater Command, People's Liberation Army (PLA), Guangzhou, China.
21. Cureus. 2023 Oct 24;15(10):e47562.
doi: 10.7759/cureus.47562. eCollection 2023 Oct.
A Case Report of an Unusual Presentation of a Pedunculated Gastrointestinal Stromal Tumor: Acute Upper Gastrointestinal Bleeding in a 57-Year-Old Female
Atheer Almutairi, Alanoud Almuhana, Rahaf Alanazi, et al.
College of Medicine, King Saud Bin Abdulaziz University for Health Sciences, Riyadh, SAU.
22. Cureus. 2023 Oct 20;15(10):e47398.
doi: 10.7759/cureus.47398. eCollection 2023 Oct.
Is Bleeding Gastrointestinal Stromal Tumor Associated With Higher Mortality and Morbidity?
Rema Alrashed, Hussam AlHarbi, Bandar Ali, et al.
Department of Surgery, Prince Sultan Military Medical City, Riyadh, SAU.
23. R I Med J (2013). 2023 Dec 1;106(11):52-53.
Large Gastrointestinal Stromal Tumor Presenting as Vascular Insufficiency
Vijairam Selvaraj
Division of Hospital Medicine, Miriam Hospital, Providence, RI; Department of Medicine, Warren Alpert Medical School of Brown University, Providence, RI.
24. Abdom Radiol (NY). 2023 Nov 25.
doi: 10.1007/s00261-023-04093-8. Online ahead of print.
Predicting the progression-free survival of gastrointestinal stromal tumors after imatinib therapy through multi-sequence magnetic resonance imaging
Linsha Yang, Duo Zhang, Tao Zheng, et al.
Department of Medical Imaging, The First Hospital of Qinhuangdao, Qinhuangdao, People's Republic of China.
25. Pharmaceuticals (Basel). 2023 Nov 16;16(11):1618.
doi: 10.3390/ph16111618.
Esterase-Responsive Polyglycerol-Based Nanogels for Intracellular Drug Delivery in Rare Gastrointestinal Stromal Tumors
Sebastian Schötz, Adele K Griepe, Björn B Goerisch, et al.
Institute of Chemistry and Biochemistry, Freie Universität Berlin, Takustr, 3, 14195 Berlin, Germany.
排版编辑:肿瘤资讯-Bree




















 苏公网安备32059002004080号
苏公网安备32059002004080号


