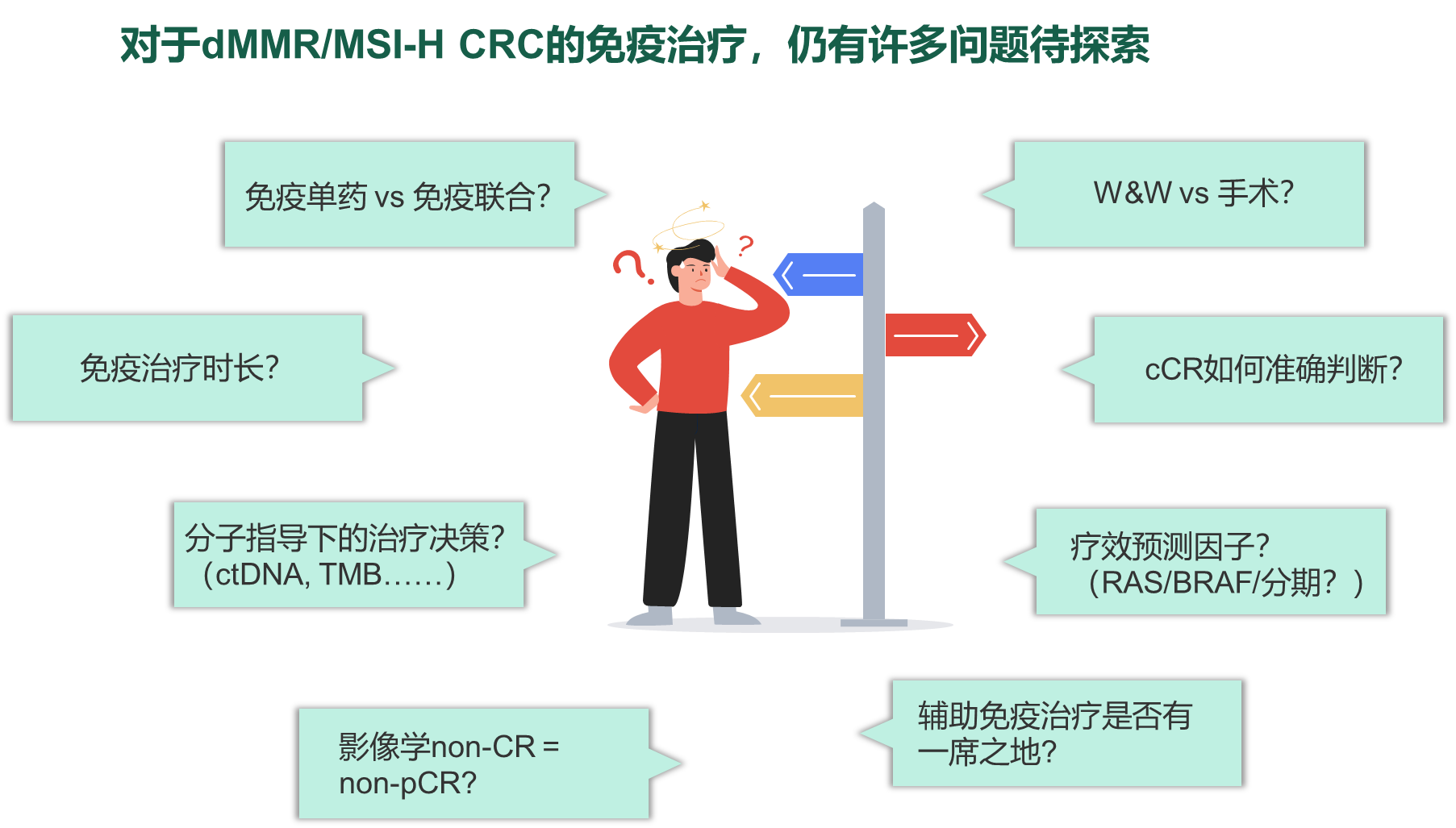
免疫治疗是近年来在结直肠癌(CRC)领域研究的热点之一。错配修复缺陷(dMMR)/微卫星高度不稳定(MSI-H)肿瘤具有免疫原性高、肿瘤微环境淋巴细胞浸润丰富、预后好和对常规放化疗不敏感等特点,是免疫治疗的主要获益人群。本届欧洲肿瘤内科学会(ESMO)年会中,MSI-H/dMMR转移性结直肠癌(mCRC)免疫治疗里程碑式研究KEYNOTE-177研究的五年随访数据重磅公布,【肿瘤资讯】非常荣幸地邀请到了两位在肿瘤领域有着丰富经验和深厚造诣的专家,他们是北京大学肿瘤医院消化肿瘤内科的李健教授和中山大学肿瘤防治中心结直肠科的丁培荣教授,做客“GI有约”栏目,为我们解读KEYNOTE-177的五年随访数据,并分享他们的见解和观点。
北京大学肿瘤医院消化肿瘤内科行政副主任、GCP中心副主任
主要学术方向:基因分型指导下的消化道肿瘤个体化药物治疗与多学科治疗、责任作者或第一作者发表科研论著30余篇,参编医学专著10本
中国临床肿瘤学会大肠癌专委会常委
中国抗癌协会大肠癌专业委员会委员兼青委副主委
中国医师协会外科分会结直肠肝转移学组副主委
中国医师协会外科分会MDT专委会常委兼青委主委
中国医师协会外科分会胃肠间质瘤专委会副主任委员
中国抗癌协会肿瘤药物临床研究专委会常委兼副秘书长
中国抗癌协会胃肠间质瘤专委会常委兼副秘书长
中国抗癌协会青年理事会常务理事
中国临床肿瘤学会胃肠间质瘤专委会委员
中国医促会软组织肿瘤专委会副主任委员
《中华结直肠疾病杂志电子版》编委
《中华临床医师杂志》编委
《中国医学前沿杂志》编委
《肿瘤临床与研究》编委
中山大学附属肿瘤医院结直肠科副主任
结直肠科黄埔病区区长
广东省杰出青年医学人才(首批)
中国抗癌协会家族遗传性肿瘤专业委员会副主任委员
中国临床肿瘤学会(CSCO)青年专家委员会副主任委员
广东省抗癌协会遗传性肿瘤专业委员会主任委员
广东省医学会胃肠外科学分会副主任委员
中国医师协会结直肠遗传专委会副主任委员
中国医师学会外科医师分会MDT专业委员会青委会副主任委员
广东省抗癌协会大肠癌专业委员会青委会副主任委员
美国纪念斯隆凯特林癌症中心(MSKCC)访问学者
Fellow of American College of Surgeons
KEYNOTE-177研究5年随访数据更新概述
KEYNOTE-177研究是一项国际多中心、随机开放标签Ⅲ期研究,旨在评估帕博利珠单抗对比研究者选择的化疗方案在既往未经治MSI-H/dMMR mCRC中的疗效,研究纳入≥18岁、晚期MSI-H/dMMR结直肠癌患者,按照1:1随机分配至帕博利珠单抗组(200mg Q3W)或研究者选择的mFOLFOX6或FOLFIRI±贝伐珠单抗或西妥昔单抗。化疗组的患者在疾病进展后可交叉到帕博利珠单抗组治疗。主要终点是盲态独立中心(BICR)基于RECIST v1.1评估的无进展生存期(PFS)和总生存期(OS)。次要终点是BICR基于RECIST v1.1评估的客观缓解率(ORR)和安全性。既往数据显示[1-2],帕博利珠单抗一线治疗MSI-H/dMMR mCRC患者可以显著提升ORR、PFS,且具有OS的改善趋势,是帕博利珠单抗用于这类患者一线治疗的证据支持。
本届ESMO年会中更新了KEYNOTE-177研究的5年随访结果[3],中位随访时间达到73.3个月。数据截止时,帕博利珠单抗组有153例、化疗组有154例患者。
组间停止治疗情况:
帕博利珠单抗组有61.4%(94例)的患者停止治疗,化疗组所有患者停止治疗,多由疾病进展(PD)导致,分别是32.7%和60.8%。
组间交叉治疗情况:
化疗组中37%(57例)的患者符合交叉治疗标准并接受帕博利珠单抗治疗,36.8%(21例)的患者完成了35个周期的帕博利珠单抗治疗,另外25.3%(39例)接受化疗的患者接受了方案外的PD-1/L1抑制剂交叉治疗,两组间的有效治疗交叉率达62%。
帕博利珠单抗组 vs 化疗组疗效数据:
mOS分别为77.5个月和36.7个月(HR=0.73),5年OS率达54.8%;
mPFS分别是16.5个月和8.2个月(HR=0.6),帕博利珠单抗组的5年PFS率是化疗组的近5倍(34% vs 7.6%);
mDOR分别是75.4个月和10.6个月,DOR≥24个月的患者分别达到85.7% 和33.6%。
帕博利珠单抗组 vs 化疗组安全性表现:
帕博利珠单抗组治疗相关不良反应的发生率为79.7%,而化疗组为98.6%,3-5级TRAE的发生率分别为21.6%和67.1%。
内科角度解读KEYNOT-177更新:从远期生存获益到临床治愈
点击观看李健教授完整采访视频
Q1.如何解读在今年ESMO年会上更新发布KEYNOTE-177研究的五年的随访数据?
李健教授:KEYNOTE-177研究是肠癌医生特别关注的一项临床研究,是肠癌一线免疫治疗的重要依据,也是指导临床试验的重要参考。免疫治疗的长生存获益是肿瘤治疗的革命性变化,也是临床治疗中关注的核心。
本次ESMO年会的长期随访数据让我们看到了帕博利珠单抗对于远期生存的改善,给了临床医生更多的信心。免疫治疗组的mOS高于化疗组一倍多(77.5个月vs 36.7个月),5年OS率高达54.8%,降低了27%的死亡风险,尤其是PFS的改善非常明显,免疫治疗组的5年PFS率是化疗组的5倍。KEYNOTE-177此次更新数据再次验证了帕博利珠单抗方案带来的远期生存获益。
此外,如何鉴别免疫治疗的优势人群是临床医生同样关注的。对于免疫治疗有效的患者再进一步观察是否能长期获益,或提出更高的要求即免疫治疗是否能带来治愈。这可通过mDOR来观察,即免疫治疗一旦起效,能持续多久?如果缓解非常持久,可能意味着给患者带来较好的生存,甚至治愈。KEYNOTE-177研究中帕博利珠单抗组的mDOR高达75.4个月,而化疗仅10.6个月,因此更加期待免疫治疗的“长拖尾效应”实现患者临床治愈。整体上,KEYNOTE-177研究5年长期数据,符合人们对免疫治疗对MSI-H肿瘤治疗的预期。
Q2. 从内科医生的角度,这种长期生存随访的结果对于肿瘤患者临床治疗有何提示意义?
李健教授:从内科医生角度,通过药物治疗实现患者治愈是一直追求的目标。对于肿瘤的药物治疗,评价一个药物最核心的指标是OS,因此OS是临床试验的金标准。一旦患者实现长期生存,取得较好的OS,某种程度上对于评价治疗方案和优化全程管理,以及评估后续治疗情况,都具有重要意义。而随访时间的延长也将有利于获得更为稳健、成熟、准确的研究数据,不仅能为临床决策提供依据,也对临床试验解读和后续设计具有重要意义。KEYNOTE-177研究5年随访数据不仅体现了OS作为肿瘤治疗目标的金标准价值,OS的延长也凸显了免疫治疗的“长拖尾效应”,相信随访时间的进一步延长,随访7年、10年时,可能有大部分患者得益于“长拖尾效应”并保持长期生存状态,达到真正的疾病治愈。
相似的,CheckMate-142研究4年随访结果报告显示截至随访时间(中位随访50.9个月),中位PFS和中位OS均未达到(mPFS:95%CI 38.4个月-NR;mOS:95%CI NR-NR)[4],同样证实了纳武利尤单抗联合伊匹木单抗在既往接受过治疗的MSI-H肠癌患者中的长期益处。这些长期随访数据的生成给了我们内科医生治疗的信心,同时也重拾了MSI-H肠癌患者获得长生存的信心。
Q3. KEYNOTE-177研究中部分患者因PD导致停止治疗,这对mCRC的一线治疗带来哪些启示?
李健教授:在临床研究中,持续地在组内接受治疗意味着患者在持续获益,而肿瘤进展是常见的出组原因。从KEYNOTE-177研究此次更新数据看,化疗组患者全部出组,也就是终止了一线治疗,而免疫治疗组中仍有近40%的患者仍在接受治疗,说明试验组仍有部分患者仍能从免疫一线治疗中持续获益。
同时从另一个角度考虑,前期肿瘤免疫治疗缓解或不缓解都可以作为治疗人群筛选。若基于前几个月的抗肿瘤情况,有效筛选出获益于免疫治疗的部分人群,则该人群的疗效应答是持久的。而对于无效的人群,分析其治疗无效的原因也同样具有重要意义。研究更新中的PFS的Kaplan-Meier曲线呈现为最初有交叉,然后分离平稳过渡,最后呈现平尾。而两组间前期的曲线交叉,可能提示MSI-H人群原发耐药、假进展、瘤内异质性与不准确的MSI检测等因素的存在。同样我们在临床实践中也曾遇到部分经确认的MSI-H患者对免疫治疗原发耐药的情况,我们也期待早日找到原发耐药基因,更好地指导治疗。与此同时,区分免疫治疗长期治疗获益的继发性耐药患者,继发耐药后治疗策略制定,以及后续的长期随访都是临床医生需要关注的。
Q4. 对于MSI-H/dMMR mCRC患者,一线免疫单药疗法存在哪些问题?有哪些方向值得探索?
李健教授:我们看到部分患者对免疫单药治疗反应不佳,可能说明对于该类患者,免疫治疗可能需要采取联合治疗策略来改善疗效,包括双免联合,联合抗血管生成药物、肿瘤疫苗、溶瘤病毒,以及免疫调节剂等,目前北京大学肿瘤医院也正在进行相关研究。结合北肿的经验,对于免疫单药治疗无效的患者,不建议直接改为传统化疗,建议以免疫治疗为主的联合治疗。整体上,对于MSI-H mCRC患者,免疫治疗仍是主要治疗策略。
此外,临床上的免疫治疗中常会出现“假进展”,即患者前期治疗中,使用免疫治疗后短期内症状加重,影像学显示肿瘤病灶进展,但继续用药后病灶又出现明显缓解。临床医生在实施免疫治疗过程中应甄别假进展的出现,如果免疫单药治疗后出现肿瘤进展,则应在谨慎分析后选择后续治疗方案。
从外科角度解读KEYNOT-177更新:从高pCR到新辅助免疫的器官保留
点击观看丁培荣教授完整采访视频
Q1. 作为外科医生,您如何看待KEYNOTE-177研究5年长生存数据中高ORR(43.8%)和长DoR(6.3年)对外科的影响?
丁培荣教授:KEYNOTE-177此次更新的数据非常激动人心,同时也对外科医生提出更高的要求。首先可以看到,接受帕博利珠单抗治疗的人群中有一半以上可以实现长生存,甚至达到治愈,由此可见尽早及时识别出帕博利珠单抗治疗的优势人群,即dMMR/MSI-H状态,非常重要。
与此同时,治疗过程中如何为患者保驾护航使其能更为平稳地接受非常有效的疗法,是外科医生着重关注的。如果患者在外科治疗过程中发生各种并发症,势必会影响患者接受免疫治疗的及时性,从而错失获得治愈的机会。
再者,如何为患者及时地提供外科干预的机会使患者获得无瘤状态(NED),是外科医生需要鉴别的。既往在化疗和靶向治疗时代,晚期病人只要得到有效控制即可行外科手术转化且争取NED状态,有望获得比较好的生存期。但免疫治疗时代,对MSI-H这类免疫治疗高度敏感的患者,部分患者可能获得病理完全缓解(pCR)从而没必要进行手术,就需要外科医生准确筛选出需要手术的患者。来自MD Anderson癌症中心的一项研究中也能带给我们一些启示:Kaysia Ludford et al[5]报告了14例MSI-H/dMMR mCRC在接受一线免疫治疗后进行了手术,尽管其中12例患者的术前影像显示存在残留肿瘤,但13例患者的切除标本显示出病理完全缓解(pCR)。中位随访时间为 9 个月,没有患者出现疾病复发或进展。不过临床实践中的免疫治疗后转化手术的pCR率似乎并没有这么高,pCR率可能与转移灶的病理类型、转移部位等有关,当然这还需要更大样本量数据来验证。
Q2. 请您结合相关研究谈谈免疫检查点抑制剂(ICIs)在早期结直肠癌患者的新辅助治疗的应用前景和探索方向?
丁培荣教授:随着ICIs在MSI-H/dMMR mCRC中实现突破,其在早期结直肠癌患者的新辅助治疗应用已成为国际肠癌领域内最为热门的话题之一。既往多项Ⅱ期研究[6-10]已显示出早中期dMMR CRC患者接受新辅助免疫治疗可获得显著缓解,近100%的肿瘤病理退缩和60%~70%的pCR率。MSKCC研究[11]则进一步告诉我们MSI-H直肠癌接受新辅助免疫治疗并获得临床完全缓解(cCR)后采取观察等待(W&W)策略是安全可行的。我们针对24例MSI-H直肠癌患者进行新辅助治疗获得了cCR后采取W&W,随访时间近3年未发生复发[12],而在观察等待策略中3年是一个重要的时间窗口,3年未发生肿瘤局部再生长意味着远期再生长风险小于5%,也同样验证了新辅助免疫治疗后W&W策略的安全性和可行性。
新辅助治疗关注点主要包括两点:其一,新辅助治疗能否改善生存?我们的一项研究在T4b期MSI-H结直肠癌中比较了三种新辅助治疗模式和直接手术的疗效[13],新辅助治疗疗效优势非常明显:T4b期结直肠癌直接手术治疗,50%的患者会发生复发转移;如果采取传统的新辅助放化疗或者新辅助化疗,复发风险是25%,也就是3年DFS率为75%;而如果采取新辅助免疫治疗,3年DFS率则接近100%。
其二,免疫治疗是否安全?疗效是一方面,新辅助治疗中免疫治疗毒副作用的预防和处理是另一方面。比如免疫治疗相关内分泌系统疾病(甲状腺功能异常、糖尿病等)具有终身毒性风险,在应激情况下可能造成生命威胁。如果免疫相关毒性问题解决,免疫治疗覆盖早中期人群不成问题,但问题解决前仍不应将适应症拓展太宽。
结直肠癌新辅助免疫治疗中直肠癌的器官保留已有所突破,结肠癌是否需要器官保留?答案是,同样需要。但目前我们在新辅助治疗中尚不能准确识别出达到完全缓解(CR)的结肠癌患者。这是因为MSI-H结肠癌一般都是巨大肿瘤,意味着肿瘤退缩需要一定的时间,而退缩过程可能出现各种并发症如梗阻、狭窄等,治疗管理和识别上存在难度。结肠癌的肿瘤退缩一般可通过影像学或内镜检查,基于此,我们建立了一个预测模型来预测MSI-H结肠癌接受新辅助免疫治疗后的CR状态,整体看来准确性非常高,也期待通过这个模型帮助MSI-H结肠癌患者实现器官功能的保留。
新辅助免疫治疗时间和用药方案也亟需解答。新辅助治疗以改善生存为目的,但究竟用多长时间合适,6周、12周还是24周?目前尚无定论,临床研究多倾向12周,也就是3个月时间。用药时选择一种药还是两种药?这个问题也仍在摸索中,但目前来看,多数研究偏向选择一个PD-1单抗即可,而对于PD-1单抗原发耐药的人群则需要尽早去预测风险,可能选择双药联合方案。
小结
今年ESMO年会中更新的KEYNOTE-177研究5年随访数据无疑为MSI-H/dMMR肠癌患者的治疗带来了新的希望,远期生存获益、高缓解率和长持续缓解时间,每个指标都在提示晚期患者中有部分患者存在治愈的机会。而新辅助免疫治疗初步尝试后所获得的高pCR率,同样提示免疫治疗在早中期CRC中的潜力。但免疫治疗中原发耐药和继发耐药现象的存在,及其预测和治疗对策仍是当务之急。虽然目前也获取了一些初步成果,但仍需更大型研究的验证,我们一起期待更多促进格局变革的里程碑数据的披露。
[1] André T, Shiu KK, Kim TW, et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med. 2020;383(23):2207-2218. doi:10.1056/NEJMoa2017699
[2] Diaz LA Jr, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23(5):659-670. doi:10.1016/S1470-2045(22)00197-8.
[3] K-K. Shiu, et al. Pembrolizumab versus chemotherapy in microsatellite instability-high (MSI-H)/mismatch repair-defificient (dMMR) metastatic colorectal cancer (mCRC): 5-year follow-up of the randomized phase III KEYNOTE-177 study. 2023 ESMO,LBA32.
[4] Diaz LA Jr, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23(5):659-670. doi:10.1016/S1470-2045(22)00197-8.
[5] Ludford K, Cohen R, Svrcek M, et al. Pathological Tumor Response Following Immune Checkpoint Blockade for Deficient Mismatch Repair Advanced Colorectal Cancer. J Natl Cancer Inst. 2021;113(2):208-211. doi:10.1093/jnci/djaa052
[6] Chalabi M, Fanchi LF, Dijkstra KK, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers[J]. Nat Med, 2020,26(4):566-576. DOI: 10.1038/s41591-020-0805-8.
[7] Chalabi M, Verschoor YL, van den Berg J, et al. LBA7 Neoadjuvant immune checkpoint inhibition in locally advanced MMR-deficient colon cancer: the NICHE-2 study [J]. Ann Oncol, 2022, 33(Suppl 7): S808-S869.
[8] Cercek A, Lumish M, Sinopoli J, et al. PD-1 blockade in mismatch repair-deficient, locally advanced rectal cancer [J]. N Engl J Med, 2022,386(25):2363-2376.
[9] Hu H, Kang L, Zhang J, et al. Neoadjuvant PD-1 blockade with toripalimab, with or without celecoxib, in mismatch repair-deficient or microsatellite instability-high, locally advanced, colorectal cancer (PICC):a single-centre,parallelgroup, non-comparative, randomised, phase 2 trial[J]. Lancet Gastroenterol Hepatol, 2022, 7(1): 38-48.
[10] Ludford K, Ho WJ, Thomas JV, et al. Neoadjuvant Pembrolizumab in Localized Microsatellite Instability High/Deficient Mismatch Repair Solid Tumors. J Clin Oncol. 2023;41(12):2181-2190.
[11] Cercek A, et al. Single agent PD-1 blockade as curative-intent treatment in mismatch repair deficient locally advanced rectal cancer..2022 ASCO, LBA5.
[12] Wang QX, Xiao BY, Cheng Y, et al. Anti-PD-1-based immunotherapy as curative-intent treatment in dMMR/MSI-H rectal cancer: A multicentre cohort study. Eur J Cancer. 2022;174:176-184. doi:10.1016/j.ejca.2022.07.016
[13] Han K, Tang JH, Liao LE, et al. Neoadjuvant Immune Checkpoint Inhibition Improves Organ Preservation in T4bM0 Colorectal Cancer With Mismatch Repair Deficiency: A Retrospective Observational Study. Dis Colon Rectum. 2023;66(10):e996-e1005. doi:10.1097/DCR.0000000000002466
审批编号:MI-PD1-5127-CN
过期日期:5/1/2024
目前中国批准帕博利珠单抗单药用于KRAS、NRAS和BRAF基因均为野生型,不可切除或转移性MSI-H/dMMR结直肠癌患者的一线治疗。
本资讯由默沙东医学团队提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
排版编辑:肿瘤资讯-Tracy











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


