奥希替尼是一种三代EGFR-TKI,可有效抑制EGFR敏感突变及EGFR T790M突变,且对CNS转移的NSCLC具有良好的治疗效果[1-5],但最终都不可避免的会产生耐药,25%的患者会出现MET变异[6-8],是常见的耐药机制之一。MET抑制剂联合EGFR-TKI治疗是一种潜在的治疗策略[9-11],但仍需有效的生物标志物来预测患者获益水平。循环肿瘤DNA(ctDNA)是一种微创方便的生物标志物,有巨大的临床应用前景。
1. 研究方法
该Ib期TATTON研究,纳入了2个扩展队列(队列B和队列D),入组人群为携带获得性MET变异的晚期NSCLC患者,队列B 入组138例,接受赛沃替尼 600 mg/300 mg每日一次(q.d) +奥希替尼 80 mg q.d治疗;队列D入组42例,接受赛沃替尼300 mg每日一次(q.d) +奥希替尼 80 mg q.d治疗,旨在评估奥希替尼联合赛沃替尼的疗效及ctDNA清除率与PFS的相关性[12]。
2. 研究结果
2.1 患者特征
2015年5月20日至2020年3月4日期间,B队列中,69例先前接受过第三代EGFR-TKI治疗(B1队列),51例从未接受过第三代EGFR-TKI治疗且T790M阴性(B2队列),18例从未接受过第三代EGFR-TKI治疗同时T790M阳性(B3队列)。奥希替尼的中位治疗持续时间为10.4个月,赛沃替尼中位治疗持续时间为8.7个月。
2.2 疗效分析
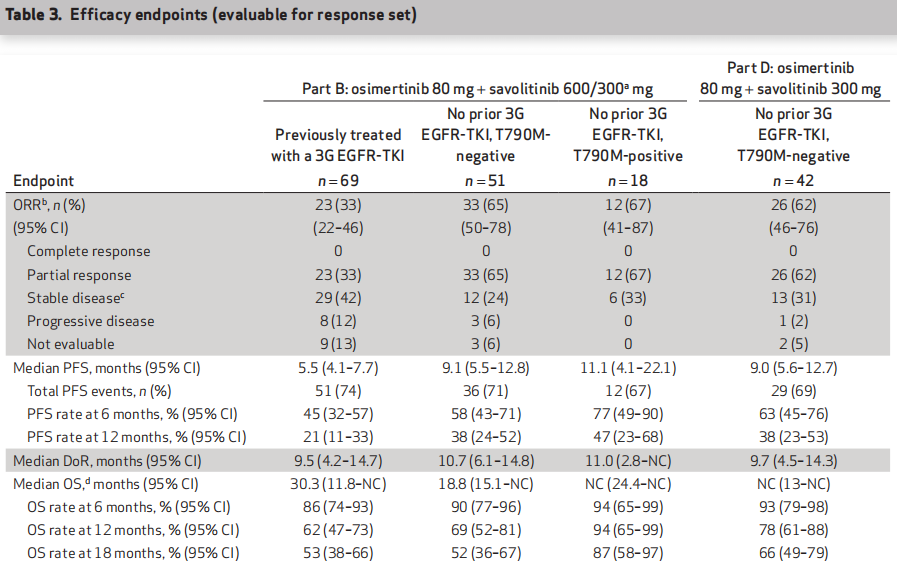
B1队列的客观缓解率(ORR)为33%, B2队列为65%,B3队列为67% 。B1-3队列的中位缓解持续时间(DOR)分别为9.5个月、10.7个月和11.0个月;中位PFS分别为5.5个月、9.1个月和11.1个月。中位OS分别为30.3个月、18.8个月和NC(未达到)。在D队列,客观缓解率(ORR)为62% ,均为部分缓解(PR),DOR为9.7个月,中位PFS为9.0个月,中位OS未达到。
2.3 安全性分析
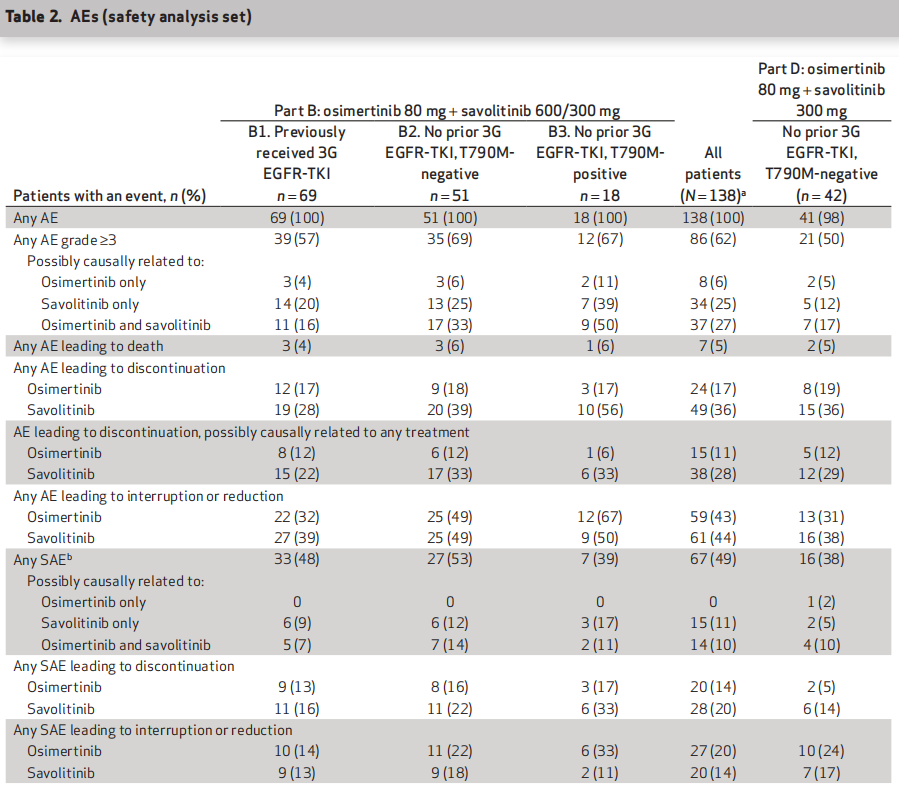
在B队列,所有患者(n = 138)均报告≥1个不良事件(AE),最常见的是恶心(72例,52%),49例(36%)患者食欲下降和周围水肿,48例(35%)患者疲劳和呕吐。在D队列,41例(98%)报告≥1个不良反应,最常见的是恶心(14例,33%),13例(31%)患者外周水肿,12例(29%)患者皮疹,9例(21%)患者食欲下降和甲沟炎。
2.4 ctDNA清除是较长的PFS预测标志物
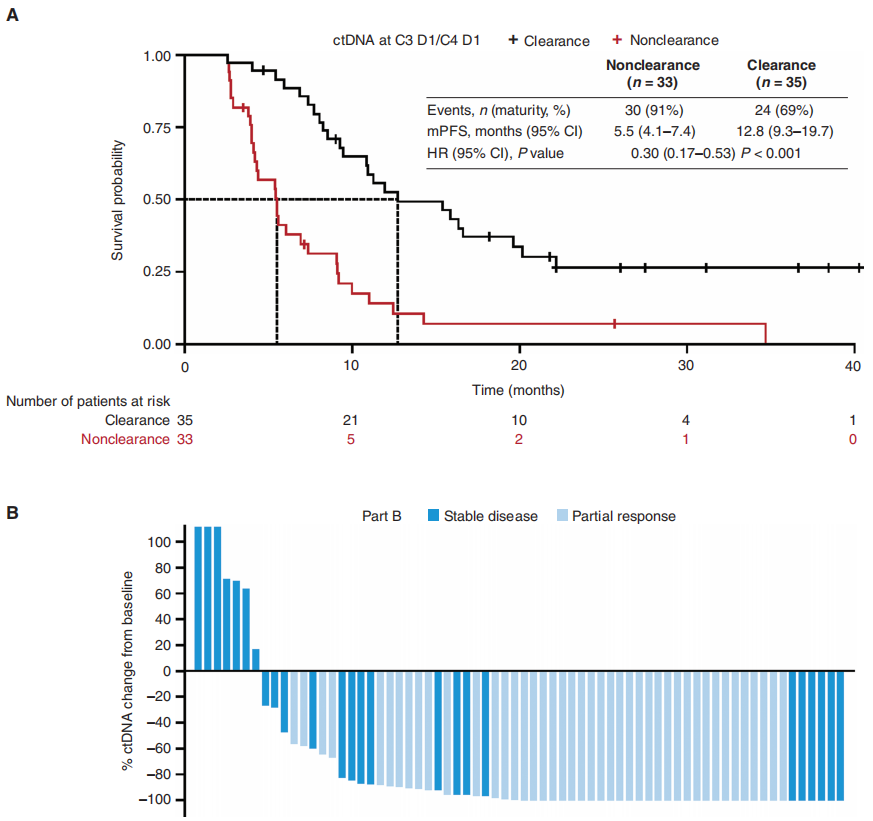
进一步对患者ctDNA进行分析,B队列有102例患者(B1组n = 52,B2组 n = 35,B3组n = 15)符合纳入条件,D队列为37例。在B队列和D队列中,分别有85例(83%)和24例(65%)患者在基线时检测到ctDNA EGFR清除。两种不同剂量赛沃替尼治疗组,ctDNA清除率相似。第3周期第1天或第4周期第1天(C3 D1/C4 D1)ctDNA EGFR突变清除与患者更长的PFS显著相关,清除组中位PFS为12.8个月,而未清除组为5.5个月。
3. 小结
该研究结果表明,奥希替尼联合赛沃替尼对获得性MET变异NSCLC患者具有良好的治疗效果且安全性可控,是一种潜在有效的治疗方法,此外治疗期间,该研究通过ctDNA动态监测发现,ctDNA清除是较长的PFS预测标志物。
阔然基因基于NGS检测平台推出了肺癌及其他常见实体肿瘤MRD监测产品,设计思路是采用WES+panel方案(panel可灵活定制),同时兼顾了Tumor-informed和Tumor-naive两种经典MRD检测策略的优势,测序深度200,000X,检测灵敏度达0.01%,在实现超深度测序时不漏检低频突变,可100%覆盖肿瘤患者,提供全面的肿瘤治疗全周期系统解决方案,为临床提供早期患者术后复发风险评估、术后辅助治疗决策、预后评估、耐药监测以及治疗指导等临床信息!
[1] Cross DA, Ashton SE, Ghiorghiu S, Eberlein C, Nebhan CA, Spitzler PJ, et al. AZD9291, an irreversible EGFR TKI, overcomes T790M-mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014;4:1046-61.
[2] Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH, et al. Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer. N Engl J Med 2018;378:113-25.
[3] Mok TS, Wu YL, Ahn MJ, Garassino MC, Kim HR, Ramalingam SS, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629-40.
[4] Wu YL, Ahn MJ, Garassino MC, Han JY, Katakami N, Kim HR, et al. CNS efficacy of osimertinib in patients with T790M-positive advanced non-small-cell lung cancer: data from a randomized phase III trial (AURA3). J Clin Oncol 2018;36:2702-9.
[5] Reungwetwattana T, Nakagawa K, Cho BC, Cobo M, Cho EK, Bertolini A, et al. CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non–small-cell lung cancer. J Clin Oncol 2018;36:3290-7.
[6] Leonetti A, Sharma S, Minari R, Perego P, Giovannetti E, Tiseo M. Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. Br J Cancer 2019;121:725-37.
[7] Oxnard GR, Hu Y, Mileham KF, Husain H, Costa DB, Tracy P, et al. Assessment of resistance mechanisms and clinical implications in patients with EGFR T790M-positive lung cancer and acquired resistance to osimertinib. JAMA Oncol 2018;4:1527-34.
[8] Ramalingam SS, Cheng Y, Zhou C, Ohe Y, Imamura F, Cho BC, et al. Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study. Ann Oncol 2018;29 Suppl 8:viii740.
[9] York ER, Varella-Garcia M, Bang TJ, Aisner DL, Camidge DR. Tolerable and effective combination of full-dose crizotinib and osimertinib targeting MET amplification sequentially emerging after T790M positivity in EGFR-mutant non–small cell lung cancer. J Thorac Oncol 2017;12:e85-e8.
[10] Engelman JA, Zejnullahu K, Mitsudomi T, Song Y, Hyland C, Park JO, et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling. Science 2007;316:1039-43.
[11] Gainor JF, Niederst MJ, Lennerz JK, Dagogo-Jack I, Stevens S, Shaw AT, et al. Dramatic response to combination erlotinib and crizotinib in a patient with advanced, EGFR-mutant lung cancer harboring de novo MET amplification. J Thorac Oncol 2016;11:e83–e5..
[12] Hartmaier RJ, Markovets AA, Ahn MJ, et al. Osimertinib + Savolitinib to Overcome Acquired MET-Mediated Resistance in Epidermal Growth Factor Receptor-Mutated, MET-Amplified Non-Small Cell Lung Cancer: TATTON. Cancer Discov. 2023;13(1):98-113.

排版编辑:肿瘤资讯-Lynn












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


