三级淋巴结构(TLS)是免疫微环境中的一种特殊成分,主要由肿瘤浸润淋巴细胞(TILs)组成,包括T细胞、B细胞、树突状(DC)细胞和高内皮小静脉(HEVs)。对于癌症患者而言,免疫微环境的评价对肿瘤生物学行为、治疗方法和预后具有预测作用。因此,TLSs作为一种潜在的新型生物标志物开始受到研究人员的关注。为了更好地了解什么样的TLSs可能对患者有益,以及TLSs在肿瘤免疫治疗中的作用,本文对TLSs的总体作用及其组成,以及近年来以TLSs为标志物的临床试验和相关研究进行了综述。
根据过去一年的大量研究,TLSs通常出现在自身免疫性疾病、感染性疾病、器官移植、炎症性疾病和肿瘤的炎症部位。越来越多的证据表明,它们的形成与暴露于慢性炎症介导的免疫反应密切相关。目前,随着抗肿瘤免疫研究的不断深入,免疫治疗特别是以抗PD-1/PD-L1为主导的免疫检查点抑制剂已成为临床广泛接受的治疗方法。在这个阶段,针对免疫细胞的免疫疗法,特别是针对T细胞的免疫疗法,已经成为对抗肿瘤的有力武器,包括免疫检查点阻断、过继细胞疗法和癌症疫苗。然而,大量的癌症患者并没有从这种新颖有效的治疗中获益。这主要是由于肿瘤微环境(TME)的复杂性和异质性以及免疫调节网络[1]的多样性。PD-L1在肿瘤细胞上的表达强度和肿瘤的突变负荷被认为是确定免疫治疗有效人群的生物标志物,肿瘤浸润淋巴细胞(TIL)已被证明与疗效高度相关 [2,3]。虽然免疫治疗联合其他治疗在无PD-L1表达人群中的疗效已在先前的研究中得到证实,但其机制仍需进一步探索。TLS是一种以B细胞为中心,被T细胞和多种免疫细胞及免疫相关细胞包围的空间结构,其表面无包膜覆盖。与次级淋巴器官(SLO)类似,TLSs通过募集循环免疫细胞和增强局部免疫作用来调节免疫微环境。TLSs作为控制肿瘤进展和预后的循环免疫细胞生成位点,不依赖于PD-L1的表达,具有很大的前景和潜力。一些研究表明,无论PD-L1是否表达,肿瘤或肿瘤周围由免疫浸润细胞群定义的三级淋巴结构(TLSs)大多与患者预后良好相关[4]。
TLS的密度、位置和成熟度已被证明与良好的临床结果密切相关[5-10],包括无病生存期(DFS)和总生存期(OS)。TLS密度与生发中心形成和适应性免疫反应相关基因的表达相关,是肺癌、结直肠癌、胰腺癌和乳腺癌的独立预后指标。也有相反的观察结果认为TLS密度与更好的生存率相关性有限。在接受新辅助化疗的肺鳞状细胞癌患者中,肿瘤中TLSs的密度变得相似,失去了其预测作用。肿瘤中高TLS密度通常伴随高TIL密度以及PD-1/PD-L1的表达,提示免疫治疗的潜在益处。然而,我们发现一种高免疫浸润和TLSs的胶质瘤亚型导致预后不良。这可能是因为在具有较高免疫抑制细胞(如髓源性抑制细胞)的患者中,TLSs的有益作用可能会降低。关于TLS的位置,许多研究报道了TLS在肿瘤或肿瘤周围的持续性。在肺癌、胰腺癌、结直肠癌、口腔鳞状细胞癌、黑色素瘤转移、卵巢癌中,瘤周TLSs往往对预后有良好的影响。但在乳腺癌中,TLSs也与预后不良和浸润性转移有关。肿瘤内TLSs被认为是肺癌和HCC的有利制造者。对于TLS的成熟度,Silina等人认为肿瘤相关TLSs的发展遵循顺序的成熟阶段:(1)早期TLSs (E-TLSs),T细胞、B细胞和表达CXCL13的血管周围细胞聚集成簇,无FDC;(2)原发滤泡样TLSs (PFL-TLSs),即不含GCs的含FDC的TLSs;(3)继发性卵泡样TLSs (SFL-TLSs),即类似于SLO卵泡的TLSs。缺乏生发中心的E-TLSs可能有利于免疫逃避并在肝癌前病变中发展为成熟的HCC。成熟TLSs的存在也与客观缓解率、无进展生存期和总生存期的提高相关,而不依赖于PD-L1表达状态和CD8+ T细胞密度[4]。总的来说,TLSs在密度、位置、成熟度、组成以及在不同个体中的比例上存在很大差异,这种高度的异质性需要更好的分类和进一步的研究,以便在临床实践中应用。
TLS的预测作用——手术患者预后评估[11]
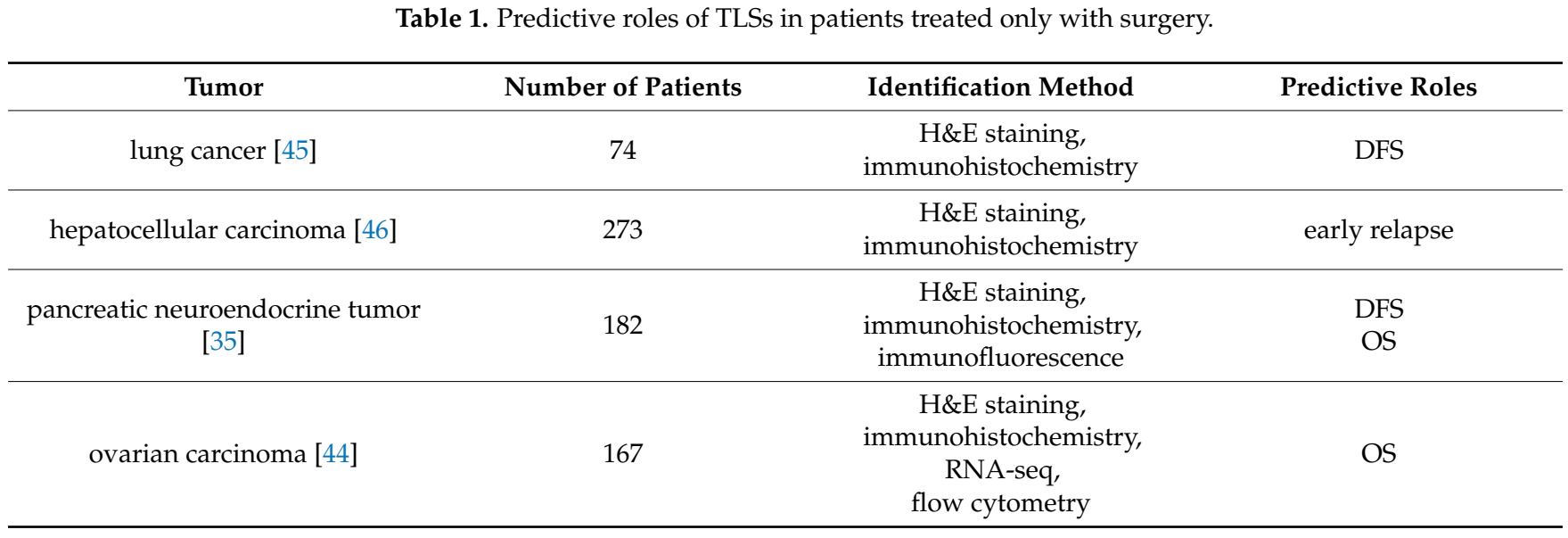
一些研究基于手术标本中的TLSs来确定与良好预后的关系;表1对这些进行了总结。高数量的肿瘤浸润性成熟树突细胞(DC-LAMP)可以鉴别出DFS较长的早期NSCLC患者。在两个肝细胞癌队列中,肿瘤内TLSs可能反映了持续有效的抗肿瘤免疫的存在,这与较低的早期复发风险相关。在切除的G1/G2胰腺神经内分泌肿瘤中,TLSs的存在是一个独立且有利的预测因子,表明DFS和OS较长。卵巢癌的研究结果表明,肿瘤微环境中成熟树突细胞(DC-LAMP+)的存在可能代表了两个独立队列的预后生物标志物,表明更好的DFS和OS。放疗、化疗和免疫治疗都会对TLSs的数量和性质产生一定的影响。这些研究表明,TLSs在肿瘤的发生发展中起着抵抗肿瘤的作用,并具有良好的预后。
表1 TLSs在仅接受手术治疗的患者中的预测作用
TLS的预测作用——免疫疗法评估
TLS与免疫微环境和免疫治疗有着千丝万缕的联系。虽然其在免疫治疗中的作用机制尚不完全清楚,但TLSs对免疫治疗的疗效也具有重要的预测作用。最近的临床试验见表2。Helmink, BA等研究了B细胞和TLSs在免疫治疗应答中的潜在预测作用,描述了TLSs与治疗相关的变化及其与疗效的关联。一种新的免疫治疗评价指标称为“免疫-相关病理反应标准”包括TLSs形态学计数。该标准在主要病理应答者和无应答者之间存在显著差异,并且在病理学家中也被证明是可重复的。LC和LC-COPD患者肿瘤中TLS面积和B细胞显著增加,T细胞数量显著减少。此外,TLSs面积和B细胞比例越大,生存率越长。TLSs通过赋予不同的T细胞表型,在黑色素瘤的免疫微环境中发挥关键作用,并能延长患者的总生存期。与前面提到的乳腺癌化疗的生物标志物一样,黑色素瘤的免疫治疗也使用相同的趋化因子12基因表达评分来识别TLSs,揭示了TLSs与患者长期生存的可能联系。这表明12-趋化因子基因表达反映的是TLSs的本质特征,而不是不同处理引起的其他变化。乳腺癌中TILs是TLSs的组成部分,相邻TLSs与TILs相关。在HR肿瘤患者中,TILs与更长的无病生存期相关,但TLSs在HR+或HR-亚组中均无显著相关性。在另一项乳腺癌试验中,TLSs对DFS有预测作用,但对OS无预测作用。在乳腺癌中,HR和HER2的状态对免疫微环境和治疗策略有很大影响,在后续研究中应考虑不同亚群的分析。当Th17通路基因过表达时,TLSs与更长的OS (>3 y)相关,其中IL17A的作用最为显著。然而,Treg相关基因的表达与相对较短的OS (<1.5 y)相关,这表明TLS的类型也与疾病预后密切相关。然而,在尿路上皮癌患者中,CR患者的TLS基线水平较低,新辅助免疫治疗后TLS变化倍数较高,提示免疫微环境中淋巴细胞浸润较少的某些癌症类型可通过免疫治疗激活。TLSs中DC和T细胞对结直肠癌预后有利。在口腔鳞状细胞癌中,可能标志TLS形成的HEV与有利的免疫微环境相关,并且TLSs的存在可以预测更长的DFS和OS。在胰腺相关肿瘤中,TLSs或TLSs内免疫细胞的相似分布可预测患者的生存获益。免疫治疗与TLSs之间的关系非常复杂,其具体机制和长期疗效观察有待进一步研究。
表2 TLSs在免疫治疗患者中的预测作用

TLSs作为B细胞应答的主要载体和T细胞应答的重要辅助物,在免疫治疗时代将受到越来越多的关注。在总结临床试验的过程中,我们发现,无论是单纯观察手术患者的预后,还是围手术期辅助/新辅助治疗,与TLSs相关的预测因素大多具有一定的预后作用,预后价值包括短期疗效指标(ORR)和长期生存指标(DFS、OS)。然而,目前尚无标准化的TLSs鉴定方法,针对每种特定类型肿瘤的研究数量仍然不足。我们可以相信,随着对TLSs的不断研究,它可以为临床治疗和预后评估提供帮助。如果TLSs的作用和机制得到证实,有望成为病理诊断的常规检测手段,并广泛应用于临床。
[1] O’Donnell, J.S.; Teng, M.W.L.; Smyth, M.J. Cancer immunoediting and resistance to T cell-based immunotherapy. Nat. Rev. Clin. Oncol. 2019, 16, 151–167.
[2] Kim, T.K.; Vandsemb, E.N.; Herbst, R.S.; Chen, L. Adaptive immune resistance at the tumour site: Mechanisms and therapeutic opportunities. Nat. Rev. Drug Discov. 2022, 21, 529–540.
[3] Bagchi, S.; Yuan, R.; Engleman, E.G. Immune Checkpoint Inhibitors for the Treatment of Cancer: Clinical Impact and Mechanisms of Response and Resistance. Annu. Rev. Pathol. 2021, 16, 223–249.
[4] Vanhersecke, L.; Brunet, M.; Guégan, J.P.; Rey, C.; Bougouin, A.; Cousin, S.; Moulec, S.L.; Besse, B.; Loriot, Y.; Larroquette, M.; et al. Mature tertiary lymphoid structures predict immune checkpoint inhibitor efficacy in solid tumors independently of PD-L1 expression. Nat. Cancer 2021, 2, 794–802.
[5] Sofopoulos, M.; Fortis, S.P.; Vaxevanis, C.K.; Sotiriadou, N.N.; Arnogiannaki, N.; Ardavanis, A.; Vlachodimitropoulos, D.; Perez, S.A.; Baxevanis, C.N. The prognostic significance of peritumoral tertiary lymphoid structures in breast cancer. Cancer Immunol. Immunother. 2019, 68, 1733–1745.
[6] Hiraoka, N.; Ino, Y.; Yamazaki-Itoh, R.; Kanai, Y.; Kosuge, T.; Shimada, K. Intratumoral tertiary lymphoid organ is a favourable prognosticator in patients with pancreatic cancer. Br. J. Cancer 2015, 112, 1782–1790.
[7] Silina, K.; Soltermann, A.; Attar, F.M.; Casanova, R.; Uckeley, Z.M.; Thut, H.; Wandres, M.; Isajevs, S.; Cheng, P.; CurioniFontecedro, A.; et al. Germinal Centers Determine the Prognostic Relevance of Tertiary Lymphoid Structures and Are Impaired by Corticosteroids in Lung Squamous Cell Carcinoma. Cancer Res. 2018, 78, 1308–1320.
[8] Gunderson, A.J.; Rajamanickam, V.; Bui, C.; Bernard, B.; Pucilowska, J.; Ballesteros-Merino, C.; Schmidt, M.; McCarty, K.; Philips, M.; Piening, B.; et al. Germinal center reactions in tertiary lymphoid structures associate with neoantigen burden, humoral immunity and long-term survivorship in pancreatic cancer. Oncoimmunology 2021, 10, 1900635.
[9] Posch, F.; Silina, K.; Leibl, S.; Mundlein, A.; Moch, H.; Siebenhuner, A.; Samaras, P.; Riedl, J.; Stotz, M.; Szkandera, J.; et al. Maturation of tertiary lymphoid structures and recurrence of stage II and III colorectal cancer. Oncoimmunology 2018, 7, e1378844.
[10] Li, Q.; Liu, X.; Wang, D.; Wang, Y.; Lu, H.; Wen, S.; Fang, J.; Cheng, B.; Wang, Z. Prognostic value of tertiary lymphoid structure and tumour infiltrating lymphocytes in oral squamous cell carcinoma. Int. J. Oral Sci. 2020, 12, 24.
[11] Zou, Ji'an et al. “Tertiary Lymphoid Structures: A Potential Biomarker for Anti-Cancer Therapy.” Cancers vol. 14,23 5968. 2 Dec. 2022,













 苏公网安备 32059002004080号
苏公网安备 32059002004080号


