非小细胞肺癌(NSCLC)中,生物标志物驱动疗法和免疫检查点阻滞发展迅速,临床研究的广度和深度以前所未有的速度不断改善,个体化治疗格局进展不断。近日,Journal of Hematology&Oncology发表了一篇广东省人民医院吴一龙教授和暨南大学附属第一医院李杨秋教授团队的综述,该综述总结了改变NSCLC治疗格局的重要疗法,提出了NSCLC治疗框架以及若干待解决问题。
广东省医师协会(GDMDA)会长 广东省人民医院(GDPH)首席专家 广东省肺癌研究所(GLCI)名誉所长 中国胸部肿瘤研究协作组(CTONG)主席 2018-2021年临床医学领域全球高被引科学家 2020年世界肺癌大会(WCLC )主席 中国临床肿瘤学会前任理事长,现指导委员会主任委员
中国病理生理学会实验血液学专业委员会副主任委员和血液免疫学组组长 中国临床肿瘤学会(CSCO)理事 中国免疫学会血液免疫专业委员会常员 中国抗癌协会血液肿瘤专业委员会常员 中国抗癌协会血液病转化医学专业委员会常委 中国生理学会血液生理专业委员会委员 中国医师协会临床精准医疗专业委员会委员 中国研究型医院学会细胞研究与治疗专业委员会常委 广东省免疫学会副理事长 广东省医学会血液学分会副主任委员 广东省抗癌协会理事、广东省病理生理学会理事等
背景
近年来,多项研究显示驱动基因阳性NSCLC患者接受酪氨酸激酶抑制剂(TKI)治疗具有良好生存结局,EGFR-TKI的发展变革了EGFR突变NSCLC患者的个体化治疗格局。免疫检查点抑制剂(ICI)如PD-1/PD-L1抑制剂的发展同样是肺癌治疗中的里程碑事件。此外,针对至少9个其他分子靶点的靶向药物已经获批。文章将讨论可改善所有临床分期NSCLC临床结局的靶向和免疫治疗,并强调应在未来研究中探索的其他临床问题。
早期NSCLC
既往推荐新辅助或辅助化疗用于可切除NSCLC,但是5年总生存(OS)率仅改善5%,需要新型辅助治疗策略优化早期NSCLC患者完全切除后的临床结局。
EGFR-TKI辅助治疗证据和临床意义
Ⅲ期ADAURA研究中,奥希替尼可显著改善术后EGFR突变NSCLC患者的无病生存期(DFS)。Ⅱ~ⅢA期患者的疾病复发及死亡风险降低77%,ⅠB~ⅢA期患者风险降低73%。DFS获益可见于行(HR 0.29)或不行(HR 0.36)辅助化疗的患者。奥希替尼获得美国食品药品监督管理局(FDA)批准作为EGFR突变患者的辅助治疗。
3项一代EGFR-TKI对比化疗作为EGFR突变NSCLC患者辅助治疗的Ⅲ期临床研究结果矛盾。CTONG1104研究显示和化疗相比,吉非替尼辅助治疗显著延长Ⅱ~ⅢA期NSCLC患者的DFS(30.8个月 vs 20.8个月),复发或死亡风险降低44%(P=0.001),但是中位OS未达到显著性(75.5个月 vs 62.8个月,HR 0.92,P=0.674)。EVIDENCE研究对比了Ⅱ~ⅢA期EGFR突变NSCLC患者中辅助埃克替尼和化疗的疗效,显示二者中位DFS分别是47.0个月 vs 22.1个月(HR 0.36,P<0.0001)。尽管缺乏OS数据,国家药品监督管理局(NMPA)批准埃克替尼作为EGFR突变患者完全切除后的辅助治疗。IMPACT研究则显示吉非替尼未延长EGFR突变术后患者的DFS或OS,两组中位DFS分别是35.9个月 vs 25.1个月(HR 0.92,P=0.63),吉非替尼未获批准。
PD-1/PD-L1抑制剂辅助或新辅助治疗
IMpower010研究是第一项对比辅助免疫治疗和标准疗法用于可切除ⅠB~ⅢA期NSCLC患者的Ⅲ期研究。阿替利珠单抗可显著改善DFS,将PD-L1≥1%的Ⅱ~ⅢA期患者复发和死亡风险降低34%,所有Ⅱ~ⅢA期患者复发和死亡风险降低21%。2021年FDA批准阿替利珠单抗辅助用于PD-L1≥1%的Ⅱ~ⅢA期患者切除和含铂化疗后。OS的46个月随访数据显示阿替利珠单抗组在PD-L1≥1%的Ⅱ~ⅢA期患者中具有OS改善趋势(HR 0.71)。PD-L1≥50%的患者中具有显著OS优势(HR 0.43)。
KEYNOTE-091是第二项辅助免疫治疗研究。中位随访35.6个月,帕博利珠单抗组中位DFS优于安慰剂组(53.6个月 vs 42.0个月,HR 0.76,P=0.0014)。在PD-L1≥50%的患者中,帕博利珠单抗和安慰剂相比未改善DFS(HR 0.82,P=0.14)。2023年1月26日,FDA批准帕博利珠单抗作为辅助治疗用于ⅠB~ⅢA期NSCLC患者。
CheckMate 816是第一项显示出新辅助免疫治疗在可切除ⅠB~ⅢA期NSCLC患者具有良好结局的Ⅲ期研究,主要终点是病理完全缓解(pCR)和无事件生存期(EFS)。中位随访29.5个月,新辅助纳武利尤单抗联合化疗对比单纯化疗显著改善pCR率(24.0% vs 2.2%,P<0.0001),延长EFS达11个月(31.6个月 vs 20.8个月,HR 0.63,P=0.0052)。中期分析显示OS具有改善趋势(HR 0.57,P=0.0079)。2022年3月4日,新辅助纳武利尤单抗联合化疗获得FDA批准,并于2023年1月获得NMPA批准。
基于近来获批药物,早期NSCLC治疗格局改变(图1)。表1总结了正在进行的在未来5年具有有潜力的研究。
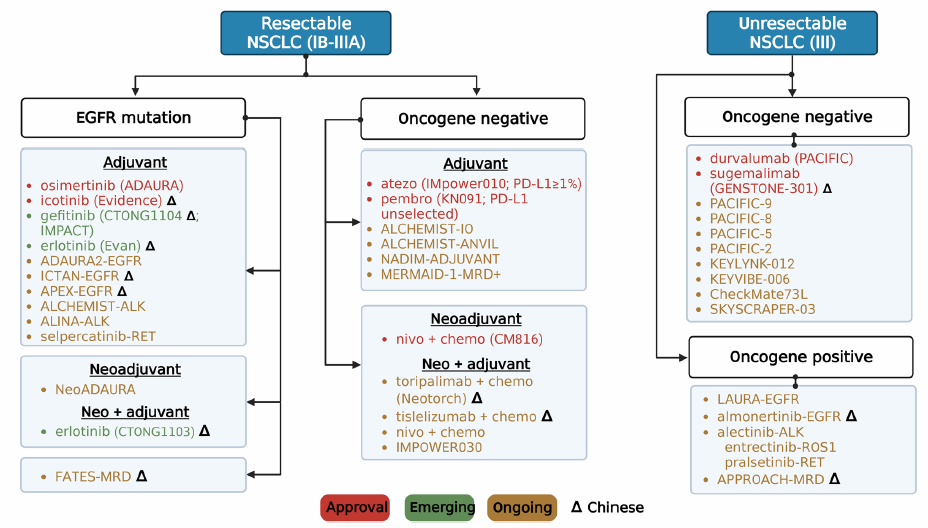
图1. 可切除及不可切除NSCLC的治疗格局
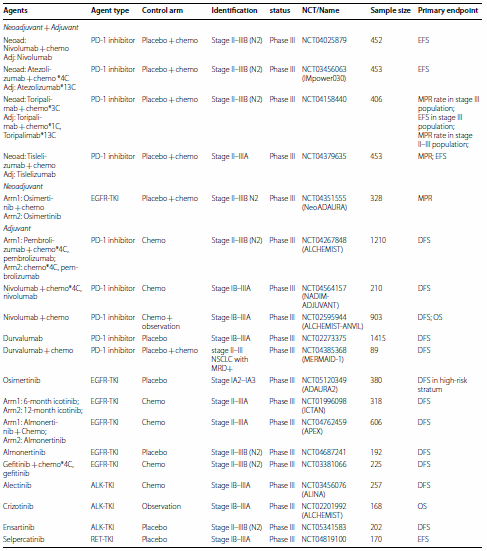
表1. 未来5年可能改变早期NSCLC治疗格局的在研临床研究
未解决的临床问题
首先,还不清楚辅助化疗是否对所有患者均有必要。大多数辅助治疗研究如CTONG1104和EVIDENCE发现EGFR-TKI联合化疗的获益效应,但是ADAURA研究发现辅助化疗应个体化给予。将来的研究应对比研究药物联合化疗和单纯研究药物,以发现差异。正在进行的APEX研究对比阿美替尼联合化疗,阿美替尼单药和单纯化疗用于可切除EGFR突变NSCLC患者的疗效和安全性。
第二,新辅助治疗对于病理反应的效应还不清楚。病理反应是完全切除术后新辅助治疗的早期治疗标志物,并可指导治疗决策。之前研究发现主要病理反应(MPR)和pCR率改善和更长的EFS和DFS相关,但是还不清楚是否MPR或pCR率提示生存获益。尽管若干Ⅲ期新辅助研究使用MPR作为主要终点,还需要将来研究确认这些结果。
第三,还不清楚分子残留病(MRD)状态是否可指导个体化辅助治疗选择。动态MRD监测可提供治疗指导。之前研究显示ICI巩固治疗可改善MRD患者结局。EGFR突变晚期患者在局部治疗达到MRD阴性后可行EGFR-TKI“药物假期”。但是需要将来研究决定是否个体化辅助治疗可基于MRD状态进行选择。
第四,还不清楚辅助靶向治疗对于罕见基因变异肿瘤是否有效。表1和表2总结了正在进行的探索靶向治疗在可切除携带罕见基因变异患者中作用的前瞻性临床研究。ALINA研究对比辅助阿来替尼和辅助化疗在ALK融合患者中的作用,结果将影响未来的临床治疗。
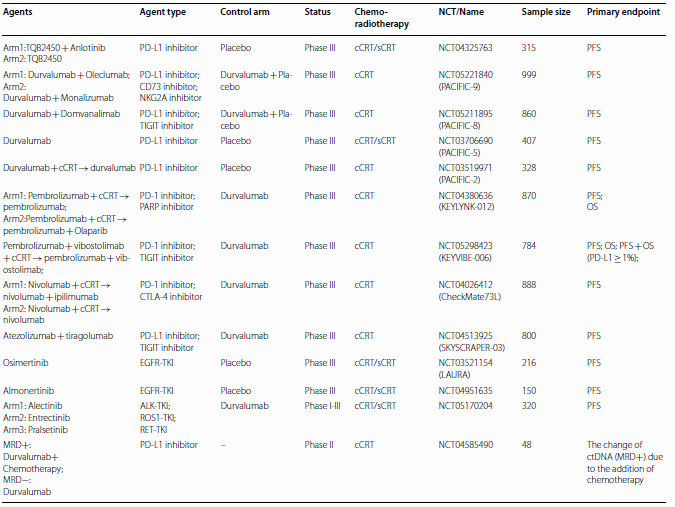
表2. 未来5年可能改变不可切除Ⅲ期NSCLC治疗格局的在研临床研究
局部NSCLC
Ⅲ期NSCLC患者是一组高度异质性人群。这些患者分为不可切除、可切除或潜在可切除。临床实践中,根治性化放疗是Ⅲ期不可切除患者的标准治疗。
具有临床意义的新证据
PACIFIC是第一项影响不可切除Ⅲ期NSCLC患者临床治疗的研究。这项Ⅲ期研究对比了同步化放疗后,度伐利尤单抗和安慰剂巩固治疗。2018年2月FDA批准度伐利尤单抗用于接受化放疗的不可切除Ⅲ期NSCLC患者。两组中位无进展生存期(PFS)分别是16.9个月 vs 5.6个月(HR 0.55),5年PFS率分别是33.1% vs 19.0%。中位OS分别是47.5个月 vs 29.1个月,5年OS率分别是42.9% vs 33.4%(HR 0.72)。各亚组获益一致,但是由于样本量小,还不清楚度伐利尤单抗对于EGFR/ALK异常患者是否具有生存获益。
GEMSTONE-301是一项在局部晚期不可切除Ⅲ期NSCLC患者行同步或序贯化放疗后,对比舒格利单抗和安慰剂PFS的Ⅲ期研究。舒格利单抗巩固治疗显著改善中位PFS,降低复发风险达36%。2022年6月6日,舒格利单抗在中国获批用于治疗不可切除Ⅲ期NSCLC患者。舒格利单抗组和安慰剂组中位PFS分别是10.5个月 vs 6.2个月(HR 0.65),序贯化放疗是8.1个月 vs 4.1个月(HR 0.57),同步化放疗是15.7个月 vs 8.3个月(HR 0.71)。两组OS分别是未达到(NR)vs 25.9个月。
PACIFIC-R研究回顾性分析真实世界疗效。患者在同步或序贯化放疗后接受度伐利尤单抗巩固治疗,主要终点是研究者评估真实世界PFS(rwPFS)和OS。度伐利尤单抗中位rwPFS 21.7个月,3年OS率63.2%。接受序贯化放疗的患者同样具有生存获益,中位rwPFS 19.3个月。
未解决的临床问题
诱导治疗在不可切除Ⅲ期NSCLC中的角色还不清楚。CheckMate 816研究显示纳武利尤单抗联合化疗具有更大的病理退缩(pCR率:24.0% vs 2.2%)、临床反应(OR:54% vs 24%)和影像学降期(31% vs 24%)。因此,新辅助疗法将Ⅲ期NSCLC患者的疾病状态从不可切除转化为可切除。但是大多数不可切除Ⅲ期患者的临床研究没有行诱导治疗。一项Ⅱ期研究(NCT04580498)入组107例患者,患者接受3周期PD-L1/TGF-β抗体SHR-1701±化疗诱导治疗,之后行手术或根治性化放疗和SHR-1701维持治疗。诱导后和最佳客观反应率(ORR)为56.1%和70.1%。中位EFS 18.2个月,1/4患者接受手术,MPR率44.4%,pCR率25.9%,中位EFS NR。结果提示部分患者不可切除转化为可切除并具有生存改善。一项类似的APPROACH/CTONG2101研究使用阿美替尼作为EGFR突变Ⅲ期NSCLC患者诱导治疗的研究正在进行。
驱动基因异常不可切除Ⅲ期NSCLC的最佳治疗还不清楚。PACIFIC研究包括43例EGFR突变患者,由于样本量小,亚组分析未能显示具有显著性的差异。一项回顾性研究中,Ⅲ期患者根治性化放疗后接受度伐利尤单抗巩固治疗。和野生型患者相比,EGFR或HER2突变患者DFS更短(7.5个月 vs NR,P=0.04)。因此,驱动基因阳性NSCLC患者应谨慎接受度伐利尤单抗治疗。
还不清楚Ⅲ期患者的新型治疗应在化放疗中或维持治疗中加入。度伐利尤单抗和舒格利单抗应作为根治性化放疗后的维持治疗。大多数研究如PACIFIC-8,PACIFIC-9和SKYSCRAPER-03根据PACIFIC研究设计。部分临床研究如KEYVIBE-006、KEYLYNK-012和CheckMate73L将PD-1抑制剂或其他ICI加入同步化放疗中。需要未来研究确定化放疗后这些药物的毒性。
晚期NSCLC
约60%的患者诊断时处于局部晚期或晚期。EGFR、ALK、ROS1、RET、MET 14外显子跳跃突变、BRAF V600突变患者已经具有可及靶向药物。没有可治疗癌基因的患者接受ICI单药或联合治疗。近来,由于新型疗法获批,驱动基因扩展至KRAS G12C、NTRK1和HER2(图2)。
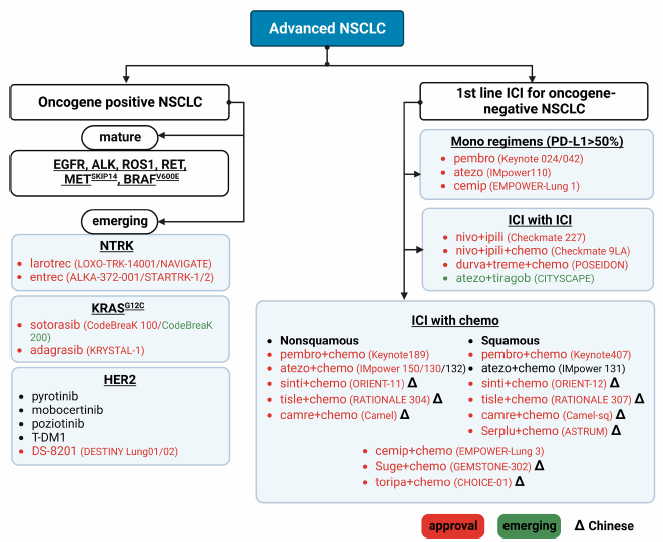
图2. 晚期NSCLC治疗格局
寡转移
具有临床意义的新证据
寡转移传统上是基于影像学特征和转移灶数量及大小定义,指不超过5个转移部位并具有惰性生物学。但是这个定义缺乏特异性,可导致预后和5年OS率的显著异质性。
近来,多部共识认为寡转移谱应包括基于临床特征的不同状态,包括首次发现的时间和治疗反应。新分类纳入独立预后因素。但是寡转移谱也依旧应基于以肿瘤生物学特征和免疫构成为基础的前瞻性精准医学分类。
若干Ⅱ期随机研究证据表明寡转移疾病中,系统治疗中加入局部巩固治疗(LCT)可延长PFS和OS,甚至可在部分患者中达到根治。Gomez等发现和未行LCT的患者相比,诱导化疗后的局部治疗延长中位PFS(14.2个月 vs 4.4个月,P=0.022)和OS(41.2个月 vs 17.0个月,P=0.017)。Iyengar等同样发现系统化疗后LCT的获益效应。另一项研究在EGFR突变NSCLC患者中给予一代EGFR-TKI治疗和原发及转移灶放疗,发现和未行放疗的患者相比,局部治疗可显著延长中位PFS(20.2个月 vs 12.5个月,P<0.001)和中位OS(25.5 vs 17.4个月,P<0.001)。目前很多指南推荐手术或放疗用于寡转移疾病。
具有临床意义的新证据
还不清楚是否特定亚组患者可从LCT中获益。Ⅱ期SABR COMET研究中,局部治疗的获益见于寡转移癌症各个组织学亚型。一项乳腺癌Ⅱ期研究CURB显示立体定向放疗对于寡转移疾病的PFS无效应,但是NSCLC队列具有显著反应。因此,需要LCT反应预测生物标志物。液体活检、影像学技术和肿瘤生物学进展可能有助于评估LCT在不同寡转移状态下角色。期待确证性随机研究结果促进未来临床指南改变。此外,将来研究需要探索局部治疗联合新型疗法治疗寡转移的有效性(表3)。
表3. 未来5年可能改变晚期NSCLC治疗格局的在研临床研究
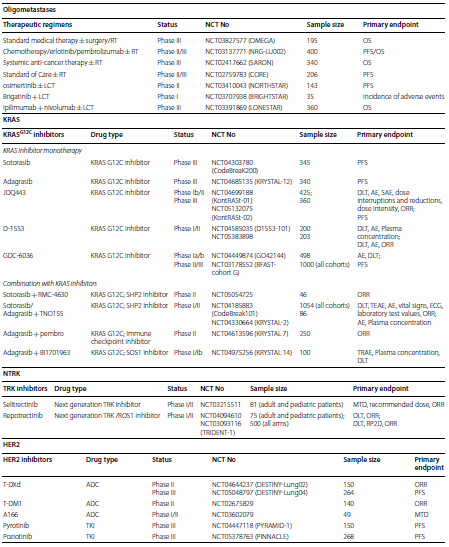
KRAS G12C
具有临床意义的新证据
KRAS突变见于25%~30%的肺腺癌,G12C变异见于39%的KRAS突变。约10%的中国NSCLC患者具有KRAS突变。这些患者中30%具有KRAS G12C突变。
Ⅱ期CodeBreaK100研究中,124例KRAS G12C突变经治NSCLC患者接受Sotorasib治疗,ORR 41%,中位PFS 6.3个月,中位OS 12.5个月,促使FDA批准其作为第一个KRAS抑制剂。对比Sotorasib和多西他赛的Ⅲ期CodeBreaK200研究达到PFS研究终点(中位5.6个月 vs 4.5个月,P=0.002),但是中位OS无显著差异(10.6个月 vs 11.3个月,P=0.53)。另一项Ⅱ期KRYSTAL-1研究在116例KRAS G12C突变NSCLC患者中探索了Adagrasib二线及以上治疗的疗效,ORR 42.9%,中位PFS 6.5个月,中位OS 12.6个月。因此,Adagrasib成为FDA批准的第二个KRAS抑制剂。Sotorasib缺乏颅内反应。Adagrasib似乎控制颅内疾病有效。KRYSTAL-1研究回顾性亚组分析显示经过治疗的中枢神经系统(CNS)转移患者中,颅内ORR 33%,中位颅内PFS 5.4个月。未经治疗CNS转移患者的颅内ORR 32%。KRAS G12C靶向治疗实现临床可及(图2)。
未解决的临床问题
由于Sotorasib未改善OS,CodeBreaK200研究未达到确证性目的。这可能是由于KRAS的异质性基因特征。Sotorasib和Adagrasib耐药机制包括继发KRAS突变,RTK/RAS信号通路旁路活化,共存突变,组织学转化和免疫适应。需要更为强力的KRAS G12C抑制剂和联合治疗策略。至少13种KRAS G12C抑制剂在临床研究中评估。其中部分(JDQ443和GDC-6036)具有高度选择性,疗效良好。联合KRAS抑制剂和其他靶向抑制剂可能有助于延缓耐药。此外,正在研究联合KRAS抑制剂和ICI(表3)。
NTRK
具有临床意义的新证据
NTRK1~3融合基因在NSCLC中<1%。NTRK异常见于中国NSCLC患者的0.59%。一代TRK抑制剂拉罗替尼和恩曲替尼分别在2018年和2019年获得FDA批准。汇总若干Ⅰ/Ⅱ期研究显示肺癌中ORR 73%,中位PFS 35.4个月;实体瘤ORR 69%,中位PFS 29.4个月。恩曲替尼ORR 61.3%,中位PFS 13.8个月。两种药物均具有CNS活性。肺癌CNS转移患者接受拉罗替尼治疗ORR 63%,恩曲替尼ORR 67%。因此TRK抑制剂治疗NTRK融合肺癌有效(图2)。
未解决的临床问题
TRK抑制剂耐药不可避免,由靶内耐药NTRK激酶域突变和靶外耐药如MET扩增和BRAF或KRAS突变介导。克服靶内耐药需要二代TRK抑制剂。很多新型药物正在研究中,其中Selitrectinib和Repotrectinib在早期研究中结果最具潜力(ORR 45% vs 50%)。PBI-200具有较高的颅脑穿透力。ICP-723是强力二代TRK抑制剂,对于耐药突变如NTRK G595R,F589L和G667C/A/S突变具有高度活性(NCT04685226)。未来研究需要研究抑制靶外耐药通路的策略。
HER2
具有临床意义的新证据
HER2突变占NSCLC的1%~4%。NSCLC的主要HER2突变是20外显子A775_G776insYVMA(80%~90%)。
泛HER2-TKI如阿法替尼、来那替尼和达可替尼对于NSCLC无效。选择性HER2-TKI如吡咯替尼、莫博赛替尼和Poziotinib作为二线或后线治疗疗效中等,ORR 20%~30%。联合HER2抗体曲妥珠单抗和帕妥珠单抗±多西他赛的ORR为21%~29%。
近来,抗HER2抗体偶联药物(ADC)数据报道。首个ADC T-DM1治疗肺癌ORR 44%,中位PFS 5个月。Ⅱ期DESTINY-Lung01研究纳入91例HER2突变经治NSCLC患者, DS-8201治疗的ORR 55%,中位PFS 8.2个月,中位OS 17.8个月。另一项Ⅰ期研究中,DS-8201的ORR 72.7%,中位PFS 11.3个月。基于Ⅱ期随机DESTINY-Lung02研究中经治HER2突变NSCLC患者的ORR 53.8%,FDA授予DS-8201加速批准用于经治HER2突变NSCLC,建立了HER2突变治疗新标准(图2)。
未解答的临床问题
还不清楚DS-8201作为一线治疗是否有效,目前DESTINY-Lung04研究(NCT05048797)正在探索。其次,靶向药物和ADC耐药机制证据还有限。需要将来研究探索克服耐药策略。第三,这些药物的CNS活性尚未评估,未来研究需要纳入CNS转移患者(表3)。
ICI
具有临床意义的新证据
PD-L1是ICI最有效的生物标志物。PD-1/PD-L1抑制剂单药获批用于PD-L1≥50%的患者。PD-1/PD-L1抑制剂联合化疗获批用于PD-L1<50%患者的一线治疗。但是接受ICI联合化疗的PD-L1高表达患者较ICI单药具有更佳疗效。
首先,新型PD-1/PD-L1药物提供了额外治疗选择。EMPOWER-Lung 1研究纳入PD-L1 TPS≥50%的患者,Cemiplimab显著延长中位PFS(8.2个月 vs 5.0个月)和OS(21.9个月 vs 13.0个月)。Ⅲ期EMPOWER-Lung 3研究发现Cemiplimab联合化疗较单纯化疗显著改善PFS和OS。特瑞普利单抗(CHOICE-01)和舒格利单抗(GEMSTONE-302)联合化疗均较单纯化疗改善PFS和OS。
第二,新型治疗联合可增强疗效。联合PD-L1和TIGIT抑制剂具有潜力。Ⅱ期CITYSCAPE研究中,一线Tiragolumab联合阿替利珠单抗改善PD-L1 TPS≥50%患者的ORR和PFS。Ⅲ期POSEIDON研究显示一线Tremelimumab联合度伐利尤单抗和化疗较化疗显著改善PFS(6.2个月 vs 4.8个月,P=0.003)和OS(14个月 vs 11.7个月,P=0.003)。
第三,研究中很少纳入未经治疗或活跃脑转移患者。单臂Ⅱ期ATEZO-BRAIN研究中,一线阿替利珠单抗联合化疗具有类似的系统和颅内反应率(47.5% vs 40%)。中位颅内PFS 6.9个月,中位OS 13.6个月。
此外,Ⅲ期ORIENT-31研究中,信迪利单抗联合贝伐珠单抗类似物IBI305和化疗延长EGFR-TKI治疗失败EGFR突变患者的PFS(6.9个月 vs 4.3个月,P<0.0001)。IMpower150研究亚组显示阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇对比贝伐珠单抗+卡铂+紫杉醇可延长EGFR突变患者的OS。但是结果应谨慎解读。第一项随机Ⅲ期研究CheckMate 722为阴性结果,纳武利尤单抗联合化疗未改善EGFR突变患者的PFS。矛盾结果显示抗血管生成策略具有重要效应。
未解决临床问题
尽管ICI疗效良好,但是由于原发或继发耐药而无反应也十分常见。耐药机制包括丢失新抗原、抗原提呈缺陷、免疫抑制因子上调和T细胞耗竭。需要转化研究和生物学研究增强ICI疗效,克服耐药(表3)。
结论
靶向治疗对于晚期、早期和局部晚期NSCLC同样有效。新近研究显示针对多种癌基因的靶向疗法具有活性,新涌现数据可能影响治疗指南,促进个体化疗法的发展。期待治疗格局继续改变,不断改善肺癌患者生存和生活质量。
Liu SM, Zheng MM, Pan Y, et al. Emerging evidence and treatment paradigm of non-small cell lung cancer. J Hematol Oncol. 2023;16(1):40.
排版编辑:Linda











 苏公网安备32059002004080号
苏公网安备32059002004080号


