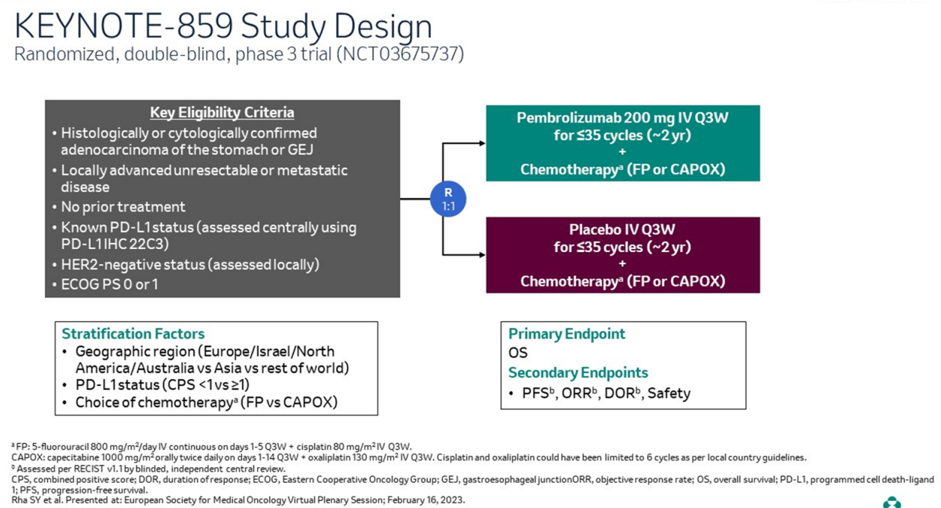
近日胃癌免疫治疗再次迎来重磅里程碑,期待已久的关键性Ⅲ期KEYNOTE-859研究在ESMO Virtual Plenary会议上隆重发布研究结果。研究旨在探索帕博利珠单抗联合化疗一线治疗HER2阴性局部晚期不可切除或转移性胃或胃食管连接部腺癌(G/GEJC)患者的疗效性和安全性。
研究共纳入1579例患者,按1:1随机接受帕博利珠单抗(200mg,Q3W)+FP/CAPOX方案化疗或安慰剂+FP/CAPOX治疗,研究主要终点意向治疗(ITT)人群的总生存期(OS)和次要终点无进展生存期(PFS)、客观缓解率(ORR)等均取得阳性结果,帕博利珠单抗联合化疗为晚期胃癌一线治疗带来新的选择,将重塑当下胃癌治疗格局。
帕博利珠单抗加入化疗较仅单纯化疗显著延长患者总生存并降低22%的死亡风险,中位OS分别为12.9个月vs 11.5个月(HR=0.78,P<0.0001)。
帕博利珠单抗联合组vs化疗组:中位PFS :6.9个月 vs 5.6个月(HR=0.76,P<0.0001);客观缓解率(ORR):51.3% vs 42.0%(P=0.00009);中位DoR:8.0个月 vs 5.7个月。
KEYNOTE-859研究的全阳性结果将对胃癌临床实践产生哪些影响?对胃癌免疫治疗的未来发展带来哪些方向性启示?胃癌精准治疗还存在哪些可能?【肿瘤资讯】荣幸地邀请到北京大学肿瘤医院张小田教授阐述她的思考。
专家简介
北京大学肿瘤医院副院长
中国临床肿瘤学会胃癌专家委员会常务委员
中国抗癌协会肿瘤支持治疗委员会副主任委员
中国抗癌协会肿瘤胃癌专业委员会常务委员
中国女医师协会临床肿瘤学专家委员会秘书长
北京癌症防治学会胃癌防治专家委员会主任委员
点击观看张小田教授采访完整视频
KEYNOTE-859研究会对您的临床实践产生怎样的影响?您认为PD-L1的表达在免疫治疗的决策中发挥怎样的作用?
张小田教授:KEYNOTE-859研究取得了阳性结果,帕博利珠单抗联合氟尿嘧啶类和铂类化疗显著改善了患者的OS、PFS和ORR等。这对临床实践产生了一个直接的影响,即帕博利珠单抗的临床应用又增加了一个高级别的循证医学证据,临床医生在晚期胃癌一线治疗的临床实践中又多了一个有力“武器”。
目前在晚期胃癌一线治疗中通常会考虑PD-L1作为指导治疗的生物标志物,初步认为PD-L1表达评分越高,患者从免疫治疗中获益越多。但PD-L1表达并非是唯一的标志物,用PD-L1表达作为生物标志物去筛选胃癌一线免疫治疗的价值仍存在一定争议。此外不同研究中PD-L1表达的cut off值也可能存在一定差别,有的采用CPS表达大于等于1或5分,有的采用肿瘤面积阳性(tumor area positive,TAP)。总体来说,PD-L1表达在当下晚期胃癌免疫治疗决策中,起着重要但并非唯一的作用。总之,我们期待未来能够基于KEYNOTE-859研究数据将帕博利珠单抗应用于胃癌临床实践,为临床提供多一个选择,为患者带来获益。
在KEYNOTE-859公布的当下,您如何看待KEYNOTE-062的帕博利珠单抗单药在PD-L1高表达胃癌患者中的临床价值?
张小田教授:KEYNOTE-859和KEYNOTE-062研究均是三期RCT,但两者在研究设计上存在差异。KEYNOTE-062的临床研究设计更为复杂,除了帕博利珠单抗联合化疗对比单纯化疗的优效性设计,还包括了帕博利珠单抗单药在PD-L1 CPS≥1人群中非劣效于化疗的比较。
个人认为,在临床实践中,会存在一部分适用chemo-free(去化疗)方案的人群,也就是说KEYNOTE-062研究中帕博利珠单抗单药组数据依然有其指导价值。尽管KEYNOTE-859、Checkmate 649、ORIENT-16、RATIONAL-305研究等均支持化疗联合免疫疗效优于化疗,但仍有部分患者的治疗决策可采用帕博利珠单抗单药或免疫检查点抑制剂单药。
KEYNOTE-062研究的ITT人群中,帕博利珠单抗单药治疗疗效非劣效于化疗,特别是在亚洲人群中,帕博利珠单抗单药不仅非劣于化疗、且中位OS表现出两倍于化疗的获益趋势,并且付出的不良事件代价更小。因此,在临床实践中,仍然有一部分患者适合在初始治疗时接受帕博利珠单抗单药治疗,比如肿瘤负荷比较小、体力状况比较好、PD-L1 CPS高表达的患者。这些患者在后续治疗中还有可能再接受传统化疗等治疗。我们也看到一些数据显示,既往应用过PD-1单抗治疗的患者,后续接受化疗或抗血管生成药物治疗的生存期优于既往未接受过PD-1单抗治疗的患者,也就是说,前线免疫治疗应用对后续治疗疗效有着深远的影响。
在HER2阳性胃癌领域,KEYNOTE-811研究的帕博利珠单抗+抗HER2单抗+化疗模式为一线治疗带来了新的突破。您如何看待KEYNOTE-811帕博利珠单抗+抗HER2单抗+化疗模式的临床价值和应用前景?
张小田教授:KEYNOTE-811研究两年前在ASCO会议上首次公布数据后即引起很大的轰动,当时OS和PFS结果还未出炉,仅基于ORR结果,美国食品药品监督管理局(FDA)就加速批准帕博利珠单抗联合曲妥珠单抗和化疗用于HER2阳性晚期胃癌的一线治疗,中国临床肿瘤学会(CSCO)胃癌指南也将其列为三级推荐,充分体现出中美都对这一疗法寄予厚望。根据KEYNOTE-811研究,帕博利珠单抗+曲妥珠单抗+化疗ORR高达74.4%,其中完全缓解(CR)率更是达到了11%,这意味着这一疗法有可能在部分患者身上实现治愈。
靶免化联合模式可能带来两个突破口:第一点,伴有转移病灶的Ⅳ期胃癌可能通过转化治疗实现长生存。这种联合治疗模式将有望为部分晚期胃癌患者,如肿瘤负荷相对小、生物学行为相对好,同时技术上可切除的患者带来根治性手术的机会。
第二点,对于局部进展期胃癌患者,应当提倡进行新辅助治疗。RESOLVE研究和FLOT研究均已证实了胃癌新辅助治疗的价值。KEYNOTE-811靶免化这种高肿瘤退缩、有希望带来长生存的治疗策略将来一定会从晚期胃癌前移到胃癌围手术期治疗。目前国内外也正在进行靶免化联合模式在围手术期的探索,将有望给更多患者带来临床治愈或根治性手术的可能。
将来对于术前未进行新辅助治疗的HER2阳性胃癌患者,术后的辅助治疗如何去做,也值得关注。因为部分患者可能会由于年龄大、存在急性并发症等原因未进行新辅助治疗而直接手术,那么其术后治疗就非常关键,这种合理但缺乏足够循证医学证据的空白地带,需要临床医生给予关注。
总的来说,靶免化联合模式在未来将是局部进展期和晚期胃癌治疗的重要希望。
随着抗HER2 ADC等药物出现,您认为在HER2阳性晚期胃癌全程治疗中,应当如何对这些抗HER2药物进行合适的排兵布阵?未来在一线治疗中,免疫联合新型抗HER2药物的前景如何?
张小田教授:除了传统的抗HER2单抗曲妥珠单抗外,针对HER2的抗体偶联药物,无论是国内的维迪西妥单抗还是国外T-DXd(德曲妥珠单抗)都是在从末线向前线推进中。基于现有临床证据,一线治疗选择上述的靶免化联合疗法(帕博利珠单抗联合曲妥珠单抗和化疗),二线正在进行ADC类药物的临床研究探索,三线则ADC类药物已在国内获批适应证。
随着ADC类药物的探索不断前移,未来应如何思考HER2阳性晚期胃癌的排兵布阵?首先,ADC类药物已具有一个化疗和一个靶向,再增加一个免疫治疗则要充分考虑安全性问题;同时在晚期一线治疗中,如何选择对照组将是一个复杂问题。如对照KEYNOTE-811研究设计(帕博利珠单抗+曲妥珠单抗+双药化疗),ADC类本身包含有一个化疗药,在ADC平台下,是否化疗药越多越好,我们仍没有答案。因此,ADC向一线治疗迈进中,ADC类药物应当如何选择联合方案、以及如何选择对照组(KEYNOTE-811靶免化模式还是曲妥珠单抗+化疗?)将是我们需要回答的首要问题。
在未来还将涌现其他新型抗HER2药物,包括在研的抗HER2肿瘤疫苗、新型抗HER2双抗、抗HER2 CAR-T等,在往胃癌一线治疗的推进中势必是大浪淘沙。未来一线治疗中,也可能将基于不同的HER2表达状态和不同的HER2变异形式如HER2突变或HER2蛋白融合等选择合理的抗HER2药物。在选择合理的HER2药物后还需考虑合理的免疫联合策略。总而言之,HER2是胃癌最重要的靶点之一,为患者带来了更多治疗可能,但随着更多药物的出现,也迫使临床医生在保持乐观的同时谨慎考虑选择药物、思考联合机制和排兵布阵。
KEYNOTE-062, KEYNOTE-061, KEYNOTE-059的MSI-H亚组分析显示不论线数,MSI-H人群都是帕博利珠单抗的优势人群,而CLDN18.2靶向治疗近期在HER2阴性晚期胃癌一线治疗也取得阳性结果,未来对于HER2, PD-L1, MSI/MMR, CLDN18.2的检测应该怎样排序来指导精准胃癌治疗?
张小田教授:胃癌本身是异质性较强的肿瘤,大部分患者是以一个驱动基因为主,在治疗过程中出现其他突变作为继发耐药机制;也有部分肿瘤由于异质性较强,瘤体内存在不同克隆,分别表达不同的标志物,导致瘤内的异质性,以及可能具有不同的侵袭转移能力的细胞克隆转移到不同器官的器官间异质性。这两种情况都会导致胃癌靶向治疗在不同阶段中对于治疗靶点的选择存在不同的考虑。
简单来说,HER2、PD-L1、MSI、CLDN18.2,以及FGFR、MET等在胃癌患者身上可能存在两个共表达,甚至三个共表达,在整个治疗过程中也可能相继出现更多标志物的表达。因此,首先,临床医生可能需要针对患者的每个阶段、每个转移部位来考虑患者的病理学特征,选择针对性靶点。如卵巢转移的可能CLDN18.2阳性可能性大、肝转移的可能HER2阳性可能性大、大体积肿瘤可能是MSI-H/dMMR型肿瘤等。同时,临床医生需要基于既往临床证据或实践经验来判断不同靶点的驱动价值,判断其是否是值得对抗的靶点。第二点,治疗过程中准确全面检测基因变异情况是准确选择治疗靶基因的前提。未来我们可能需要建立预测模型来帮助临床医生去判断肿瘤的主要驱动基因,以弥补单纯人脑分析和综合临床信息分析存在的不足。因此,在人工智能时代,利用医工交叉学科的新方式来做智能决策是未来的重要需求,完善的基线检测、治疗过程中的新的检测、区别液体活检和组织活检结果、区别空间异质性和时间异质性等,都可以帮助临床医生针对患者的实时状态进行精准的治疗决策规划。
我想,不断发现的靶点,既是临床医生的幸福也是临床医生的苦恼,幸福在于“有靶可用”,苦恼在于不知该针对哪个靶点治疗。相信未来随着更多临床经验和临床数据的积累,我们能够获得一个办法帮助我们全面检测出变异基因并精准选择驱动基因,也期待我们能在前瞻性临床研究中将伴随的转化研究做好,来回答这些临床问题。
审批编号:MI-PD1-4293-CN
过期日期:3/15/2024
本资讯由默沙东医学团队提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
排版编辑:肿瘤资讯-Phoebe











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


