随着基础研究的不断推进,乳腺癌相关的分子事件被逐步阐明。在诸多分子信号通路中ER通路和HER2通路已经被临床医生作为治疗特定乳腺癌的靶点,大量靶向ER和HER2信号通路的药物的临床疗效已被临床试验的证实。内分泌药物和HER2靶向药物的临床广泛运用极大改善了乳腺癌患者的预后。

浙江大学医学院附属邵逸夫医院肿瘤外科 副主任医师
耶鲁大学与浙江大学联合培养肿瘤学博士,耶鲁大学博士后,剑桥大学附属阿登布鲁克医院访问学者,伦敦圣乔治大学附属医院访问学者
临床方面严格按照循证原则,擅长乳腺,甲状腺,胃肠道肿瘤等常见实体瘤的个体化精准治疗。包括乳腺良恶性肿瘤微创活检,保乳根治术,改良根治术,前哨淋巴结活检,各种乳房重建术,以及乳腺癌综合诊治,甲状腺良恶性疾病的微创治疗。基础研究方面主要围绕乳腺癌内分泌耐药机制及逆转策略,乳腺癌癌前病变开展转化医学研究。
浙江省卫生高层次人才培养对象(医坛新秀)( 2020年),浙江大学郑树医学精英奖学金获得者( 2019年),浙江大学医学院附属邵逸夫医院优青培育人才项目( 2018年),首届中国临床肿瘤学会(CSCO)“35 under 35”青年潜力肿瘤医生称号获得者( 2017年)。
主持和主参与国家自然科学基金课题5项,科技部支撑项目1项及浙江省自然基金项目多项。已发表SCI论文30余篇,包括PNAS, Nature Communications, Nucleic Acids Research,Journal of Hematology & Oncology, Oncogene, EMBO Molecular Medicine等国际知名杂志,被他人引用次数超1700次, H-Index 17 。
经典的PI3K-AKT-mTOR信号通路在人体病理生理过程中具有重要作用,在肿瘤细胞中存在该信号通路的异常激活,导致肿瘤细胞增殖、转移、耐药等可致不良预后的现象出现。因此靶向PI3K-AKT-mTOR信号通路是乳腺癌极具潜力的治疗策略。
基于BOLERO-2试验研究结果,靶向mTOR的依维莫司(everolimus)已获批用于HR+进展期乳腺癌。尽管后续靶向泛PI3K(Pan-PI3K)的抑制剂并未获得理想的临床效果,近期发表的SOLAR-1试验提示PI3K特异性抑制剂(特异性靶向抑制p110α-PIK3CA)的药物Alpelisib (ALP)能显著延长HR+ PIK3CA突变晚期乳腺癌患者的无进展生存期 5.3个月(11个月 vs 5.7个月)。
为了更加全面的认识PI3K-AKT-mTOR信号通路在乳腺癌中的作用和治疗策略,本文对此进行简述。
内容提示:
本期周济春博士将围绕PI3K-AKT-mTOR信号通路在乳腺癌中的研究现状,简要阐述靶向PI3K-AKT-mTOR信号通路的前世今生。本文将介绍以下内容:
1. PI3K/AKT/mTOR信号通路概述
2. PI3K/AKT/mTOR信号通路与乳腺癌
3. 靶向PI3K/AKT/mTOR信号通路的策略分析
4. 靶向PI3K/AKT/mTOR信号通路的临床试验简述
5. 靶向PI3K/AKT/mTOR信号通路的前景探讨

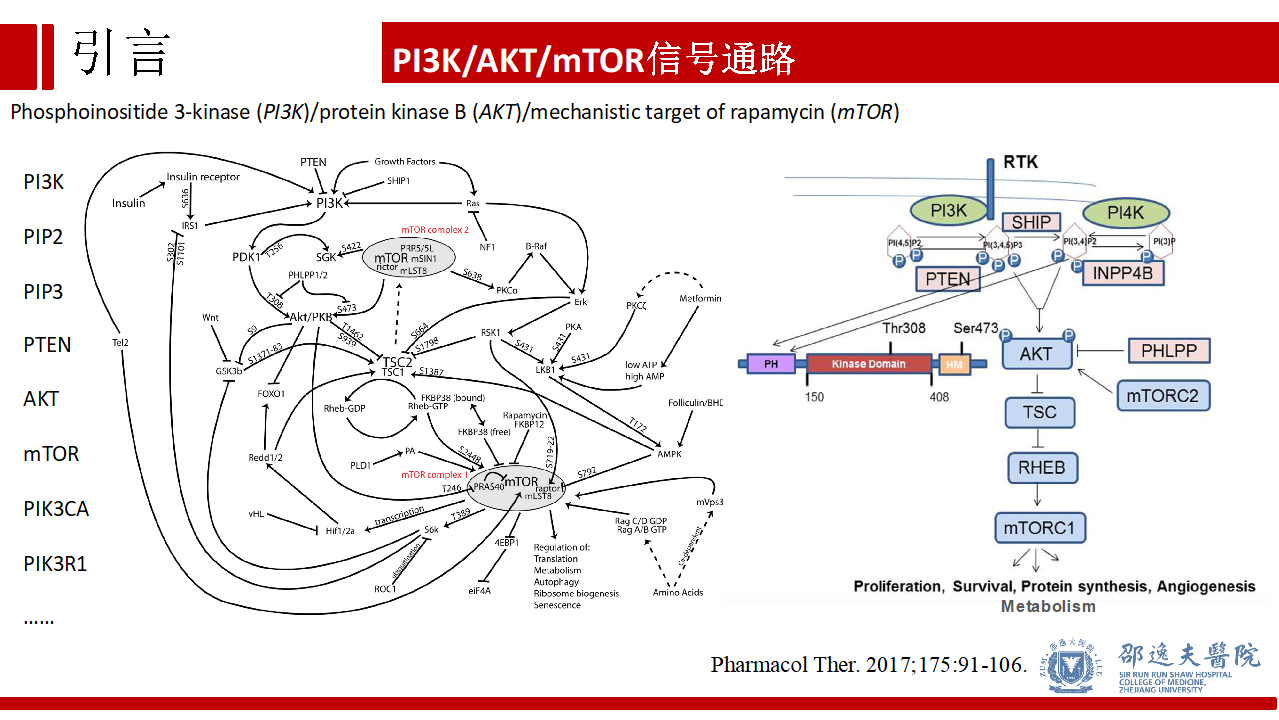
PI3K/AKT/mTOR信号通路是临床医生耳熟能详的信号通路。在正常细胞组织中具有促增殖,蛋白合成,血管生成,代谢等作用,而在肿瘤细胞中具有驱动肿瘤细胞转移,耐药,增殖等作用。
实际上PI3K/AKT/mTOR信号通路及其复杂性远非三个分子可以概括,要了解这条信号通路,我们需要了解该信号通路的多个参与分子,其中又以PIP2,PIP3,PTEN,PIK3CA,PIK3R1等几个分子最为重要。
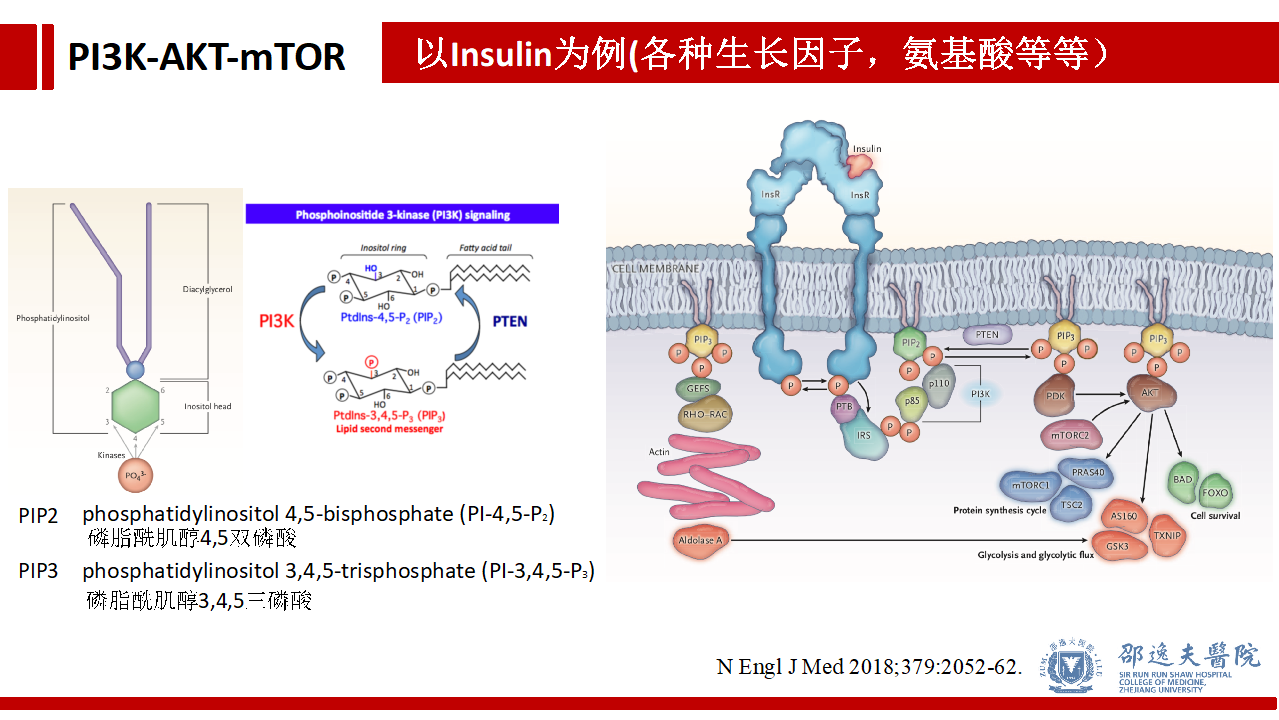
以胰岛素作用于细胞的分子机制为例。胰岛素作为第一信使与细胞表面的胰岛素受体(InsR)结合,其他诸多的生长因素,氨基酸等都可通过类似途径激活受体赖氨酸激酶RTK,进而活化PI3K家族分子。
PI3K使磷脂酰肌醇4,5二磷酸(PIP2,phosphatidylinositol 4,5-bisphosphate (PI-4,5-P2) )发生磷酸化生成磷脂酰肌醇3,4,5三磷酸(PIP3,phosphatidylinositol 3,4,5-bisphosphate (PI-4,5-P2) )。而抑癌基因PTEN能够抑制上述过程,避免上述分子事件过渡激活。
活化的PIP3作为第二信使作用于AKT,引起下游信号通路(包括mTOR)的活化,最终导致蛋白合成增加和细胞增殖等。
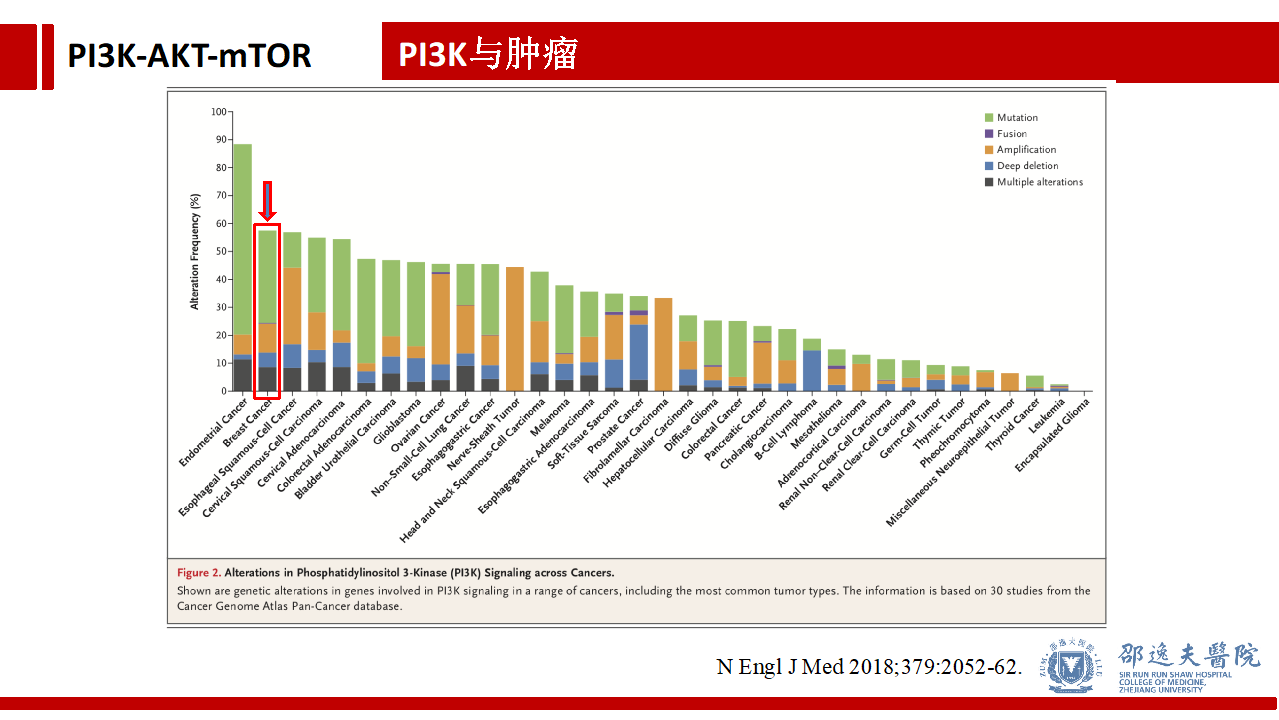
如前所述PI3K/AKT/mTOR信号通路在肿瘤细胞中具有重要作用,在诸多肿瘤中均存在PI3K信号的改变。接近60%的乳腺癌存在PI3K信号通路的异常。
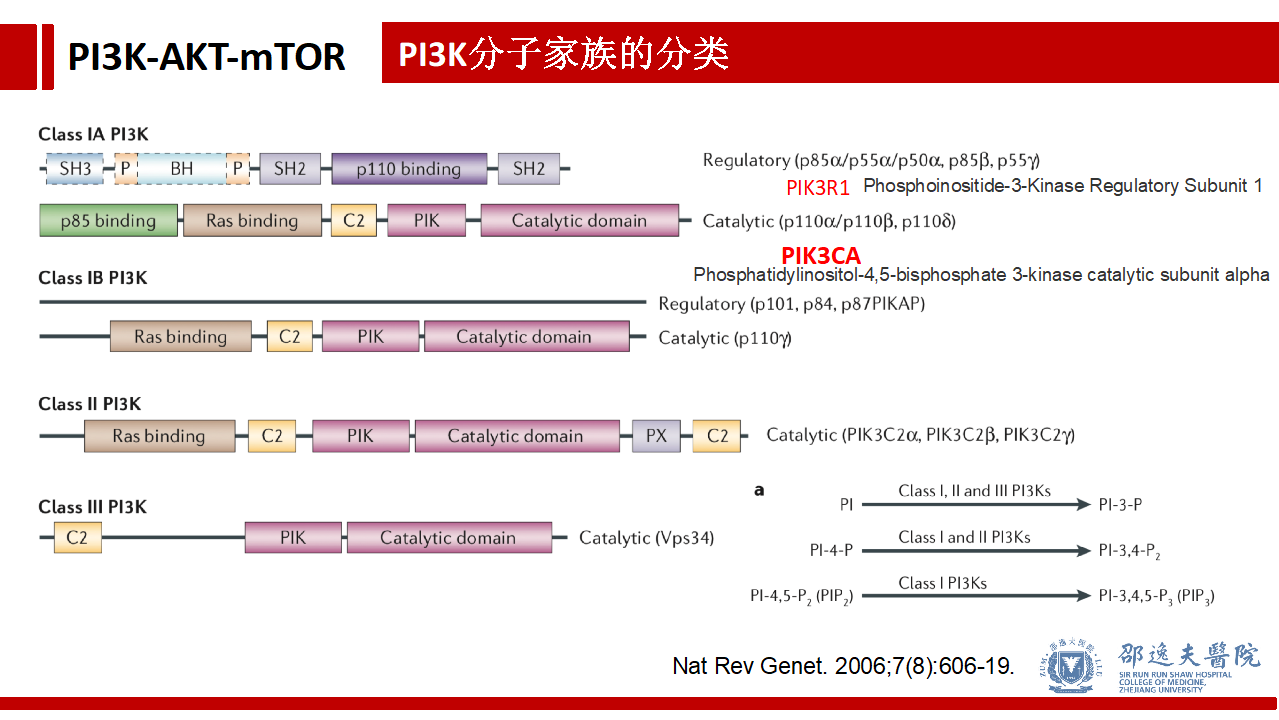
PI3K是一个非常大的分子家族,分为 Class IA,Class IB,Class Ⅱ,Class Ⅲ几个大类。其中Class IA在PIP2(磷脂酰肌醇4,5二磷酸)转化为PIP3(磷脂酰肌醇3,4,5三磷酸)中具有重要作用。
Class IA PI3K分子结构中根据功能又可分为:调节亚单位和催化亚单位。其中调节亚单位包括p85α(又称PIK3R1,Phosphoinositide-3-Kinase Regulatory Subunit 1)、p55α,p50α,p85β,p55γ等,而催化亚单位包括p110α(大名鼎鼎的PIK3CA Phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha)、p110β和p110δ。
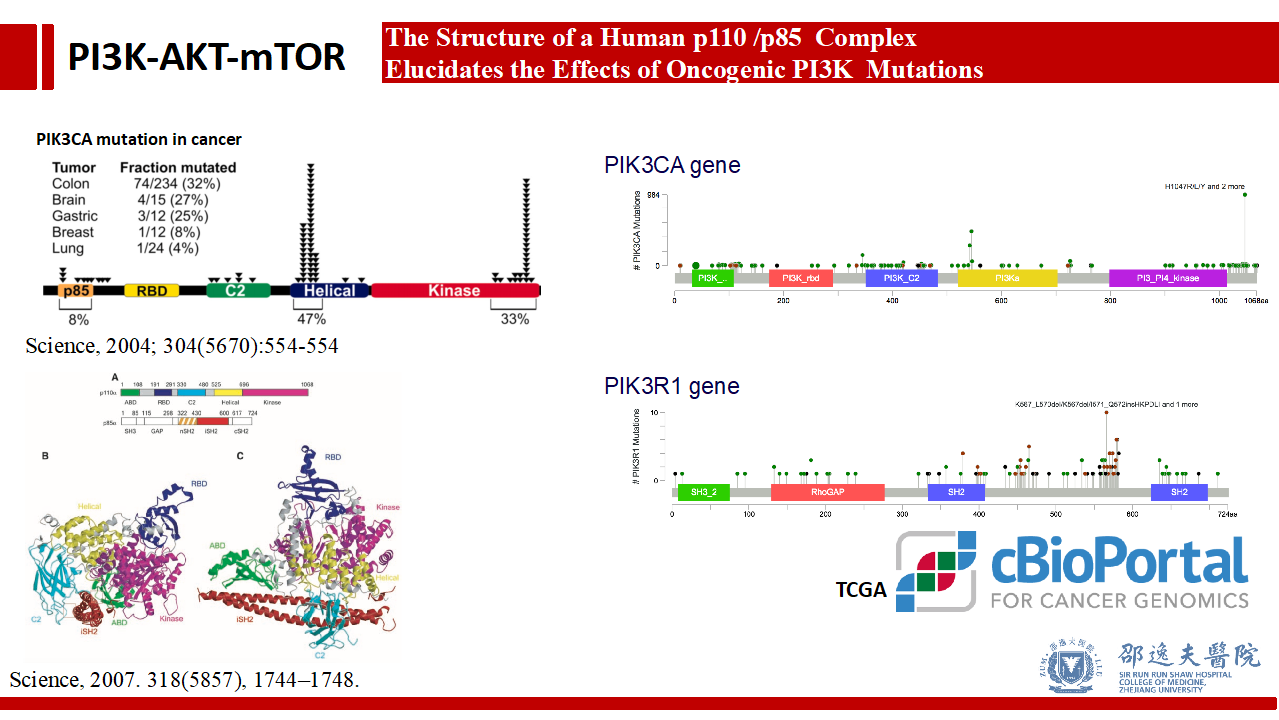 既往已有众多研究证实p110α(PIK3CA)和p85α(PIK3R1)的突变是重要的肿瘤发生发展机制。通过简单检索cBioPortal(基于TCGA数据库)可以发现乳腺癌中存在PIK3CA和PIK3R1基因的多个位点突变情况。
既往已有众多研究证实p110α(PIK3CA)和p85α(PIK3R1)的突变是重要的肿瘤发生发展机制。通过简单检索cBioPortal(基于TCGA数据库)可以发现乳腺癌中存在PIK3CA和PIK3R1基因的多个位点突变情况。
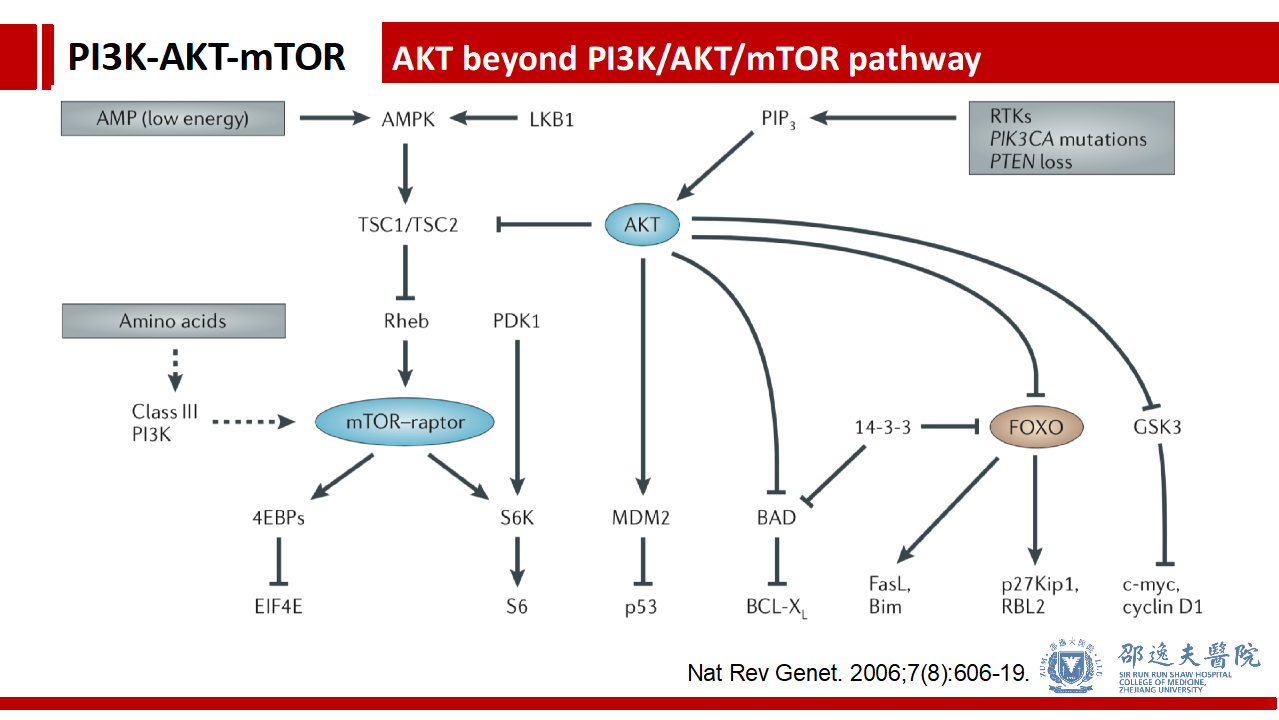
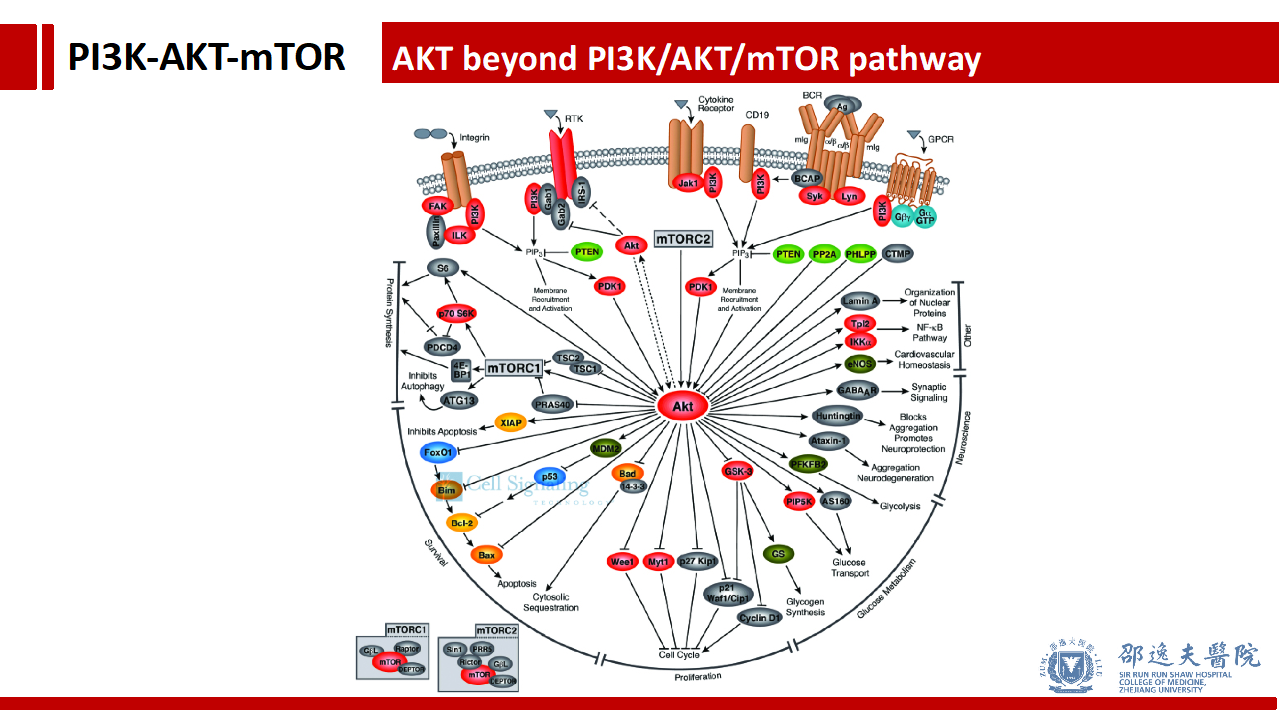
PI3K/AKT/mTOR信号通路的第二个重要分子节点是AKT, 实际上AKT分子除了参与PI3K/AKT/mTOR信号通路以外,还参与细胞内其他众多分子事件。这一特性可能也阻碍了相应靶向抑制剂的开发。由于AKT分子的广泛存在(且肿瘤内突变率较低)导致,靶向药物不可避免的影响其他信号通路,而杀伤正常细胞,将导致临床不可控的毒副反应发生。
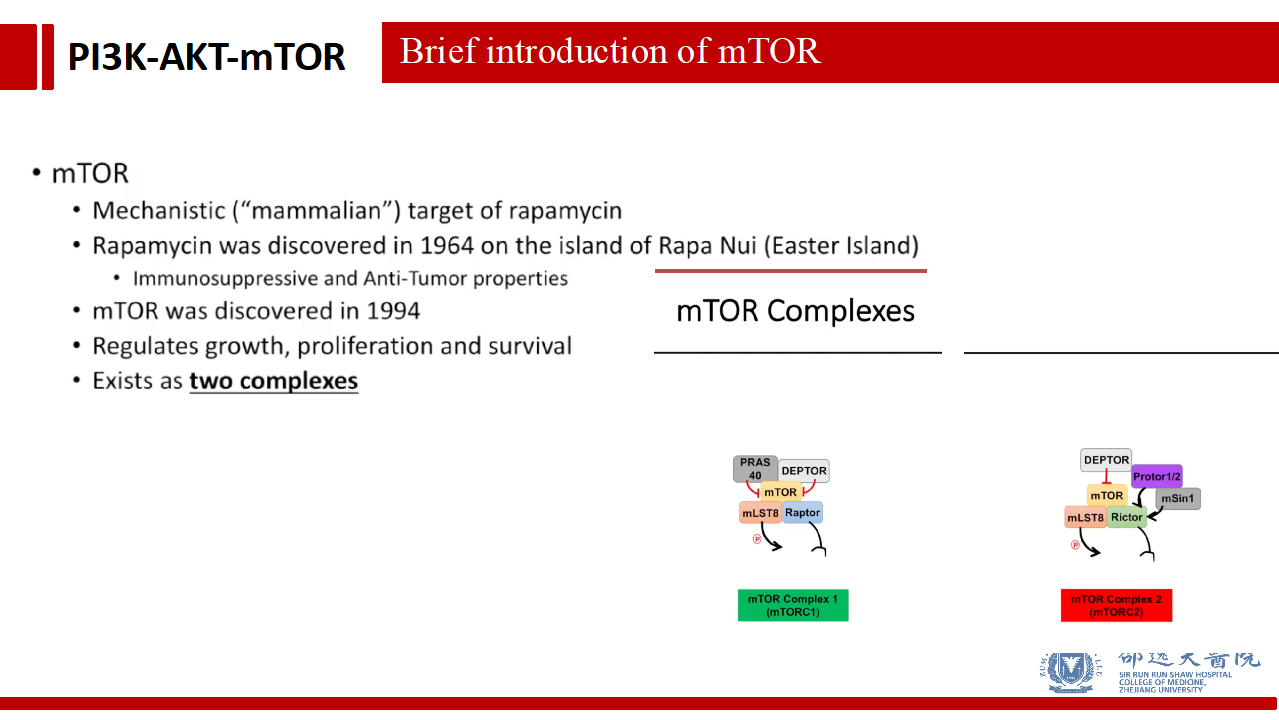
PI3K/AKT/mTOR信号通路的第三个重要分子节点是mTOR分子。mTOR是哺乳动物雷帕霉素靶点的简称(Mechanistic/mammalian target of rapamycin)。雷帕霉素Rapamycin早在1964年在一个名为Rapa Nui的小岛上发现,被证明具有免疫抑制和抗肿瘤特性。一直到1994年,雷帕霉素的作用靶点mTOR才被正式发现。目前发现mTOR复合物具有两大类,分别为mTOR1和mTOR2,其中以mTOR1的研究更为透彻。

在2017年,有诺贝尔奖风向标之称的拉斯克奖颁给了Michael N. Hall教授以表彰他在发现mTOR1和mTOR2中的贡献。由此可见mTOR分子的重要性。
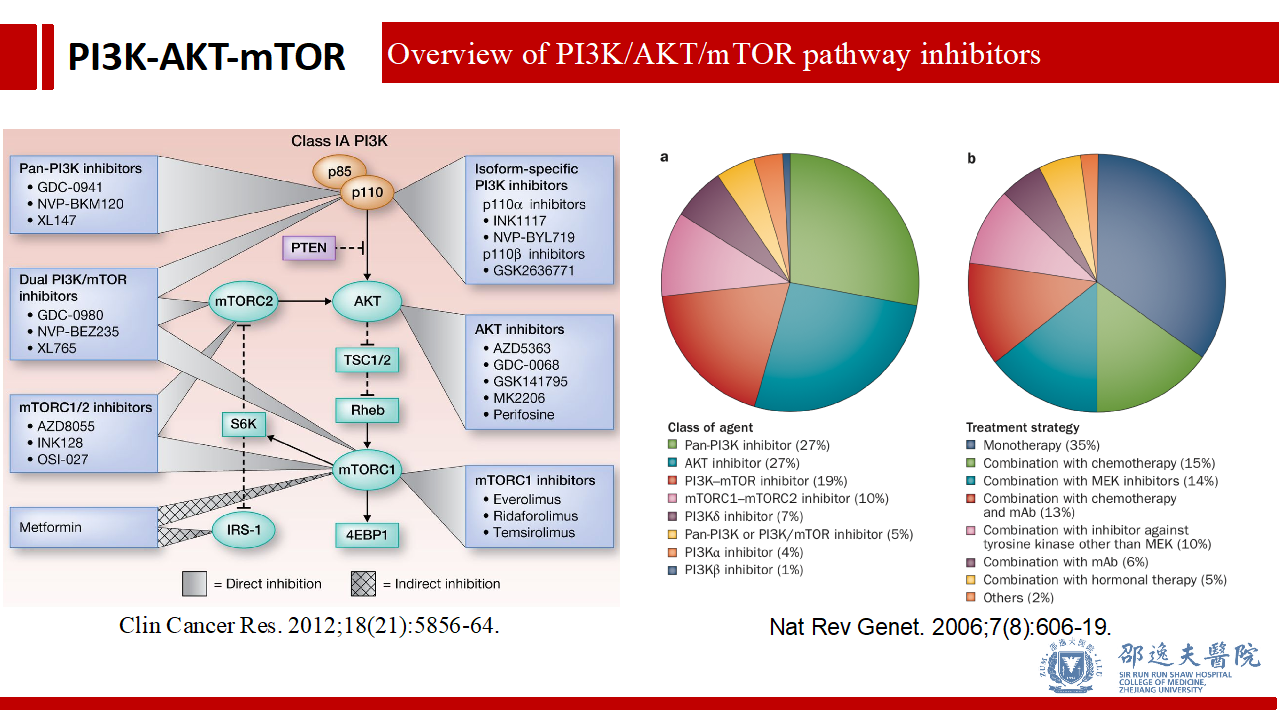
在完成上述PI3K/AKT/mTOR信号通路简述以后,我们把目光转移到靶向该信号通路的药物研发上。目前已有大量靶向处于不同研发验证阶段PI3K/AKT/mTOR信号通路的抑制剂,同时也存在与现有药物的多种不同组合策略。
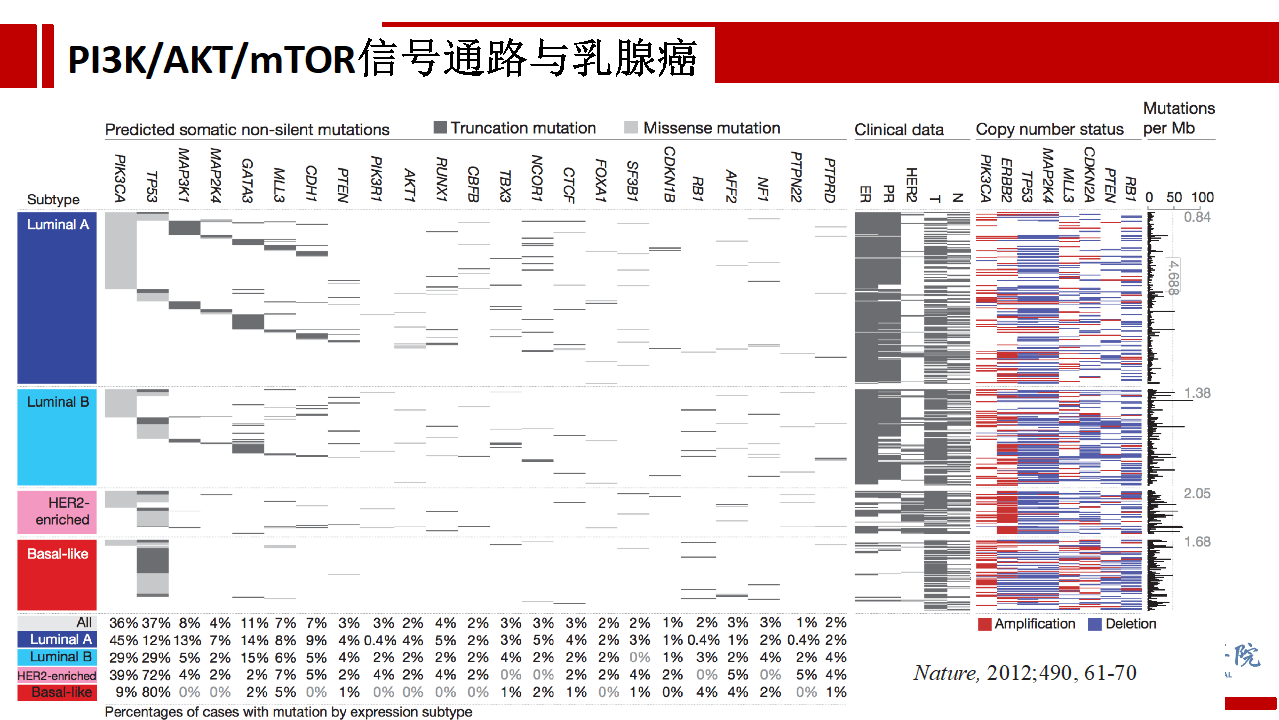
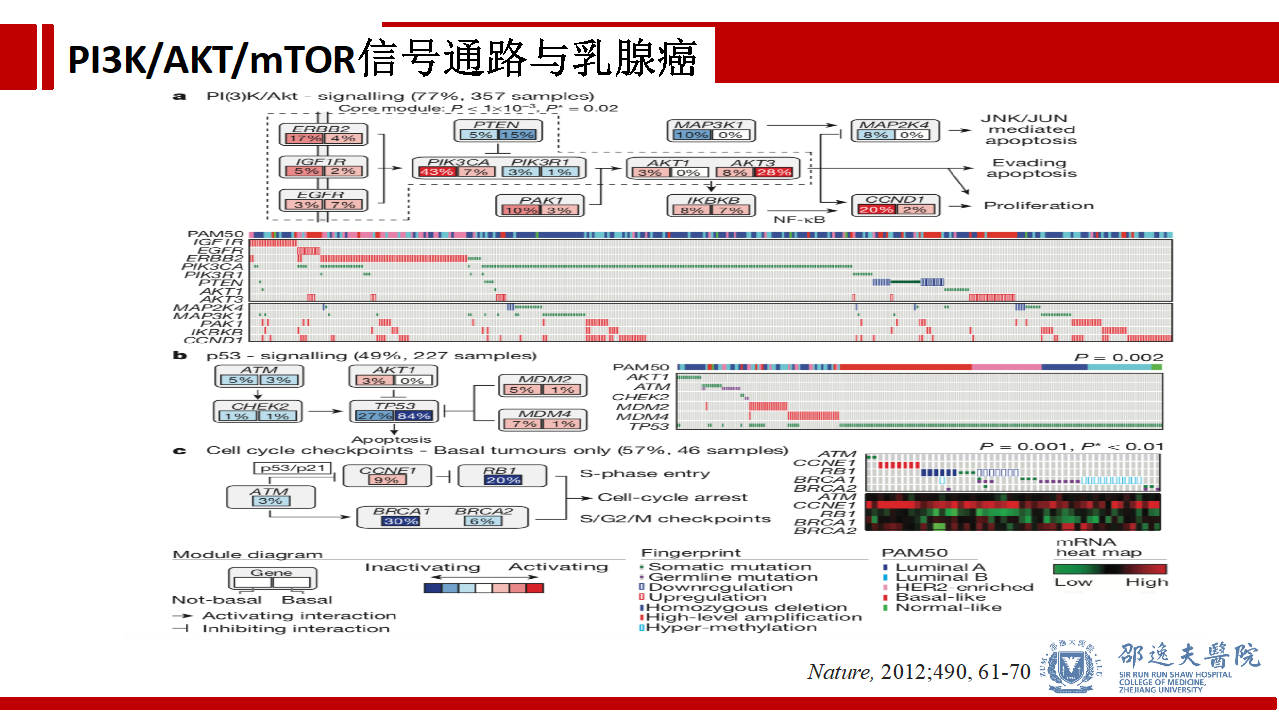
在乳腺癌领域,以TCGA为代表的高通量测序研究结果提示乳腺癌的中各种癌基因变异谱。在PI3K/AKT/mTOR信号通路中,平均36%的乳腺癌存在PIK3CA突变,其中Luminal A(45%),Luminal B(29%),HER2阳性型(39%),三阴性型(9%)。此外信号通路激活情况分析亦提示77%乳腺癌标本中存在PI3K/AKT信号通路的激活。基于这些结果,靶向PI3K/AKT/mTOR信号通路是乳腺癌极具潜力的治疗策略。
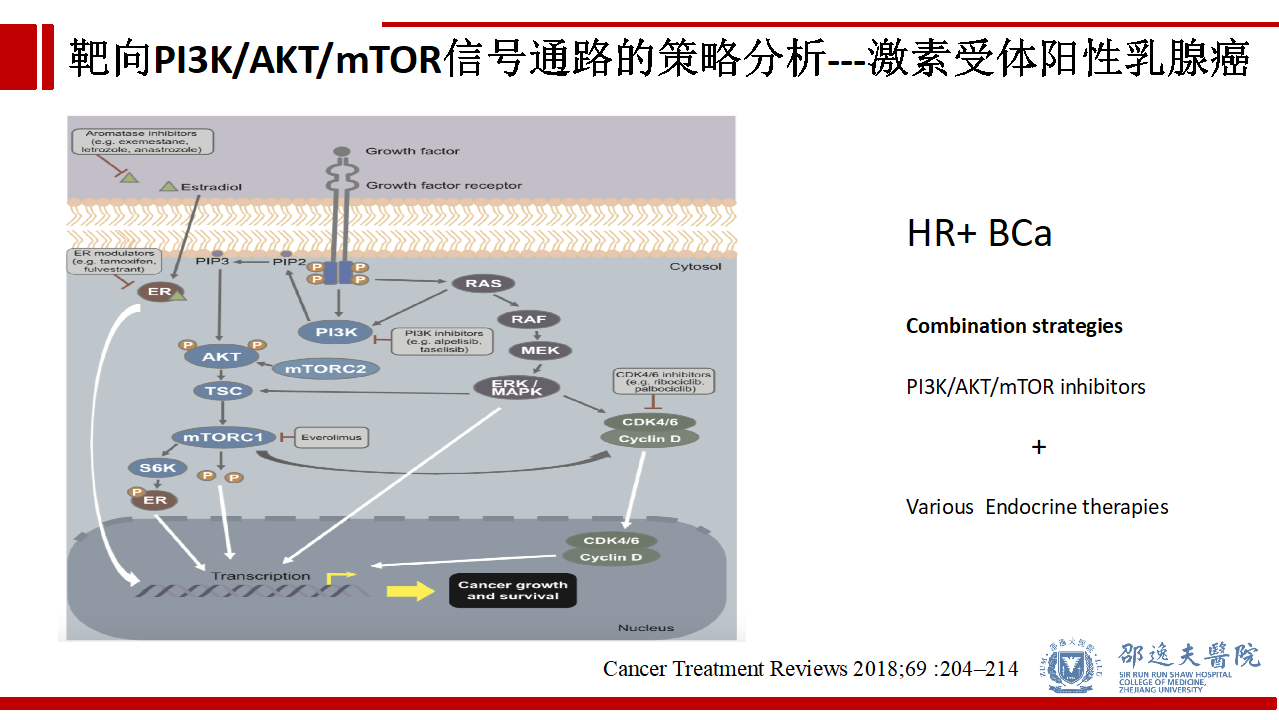
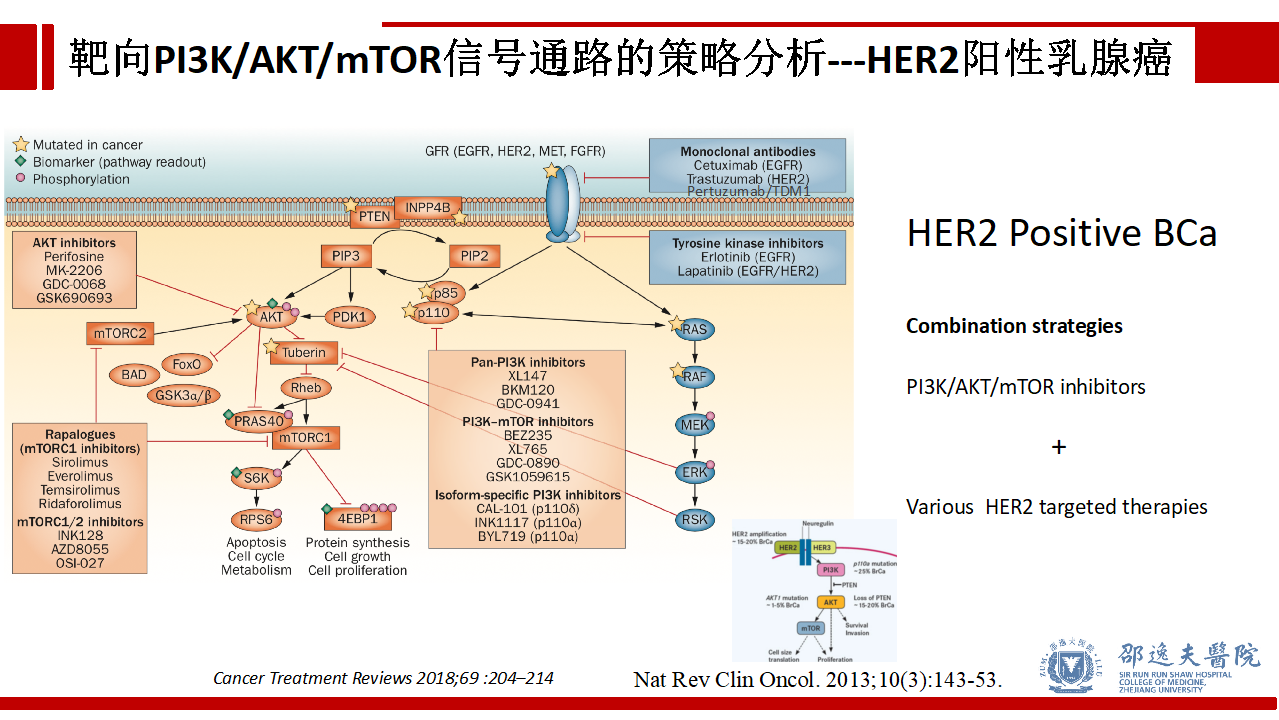
乳腺癌中ER信号通路/HER2信号通路与PI3K/AKT/mTOR信号通路存在crosstalk现象。理论上,在激素受体阳性的乳腺癌中,PI3K/AKT/mTOR信号通路抑制剂可与现有的内分泌治疗药物联合,在HER2阳性的乳腺癌中,PI3K/AKT/mTOR信号通路抑制剂可与现有的靶向HER2治疗的药物联合,上述两种联合策略具有增强肿瘤杀伤的作用。


从指南层面来看,不管是NCCN指南还是ESO-ESMO指南推荐mTOR抑制剂依维莫司联合内分泌治疗作为HR+晚期乳腺癌的治疗方案。目前为止,尚无其他PI3K/AKT/mTOR信号通路抑制剂进入指南推荐行列。随着SOLAR-1试验结果的公布,Alpelisib (ALP)能否进入指南推荐,值得期待。
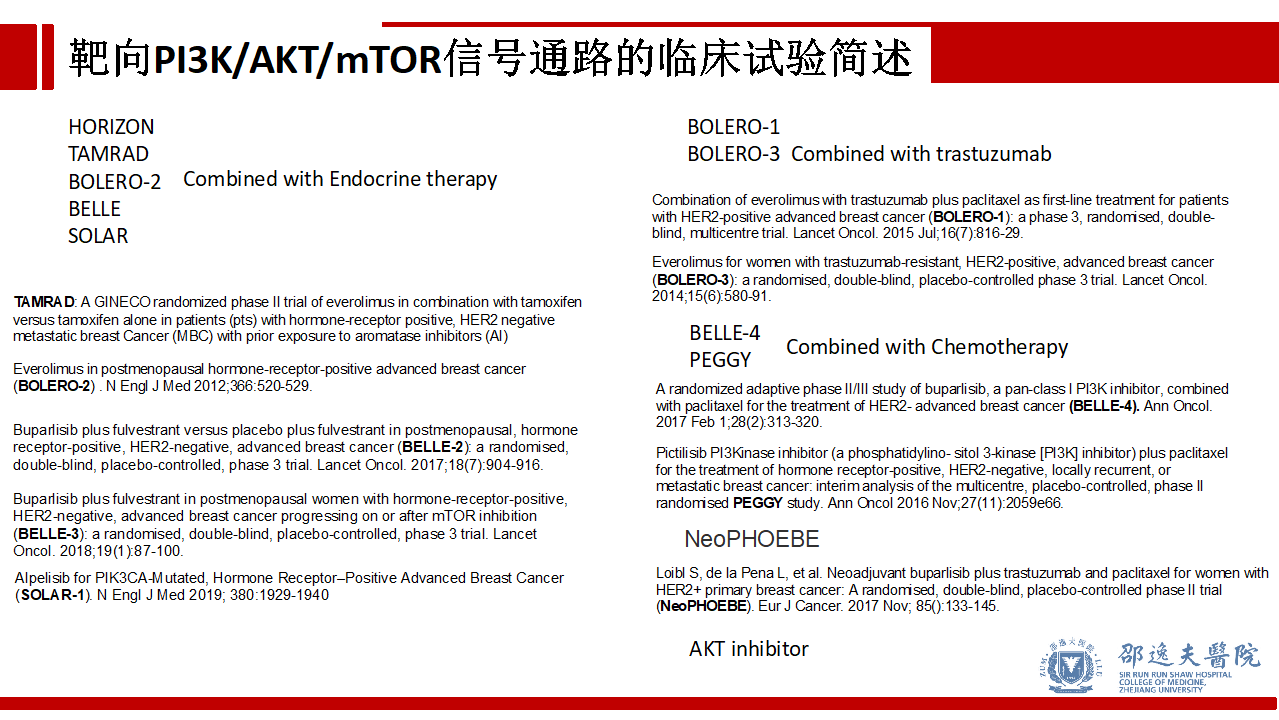
简单总结PI3K/AKT/mTOR信号通路抑制相关已发表的临床试验,相关抑制剂分别联合内分泌治疗,靶向治疗和化疗,主要涉及晚期乳腺癌,同时也有新辅助领域的尝试和探索。目前以mTOR抑制剂Everolimus为主,同时涉及Pan-PI3K抑制剂和特异性靶向p110α-PIK3CA的抑制剂。
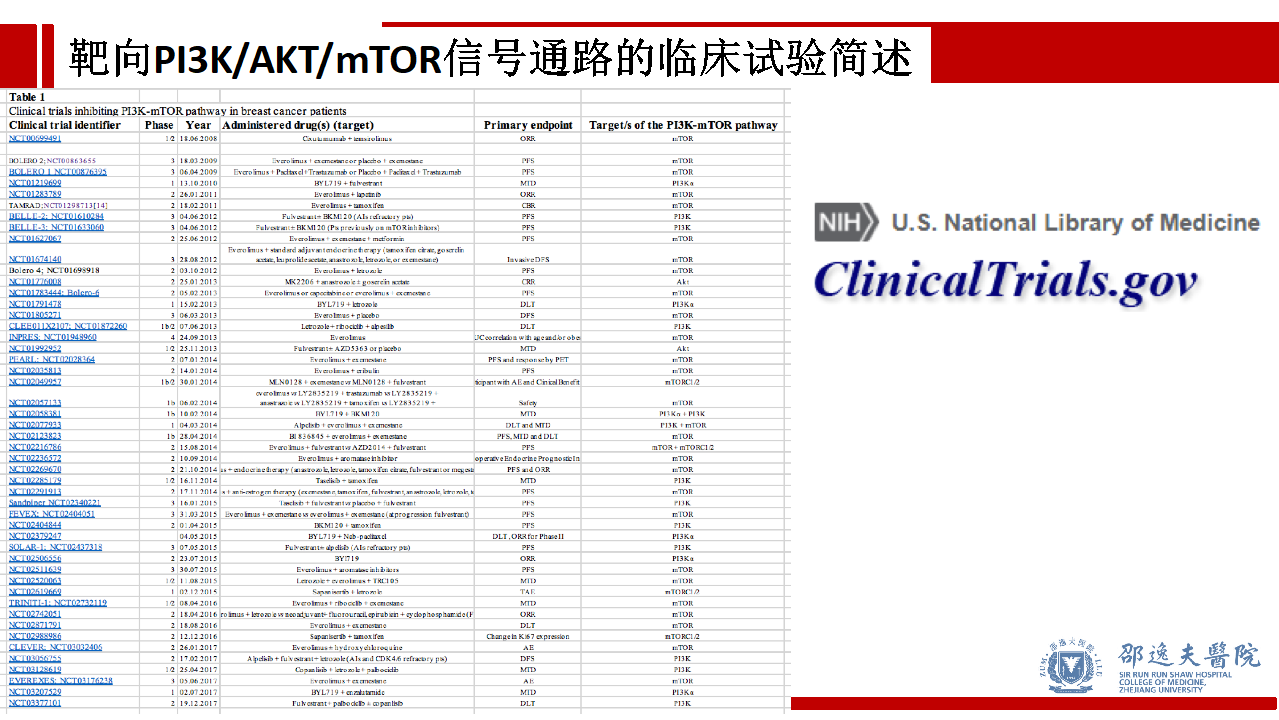
查询ClinicalTrials.gov可发现众多处于不同阶段不同组合抑制PI3K/AKT/mTOR信号通路药物的临床试验。这些临床试验结果将可能改变现有晚期乳腺癌的药物治疗方案,值得期待。

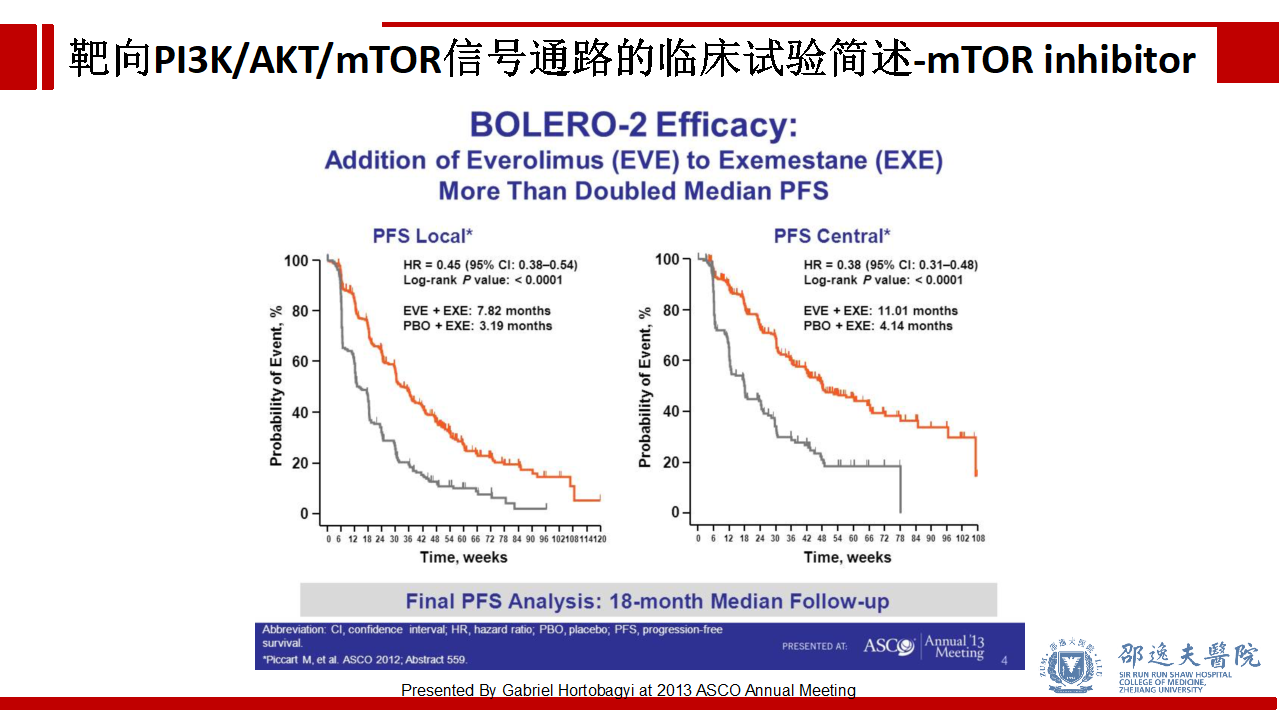
BOLERO-2试验证实依维莫司联合依西美坦较单独依西美坦显著改善HR+晚期乳腺癌患者的预后,尽管存在较大的毒副反应,该研究结果改变了HR+晚期乳腺癌治疗的临床实践。

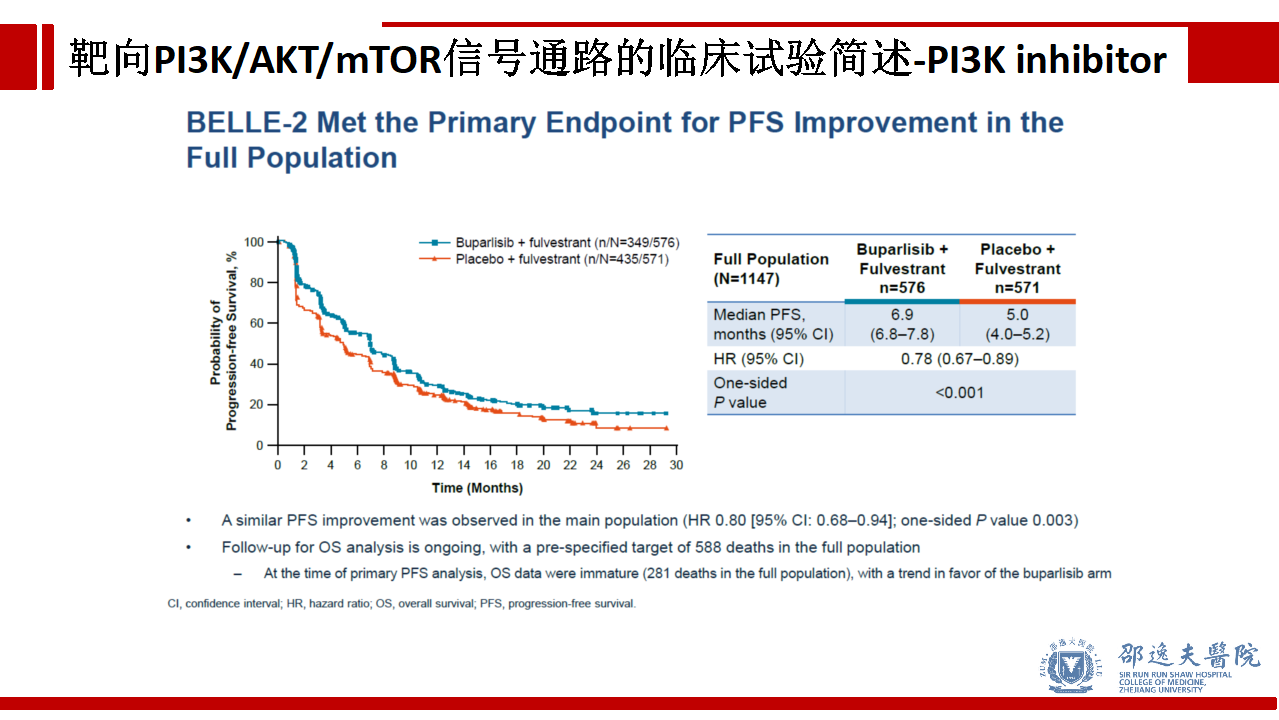
如前所述靶向PI3K存在两种策略:泛PI3K(Pan-PI3K)抑制和PI3K异构体特异性抑制。作为Pan-PI3K抑制剂的代表性试验BELLE-2结果在统计学上取得了显著差异,但这种差异并没有临床意义,加入Buparlisib仅获得1.9个月的PFS获益。
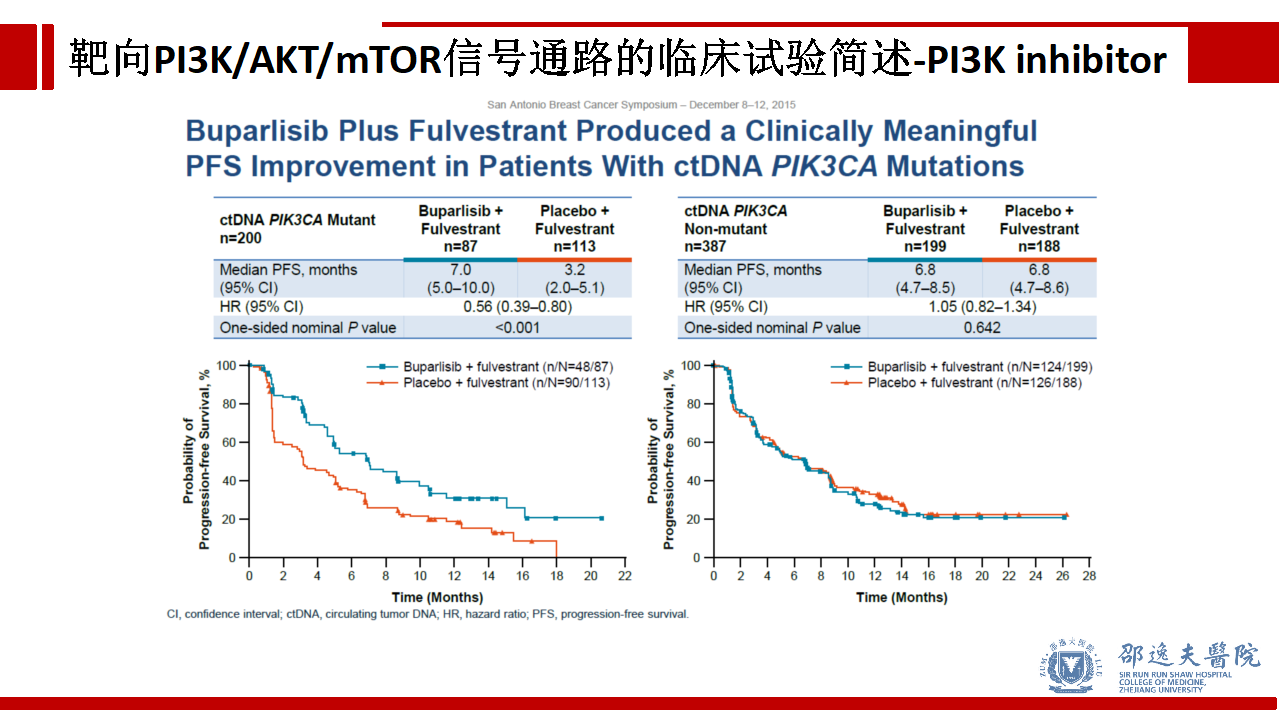
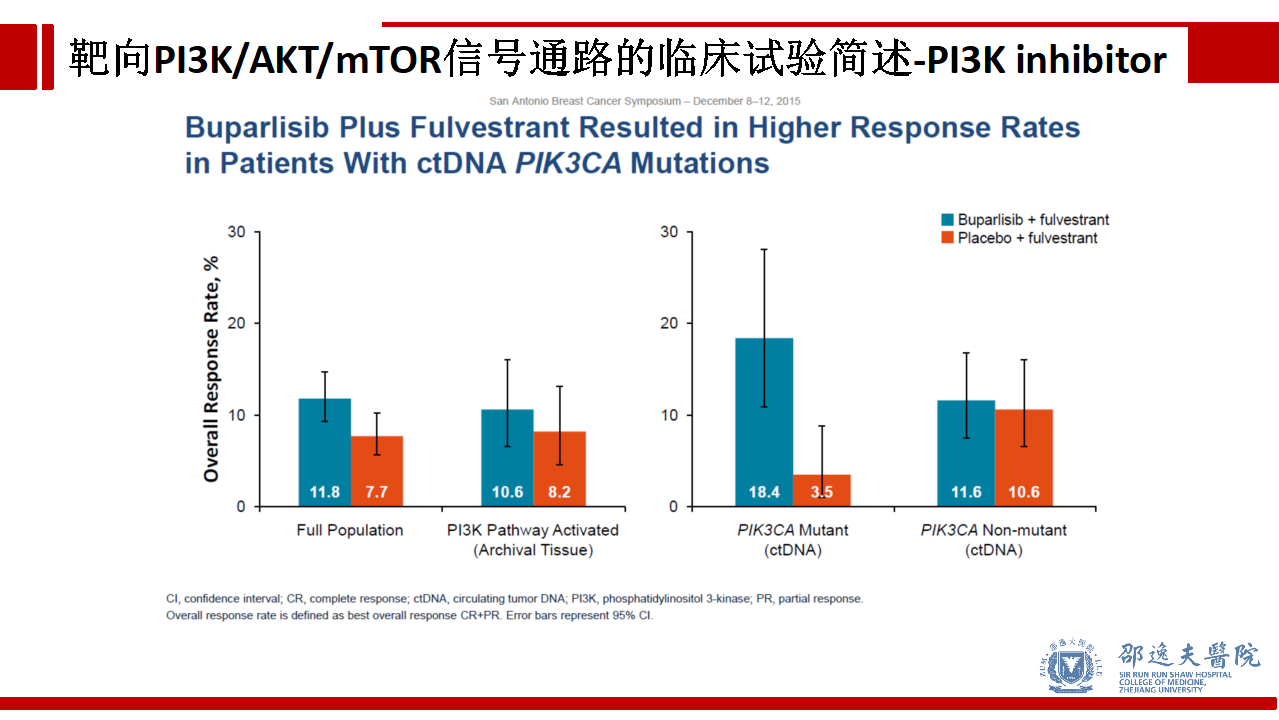 但在ctDNA PIK3CA突变的亚组人群中,加入Buparlisib可使患者的PFS从3.2个月提高到7.0个月。
但在ctDNA PIK3CA突变的亚组人群中,加入Buparlisib可使患者的PFS从3.2个月提高到7.0个月。
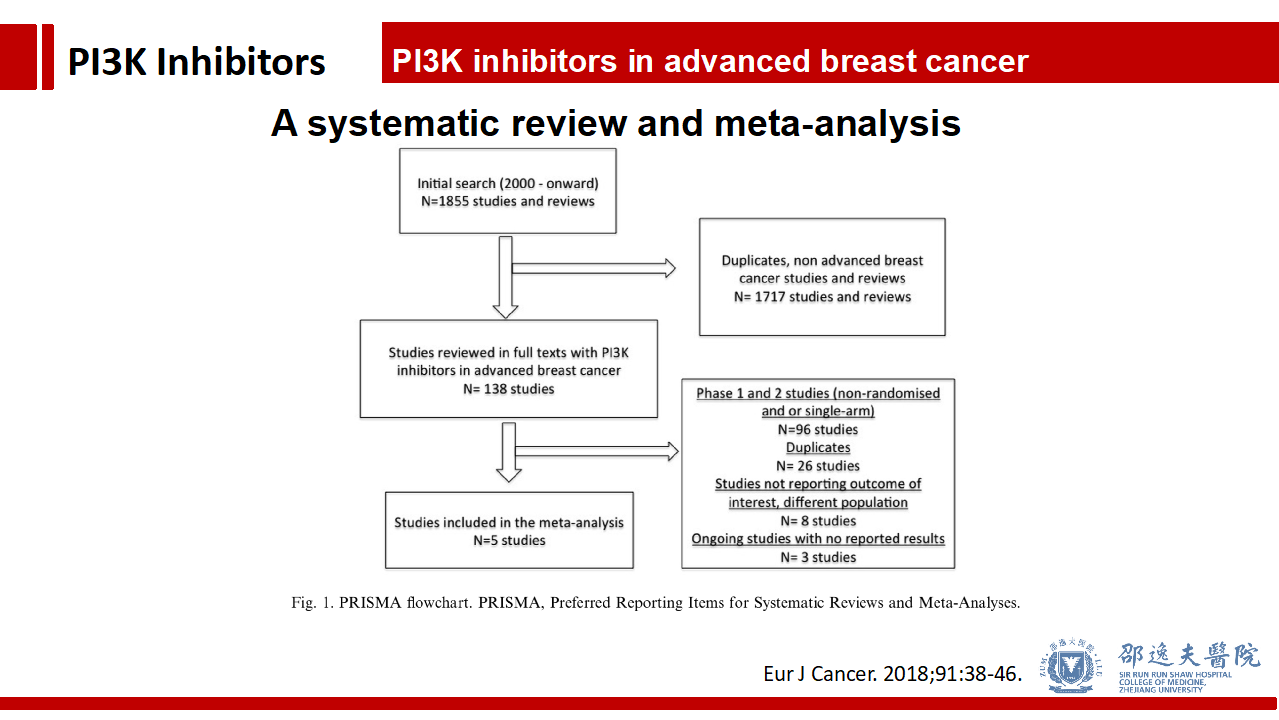
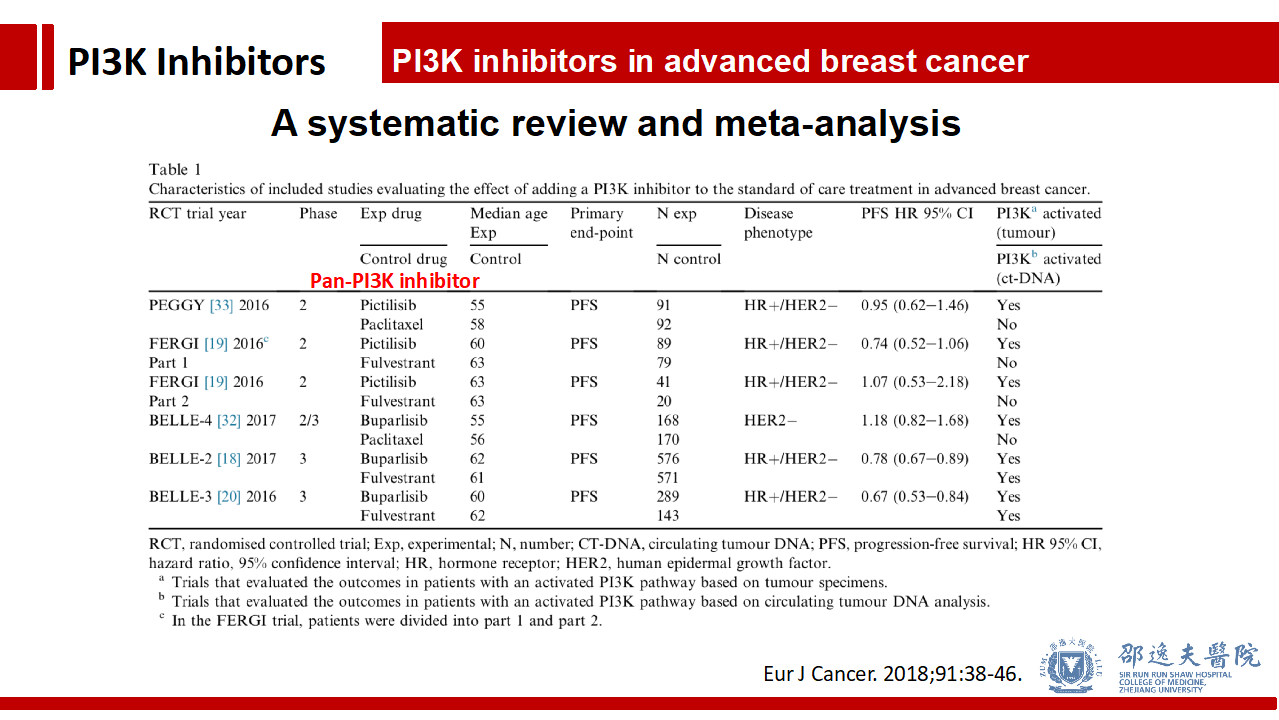
其他Pan-PI3K抑制剂的临床试验不逐一介绍,我们通过2018年发表于Eur J Cancer上的荟萃分析进行总体介绍。该荟萃分析共纳入5个Pan-PI3K抑制剂的临床试验。
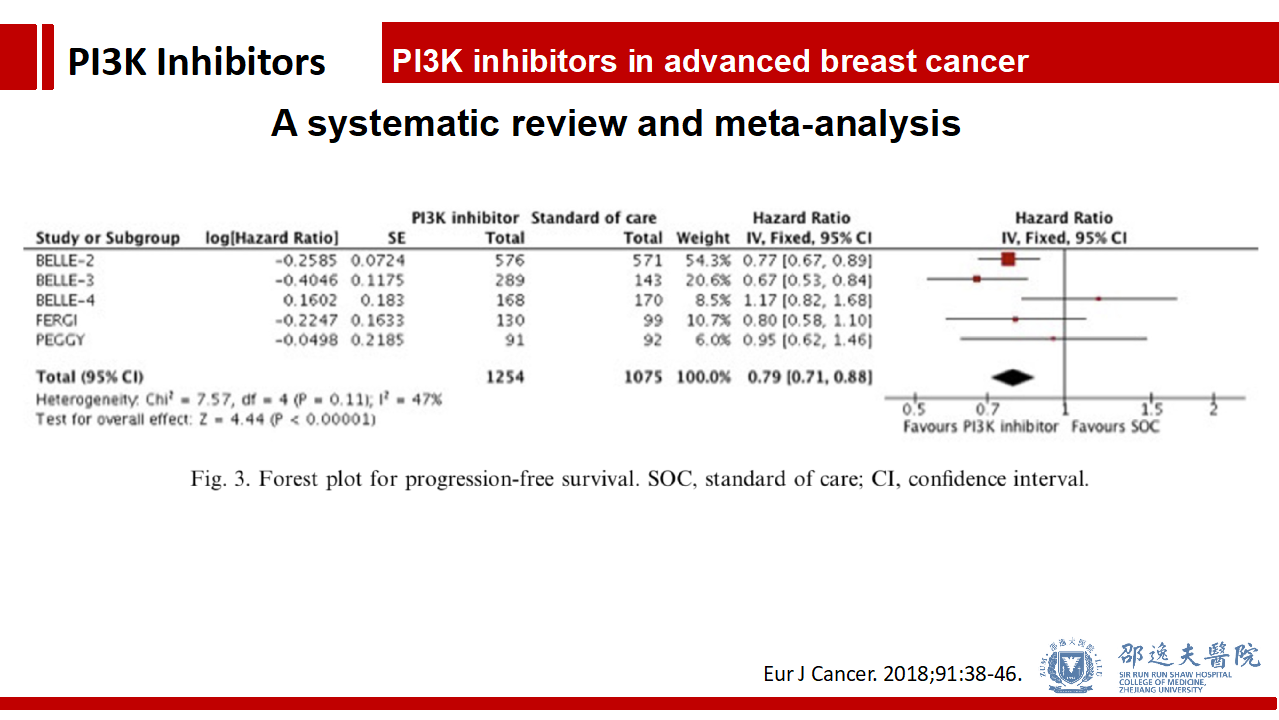
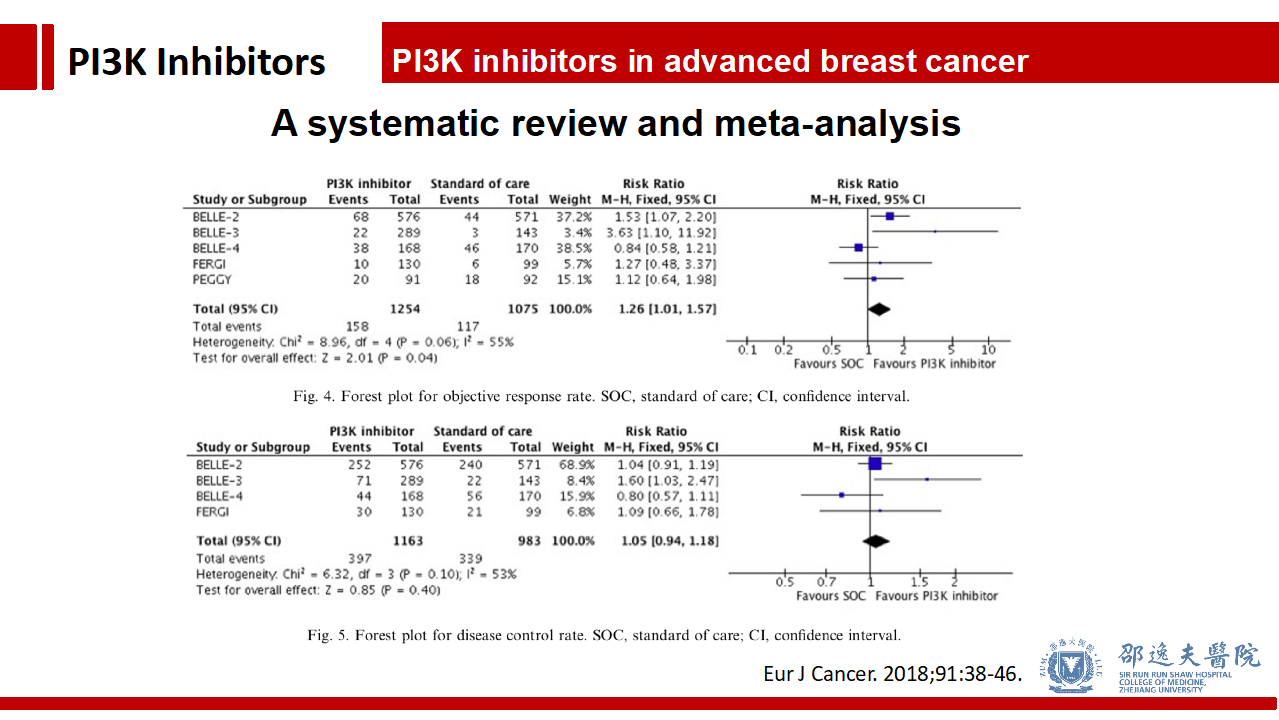
总体而言Pan-PI3K抑制剂能改善PFS和客观反应率,不改善疾病控制率。
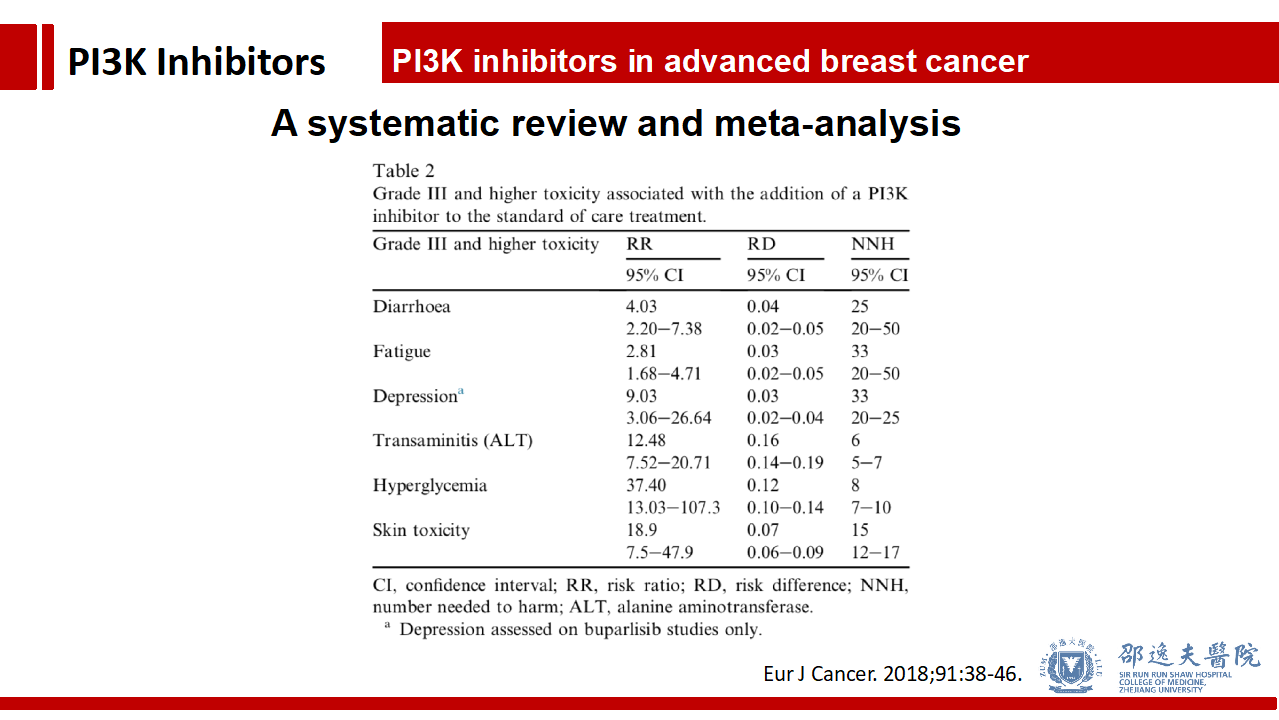
与对照组相比,Pan-PI3K抑制主要的III级及以上毒副反应为腹泻,疲劳,抑郁,转氨酶升高,高血糖及皮肤毒性。
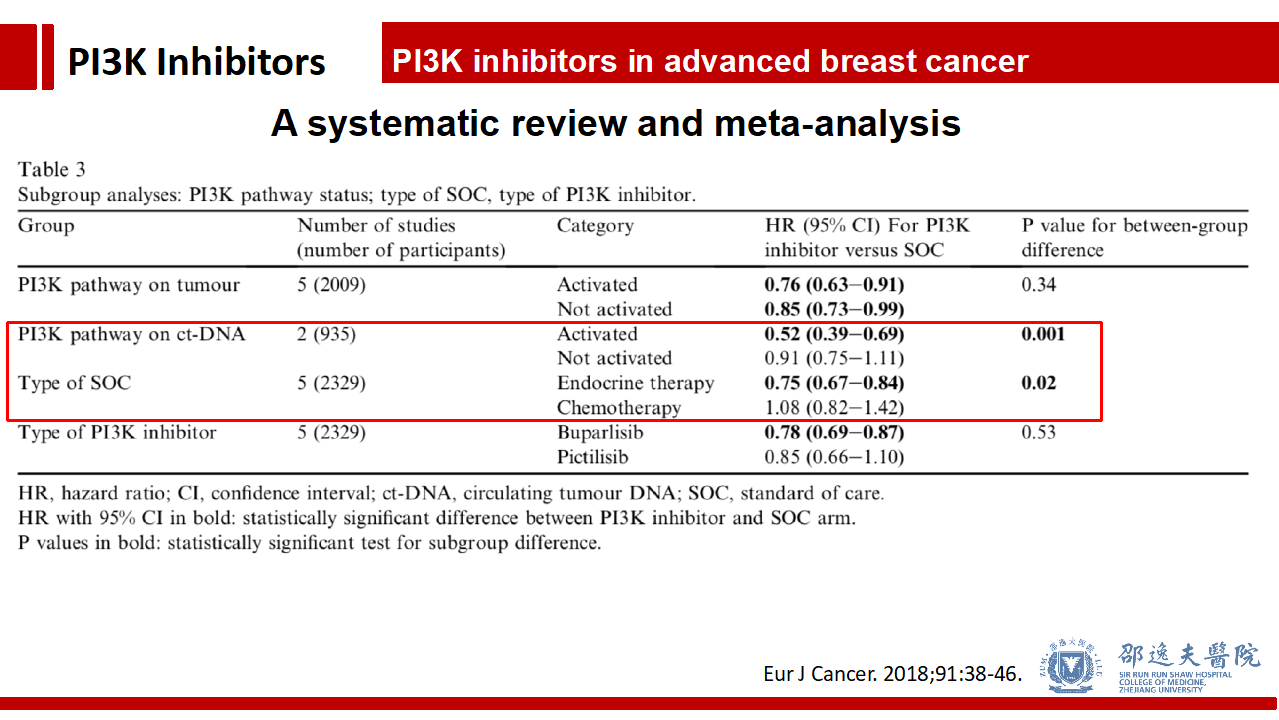
荟萃分析还发现,与内分泌治疗联合及ctDNA PI3K突变的患者更能从加入Pan-PI3K抑制剂中获益。
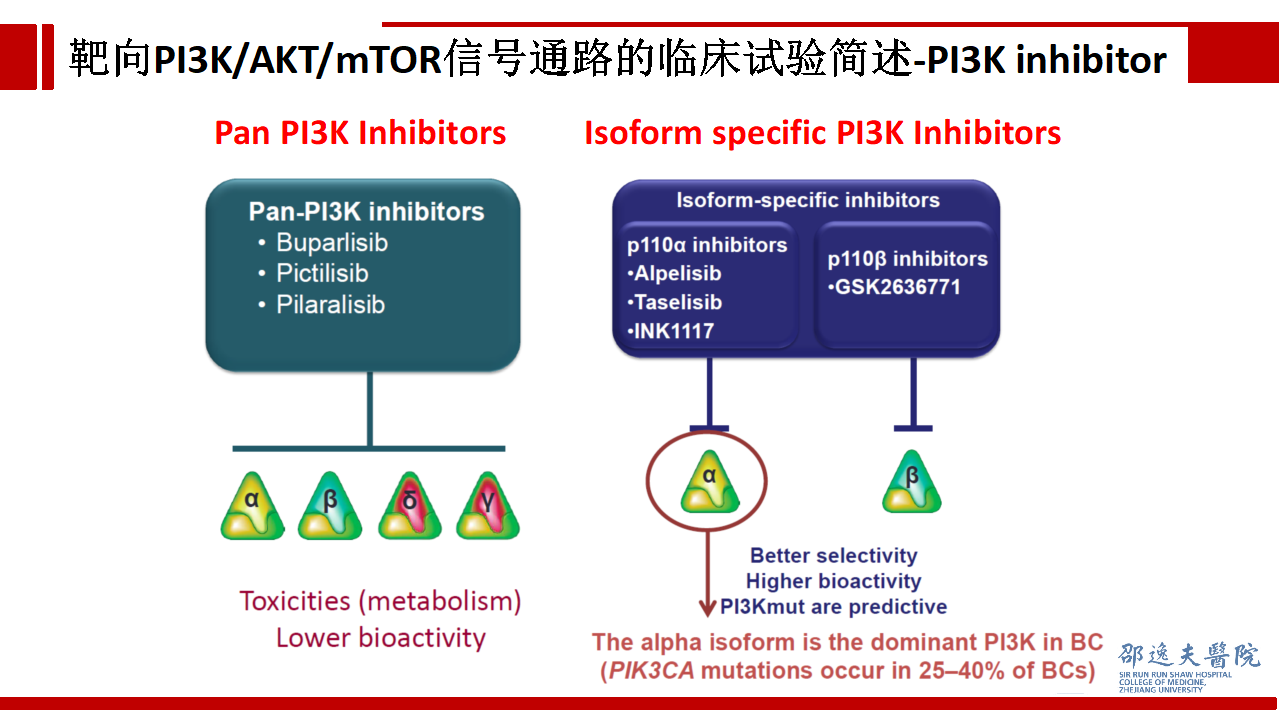
目前认为泛PI3K(Pan-PI3K)抑制具有毒性大,生物活性低等劣势。而PI3K异构体特异性抑制,如精准抑制p110α-PIK3CA具有更高的选择性,更高的生物活性,且具有预测标志。前文中已经提到,PIK3CA在乳腺癌中的突变发生率极高,具有成为治疗靶点的潜在优势。
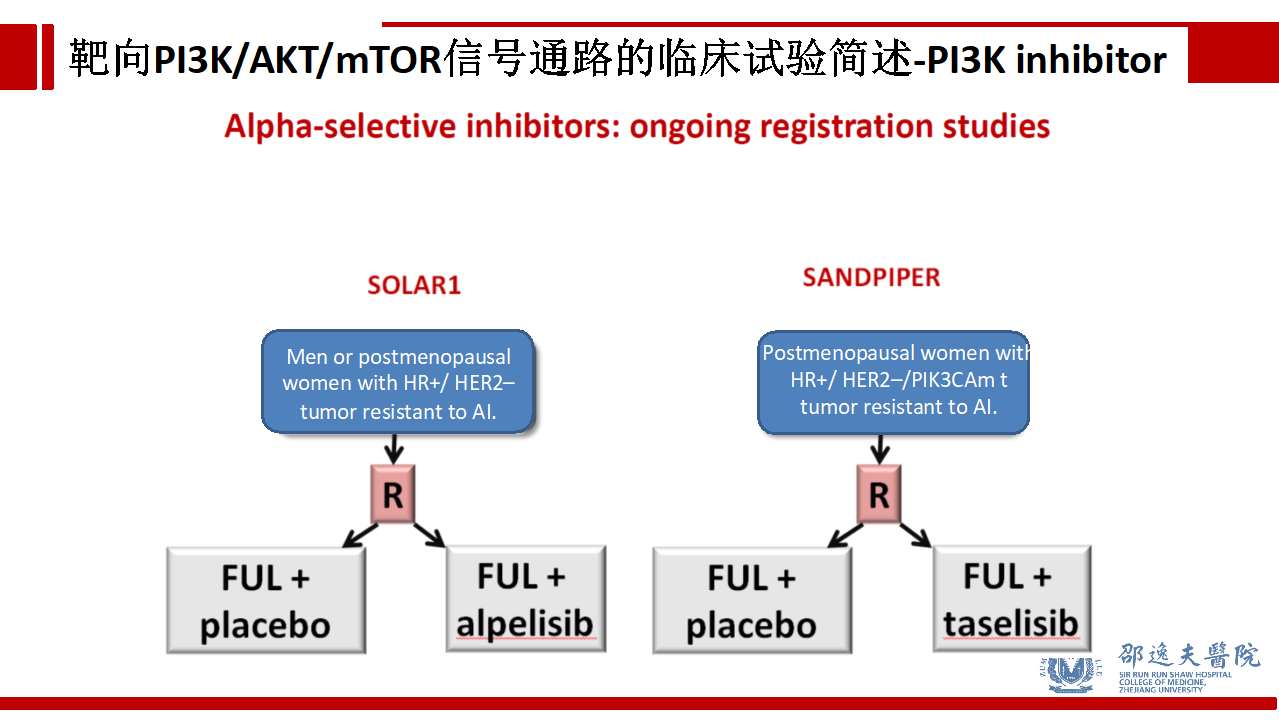
除上述Pan-PI3K抑制剂以外,目前两个特异性PI3K靶点抑制剂,即PIK3CA(p110α)抑制剂。SOLAR-1试验和SANDPIPER试验分别研究Alpelisib和Taselisib联合氟维司群(Fulvestrant)用于芳香化酶耐药的HR+/HER2-晚期乳腺癌。
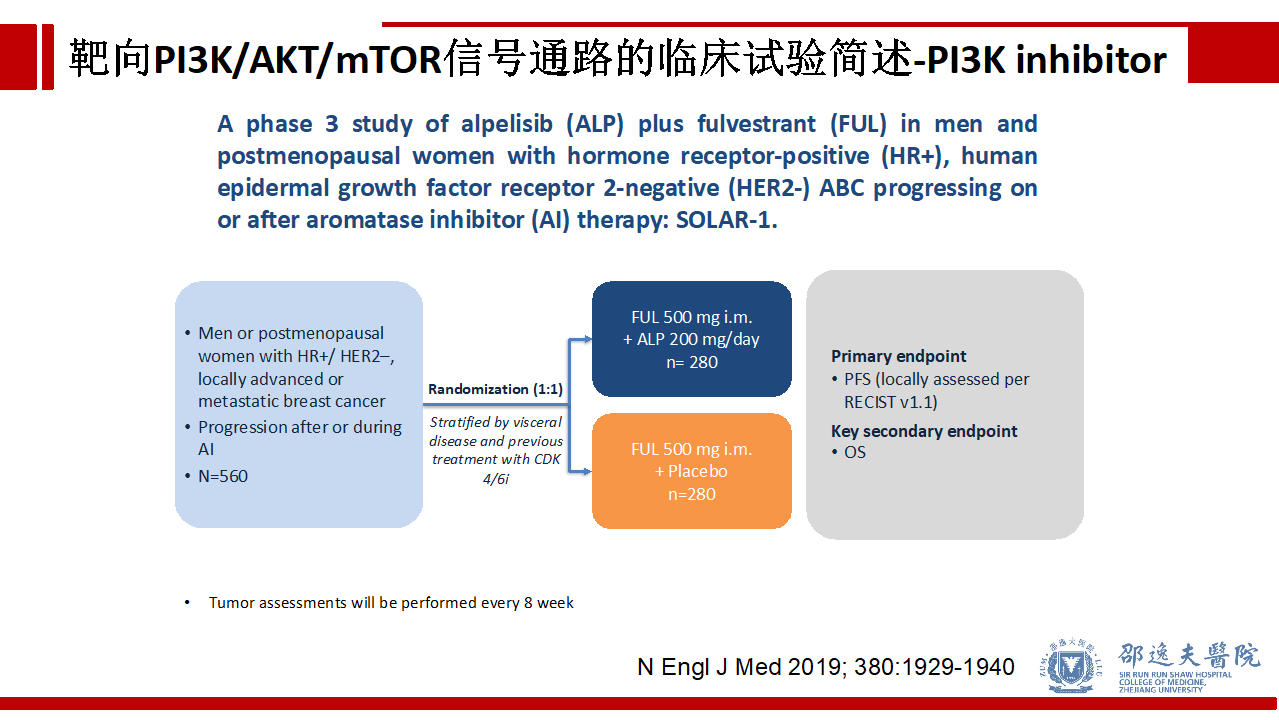 如前所述约40%的HR+/HER2-乳腺癌存在PIK3CA突变,SOLAR-1研究共纳入560例HR+/HER2-芳香化酶耐药的晚期乳腺癌患者,随机分为Alpelisib + 氟维司群组和安慰剂 + 氟维司群组。主要观察终点为无进展生存期(PFS),次要观察终点是总体生存期(OS)。
如前所述约40%的HR+/HER2-乳腺癌存在PIK3CA突变,SOLAR-1研究共纳入560例HR+/HER2-芳香化酶耐药的晚期乳腺癌患者,随机分为Alpelisib + 氟维司群组和安慰剂 + 氟维司群组。主要观察终点为无进展生存期(PFS),次要观察终点是总体生存期(OS)。
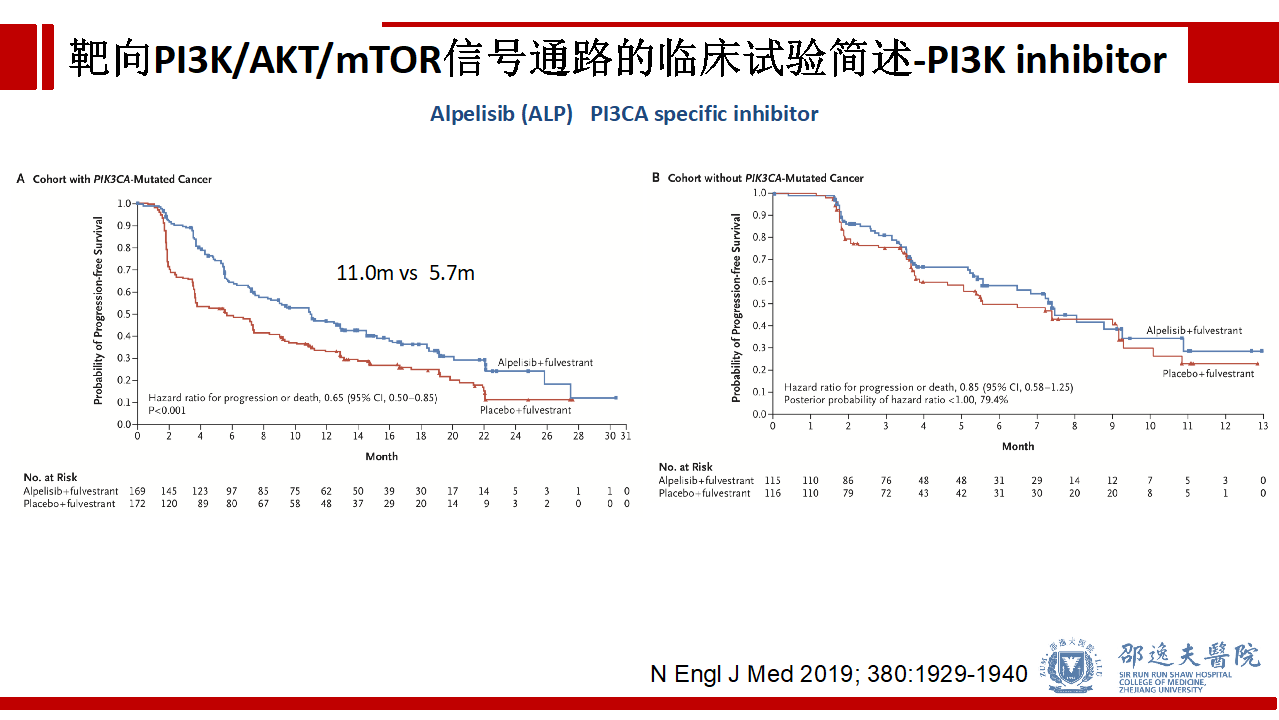 SOLAR-1研究结果提示在存在PIK3CA突变的HR+/HER2-芳香化酶抑制剂耐药的晚期乳腺癌患者中,Alpelisib + 氟维司群组较安慰剂 + 氟维司群组显著延长PFS(11.0个月 vs 5.7个月),而在PIK3CA无突变亚组中未见显著差异。基于这一研究结果,Alpelisib用于HR+/HER2-芳香化酶抑制剂耐药的,肿瘤存在PIK3CA突变的晚期乳腺癌的临床治疗。
SOLAR-1研究结果提示在存在PIK3CA突变的HR+/HER2-芳香化酶抑制剂耐药的晚期乳腺癌患者中,Alpelisib + 氟维司群组较安慰剂 + 氟维司群组显著延长PFS(11.0个月 vs 5.7个月),而在PIK3CA无突变亚组中未见显著差异。基于这一研究结果,Alpelisib用于HR+/HER2-芳香化酶抑制剂耐药的,肿瘤存在PIK3CA突变的晚期乳腺癌的临床治疗。
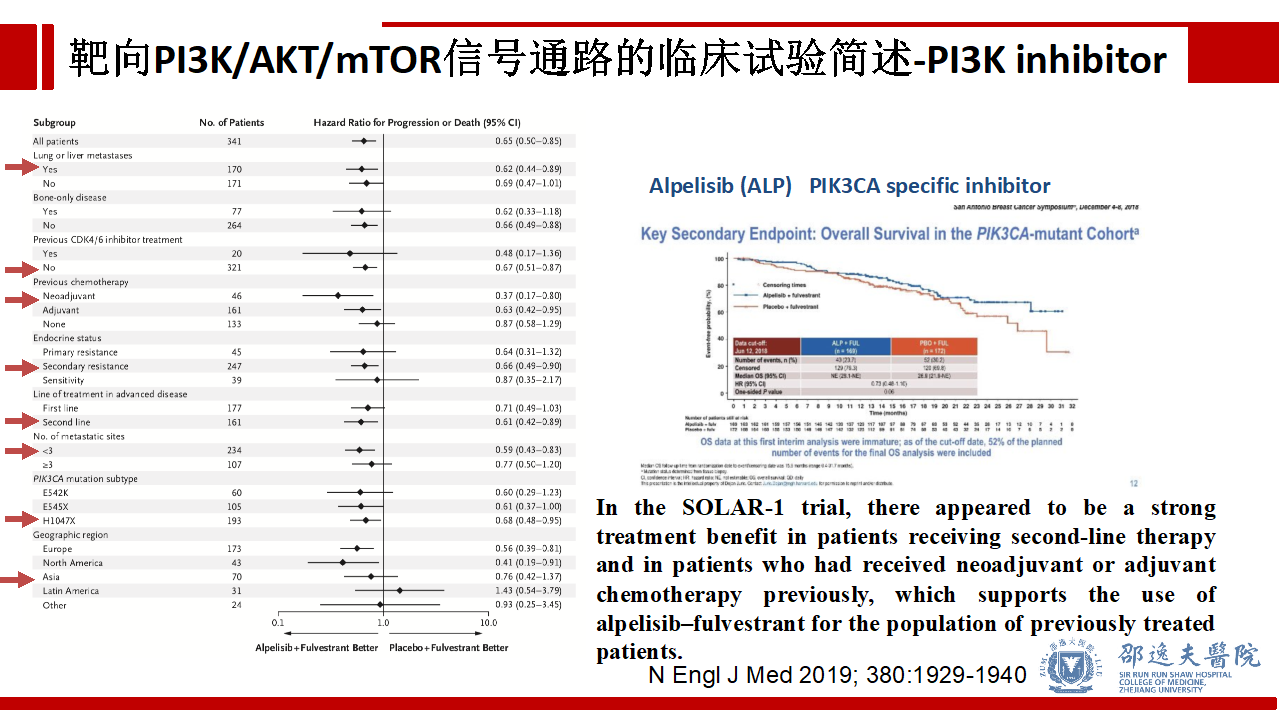 同时亚组分析还发现,既往接受过辅助或新辅助化疗的亚组,继发性内分泌耐药亚组,欧洲和北美人群亚组更能够从Alpelisib + 氟维司群的联合治疗中获益。中期分析提示Alpelisib + 氟维司群组较安慰剂 + 氟维司群组在OS方面可能存在获益趋势,但最终结果仍需要更长的随访时间进行验证。
同时亚组分析还发现,既往接受过辅助或新辅助化疗的亚组,继发性内分泌耐药亚组,欧洲和北美人群亚组更能够从Alpelisib + 氟维司群的联合治疗中获益。中期分析提示Alpelisib + 氟维司群组较安慰剂 + 氟维司群组在OS方面可能存在获益趋势,但最终结果仍需要更长的随访时间进行验证。
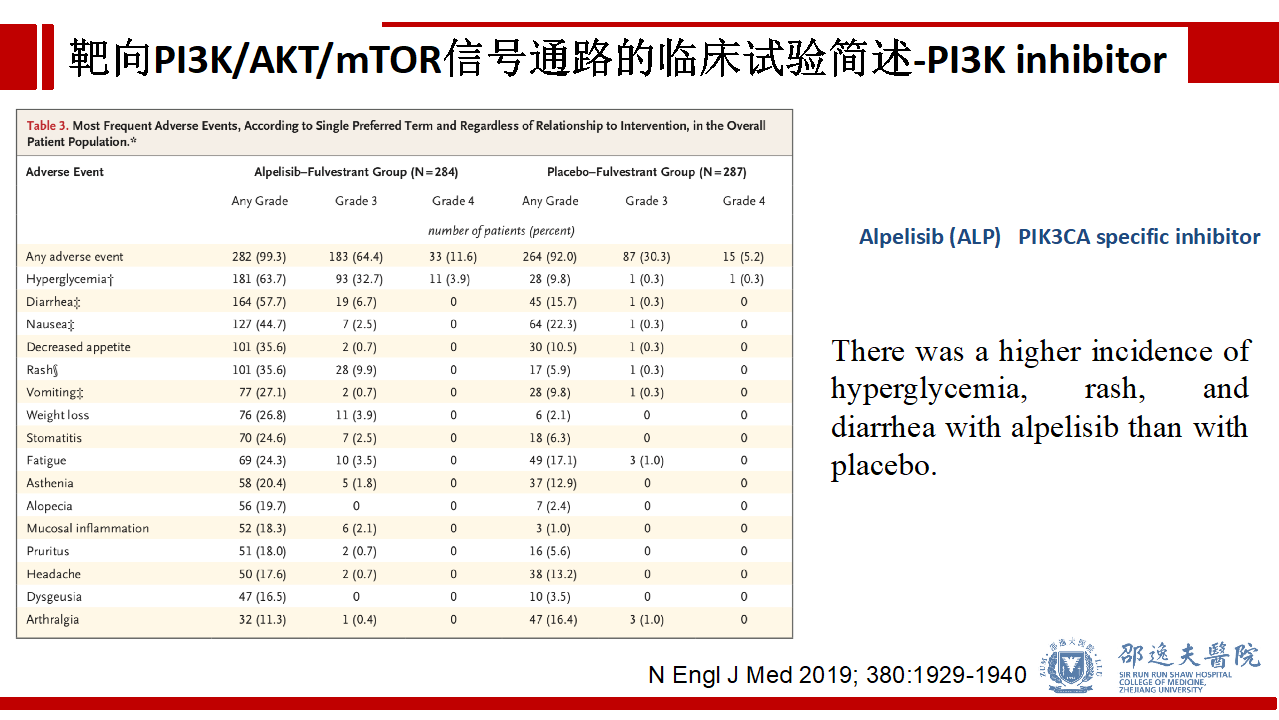 SOLAR-1研究提示在毒副反应方面:Alpelisib + 氟维司群组较安慰剂 +氟维司群组有更高的高血糖,红疹,腹泻等情况的发生率。
SOLAR-1研究提示在毒副反应方面:Alpelisib + 氟维司群组较安慰剂 +氟维司群组有更高的高血糖,红疹,腹泻等情况的发生率。
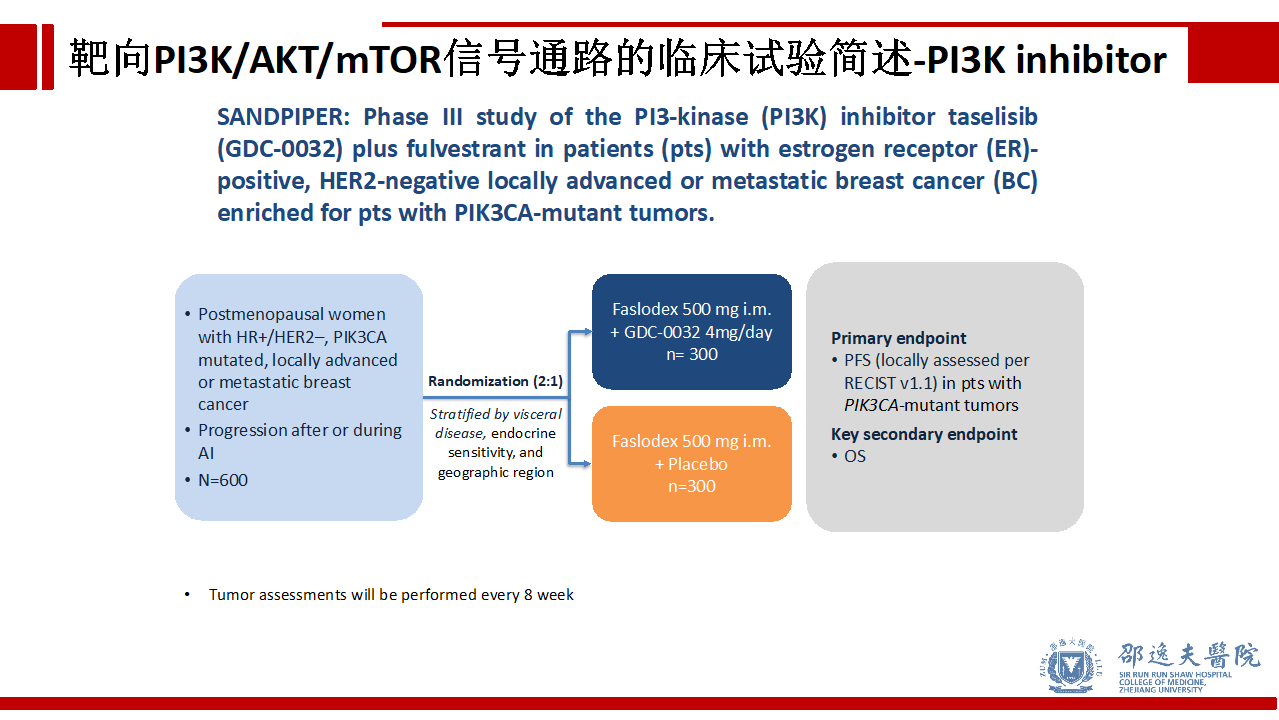
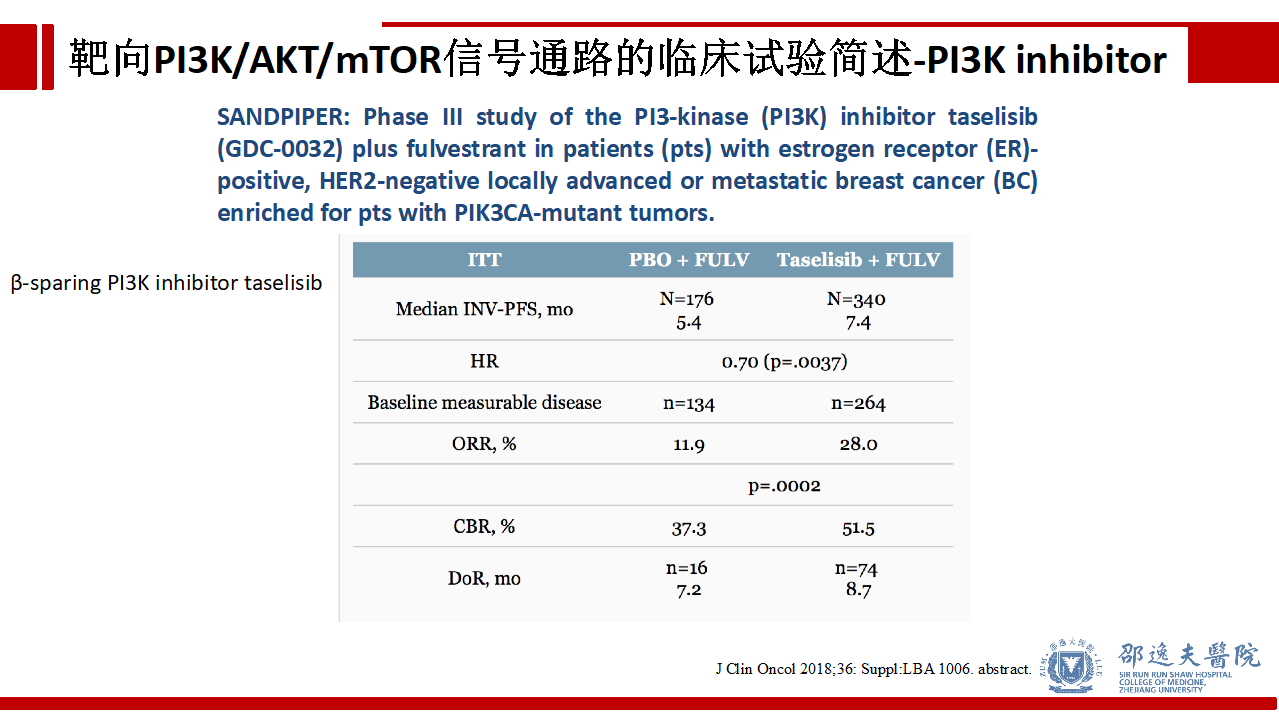 SANDPIPER试验研究了同样特异性靶向PIK3CA的Taselisib,该研究同样达到了主要研究终点,Taselisib+氟维司群使PIK3CA突变肿瘤患者PFS明显改善。ORR、CBR、DOR等也明显改善,且具有可管理的用药安全性。
SANDPIPER试验研究了同样特异性靶向PIK3CA的Taselisib,该研究同样达到了主要研究终点,Taselisib+氟维司群使PIK3CA突变肿瘤患者PFS明显改善。ORR、CBR、DOR等也明显改善,且具有可管理的用药安全性。


尽管靶向PI3K-AKT-mTOR取得了一些可喜成果。目前认为该领域存在以下不足和未来可能突破的方向。首先该类药物的毒副反应限制了其临床效果(最佳剂量窗口无法确定);其次人体内细胞信号通路极其复杂,某一特定信号通路的抑制,必然存在其他替代信号通路的反馈性激活或上调,导致药物无法到达预期效果。第三,Pan-PI3K抑制剂无法特异性靶向相关突变导致其临床效果不显著,特异性靶向相关突变,如PIK3CA是极具潜力的治疗靶点。最后,精准筛选获益人群是未来亟待解决的难点,精准筛选患者人群是提高药物效果的关键。
*点击图片,查看大图
周济春博士总结及点评
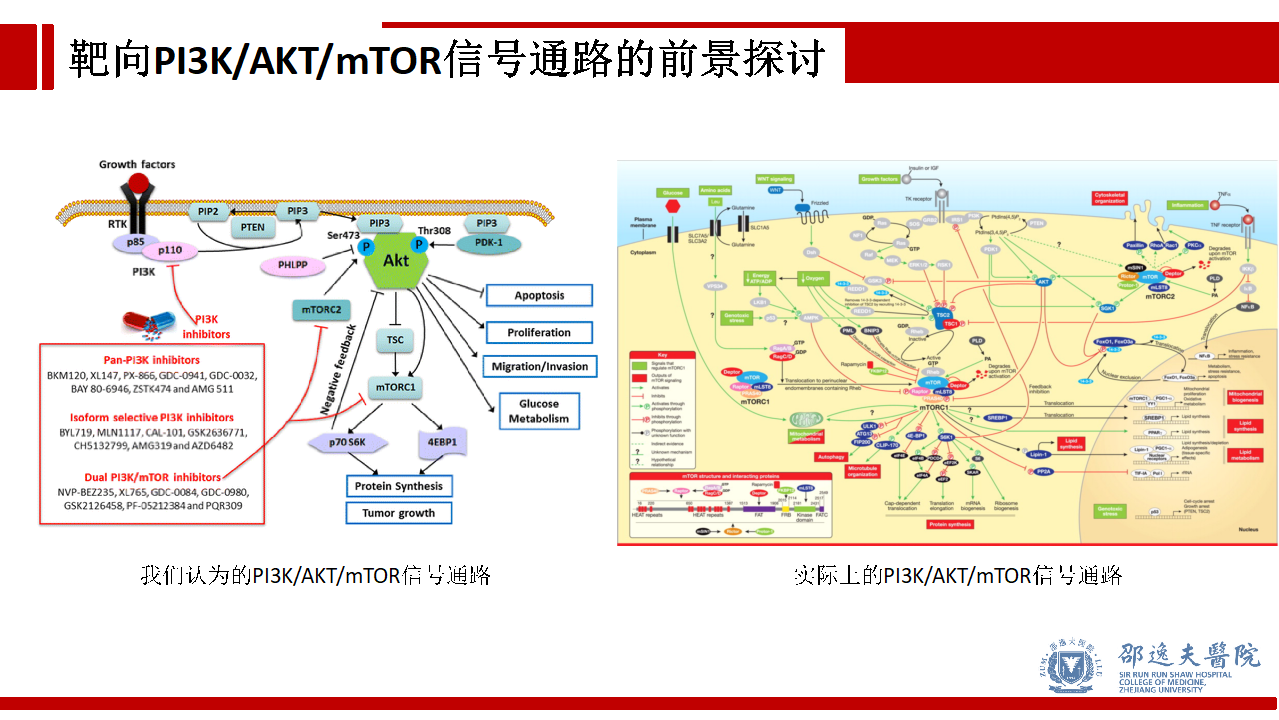
肿瘤细胞的运行机制远非我们所认为的那么简单,单纯PI3K/AKT/mTOR信号通路无法涵盖肿瘤的真实状态。各种反馈机制,旁路途径,不同信号通路之间Crosstalk的存在使很多机制明确,理论可行的靶向药物铩羽而归。
理想很丰满,但现实很骨感。尽管我们在乳腺癌PI3K/AKT/mTOR信号通路方面已经取得了令人振奋的成果,但如何提高药物疗效,改善患者预后,仍需要进一步研究。











 苏公网安备32059002004080号
苏公网安备32059002004080号


