第二届“35 under 35”CSCO-良医汇2018优秀青年肿瘤医师风采大赛评选活动”报名及筛选阶段已正式结束!在众多参与报名筛选的医生中,有100位优秀青年医生脱颖而出!他们将在近期进行三轮PK,展示青年医生风采!第一轮为ASCO最新摘要解读,候选人在主办方指定的2018ASCO口头报告专题中自由选择一份口头报告进行点评(如:背景,结果的评价,对临床的意义,和其他研究的对照,优点和不足等等),目前100位青年医生在规定的时间内已将解读提交,解读很精彩,现展示出来,供各位品读!欢迎转发,让更多的医生同道看到青年力量!欢迎评论,发表您的见解,与青年医师同台论道!

Abstract 8500:一项多中心、单臂、Ⅱ期临床研究,以评估奥拉帕利和脂质体阿霉素(PLD)联用治疗铂耐药复发卵巢癌、原发性腹膜癌和输卵管癌患者的安全性和疗效的试验(GEICO-1601 ROLANDO)。
背景:奥拉帕利(Olaparib)是一种PARP抑制剂,已在铂类敏感和铂类耐药复发卵巢癌中证实有效。 BRCA突变已被确定为对奥拉帕利是否应答的重要预测因子,然而在study 19中,BRCA野生型(BRCAwt)患者的无进展生存期(PFS)也得到改善。临床前研究显示多柔比星和奥拉帕利在卵巢癌的2D和3D模型中具有协同作用。聚乙二醇化脂质体多柔比星(PLD)40 mg / m2和奥拉帕利400 mg bid(胶囊制剂)的组合被认为是耐受的并且适合于I期试验。
方法:铂类耐药复发性的卵巢癌女性每28天接受聚乙二醇脂质体多柔比星(PLD)40mg / m2,同时olaparib 300mg bid片剂进行6个循环,随后olaparib 300mg bid维持直至毒性或疾病进展。主要终点是6个月的无进展生存期(PFS6m)。次要终点是PFS,总生存,反应率,生活质量和生长调节指数。主要入选标准是:1)浆液性或子宫内膜样卵巢癌2)铂耐药复发(最后一次含铂化疗(CT)后28天至6个月)3)如果作为铂敏感的一部分给药,则允许使用以前的PLD包括前复发和> 6个月4)BRCA突变患者仅符合之前1个CT线,5)BRCAwt或未知符合条件后至少2个铂敏感线6)允许不超过3个CT线,7)血红蛋白> 10g / dl和8)左心室射血分数> 50%。样本量计算假设PFS6m 40%或更高将有利于进一步调查;具有90%的功率和双侧α误差0.05,所需患者的数量将为32名患者。入组于2017年12月开始,第一位患者已入组。
点评:
GEICO-1601 ROLANDO研究是一项评估奥拉帕利和脂质体阿霉素(PLD)联用治疗铂耐药复发卵巢癌、原发性腹膜癌和输卵管癌患者的安全性和疗效的试验。预计入组32例患者,已于2017年12月启动,试验设计如下:
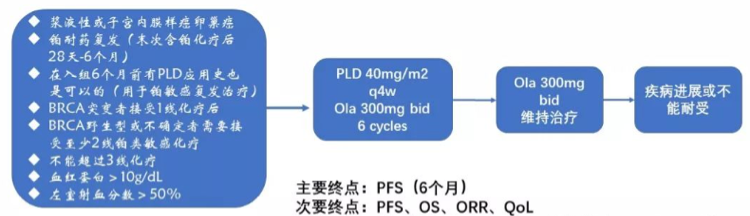 其意义在于:对于铂耐药复发患者的治疗仍是临床上的难点,目前临床上会选择单药化疗但疗效不理想,缓解率仅20%左右。本试验是PARPi联合化疗用于铂耐药复发卵巢癌治疗的一次尝试,很可能使以DNA损伤修复异常为基础的治疗成为铂耐药卵巢癌患者治疗的新希望。
其意义在于:对于铂耐药复发患者的治疗仍是临床上的难点,目前临床上会选择单药化疗但疗效不理想,缓解率仅20%左右。本试验是PARPi联合化疗用于铂耐药复发卵巢癌治疗的一次尝试,很可能使以DNA损伤修复异常为基础的治疗成为铂耐药卵巢癌患者治疗的新希望。
一、什么是PARP抑制剂?
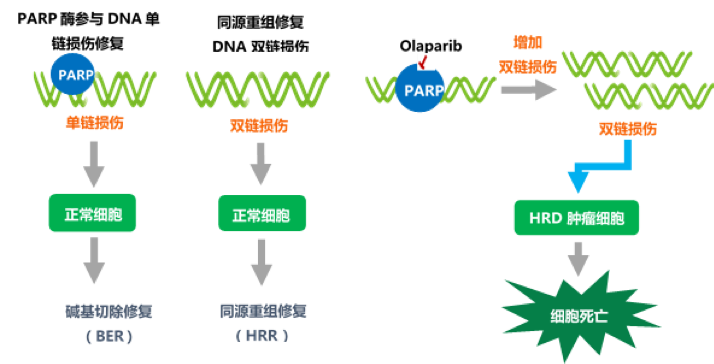
PARP抑制剂是一种靶向聚ADP核糖聚合酶 (Poly ADP-ribose Polymerase) 的抑制剂[1]。它的作用机制是:存在HRR(同源重组修复)缺陷的肿瘤细胞,DNA双链损伤修复途径被阻断,变得非常依赖于PARP介导的DNA单链修复途径,倘若PARP蛋白活性进一步受到抑制,肿瘤细胞的单链修复途径也被阻断,单链断裂得不到及时修复,再复制过程中不断累积成双链断裂,双链断裂又不能通过HRR及时修复,最终导致癌细胞的死亡[2,3]。
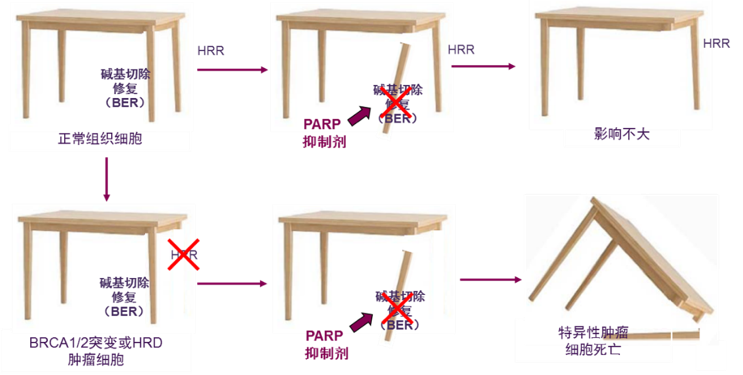
 将细胞比喻成一张桌子,各种DNA修复途径就如同桌子腿,功能正常确保桌子保持直立,在正常细胞中,当其中一条桌腿折断(BER修复途径被PARP抑制剂阻断)时,另外的桌腿(HRR修复途径)仍然完好,桌子依然能保持直立;在HRD突变肿瘤细胞中,当两条桌腿(BER和HRR修复途径)同时被破坏时,桌子再无法保持直立,也就是细胞死亡。
将细胞比喻成一张桌子,各种DNA修复途径就如同桌子腿,功能正常确保桌子保持直立,在正常细胞中,当其中一条桌腿折断(BER修复途径被PARP抑制剂阻断)时,另外的桌腿(HRR修复途径)仍然完好,桌子依然能保持直立;在HRD突变肿瘤细胞中,当两条桌腿(BER和HRR修复途径)同时被破坏时,桌子再无法保持直立,也就是细胞死亡。
 二、卵巢癌有什么特点?
二、卵巢癌有什么特点?
卵巢癌是全球女性第7大常见癌症和第8大癌症死亡原因[4]。过去30年,卵巢癌的主要治疗方式始终停留在手术和化疗,70%患者易复发,卵巢癌患者五年生存率仅为30%,是致死率最高的女性恶性肿瘤[5,6]。
卵巢癌的复发分为铂敏感(PSR)和铂耐药(PRR),对于铂敏感复发的患者,复发后继续选择含铂化疗仍然可以获得较好获益,且用Olaparib进行维持治疗也有明显的获益。
三、PARP抑制剂在铂敏感复发卵巢癌治疗中有什么意义?
在两项随机、设置安慰剂对照的双盲、多中心临床试验中, Olaparib作为维持疗法的可行性得到了评估。
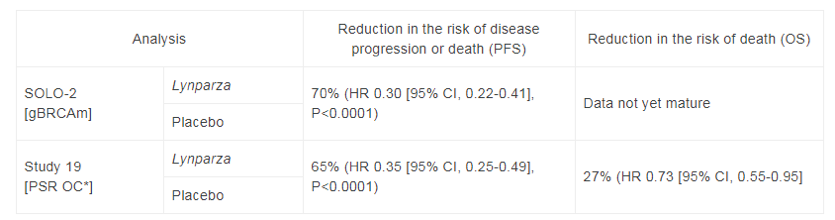
在一项名为study19的临床试验里,研究人员招募了265名患者,她们的BRCA突变状况未纳入考量。研究发现,服用olaparib胶囊(400mg,每日口服两次)的患者,中位PFS为8.4个月,也显著超过了对照组(4.8个月)[7]。
在另一项名为SOLO-2的临床试验里,研究人员招募了295名复发性卵巢癌、输卵管癌、或是原发性腹膜癌患者,她们都带有gBRCA突变,且正处于铂类化疗后的缓解期。研究发现,接受olaparib治疗(片剂,300mg,每日口服两次)的患者,无进展生存期(PFS)为19.1个月,相较对照组的患者(5.5个月)得到了显著延长[8]。
 四、对于铂耐药复发卵巢癌,PARPi能否实现治疗上的突破?
四、对于铂耐药复发卵巢癌,PARPi能否实现治疗上的突破?
对于铂耐药复发的患者,临床上会选择不含铂的单药治疗,如紫杉醇周疗,吉西他滨,拓扑替康和VP16等。但此类单药化疗的疗效不理想,缓解率仅20%左右,铂耐药复发患者的治疗是临床上的难点。以DNA损伤修复异常为基础的研究为BRCAwt和铂耐药卵巢癌患者的治疗带来希望。目前对于铂耐药复发卵巢癌的治疗方式主要有以下几种:
1. 抗血管生成药物可导致肿瘤细胞DNA损伤修复反应的异常,抗血管生成药物联合PARPi可能增强PARPi在BRCAwt/铂耐药患者的疗效[9];
2. PARPi和抗血管生成药物可导致肿瘤新抗原形成,抗血管生成药物/PARPi联合PD-L1单抗可能增强PD-L单抗的疗效[10];
3. 针对不同DNA损伤修复机制的药物联合可能有协同作用,从而增强抗肿瘤活性[11];
4. 细胞周期检查点抑制剂导致DNA损伤修复的异常,可增强PARPi对铂耐药患者的疗效[12]。
因此,PARPi用于铂耐药复发卵巢癌的治疗,是突破临床上治疗难点的一次突破,期待这个试验能够给我们带来好消息。
【温馨提示】:如果您觉得鲍伟医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Helleday et al. Molecular Oncology 2011 5,387-393.
[2] Aly A et al. J Mol Cell Biol. 2011, 3, 66-74.
[3] O’Connor, M. et al. Poster 392P presented at ESMO 2017.
[4] Hanker LC, Loibl S, Burchardi N, et al. Ann Oncol. 2012;23(10):2605-2612.
[5] CONCORD Working Group, et al. Lancet, published online Jan 30, 2018.
[6] Lancet, 2009, 374(9698): 1371-1382.
[7] Jonathan Ledermann, Philipp Harter, Charlie Gourley, et al. Lancet Oncology , 2014 , 15 (8) :852.
[8] Eric Pujade-Lauraine, Jonathan A Ledermann, et al. Lancet Oncology , 2017 , 18 (9) :1274.
[9] 2017 ESMO 989TiP.
[10] 2017 ESMO 942PD.
[11] Hamilton EF, et al. 2016 ASCO abstract.
[12] J-m Lee et al. 2016 ESMO abstract.
41本,27种肿瘤,63万字的【肿瘤患者指南丛书】,赶紧扫描或识别下方二维码,即可免费拥有!












 苏公网安备32059002004080号
苏公网安备32059002004080号


