
本篇为龙哥查房系列第26个病例
地点:广东省人民医院伟伦楼十四楼
时间:2017-11-29 星期三15:00
参加科室与专家:
肿瘤治疗中心:吴一龙(主任医师)、张绪超(研究员)、杨衿记(主任医师)、杨学宁(主任医师)、钟文昭(主任医师)、周清(主任医师)、涂海燕(副主任医师)、陈晓明(主任医师)、李伟雄(主任医师)、潘燚(副主任医师)、陈华军(副主任医师)、汪斌超(副主任医师)、王震(副主任医师)、徐崇锐(主治医师)、廖日强(主治医师)、董嵩(主治医师)、江本元(医师)、白晓燕(医师)、孙月丽(医师)、陈志勇(医师)、李安娜(医师)、郑明英(医师)、林嘉欣(医师)、白晓燕(医师)、林辉(医师)、黄婕(医师);全体研究生。
病例汇报人:广东省人民医院肺一科 胥冰菲医师 汪斌超副主任医师
患者病史
* 主诉:确诊肺癌20月,综合治疗后疾病进展
* 现病史:
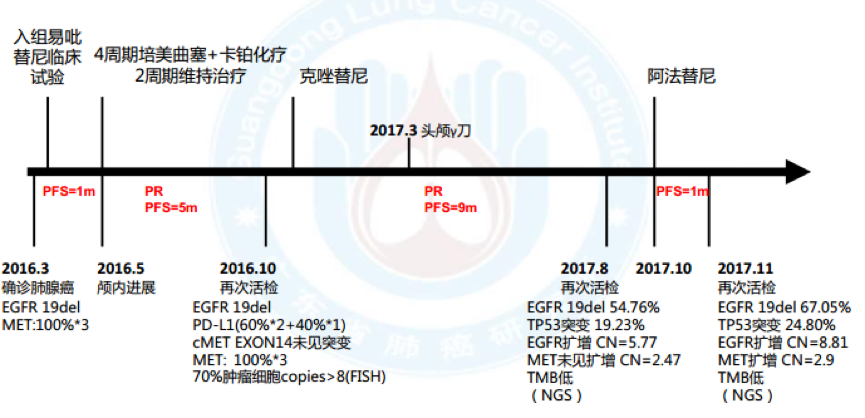
1. 2016.3 因“头痛、头晕6月”入院,确诊左下肺腺癌cT3N3M1b(脑), IVa期,EGFR 19del,cMET扩增100%*3+, HER2/KRAS/BRAF/ROS1/ALK/PIK3CA(-)
2. 一线:入组易吡替尼临床试验,服药1月颅内病灶进展, PFS=1月
3. 2016.5 二线:4周期培美曲塞+卡铂化疗,2周期培美曲塞维持治疗后病情进展,最佳疗效PR, PFS=5月
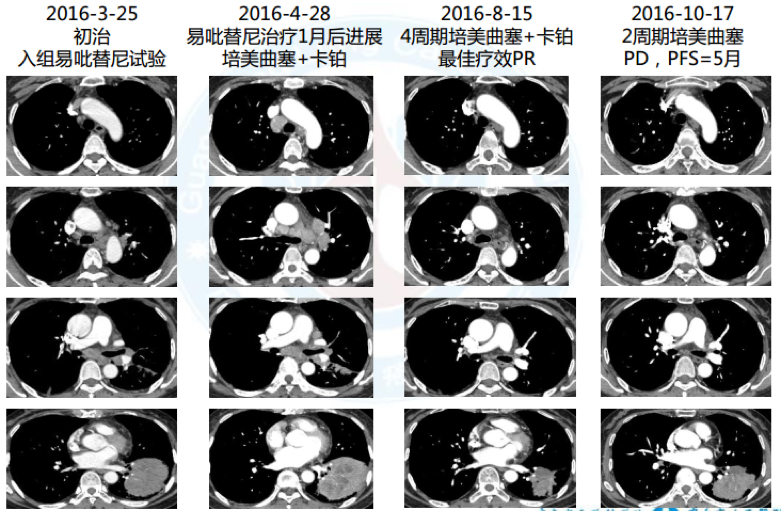 4. 2016.11 二次活检:腺癌, MET扩增(70%肿瘤细胞,拷贝数CN >8, 14外显子未见突
4. 2016.11 二次活检:腺癌, MET扩增(70%肿瘤细胞,拷贝数CN >8, 14外显子未见突
变, FISH), PD-L1(60%*2+40%*1),EGFR 19del
5. 三线:克唑替尼,最佳疗效PR, PFS=9月; 2017.3于华侨医院行头颅γ 刀
6. 2017.8 三次活检:腺癌, EGFR 19del, TP53突变, EGFR扩增(CN=5.77)
7. 四线:阿法替尼, 1月后出现神情淡漠、行动迟缓, CT示疾病进展, PFS=1月
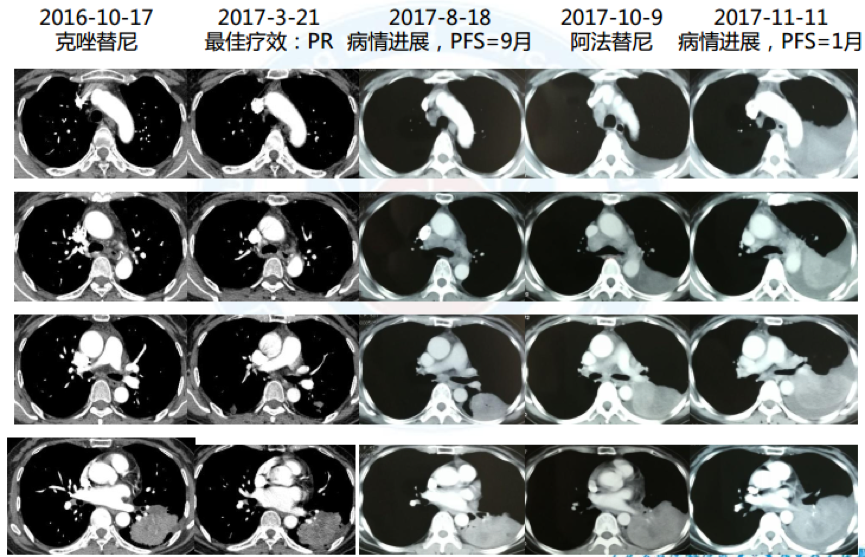
8. 2017-11-14再次入院,CT引导下肺穿刺活检,病理结果提示腺癌;送检NGS,结果如下: EGFR19del 67.05%, TP53突变 24.80%,EGFR扩增(拷贝数CN=8.81), MET扩增(CN=2.9);
9. 脑增强MRI:颅脑多发转移,已开始行全脑放疗;
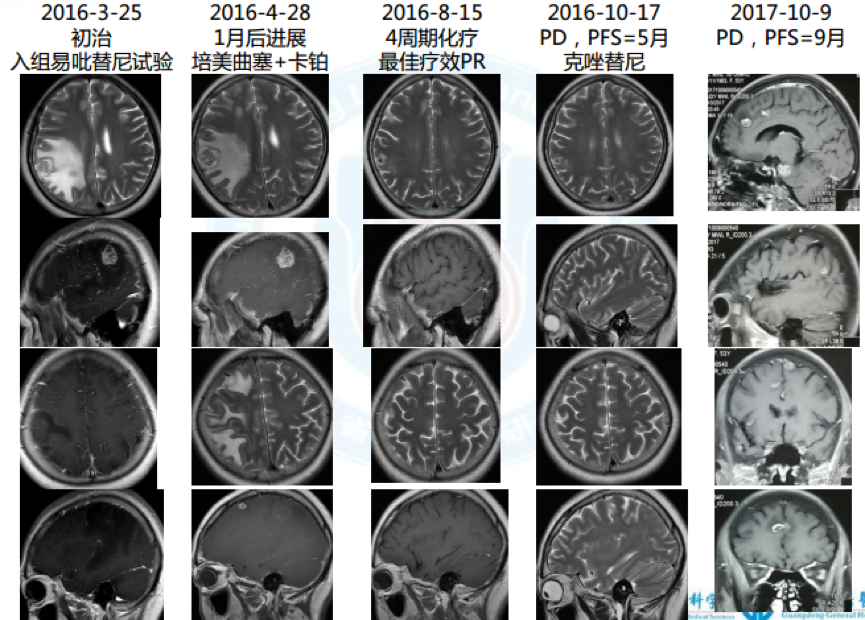 10. 实验室PD-L1、 MET(FISH)等结果未回。
10. 实验室PD-L1、 MET(FISH)等结果未回。
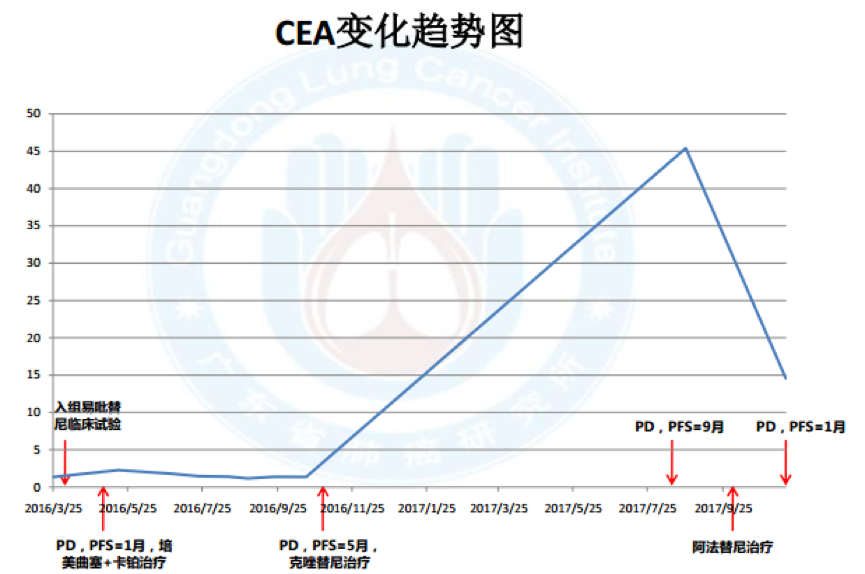
11.血液标记物变化:
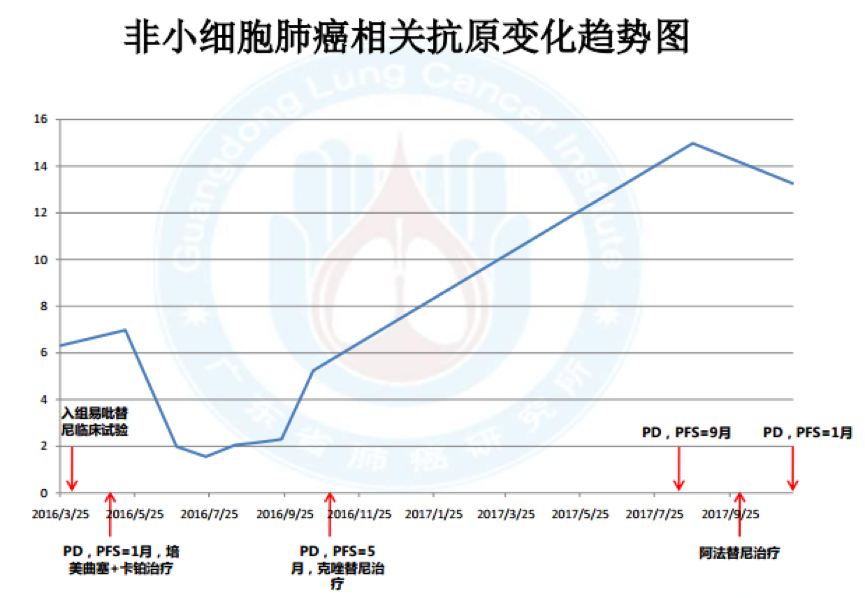
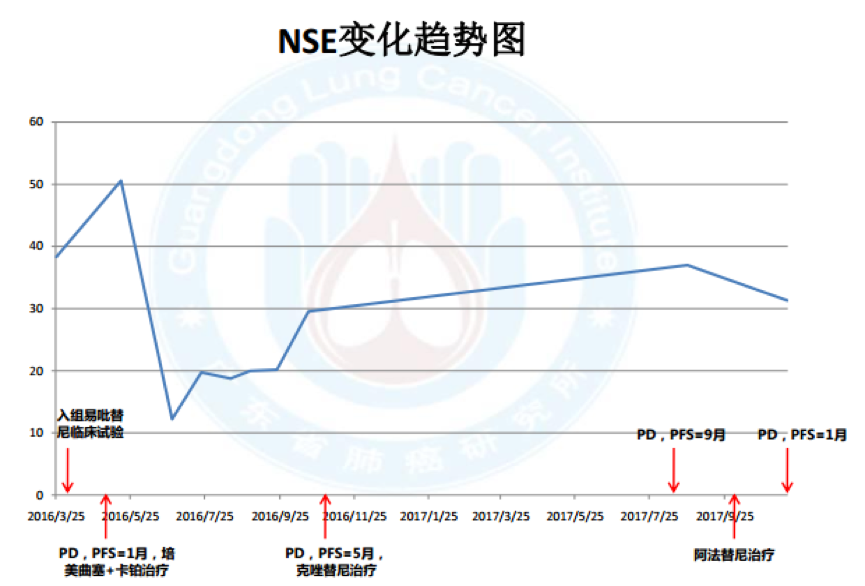
无肿瘤家族史治疗经过
病例小结:
 1. 中年女性,非吸烟者,PS评分1分;
1. 中年女性,非吸烟者,PS评分1分;
2. 左下肺腺癌IVB期,病程20月,多线治疗后病情进展
3. 同时存在EGFR与MET基因突变、 PD-L1高表达,化疗、克唑替尼疗效显著优于EGFR-TKI
讨论要点
下一步治疗?
1、免疫治疗?
2、双靶向治疗?
3、靶向治疗联合免疫治疗?
组内意见:
1、患者靶向治疗耐药, PD-L1高表达,可行免疫治疗;
2、患者阿法替尼治疗1月纵隔淋巴结明显缩小,考虑EGFR-TKI有一定疗效,本
次病情进展可能由MET通路再次活化所致,可考虑行双靶向治疗。
病例讨论
肺内科汪斌超医生:胥医生把病例介绍得非常完美。病人的治疗策略都是吴院长制定的,整个过程有三个分子水平方面的特点:EGFR通路、cMET通路、PD-L1。首先,EGFR通路的丰度不同,EGFR在整体中所占分量并不是太高。cMET所占分量相对较高,因为当时用克唑替尼维持到PFS9个月以上。现在停止克唑替尼不到两个月的时间,回归到cMET通路有点早,所以是否尝试一下PD-L1抑制剂,毕竟它有高表达。第二个特点,颅内症状起初即有,但是非常轻微;做了临床研究靶向治疗失败以后,吴院长建议用力比泰;后来用了两个周期后,病人的颅内病灶很快控制,说明力比泰、卡铂对脑转移非常有效。后期,虽然颅内新发小病灶,但在三个以内,局部处理足以控制。但是这一次疾病进展,颅内病灶明显增多,建议全脑放疗。这个病人的目前状态主要受制于脑转移;脱水治疗、放疗加进去以后,患者状态明显好转。接下来是系统性治疗该怎么选择的问题。希望各位专家讨论一下。
肺内科杨衿记医生:四线治疗用阿法替尼之后出现了混合疗效:原病灶增大恶化,纵隔淋巴结缩小,这两个混合疗效会有局部治疗干预的地方。其次,PD-L1的强表达是因为治疗后导致的、还是基线水平即存在的?放疗科注重的远隔效应,会引起免疫状态激活。第二,Pacific研究显示,加上PDL1单抗的巩固治疗会延长PFS。放疗之后导致很多新抗原发生,可能会增强肿瘤细胞的免疫原性,使得PDL1抑制剂取得更好的疗效。放疗科的同行们对这个看法有什么补充。
放疗科李伟雄医生:我说一些关于放疗和免疫的问题。SBRT大于8单次的照射是会增加免疫反应,因为大剂量照射以后肿瘤崩解、产生新抗原。另外一个作用是,放疗本身能抑制免疫。这看起来很矛盾,但是放疗以后,免疫淋巴系统的反应减少的。所以,如果跟免疫治疗结合,放疗本身可以增加疗效。但另外一个方面,放疗可以摧毁淋巴系统。综合而言,利用放疗产生的肿瘤抗原的增加、提高免疫反应,可以增加免疫治疗的疗效。
对于这个病人,首先,靶病灶可以做伽马刀,不再做预防性的全脑照射。为什么?第一,伽马刀以后马上做全脑放疗,脑水肿会很厉害。第二,可以把这个机会留在后面。比如疾病再次进展后可以继续全脑照射。
肺内科杨衿记医生:这个病人当时用一个月的一代TKI易吡替尼治疗失败;当时脑部严重水肿。基线水平时, SBRT、伽马刀、手术等局部治疗都可以做,哪个最好?
放疗科李伟雄医生:这种就要看症状。即便水肿比较严重,如果脑部结构没有移位等等,风险不是很大;如果症状严重、中线移位,或者有压迫症状、定位症状的话,还是手术切除。这个病人只是头痛,伽马刀是可以的。
放疗科潘燚医生:同意李主任意见。首先手术、还是放疗,应该还是局限于单发病灶。因为三个病灶、也不可能同时把三个病灶都切除。头颅手术选择跟病灶最接近的位置进行入路;如果病灶分布散乱,一次手术无法切除干净、只能做一个病灶,那么剩下病灶还要做伽马刀,此时病人需要接受两次治疗。这种情况下也不可能手术。第二种情况,如果是单发病灶,考虑手术还是伽马刀,主要考虑病人的水肿情况。水肿很严重、症状比较明显,或者病灶里面本身有颅内出血这种紧急情况,推荐手术优先,可以马上缓解。这个病人做分次可能会好过一次大剂量的,伽马刀很多时候是单次大剂量。如果做分次,每次量没那么大,引起的水肿相对会轻一些。
肺内科杨衿记医生:外科医生比较喜欢的词叫Tissue Provider,微创切除,能提供肿瘤标本进行耐药分析;那么手术是不是有这个优势呢?
肺外科钟文昭医生:我觉得可以,就是从颅内病灶切除。可以对肿瘤组织做更深入的基因检测,而且它是孤立的一个肿瘤。我更倾向于做摘除。
肺内科杨衿记医生:谢谢外科医生的意见。我们的cMET课题组对此有何看法?
肺内科李安娜医生:有驱动基因突变的病例,一般来说,免疫治疗的效果不好。这个病人比较特殊是因为EGFR,考虑原发耐药以后是cMET驱动。cMET和免疫的相关性在于,cMET调节免疫反应;抑制cMET通路,cMET和PDL1抑制剂的联合应用可以增强疗效。但是这只是一个细胞实验,没有病例数据。我们有一个病例是这样,cMET高表达,但是cMET原发耐药后出现PDL1高表达,改用免疫治疗以后取得很好的效果。但是这是一个cMET不活化、不驱动的状态。cMET表达高的患者,其PDL1表达比cMET阴性的病例要高。这有可能通过肿瘤微环境影响到PDL1的表达;但只能证明其表达的相关性,并不能证明疗效的相关性。
这个病例跟我们的病例不一样的是cMET驱动状态。对于存在驱动状态的时候,免疫治疗会不会也是跟之前的病例是相似的?我们没有证据。虽然从理论上来说,双抑制可能有效;但是因为考虑到经济上的原因,cMET抑制剂本身5万多,加上免疫抑制剂6万多,一个月11万多的状态。这个病人PDL1表达20%,我会倾向于免疫抑制剂的单药应用。
肺内科杨衿记医生:谢谢。那么我们忽略了一个最常见的驱动基因。我看刘思阳在WCLC的壁报展示一个病例,请你来发言。
肺内科刘思阳医生:我的研究里,EGFR突变跟ALK重排列为一个组,然后从免疫微环境去看的话,EGFR突变、 ALK重排的患者,PDL1阳性、CD8阳性的比例很低。因为对于免疫治疗,它的TME有四种分类,就是PDL1阳性、CD8阳性,然后阴性、阳性,阳性、阴性,阴性、阴性。其实PDL1阳性、CD8阳性的患者,免疫治疗效果比较好。然后我们有一个患者, TME较高、CD8是50%、PDL1阳性,其免疫治疗达到了unconformed PR,PFS是5.2个月。我们搜集了7个EGFR突变的患者,只有他是有疗效的,其PFS也高于 EGFR突变患者的中位时间1.3到2.1个月。
肺内科杨衿记医生:你会在开始建议这个病人EGFR TKI联合PD-L1单抗治疗吗?
肺内科刘思阳医生:我可能会考虑到一些副作用,我不推荐。
肺内科周清医生:我觉得这个病人大家还忽略了一个问题,患者有EGFR扩增。当时易吡替尼效果不好,对阿法替尼是混合疗效。这个病人很明显是个多基因改变,有三方面,一个是EGFR本身的突变,可能占的权重不是很大,所以肺进展很明显。第二个是cMET ,cMET抑制剂治疗后的获益蛮大,但是现在对克唑替尼是刚刚耐药,停药时间不长。第三,原来没有EGFR扩增、现在EGFR的扩增拷贝数很高、大于8。所以,我不支持免疫治疗。驱动基因明显的病人,其PD-L1表达水平无论高低,疗效都不好,尤其是TMB较低的患者。这个病人TMB也是低的。从这个角度来说,之前我们看到过这些大型研究当中的分析,包括Pacific研究,其亚组分析中,EGFR突变阳性组是没有意义的。所以对这个病人,能不能在阿法替尼基础上加一个针对EGFR扩增的药物?
肺内科胥冰菲医生:这个患者在使用阿法替尼之前,EGFR也是有扩增的,拷贝数是5.77,但是它用了阿法替尼之后EGFR的拷贝数升高了。
肺内科周清医生:正是因为这个,我更觉得EGFR扩增,尤其对阿法替尼的耐药当中扮演很重要的角色。
肺内科杨衿记医生:驱动基因的问题刚好有一篇研究双驱动基因,陈瑞莲医生有什么看法?
肺内科陈瑞莲医生:整个过程来看,主要是有两个克隆的EGFR突变,还有一个cMET扩增,当时是cMET扩增占主导。所以,一代TKI的疗效比较差。口服克唑替尼之后,NGS检测出cMET扩增,但目前暂无扩增值的明确标准。后面可以看出,cMET扩增的克隆细胞群体不断减少,后期也出现了TP53、EGFR扩增的克隆群。到底这些基因的变异,是在同一个细胞内存在,还是各种单独形成一个克隆群?目前结果暂无法判断。
肺内科周清医生:因为这个病人是多种基因改变了,理想化状态肯定针对EGFR扩增、EGFR突变、cMET扩增的药物都用;但副作用太大了,根本就无法承受。故暂时不加cMET抑制剂。
肺内科杨衿记医生:尽管后来用了克唑替尼有效,但是基线没检测cMET是遗憾。现在回答三个问题。组内意见是用PD-L1单抗,加上一个EGFR的单抗,那么这个病人目前的标准治疗用光了,包括一线、二线、三线、四线。那么,什么治疗是家属可以接受的、哪个最优,可能还是有争议。首先,目前针对肿瘤微环境的治疗,分为两大部分,一个是抗血管生成,第二种是多靶点治疗。其次,PD1、PD-L1抑制剂,但针对驱动基因阳性的患者,最好的疗效也就是3%到5%左右,其中主要得益于TMB较高等。这个患者的特点在于,PDL1不高,基线没检测。如果基线为炎症型,可能对PD1、PD-L1有效。现在需要等待此次进展后、这些指标是否能够提供佐证、针对进展期的肿瘤,选择其中一个单药方案,看治疗是否有效;如果无效,再搭配其他方案。所以,目前需要补充基线的PD-L1表达水平,完善此次活检的NGS结果,然后再行讨论治疗方案。














 苏公网安备32059002004080号
苏公网安备32059002004080号


