多基因组检测已日益成为遗传癌症患病风险的标准评估工具。BRCA1/2基因突变与遗传性乳腺癌及卵巢癌发病相关,因美国明星Angelina Jolie愈受大家关注。但BRCA1/2基因突变相关的遗传性乳腺癌只占少部分,目前很多研究提示仍存在其他基因突变导致发病。那在遗传咨询中,是否需常规检测所有已知相关基因突变呢?该研究针对白种女性患者进行了大样本量分析。
背景:
遗传性BRCA1/2基因突变增加了乳腺癌的终身患病风险。然而,通过多基因遗传癌症检测发现的其他基因突变与乳腺癌风险的相关性并不清楚。本研究旨在探讨癌症易感基因的遗传突变与乳腺癌风险的相关性。
方法:
共6,5057例乳腺癌患者接受遗传性癌症易感基因的检测。以Exome Aggregation Consortium为对照组,分析两组非BRCA1/2易感基因与乳腺癌患病风险的相关性。
结果:
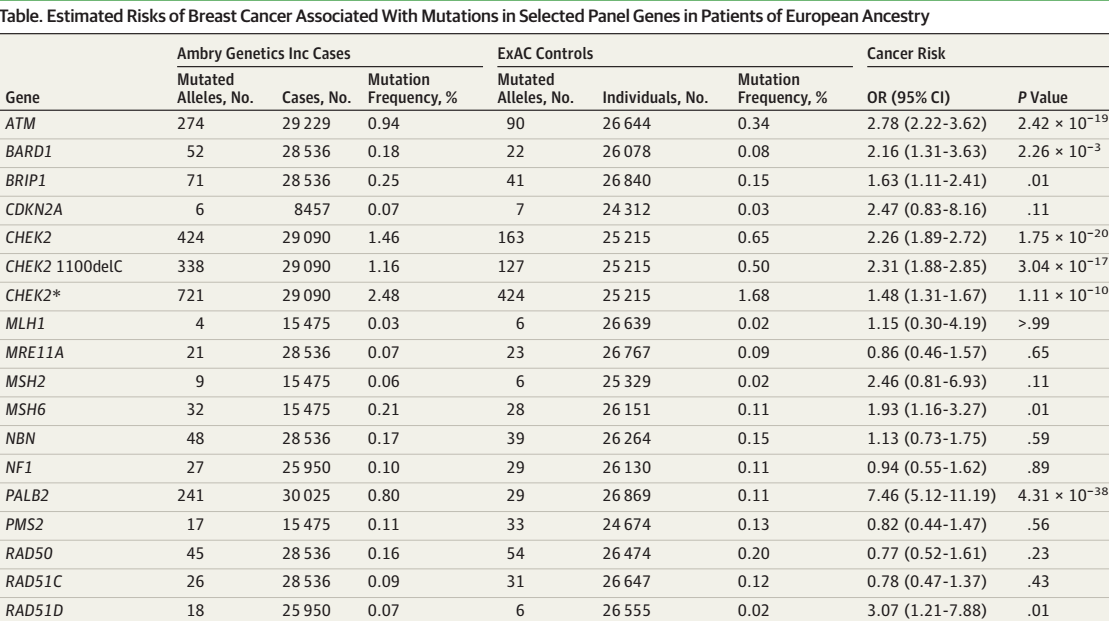
确诊时平均年龄为48.5岁。4,1611例连续检测的乳腺癌白种人女性患者中21个基因组的致癌突变率为10.2%。排除BRCA1/2及乳腺癌综合基因组(CDH1、PTEN、TP53)后,观察到5个基因中的致癌突变使乳腺癌风险中-高增加:ATM (OR, 2.78; 95% CI, 2.22-3.62), BARD1 (OR, 2.16; 95% CI,1.31-3.63), CHEK2 (OR, 1.48; 95% CI, 1.31-1.67), PALB2 (OR, 7.46; 95% CI, 5.12-11.19)和 RAD51D (OR, 3.07; 95% CI, 1.21-7.88)。相反,卵巢癌易感基因BRIP1和RAD51C的突变,MRE11A, RAD50,和 NBN MRN 复合基因、MLH和PMS2非配对修复基因、NF1的突变均未增加乳腺癌风险。
结论:
本研究明确了几个乳腺癌相关的中高风险基因组并提供了这些基因的致癌突变对需要基因检测的患者中的乳腺癌患病风险预测值。
介绍
DNA测序技术的进步推动了多基因检测的发展,增加了癌症易感突变的检出率,与单基因检测相比具有时间和成本的优势。目前我们可从基因检测实验室获得很多癌症易感基因组信息。出现这些基因致癌突变的患者需加强癌症监管或开展其他预防措施。癌基因检测可识别大部分患者中的突变。然而,需接受临床基因检测患者中的每一个基因组的突变概率以及这些突变相关乳腺癌风险目前仍未明确。这就是本研究的目的。
方法
研究人群
全国65057名乳腺癌女性患者于2012年3月15日-2016年6月30日接受Ambry 基因公司的癌症遗传基因检测。确诊时平均年龄为48.5岁。排除标准:2015年7月-12月受试患者(因资料不全)、乳腺癌不是首发癌症。以Exome Aggregation Consortium(ExAC)作对照组。最终包括54,585例乳腺癌患者,其中38,326例为白种人。两组中所有无功能突变及错误突变均纳入分析。
多基因组检测
通过靶向自定义捕获、测序以及靶向染色体微序列分析进行突变测试。本研究纳入21个已知及候选乳腺癌易感基因。
统计分析
对比乳腺癌白种人及ExAC-NFE 非TCGA对照组组间每个基因内所有致癌突变概率。基因归类为高风险(OR>5.0),中风险(OR=2.0-5.0)和低风险(<2.0)。
结果
乳腺癌患者中,59.7%患者确诊年龄≤50岁,13.6%患者是双侧乳腺癌,分别有61.3%、23.0%、13.2%的患者有乳腺癌、结直肠癌、卵巢癌的家族史。剩下无家族史的乳腺癌患者中,85.1%患者50岁以内发病或双侧乳腺癌或三阴性乳腺癌。
41611名乳腺癌白种女性患者的致癌基因突变率为10.2%,排除BRCA1/2、p.Ile157Thr和
p.Ser428Phe CHEK2突变后,突变率为6.18%。乳腺癌白种女性患者中,除外BRCA1/2突变,最常见的突变基因是CHEK2 (1.73%), ATM (GenBank, NM_000051.3) (1.06%), and PALB2 (GenBank, NM_024675.3) (0.87%)。
我们对54585名乳腺癌患者(不限种族)及38326名白种人患者进行非BRCA1/2易感基因与表型相关性分析。白种人中,CHEK2和TP53突变与双侧乳腺癌相关,BRIP1和MSH2突变与卵巢癌既往史相关。只有PALB2突变与乳腺癌家族史相关(一或二级亲属)。相反,BRIP1、RAD51C和TP53突变与卵巢癌家族史相关。与非携带者相比,携带CHEK2和TP53基因突变的乳腺癌患者发病更年轻。(表)
乳腺癌高风险突变基因包括PALB2。中风险基因包括CHEK2、ATM、BARD1、RAD51D、MSH6。低分险基因组包括BRIP1。与乳腺癌发病风险无关的突变基因有MSH2、CDKN2A、RAD51C、NF1、MRN复合基因组NBN、MRE11A和RAD50。(表)
讨论
本研究结果是21个基因组的致癌突变可见于10.2%的乳腺癌白种女性以及6.2%的乳腺癌女性患者除外BRCA1/2基因。16个非BRCA1/2的综合基因组中5个与白种人中-高乳腺癌患病风险相关(PALB2, ATM, CHEK2, BARD1和 RAD51D)。另外,本研究中BARD1、RAD51D为中风险基因,但既往研究并未显示相关性可能与样本量小相关,需进一步理解这两个基因突变的相关乳腺癌表型。MSH6为低-中风险基因,与既往研究结论相悖,提示非配对修复基因突变对乳腺癌患病风险的影响小。
值得注意的是,本研究中NF1,BRIP1,RAD51C,MLH1和PMS2非配对修复基因组、MRE11A、RAD50和NBN MRN复合基因突变未显著增加乳腺癌风险。尽管BRIP1卵巢癌基因稍增加乳腺癌发病风险,但剔除卵巢癌个人史或家族史的病例后,相关乳腺癌风险相关性显著降低。以往研究显示NF1神经纤维瘤病患者中NF1突变中度增加乳腺癌风险,但本研究并未发现这种相关性,需要观察有/无神经纤维瘤患者中NF1突变与乳腺癌的关系。没看到均增加乳腺癌发病风险,这也需要进一步研究这些疾病与乳腺癌关系。此外,RAD51C、MLH1、PMS2、RAD50、MRE11A和NBN与乳腺癌风险无相关性,与其他研究相符,但不能排除某些特异错误突变影响发病风险。
本研究缺点:不是大规模人群研究,只针对需行临床基因检测的患者;非配对的病例对照、组间使用不同检测平台可能引起OR值偏高。
结论:
临床基因检测主要见于早期发病、双侧乳腺癌、三阴性乳腺癌及乳腺癌家族史的患者。本研究中发现的基因突变主要出现在具有遗传性乳腺癌倾向病史的患者中。未来研究需针对所有年龄段、肿瘤病理特征、家族癌症史以及包括更多突变的患者,使基因突变携带者获得更多乳腺癌患病风险信息。
同期评论:多基因检测与乳腺癌风险:是时候缩小范围?
尽管过去几年多基因组检测已成为某些女性评估遗传癌症风险的标准方法,但是否该纳入中风险基因以及相关信息的临床意义仍存争议。该研究样本量大,最重要的发现是某些含括在乳腺癌多基因检测内的中风险基因与乳腺癌发生风险无相关性。这意味着检测这些基因很可能无法带来临床获益,有时候会误导患者及其家属决策。未来是否需常规检测这些基因或仅检测高风险基因突变位点值得我们思考。
该研究利用ExAC数据库作为人群基因突变概率来源的分析方法值得未来的研究借鉴。然而,该研究中未考虑组间年龄、家族史及基因型等因素是否配对,组间的可比性令人质疑。此外,确定偏倚、研究人群只受限于白种女性和乳腺癌为首发癌症的女性等因素均限制了该研究结论的外延性,尚待大规模人群研究进一步明确。再者,该研究若使用乳腺癌绝对终身风险值替代OR的话,更能提供有用的临床信息。
点评:
多基因检测已成为癌症治疗和预防的重要辅助工具。为了提高准确性,检测基因数目及突变位点很多,经济效益及临床意义仍存争议。只有挑选高精准度的基因及突变位点进行检测才真正具有临床指导意义,这仍需进一步研究。
1. http://jamanetwork.com/journals/jamaoncology/fullarticle/2618073
2. http://jamanetwork.com/journals/jamaoncology/fullarticle/2618070











 苏公网安备32059002004080号
苏公网安备32059002004080号


