编译:呆毛
来源:肿瘤资讯
目的
双重打击淋巴瘤(DHL)和双重表达淋巴瘤(DEL)是弥漫型大B细胞淋巴瘤(DLBCL)的两个亚型,在标准化学免疫治疗后预后相对较差接受自体干细胞移植(ASCT)的复发或难治性(rel / ref)DEL或DHL患者,目前预后数据很有限。我们在本研究中回顾性分析了在接受了ASCT 之后,DEL和DHL状态对rel / ref DLBCL患者预后的影响
方法
对化疗敏感rel / ref的 DLBCL患者在接受ASCT后保留有档案肿瘤组织的可以入组。入组后我们对这些患者的肿瘤组织进行了MYC BCL2,BCL6的免疫组化检测和MYC的荧光原位杂交(FISH)检测。在有MYC基因重排或复制的病例,会加上BCL2和BCL6的FISH检测。
结果
共有117名患者入组;44%是DEL,10%是DHL。DEL和DHL与较差的PFS相关,和DHL与较差的OS相关。DEL的4年PFS与无DEL的患者的PFS分别是48%和59%(P=0.049),4年OS分别是56%与67%(P =0.10);DHL的4年PFS与无DHL的患者的PFS分别是28%和57%(P = 0.013),4年OS分别是25%和61%(P = 0.002)。个别同时有DEL和DHL的患者预后差(4 PFS,0%)。在多变量模型中,DEL和DHL与较差的PFS独立相关,而DHL和移植后部分缓解(v完全缓解)与较差的OS相关。
结论
接受自体干细胞移植(ASCT)的复发或难治性(rel / ref)DLBCL患者,如果是DEL或DHL,则与较差的预后相关。尽管ASCT仍然是一个有效的治疗方法,那些有类似DHL等高风险亚型的患者应该应用标准ASCT之外的临床策略
介绍
高剂量化疗是目前化疗敏感的复发或难治性(rel/ref)弥散性大B细胞淋巴瘤在接受自体干细胞移植后的的常用治疗方案。但是一半以上的患者最终会复发,许多预测因子与接受ASCT后的预后相关,包括PET评估的ASCT前缓解状态,复发时间和预后指数,尽管这些临床预后因子是有用的,但我们还可应用新的肿瘤特异性生物标记物来改善预测效果
双重打击淋巴瘤(DHL)是DLBCL的一个亚型,同时具有MYC和BCL2和/或BCL6的基因重排,占到新诊断DLBCL的2%到10%。DHL患者用标准诱导治疗方案美罗华加环磷酰胺、阿霉素、长春新碱和泼尼松(R-CHOP)疗效差。双重表达淋巴瘤(DEL)是共表达MYC和BCL2的 DLBCLs,占新诊断DLBCL患者的21%到34%。一小部分患者可同时有DEL和DHL。和DHL相似,DEL患者在R-CHOP诱导治疗之后的预后也不佳。MYC和BCL2的共表达对预后影响也与其他预后因子独立,如原始细胞(COO)和IPI分数。虽然MYC重排(MYC-R)看起来与较差的预后相关,但是目前数据还很有限。在这项回顾性研究中,我们评估了DEL和DHL状态对接受了ASCT后的rel/ref侵袭性B细胞非霍奇金淋巴瘤患者预后的影响。
结果
研究进行期间,DFCI / BWH和COH两家机构共有751名接受ASCT的侵袭性B细胞NHL患者。其中有144例患者符合合格标准,具有可用的肿瘤组织和临床资料。这其中117例患者有完整的数据能进行IHC和FISH检测,组成研究队列。144名患者中有114例DLBCL,3例是具有伯基特淋巴瘤特性和DLBCL特性的不可归类B细胞淋巴瘤。除了一个因多年前患局部乳腺癌而接受过蒽环类药物治疗的患者,其他所有患者都接受过蒽环类为基础的CHOP方案或CHOP-样化疗方案,随访的中位生存期是45个月。就整个研究队列来说,4年PFS和OS分别是54%(95% CI,44%到63%)和95%(95%可信区间,52%到71%)总体来说,在IHC或FISH不可评估的入组患者及研究队列中的患者,预后是相似的。此外,每个中心的患者移植的预后是类似的:COH患者VS DFCI/ BWH患者的4年PFS结果是50% VS 56%(P = 0.7),4年OS结果是54% VS 68%(p=0.2)
DEL、DHL和预后
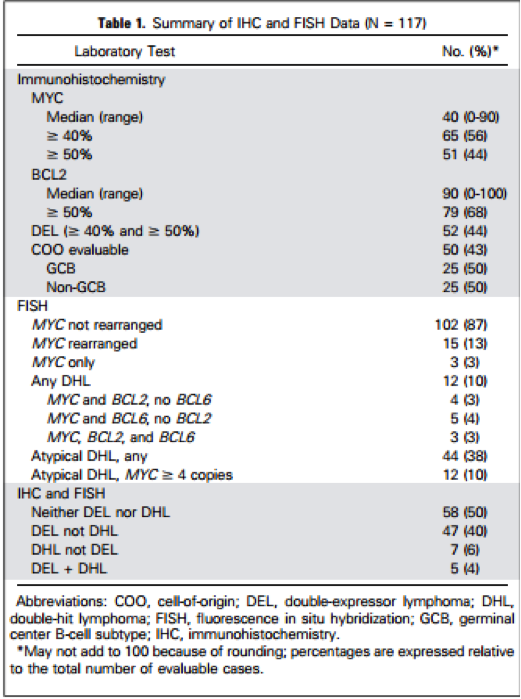
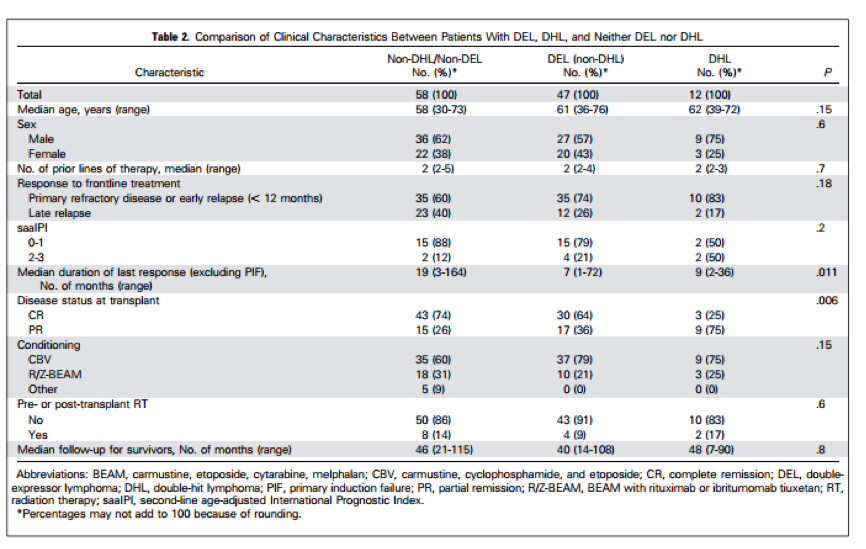
IHC和FISH数据总结在表1。MYC / BCL2 共表达的DEL有52例(44%)。15例(13%)发现MYC-R,其中12例(10%)有DHL。表2列出了DEL,DHL或这两者都不是的患者临床特点DHL的患者更有可能对抢救治疗只有部分缓解,DEL和DHL患者复发时间更短。
IHC和FISH额外分析
我们在研究队列中还评估了其他有可能的IHC和FISH生物标记物。有29例患者(16%)有MYC过表达(≥40%肿瘤细胞阳性)合并BCL6低表达(≤25%的肿瘤细胞阳性),但是和预后没有显著相关性。30例非典型DHL,有MYC和BCL2和/或 BCL6的染色体变异而不是重排,u与预后也没有相关性。一组患者(n=50)用汉斯算法评估COO:25例(50%属于有生发中心b细胞(GCB)亚型,25例(50%)属于无GCB亚型。在GCB亚型肿瘤患者中,24%患者是DEL,无GCB亚型患者中这一比例为36%。20%的GCB亚型患者有DHL,无GCB亚型中有4%。在COO数据亚组,15例有DEL,6例有DHL;60%的DEL患者(15例中有9个)是非GCB亚型,83%的DHL患者(6例中有5个)是GCB亚型。总的来说,在COO组没有明显的预后差异:GCB组的4年PFS是47%,非GCB组患者为43%(P = 0.8);分别对应的4年OS为48% VS 66%(P =0.67)
讨论
DEL或DHL患者用R-CHOP方案预后较差。然而,对于接受ASCT的rel / ref DEL或DHL患者预后数据我们却知之甚少,这些患者还在应用标准治疗方案。我们进行这个回顾性多中心研究是要了解接受ASCT后,DEL或DHL对 rel /ref DLBCL患者预后的影响。在DEL,DHL和非DEL/DHL三类患者对比,发现在化疗敏感性 rel/ref DLBCL患者,对诱导化疗和解救治疗响应的程度及持续时间都是不同的。在我们的研究人群中,DHL患者不太可能从抢救治疗中获得CR。DEL患者和患者DHL在诱导治疗后复发时间更短。
在我们回顾分析中,ASCT后的rel / ref DLBCL患者的多中心研究结果发现,DEL和DHL与较差的预后有关,合并DEL和DHL的患者似乎预后不良。这支持之前提出的双重打击/双重表达能致使DLBCL耐化疗的观点,这类患者似乎不太可能被化疗治愈。然而,很大一部分rel / ref 的DEL患者接受ASCT后缓解,特别是没有DHL的孤立DEL,这表明单独存在DEL不能认为是ASCT的禁忌症。尽管有些rel / ref的 DHL患者(孤立的DHL没有DEL)在ASCT后长期缓解,但这类患者的的低存活率提示我们还是应该改变移植策略,包括同种异体造血干细胞移植或ASCT前复发预防策略。
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
参考文献:
DOI: 10.1200/JCO.2016.68.2740 Journal of Clinical Oncology - published online before print October 24, 2016















 苏公网安备32059002004080号
苏公网安备32059002004080号


