专家介绍
广东省人民医院外科乳腺科行政主任
国际肿瘤预防和治疗学会(ISOPT)公共教育主任
美国肿瘤外科医师协会(SSO)国际理事会理事
国际前哨淋巴结协会(ISNS)国际理事会理事
美国NCCN乳腺癌指南(中文版)专家组成员
国家卫生健康委员会医政司《乳腺癌治疗规范》编写组成员
国家卫生健康委员会《乳腺癌诊断指南》专家组成员
国家卫生健康委员会合理用药专家委员会《肿瘤药物组》专家组成员
什么是PTEN基因
大家好。
今天我们将一起探讨一个在肿瘤遗传学中具有重要意义的抑癌基因—PTEN。
PTEN 是 “Phosphatase And Tensin Homolog” 的缩写,编码去磷酸酶,位于人类第10号染色体上,属于经典抑癌基因。其蛋白可去除脂质/蛋白底物上的磷酸基团,核心底物为 PIP3(去磷酸为 PIP2),从而拮抗 PI3K–AKT 促增殖/抗凋亡通路,维持细胞稳态。除PIP3外,PTEN可去磷酸化多种蛋白底物,如黏附激酶(FAK)、胰岛素受体底物1(IRS1)和转录因子CREB,调控细胞迁移、黏附和代谢。细胞核内PTEN通过结合着丝粒蛋白C(CENPC)维持染色体稳定性,并参与DNA双链断裂修复。此外,PTEN还通过激活APC/C-CDH1复合物降解细胞周期蛋白(如PLK1),诱导细胞周期阻滞和衰老。
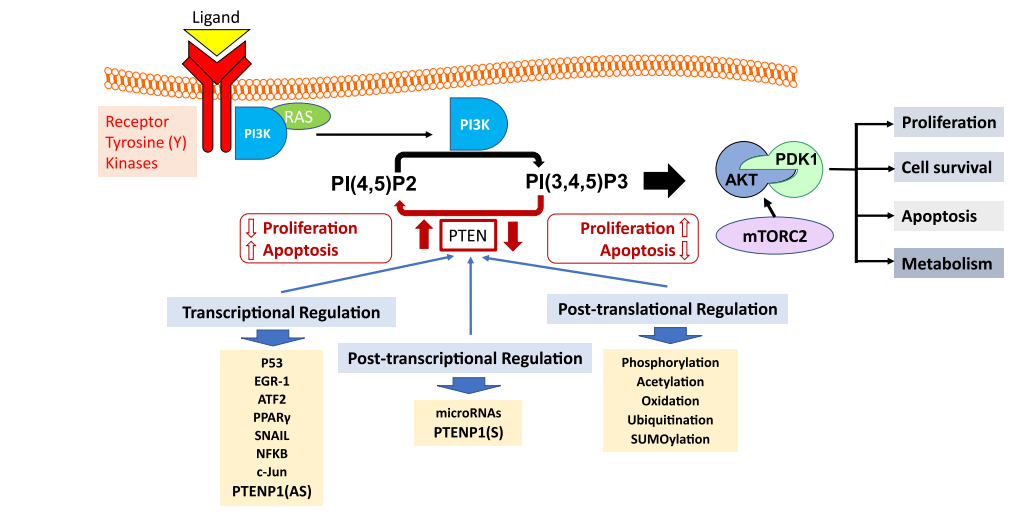
PTEN功能丧失是多种癌症的共同特征,主要通过PI3K/AKT通路过度活化驱动肿瘤进展。PTEN单倍剂量不足(单等位基因缺失)即可显著增加癌症易感性,例如在前列腺癌中驱动从雄激素依赖型向侵袭型转化;在乳腺癌中常见PTEN的表达降低或缺失,在COSMIC数据库中显示4.43%的乳腺癌中存在PTEN突变,且与更为恶性的肿瘤表型相关。
PTEN突变的临床意义
1. 遗传风险
PTEN的胚系突变错构瘤综合征(PHTS):包括Cowden综合征(80%突变率)、Bannayan-Riley-Ruvalcaba综合征(60%),表现为多发错构瘤和癌症易感性(如乳腺癌风险85%)。热点突变包括R130X、R233X(无义突变)和C124S(错义突变),多位于磷酸酶结构域。PHTS女性乳腺癌终身风险最高(约 85%),发病风险自约 30 岁起上升;男性携带者未见终身风险增加的证据;并指出 PHTS 女性良性乳腺病变发生率可高达 ~67%。NCCN 2025年V2版 《遗传性/家族性乳腺、卵巢、胰腺癌高危因素评估指南》指出,携带PTEN突变基因患乳腺癌的风险为40–60%。此外,PTEN基因突变不仅局限于乳腺癌,突变携带者有更高的胶质母细胞瘤、前列腺癌、子宫内膜癌发病风险。

2. 治疗选择
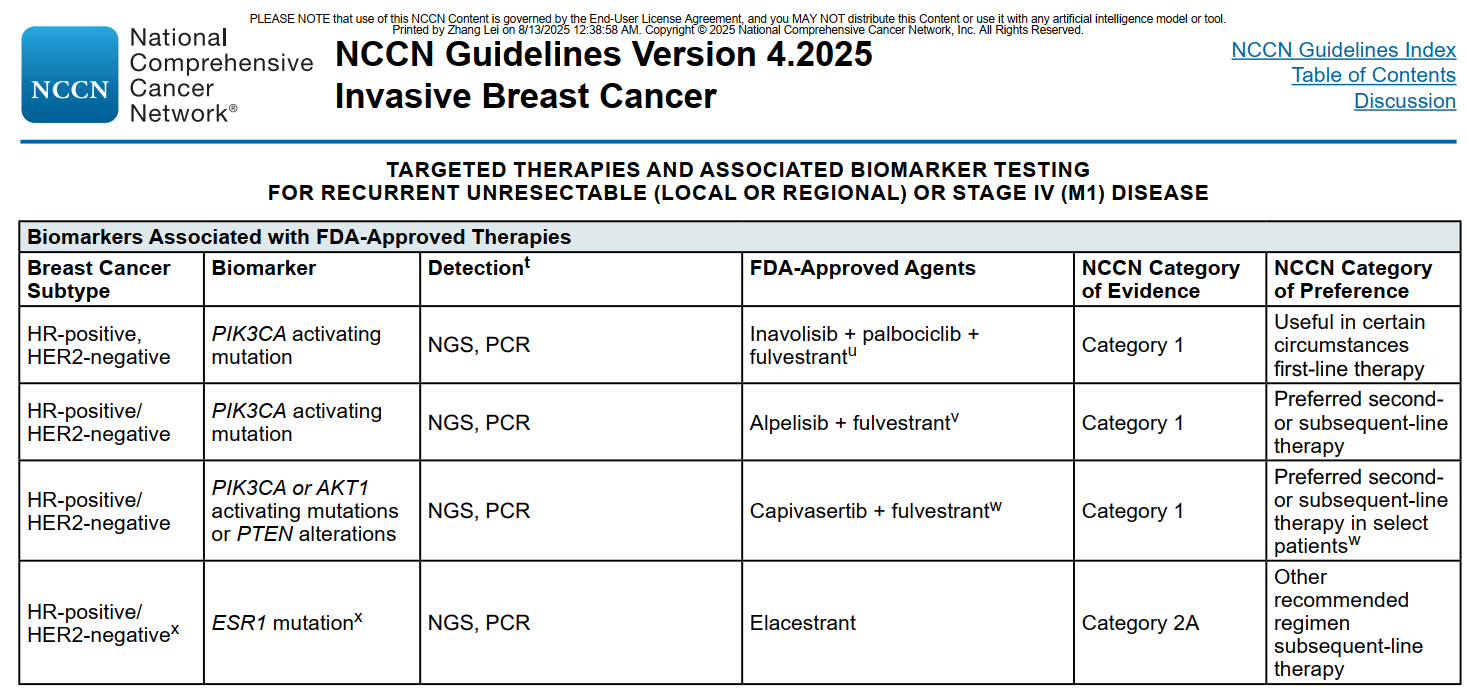
在治疗层面,NCCN 2025年V2版 《临床实践指南指南:乳腺癌》指出,在激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者中,推荐使用NGS或PCR进行PIK3CA/AKT1 /PTEN检测,对于存在突变的患者推荐使用特鲁卡普联合氟维司群联合治疗。
3. 预后评估
第三点,我们来看 PTEN 突变与预后的关系。
PTEN缺失富集于基底样亚型(54.3% vs. 非基底样13.4%, p<10⁻⁹),且与TP53突变共存时PFS极短。在HR+/HER2-乳腺癌中,PTEN缺失与更短无进展生存期(PFS)显著相关(HR=2.89, p=0.001),独立于其他因素,当与PIK3CA突变共存时,PFS进一步缩短。此外,PI3K通路激活(含PTEN缺失)可能降低靶向治疗敏感性,但非主要驱动因素。
PTEN突变检测方法
接下来我们来介绍一下PTEN 的检测方法。PTEN 缺少热点突变。
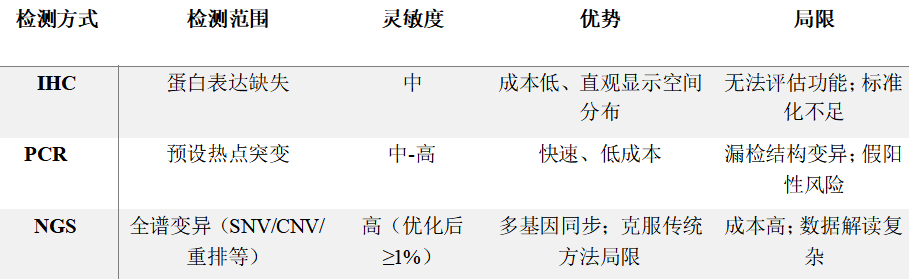
目前临床上常用的检测方法主要包括以下三种:
1. 免疫组化(IHC)
检测PTEN 蛋白的表达,截短突变常伴PTEN蛋白完全缺失(IHC评分0);
✅ 优点是:便捷、快速、常规病理室即可完成;
❌ 局限是:依赖抗体质量,存在异质性及假阴性可能。
2. PCR 检测
针对特定外显子(如PTEN第5、8外显子)设计引物,通过电泳或测序检测点突变和小片段插入/缺失。
✅ 优点是:灵敏度较高(尤其对已知热点突变),成本低且快速;
❌ 局限在于:仅覆盖预设位点,漏检大片段缺失、拷贝数变异或结构重排。
3. NGS(二代测序)
高通量测序覆盖PTEN全基因(单核苷酸变异、拷贝数变异、结构重排等),结合生物信息学分析;
同步检测PIK3CA、AKT1、BRCA等通路基因,提供多维分子图谱。
✅ 优点:避免IHC判读主观性和PCR覆盖不足;
❌ 缺点:费用高、数据分析复杂、对解读团队要求高。
在检测PTEN纯合子拷贝缺失方面,组织活检比循环肿瘤DNA(ctDNA,液体活检)更敏感。
我们可以简单总结一下三种方法的比较:
临床指征与建议检测人群
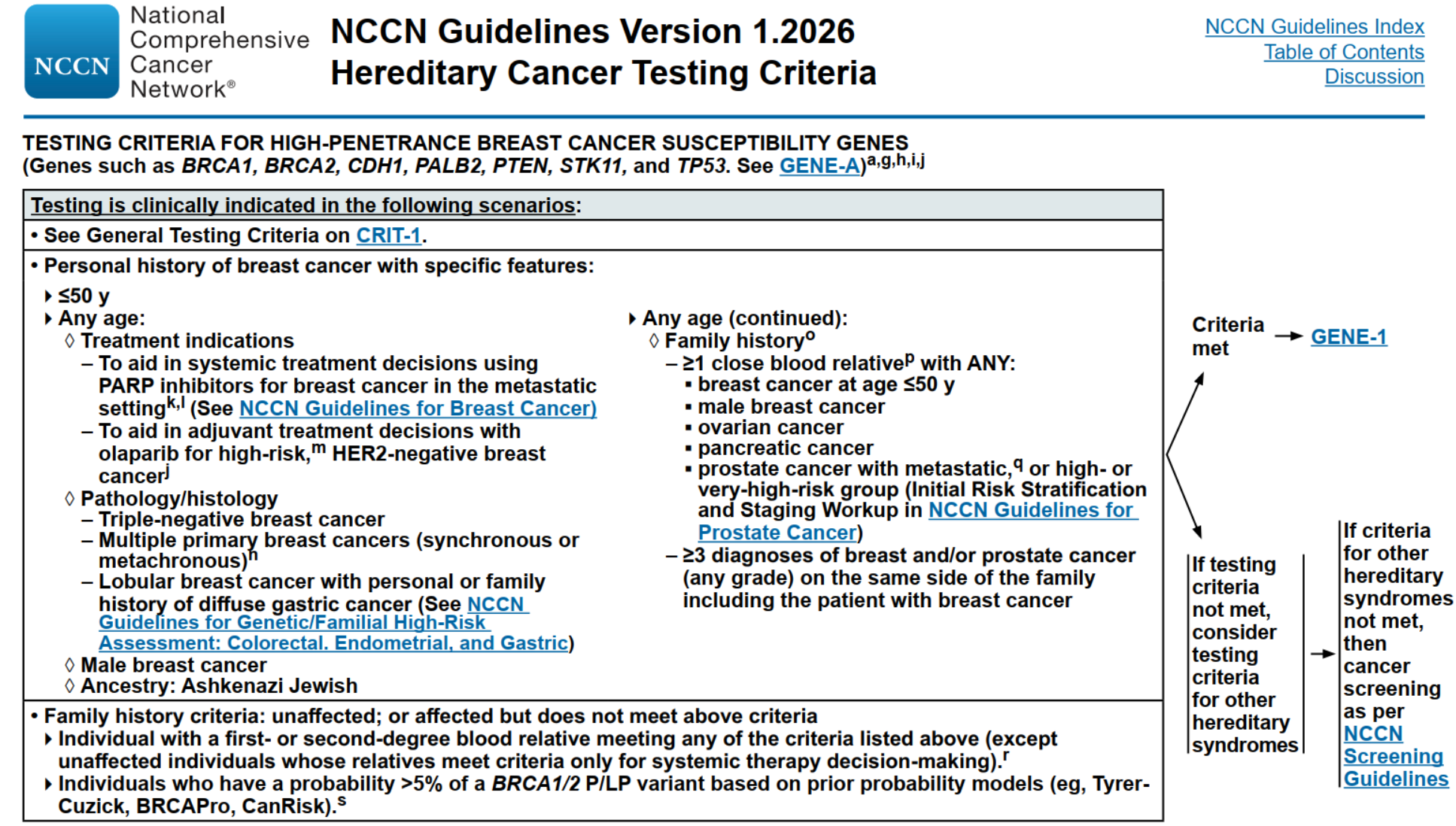
1.依据 NCCN,推荐以下人群进行 PTEN胚系检测:
- 早发乳腺癌患者(如50岁前发病);
- 有乳腺癌或卵巢癌家族史者,尤其是家族中出现多位相关肿瘤患者或男性乳腺癌;
- 已知携带 BRCA1/2 突变的家族成员的一级亲属;;
- 男性乳腺癌、前列腺癌或胰腺癌患者,特别是家族中也有类似肿瘤史者;
- 某些三阴性乳腺癌(TNBC)或高等级浆液性卵巢癌患者,也被纳入推荐筛查人群。
早期识别 PTEN 突变携带者有助于进行精准化乳腺癌筛查或考虑风险降低策略(如药物预防或预防性手术),从而降低癌症发生风险并延长生存。
2.检测结果解读与处理
在完成 PTEN 基因检测之后,我们通常会看到三种不同类型的结果。接下来我来简要说明这三类结果各自的意义和应对方式。
第一类是致病或可能致病突变,也就是我们常说的 P 或 LP。这类结果说明突变已经被证实或高度怀疑与肿瘤发生有关。对于这种情况,我们建议患者进行遗传咨询;同时也建议患者的一级亲属,比如父母、兄弟姐妹、子女,进行相应的检测;必要时还可以结合家系共分离分析,进一步明确风险来源。
第二类是意义不明确变异,也叫 VUS。这类变异目前没有足够证据证明其致病性;因此我们在临床上不建议据此做出治疗决策;更合适的做法是定期关注文献更新,有条件时也可以做功能验证,看看未来能不能明确其意义。
第三类是阴性结果。如果检测没有发现突变,初步是一个好消息;但需要注意:阴性并不代表零风险;如果患者有很强的家族史,还是应该纳入高风险人群进行管理,比如加强筛查频率、调整影像学检查方式等。
3.管理建议
明确 PTEN 检测结果后,需制定管理策略。因 PHTS 综合征罕见,CS 患者诊断与管理复杂,建议转诊至专科团队 / 中心 。
· 全身及基础管理
从 18 岁或家族中某癌症成分最年轻诊断年龄前 5 年(取先到者)起,每年全面体检,重点查甲状腺;开展癌症体征症状教育 。
· 乳腺癌专项管理
基础认知:开展乳房认知教育,让女性知晓乳房正常外观、触感,助力早发现异常 。
临床检查:25 岁或家族最早乳腺癌发病年龄前 5 - 10 年(先到者为准)起,每 6 - 12 个月做临床乳腺检查 。
影像学筛查:30 岁或家族最早乳腺癌发病年龄前 10 年(先到者为准)起,每年行乳腺钼靶 + 有 / 无对比剂的乳腺 MRI 筛查;>75 岁者依个体情况定;携带 PTEN P/LP 变异、患乳腺癌且未行双侧乳房切除术者,继续按此筛查 。
预防性手术:与携带 P/LP 变异者讨论降低风险的乳房切除术(RRM);CS/PHS 患者是否手术参考家族史 。咨询涵盖保护程度、重建方案、风险,还要考虑家族史及随年龄、预期寿命变化的残余乳腺癌风险 。关注 RRM 对患者心理社会及生活质量的影响 。

关注接受 RRM 对个体心理社会和生活质量方面的影响。
总而言之,PTEN突变不仅是一个实验室结果,更是贯穿诊断、治疗、随访与家族管理的“起点”。只有将它纳入一整套的综合管理流程,才能真正实现风险降低、疗效提升与预后改善的多重目标。
总结
PTEN胚系突变是指导乳腺癌、前列腺癌等高危患者筛查、治疗和预防的重要生物标志物。其检测不仅对患者本身有直接意义,也有助于整个家系的遗传风险管理。临床中应重视检测结果的解读与遗传咨询结合。
1. Chen, K. PTEN Gene. Encyclopedia. Available online: https://encyclopedia.pub/entry/4502 (accessed on 14 August 2025).
2. Travis, G.; Mcgowan, E.M.; Simpson, A.M.; Marsh, D.J.; Nassif, N.T. PTEN and Cancer. Encyclopedia. Available online: https://encyclopedia.pub/entry/50425 (accessed on 14 August 2025).
3. NCCN Guidelines Version 4.2025 Invasive Breast Cancer
4. Yehia, L., Keel, E., & Eng, C. (2020). The Clinical Spectrum of PTEN Mutations. Annual Review of Medicine, 71(1), 103-116. https://doi.org/10.1146/annurev-med-052218-125823
5. Álvarez-Garcia, V., Tawil, Y., Wise, H. M., & Leslie, N. R. (2019). Mechanisms of PTEN loss in cancer: It’s all about diversity. Seminars in Cancer Biology, 59, 66-79. https://doi.org/10.1016/j.semcancer.2019.02.001
6. Lee, Y.-R., Chen, M., & Pandolfi, P. P. (2018). The functions and regulation of the PTEN tumour suppressor: new modes and prospects. Nature Reviews Molecular Cell Biology, 19(9), 547-562. https://doi.org/10.1038/s41580-018-0015-0
7. Haddadi, N., Lin, Y., Travis, G., Simpson, A. M., Nassif, N. T., & McGowan, E. M. (2018). PTEN/PTENP1: ‘Regulating the regulator of RTK-dependent PI3K/Akt signalling’, new targets for cancer therapy. Molecular Cancer, 17(1). https://doi.org/10.1186/s12943-018-0803-3
排版编辑:HYC











 苏公网安备32059002004080号
苏公网安备32059002004080号


