在精准医学浪潮的推动下,胆管癌的治疗已告别“一刀切”的化疗时代,步入多维协同、动态演进的崭新阶段。当前诊疗体系的核心,在于将日益清晰的分子图谱转化为个体化的临床决策:从一线免疫联合化疗的基石建立,到基于FGFR、IDH1等经典靶点及不断涌现的新兴靶点的精准干预,治疗策略日趋立体。更为深刻的是,靶向治疗远不止于通路抑制,更能通过表观遗传重塑等方式激活系统性抗肿瘤免疫。值此契机,中国医学论坛报特邀复旦大学附属中山医院刘天舒教授聚焦这一领域的最新突破进行深度解读,以期为临床实践提供参考。
专家简介
主任医师、博士生导师
复旦大学附属中山医院肿瘤内科主任、肿瘤预防与筛查部主任、肿瘤早期研究病房主任
上海市肿瘤化疗质量控制中心主任
CSCO常务理事
CACA胃癌专委会常委
中华医学会学临床流行病与循证医学分会(第九届) 副主任委员
中华医学会肿瘤学分会(第十二届)委员
主要研究领域为消化道恶性肿瘤的综合诊疗
自2012年开始,参与国际大型多中心III期临床研究30余项,参与国内外新药早期临床研究200余项,其中牵头40余项,自主发起临床研究25项
部分研究结果改变了临床实践,被国内外临床指南所引用
作为牵头单位,制定了消化道肿瘤免疫不良反应共识
欧洲临床实践总结:靶向治疗时代下优化晚期胆管癌预后的机遇与途径
Opportunities and Approaches to Optimising Advanced Cholangiocarcinoma Outcomes in the Era of Targeted Therapies: A Narrative Review1
胆管癌是第二常见的原发性肝脏恶性肿瘤,发病率在全球范围内呈上升趋势。由于早期常无症状且症状非特异性,多数患者确诊时已处于晚期,错失根治性手术机会,导致预后极差。2024年9月,来自16个国家的30位肿瘤学专家在西班牙巴塞罗那召开了胆管癌靶向治疗专家交流会议(EXACT),讨论如何改善胆管癌的诊断与管理,应对当前未满足的临床需求。本综述基于EXACT会议上作者们的报告内容撰写,内容涵盖胆管癌的流行病学、临床表现、诊断策略、治疗选择及最新进展,特别是分子生物标志物与靶向治疗的应用。
流行病学数据显示,在大多数国家,其年发病率约为每10万人0.3至6.0例,而亚洲部分地区(如韩国、中国和泰国)因肝吸虫感染流行,发病率超过6.0例/10万人/年,成为“热点”区域。诊断方面,欧洲肿瘤内科学会(ESMO)指南推荐自最初阶段即采用多学科团队(MDT)协作模式。诊断路径包括影像学评估和活检以获取组织进行病理确诊及分子分析。然而,从胆道病变获取高质量活检样本存在显著挑战,包括技术难度高、样本失败率高(常因组织量不足)、肿瘤位置难以触及、以及样本中高纤维化或间质成分导致肿瘤细胞产量不理想等。因此,ESMO指南建议,在确诊晚期疾病时即应进行基于下一代测序(NGS)的分子检测,且最好在启动一线全身治疗之前完成分子谱分析,以便为后续治疗决策提供关键信息。若组织活检失败或不可行,液体活检可作为替代选择,用于获取循环游离DNA进行分子检测。据估计,约45-47%的胆管癌患者存在潜在可靶向的基因变异,如IDH1突变、FGFR2融合、HER2过表达/扩增、BRAF V600E突变等,凸显了早期全面分子检测的重要性。
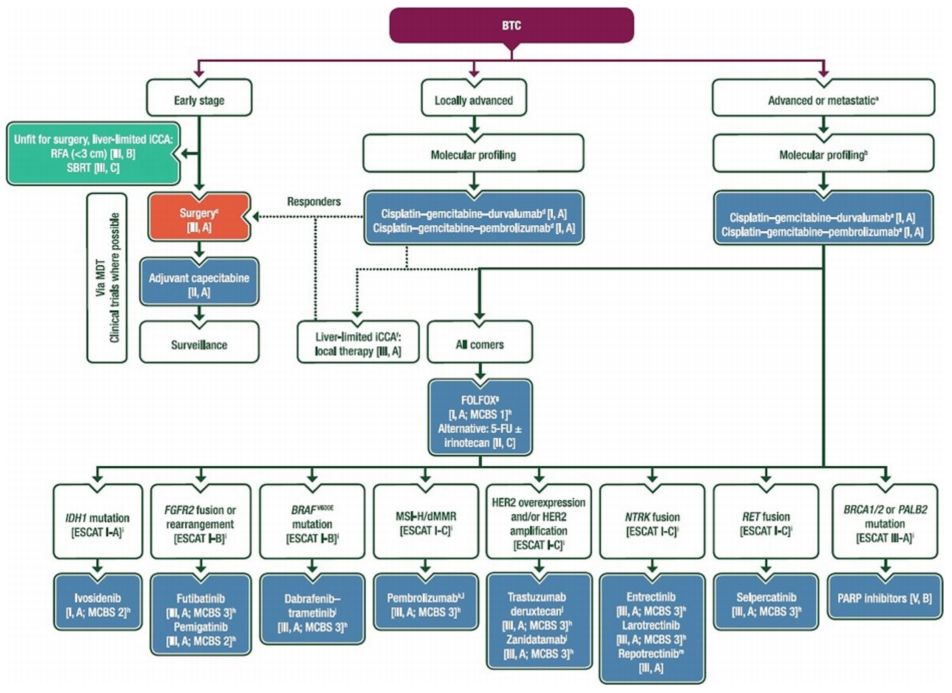
对于不可切除的局部晚期或转移性胆管癌,目前标准一线全身治疗方案为顺铂联合吉西他滨(CisGem)基础上联合免疫检查点抑制剂。顺铂的剂量通常为25 mg/m²,于每个21天周期的第1和第8天静脉输注,吉西他滨为1000 mg/m²。该方案可在门诊进行,一般无需长时间水化,耐受性较好。标准治疗周期通常为8个周期,随后可继续使用免疫单药维持直至疾病进展或不可耐受毒性。值得注意的是,尽管标准方案明确,但真实世界数据显示仍有50%至65%的患者未接受任何全身治疗,而在接受治疗的患者中,约三分之二仅完成一线治疗,突显了在临床实践中加强患者评估、支持治疗以及全程管理的重要性。
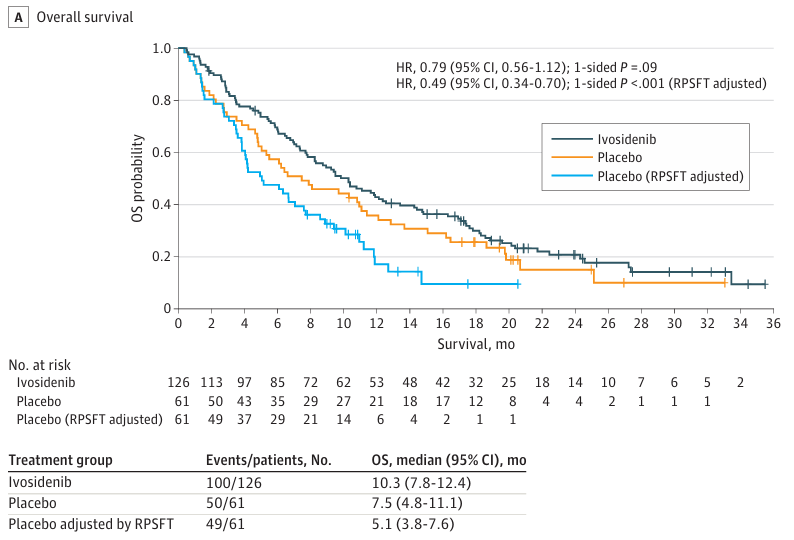
一线治疗进展后,对于存在可靶向基因变异的患者,应优先选择相应的靶向治疗。例如,IDH1抑制剂艾伏尼布适用于IDH1突变患者。值得注意的是,IDH1突变在肝内胆管癌中约占14–20%,虽通常不视为独立预后因子,但在二线治疗背景下可能提示较差预后。III期ClarIDHy研究显示,在经治的IDH1突变患者中,艾伏尼布较安慰剂显著延长PFS(中位PFS 2.7 vs. 1.4个月,HR 0.37,P<0.0001),且疾病控制率达53.2%。尽管客观缓解率较低(约2%),但近半数患者实现疾病稳定,部分患者可获得长期获益,提示该药主要通过疾病稳定实现临床控制。FGFR抑制剂佩米替尼与福巴替尼可用于FGFR2融合/重排患者,客观缓解率约40–42%。泽尼达妥单抗(双特异性抗体)与德曲妥珠单抗(抗体偶联药物)为HER2过表达/扩增患者提供有效选择。BRAF/MEK抑制剂达拉非尼联合曲美替尼适用于BRAF V600E突变患者。对于未检出可靶向变异的患者,二线化疗首选5-氟尿嘧啶+奥沙利铂(FOLFOX)方案。此外,对于高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的患者,可考虑帕博利珠单抗等免疫单药治疗。
揭示抑制IDH1突变体激活肿瘤免疫的机制
Mutant IDH1 inhibition induces dsDNA sensing to activate tumor immunity2
IDH1突变体会产生致癌代谢物(R)-2-羟基戊二酸(R-2HG)。R-2HG通过抑制包括表观遗传调控因子在内的多种酶,重塑细胞的表观遗传景观,最终诱发和促进肿瘤生长。值得注意的是,IDH1突变的实体瘤(如肝内胆管癌和低级别胶质瘤)表现出明显的免疫逃避特征,即细胞毒性CD8⁺ T细胞被排斥于肿瘤微环境之外。虽然IDH1突变抑制剂能降低R-2HG水平并在临床前及临床模型中显示出疗效,同时伴随CD8⁺ T细胞的招募和抗肿瘤免疫的激活,但其具体机制尚未完全阐明。本研究在体外和体内系统中,使用特异性IDH1突变抑制剂(如艾伏尼布)处理细胞或小鼠模型,并通过免疫组化、流式细胞术、免疫印迹、免疫荧光和细胞因子检测等手段,系统分析了肿瘤细胞的表观遗传改变、转录组变化、免疫细胞浸润及肿瘤生长动态。
研究结果揭示,mIDH1抑制剂通过激活TET2介导的DNA去甲基化,逆转了肿瘤细胞中细胞质双链DNA传感器(cGAS)基因位点的高甲基化沉默状态,同时激活了特定内源性逆转录病毒(ERV)。这些ERV编码的逆转录酶(RT)产生胞质双链DNA,进而激活cGAS-STING-IRF3信号通路,触发“病毒模拟”反应,诱导I型干扰素及其下游抗病毒和免疫刺激性基因表达程序。该过程与干扰素γ反应恢复产生协同作用,形成正向反馈环路,最终驱动CD8⁺ T细胞浸润肿瘤并抑制肿瘤细胞增殖。机制上,cGAS或ERV-RT的基因敲除完全阻断了IDH1抑制剂诱导的免疫激活和抗肿瘤效果,而dsRNA感知通路组件MAVS的敲除则无影响。在人类IDH1突变型胆管癌和胶质瘤细胞及患者样本中,同样观察到cGAS位点的特异性高甲基化与表达沉默,且IDH1抑制剂治疗能恢复其表达并诱导类似的病毒模拟反应。
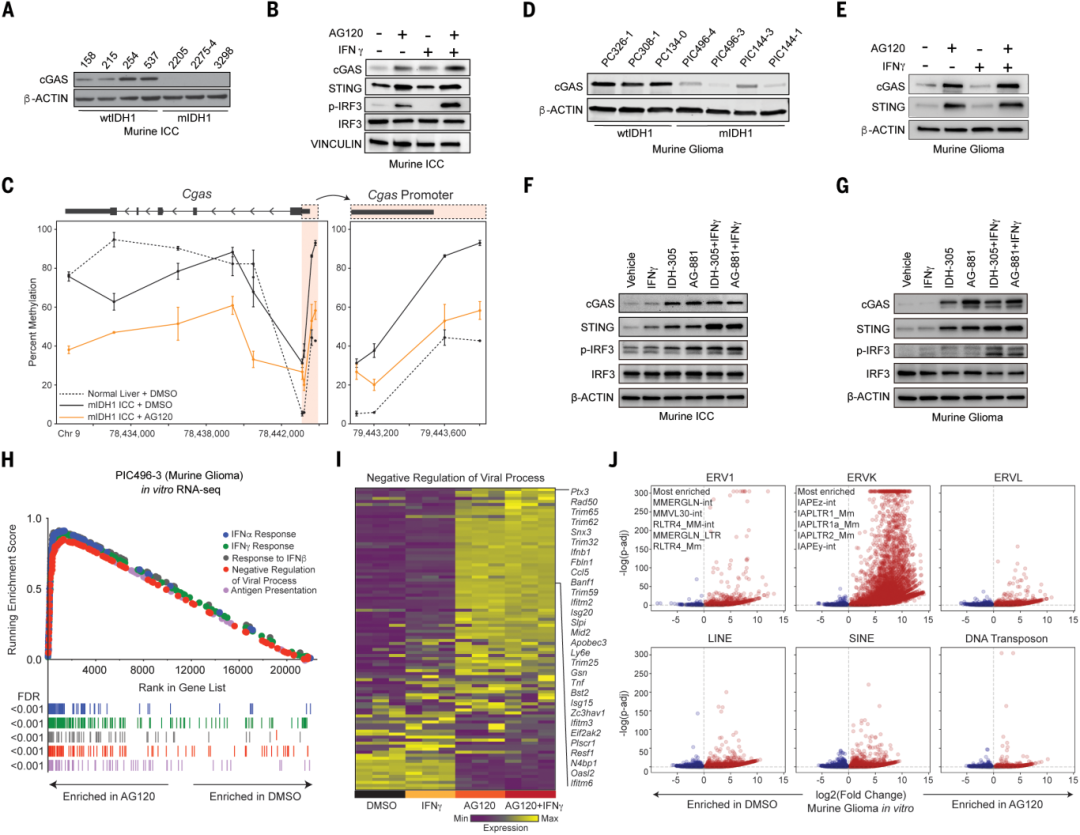
结论表明,IDH1突变通过表观遗传沉默cGAS损害了肿瘤细胞的固有免疫感知能力,而IDH1抑制剂则通过逆转这一沉默,并协同激活ERV来源的双链DNA-cGAS-STING通路,重新启动抗病毒样免疫应答,从而将“冷”肿瘤转化为“热”肿瘤,促进抗肿瘤免疫。这为IDH1突变型实体瘤的治疗提供了双重作用机制的理论基础,并为联合免疫治疗或靶向增强病毒模拟反应的策略开发指明了方向。
胆管癌视野拓展:FGFR2和IDH1之外的新兴靶点
Expanding Horizons in Cholangiocarcinoma: Emerging Targets Beyond FGFR2 and IDH13
随着基因组测序技术的进步,研究人员发现CCA存在一系列可靶向的分子变异,包括在肝内CCA(iCCA)中常见的IDH1/2突变、FGFR2融合,以及在肝外CCA(eCCA)中高发的TP53和KRAS突变等,这为精准治疗奠定了基础。
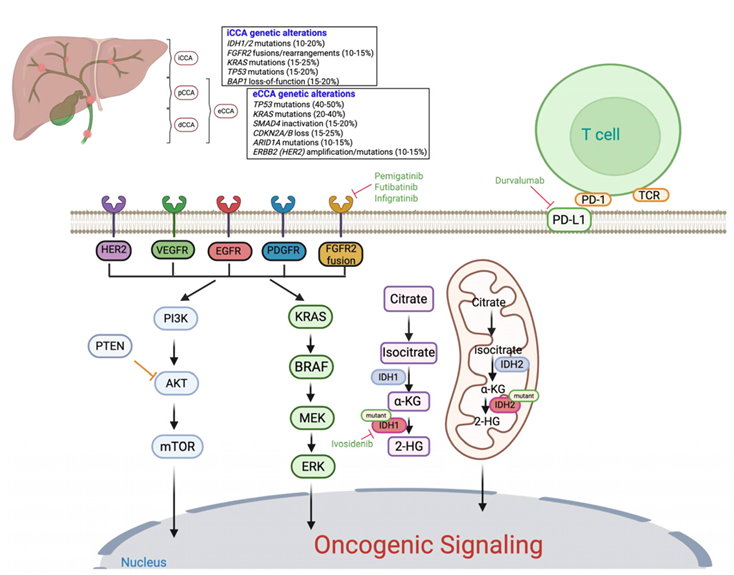
表. FDA批准的胆管癌小分子靶向治疗清单(按分子靶点和临床适应症排序)
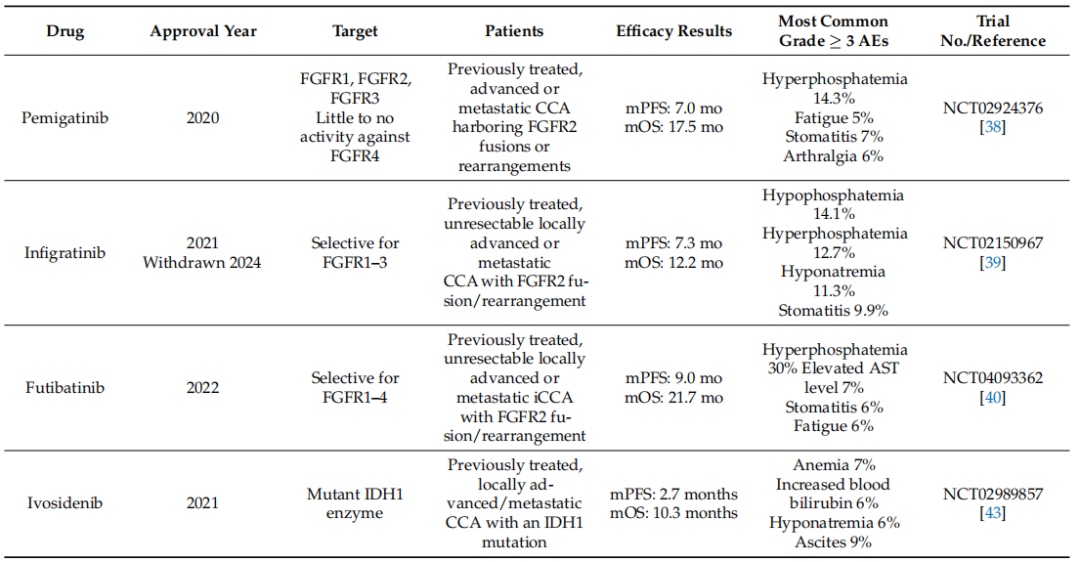
基于FGFR2融合和IDH1突变的靶向治疗在相应患者亚组中展现出显著临床获益(如艾伏尼布的中位OS达10.3个月)。其中,靶向IDH1突变的研究已不限于单药,其抑制剂艾伏尼布正与免疫检查点抑制剂(如纳武利尤单抗、伊匹木单抗)开展联合疗法探索,以期通过抑制突变IDH1所致的免疫抑制微环境,实现与免疫治疗的协同增效,相关I/II期试验正在进行中。同时,超越这两类已确立靶点的研究方兴未艾。针对p53/MDM2通路、ErbB家族(EGFR/HER2)、血管生成通路(VEGFR/PDGFR)等多种新兴靶向策略的临床前和临床研究在广泛开展中,其中,抗血管生成药物如雷莫西尤单抗、瑞戈非尼等在晚期CCA中显示出一定的疾病控制潜力,但其单药疗效有限,更多探索集中于与化疗或免疫治疗的联合。同时,免疫治疗领域本身也在深化,除已确立的PD-1/PD-L1抑制剂联合化疗一线方案外,针对其他免疫检查点(如CTLA-4)的双免联合、以及免疫治疗与靶向药物的联用(如PD-L1抑制剂联合MEK抑制剂)也处于积极探索阶段,旨在克服CCA免疫抑制性的肿瘤微环境。而在所有新兴靶点中,KRAS靶向治疗的突破尤为瞩目。尽管其G12C突变在CCA中相对少见,但新近数据显示,阿达格拉西布在KRAS G12C突变的CCA患者中取得了50%的ORR和15.1个月的中位OS,而针对更常见的G12D等突变亚型的抑制剂以及泛KRAS抑制剂正在积极研发中,展现出巨大潜力。
刘天舒教授(复旦大学附属中山医院):当前,胆道恶性肿瘤的临床与科研正经历着一场深刻的变革,其核心驱动力来自精准医学理念的深化与免疫学机制的揭示。本次三篇文献恰好从临床实践全景、基础转化机制、未来治疗探索三个递进维度,精准勾勒了当今胆管癌诊疗发展的核心脉络,为我们理解现状、洞察未来提供了清晰指引。
Macarulla T等的综述文章,是对当前欧洲临床实践的系统性“诊断”,深刻揭示了精准诊疗落地面临的挑战与未满足的需求。文章基于顶级专家共识,客观呈现了一线“免疫+化疗”标准的确立,以及FGFR、IDH1等靶向治疗为二线患者带来的生存希望。然而,其最宝贵的价值在于超越指南推荐,直面现实困境:即便在医疗资源丰富的欧洲,仍有超过半数患者未接受任何全身治疗,且多数仅能完成一线治疗。这强烈提示,胆管癌的管理不仅是一个治疗选择问题,更是一个涉及全程管理、患者支持、以及早期精准分子分层的系统性工程。文章特别强调了在启动一线治疗前完成NGS检测的重要性,并正视了胆道活检的技术挑战与分子检测的高失败率。这些未满足的需求是当前临床实践的真正瓶颈,提醒我们必须投入更多资源优化诊断路径(如推进液体活检)、加强MDT,并建立更完善的随访支持体系,确保所有患者都能及时、平等地获得最适宜的精准治疗。
IDH1抑制剂激活肿瘤免疫的研究开启了从靶向抑制到免疫重塑的认知飞跃。长期以来,IDH1抑制剂在临床中展现出部分患者能长期获益的特点。本研究从表观遗传层面揭示了其“润物细无声”的深层机制:抑制突变IDH1不仅能降低致癌代谢物R-2HG,更能逆转cGAS-STING通路的关键基因沉默,并通过激活内源性逆转录病毒触发“病毒模拟”状态,从而系统性激活I型干扰素应答,将免疫“冷”肿瘤转化为“热”肿瘤。这一发现具有双重意义:其一,它解释了为何IDH1抑制剂单药即可诱导T细胞浸润,为其临床疗效提供了坚实的理论基础;其二,它揭示了靶向药物具备成为“免疫增敏剂”的潜力,为IDH1抑制剂与免疫检查点抑制剂的联合策略提供了强有力的原理支持。这提示我们,未来对靶向药物的评估,应超越其直接的细胞毒效应,更深入地考察其对肿瘤免疫微环境的系统性重塑能力。
Darman L等则将视野投向更广阔的未来,系统梳理了超越FGFR2/IDH1的新兴治疗靶点与策略,展现了胆管癌精准治疗的无限潜力。文章不仅罗列了HER2、BRAF V600E、KRAS G12C等已显露疗效的新靶点,特别是KRAS抑制剂在胆管癌中展现的高缓解率令人振奋,更前瞻性地指出了联合治疗这一关键方向。无论是靶向药物之间的组合,还是靶向与免疫、化疗的多模式联合,都是未来突破疗效瓶颈的主要路径。文章还提及了针对p53/MDM2通路等其他靶点的探索,以及对CTLA-4等新免疫节点的尝试,共同描绘了一个多层次、多机制协同作战的未来治疗蓝图。这要求临床研究者不仅要有识别靶点的慧眼,更要有设计“组合拳”的智慧,基于对药物作用机制的深刻理解,进行有理有据的联合策略探索,以期实现“1+1>2”的协同效应。
总结而言,这三篇文献从临床实践的现实挑战出发,到基础研究揭示的作用机制深化理解,最终指向未来治疗的广阔探索方向。它们共同强调,胆管癌的诊疗已进入一个高度复杂、需动态整合的系统医学时代。临床医生不仅要掌握现有的治疗武器(免疫治疗、化疗、靶向治疗),更要理解其协同作用的原理,并积极参与到优化诊断路径、探索创新联合方案的实践中,方能为患者不断拓展生存的希望边界。
1. Macarulla T, Neuzillet C, Prager GW, et al. Opportunities and Approaches to Optimising Advanced Cholangiocarcinoma Outcomes in the Era of Targeted Therapies: A Narrative Review. Oncol Ther. 2025 Dec;13(4):939-962. doi: 10.1007/s40487-025-00370-2. Epub 2025 Oct 8. PMID: 41060610; PMCID: PMC12647446.
2. Wu MJ, Kondo H, Kammula AV, et al. Mutant IDH1 inhibition induces dsDNA sensing to activate tumor immunity. Science. 2024 Jul 12;385(6705):eadl6173. doi: 10.1126/science.adl6173. Epub 2024 Jul 12. PMID: 38991060; PMCID: PMC11602233.
3. Darman L, Kaurich Q, Hassan MS, et al. Expanding Horizons in Cholangiocarcinoma: Emerging Targets Beyond FGFR2 and IDH1. Int J Mol Sci. 2025 Nov 5;26(21):10755. doi: 10.3390/ijms262110755. PMID: 41226789; PMCID: PMC12608419.
本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批号:M-TIBSO-CN-202512-00021
本文转自:中国医学论坛报今日肿瘤











 苏公网安备32059002004080号
苏公网安备32059002004080号


