2025年欧洲肿瘤内科学会亚洲年会(ESMO Asia)于近日在新加坡盛大召开。本次大会汇聚了亚太地区以及全球的肿瘤学专家,聚焦消化道肿瘤精准诊疗前沿,分享肿瘤学领域的最新研究进展和治疗突破。
长期以来,胆管癌作为一类高度异质性的消化道恶性肿瘤,早期诊断困难,患者大多在就诊时已处于肿瘤进展期,导致手术切除率低,病死率高1-2。与此同时,胰腺癌因恶性程度高、预后极差,已成为危害公共健康的突出问题3-4。本期特邀复旦大学附属中山医院刘天舒教授围绕2025 ESMO Asia年会上胆管癌和胰腺癌领域的前沿进展发表学术观点,为临床实践提供重要的参考方向。
专家简历
复旦大学附属中山医院肿瘤内科主任
肿瘤预防与筛查部主任
肿瘤早期研究病房主任
上海市肿瘤化疗质量控制中心主任
CSCO常务理事
CACA胃癌专委会常委
中华医学会学临床流行病与循证医学分会(第九届) 副主任委员
中华医学会肿瘤学分会(第十二届)委员
主要研究领域为消化道恶性肿瘤的综合诊疗
自2012年开始,参与国际大型多中心III期临床研究30余项,参与国内外新药早期临床研究200余项,其中牵头40余项,自主发起临床研究25项,部分研究结果改变了临床实践,被国内外临床指南所引用
作为牵头单位,制定了消化道肿瘤免疫不良反应共识
胆管癌IDH靶向治疗与免疫联合策略研究进展,2025 ESMO Asia前沿解读


本次ESMO Asia年会在胆道癌领域公布了多项重磅研究,其中,IDH1突变是胆管癌的驱动基因。请您分享一下,本次年会上,关于胆管癌IDH1突变有哪些值得关注的研究进展?另外,免疫检查点抑制剂与化疗或靶向药物联用的研究也愈发受到关注,能否请您结合这些新证据,谈谈如何为不同的患者制定联合治疗策略,并展望其未来的发展方向?
刘天舒教授(复旦大学附属中山医院):
►ProvIDHe研究夯实艾伏尼布治疗获益
ProvIDHe研究是一项国际性、单臂、IIIb期早期用药研究,旨在为IDH1突变胆管癌患者提供接受艾伏尼布治疗的机会5。目前,该研究涉及15个国家。本报告重点关注澳大利亚和韩国患者的结果。截至2025年1月17日数据截止时,已入组23名澳大利亚患者和21名韩国患者,其中41名患者纳入安全性分析集。中位年龄为60.5岁,52.3%为女性。美国东部肿瘤协作组(ECOG)体能状态评分为0和1分的患者分别占45.5%和54.5%,81.8%诊断为IDH1突变的肝内胆管癌。筛查时,70.4%的患者为晚期疾病,既往接受过中位数为2线的系统治疗方案,主要为吉西他滨+顺铂联合免疫治疗(43.2%)。结果显示,中位无进展生存期(mPFS)为6.0个月,中位总生存期(mOS)尚未达到,1年OS率为78.6%。6.8%的患者达到部分缓解(PR),59.1%的患者疾病得到控制[PR+疾病稳定(SD)]。48.8%的患者出现了任何级别的治疗相关不良事件,最常见的是疲劳(14.6%)、恶心(12.2%)和QT间期延长(12.2%)。该澳大利亚和韩国队列的基线特征和结局与先前报告的整体人群一致。这些初步的安全性和疗效结果证实了III期研究的发现,并强化了艾伏尼布在不同真实世界中的治疗潜力。
表1. 最佳总体反应情况
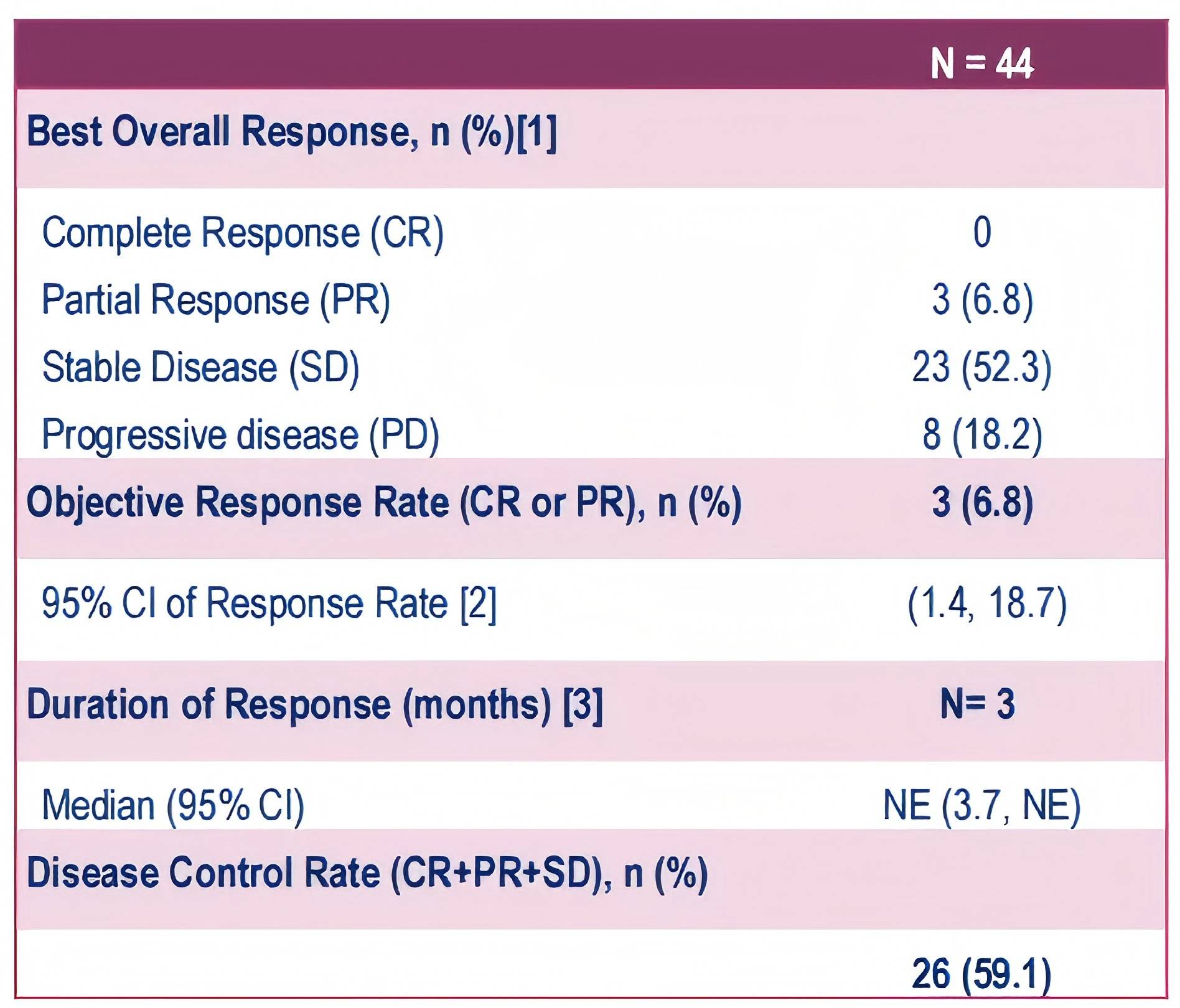
(引自2025 ESMO Asia Poster 280P.)
►艾伏尼布显著降低IDH1突变胆管癌患者TGR
在ClarIDHy研究中,与安慰剂相比,艾伏尼布在化疗耐药且IDH1突变的晚期胆管癌患者中显示出PFS改善。一项针对ProvIDHe IIIb期临床试验中纳入的两个西班牙中心的患者进行事后探索性分析,描述了开始接受艾伏尼布治疗后肿瘤体积变化的百分比(TGR)的差异6。分别在研究入组时(TGR0)和3个月时(TGR3m)进行评估。共纳入18例患者,中位年龄61岁,61.1%为女性。既往治疗线数的中位数为2。最常见的IDH1突变是R132C(10例,55.6%)。9例患者(50.0%)出现疾病稳定,未观察到部分或完全缓解。平均TGR0为20.7%/月(n=14),TGR3m为3.3%/月(n=13)。其中10例患者同时拥有TGR0(配对均值18.3%/月±标准差16)和TGR3m(配对均值4.9%/月±标准差7)的数据,患者个体内配对的平均TGR差值为13.39%/月。在3个月时,TGR的下降在达到SD的患者中(5例;患者个体内配对的平均TGR差值为15.14%/月)比疾病进展(PD)的患者(4例;5.60%/月)更为显著。这些初步结果表明,艾伏尼布在化疗耐药且IDH1突变的晚期胆管癌患者中实现了TGR的显著降低。测量TGR可能克服在分析细胞抑制药物评估为SD时面临的一些挑战。
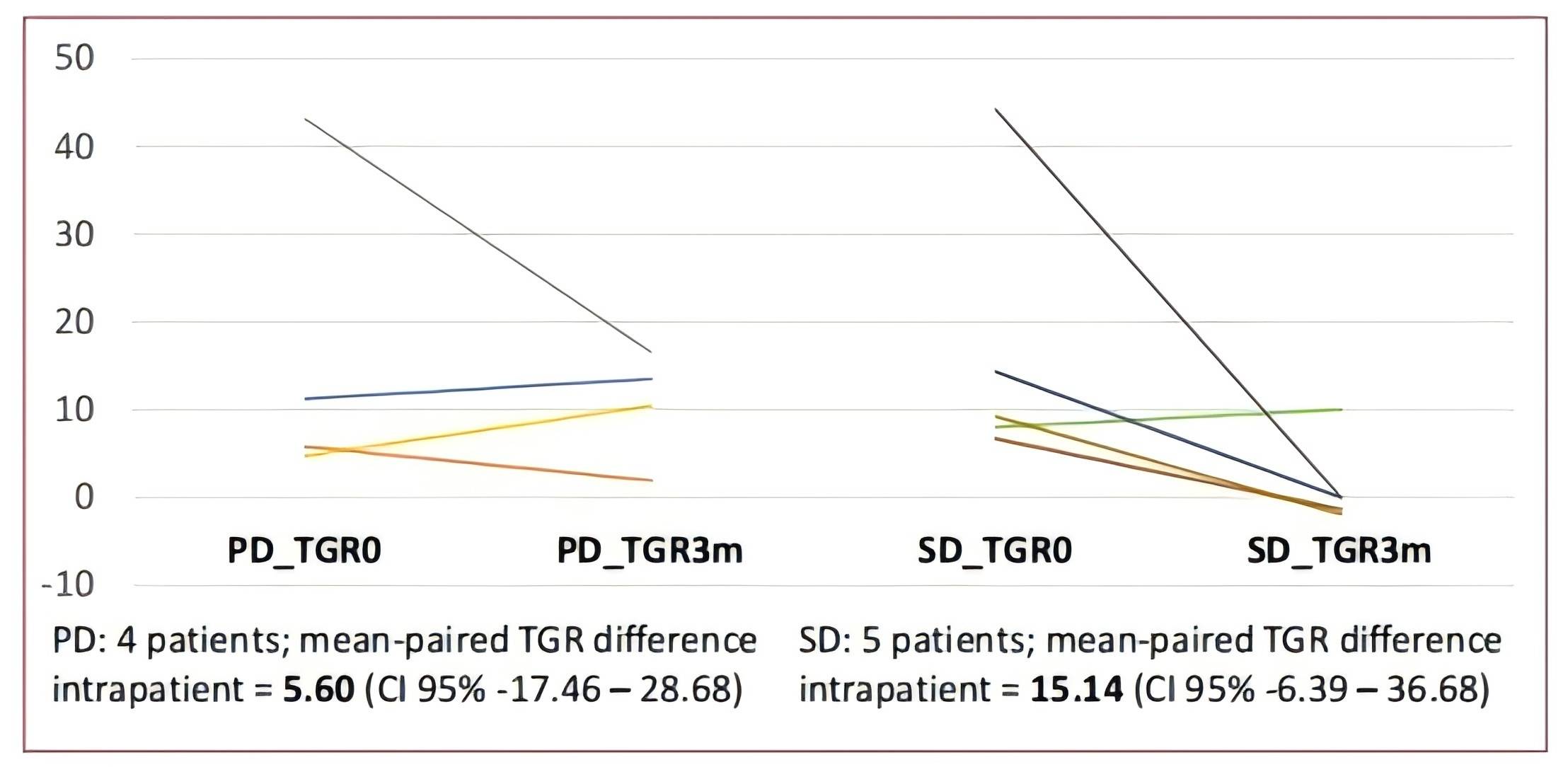
图1. 不同疾病控制状态下TGR0与TGR3差异
(引自2025 ESMO Asia Poster 294P.)
►免疫联合化疗提升局部晚期胆道恶性肿瘤疗效
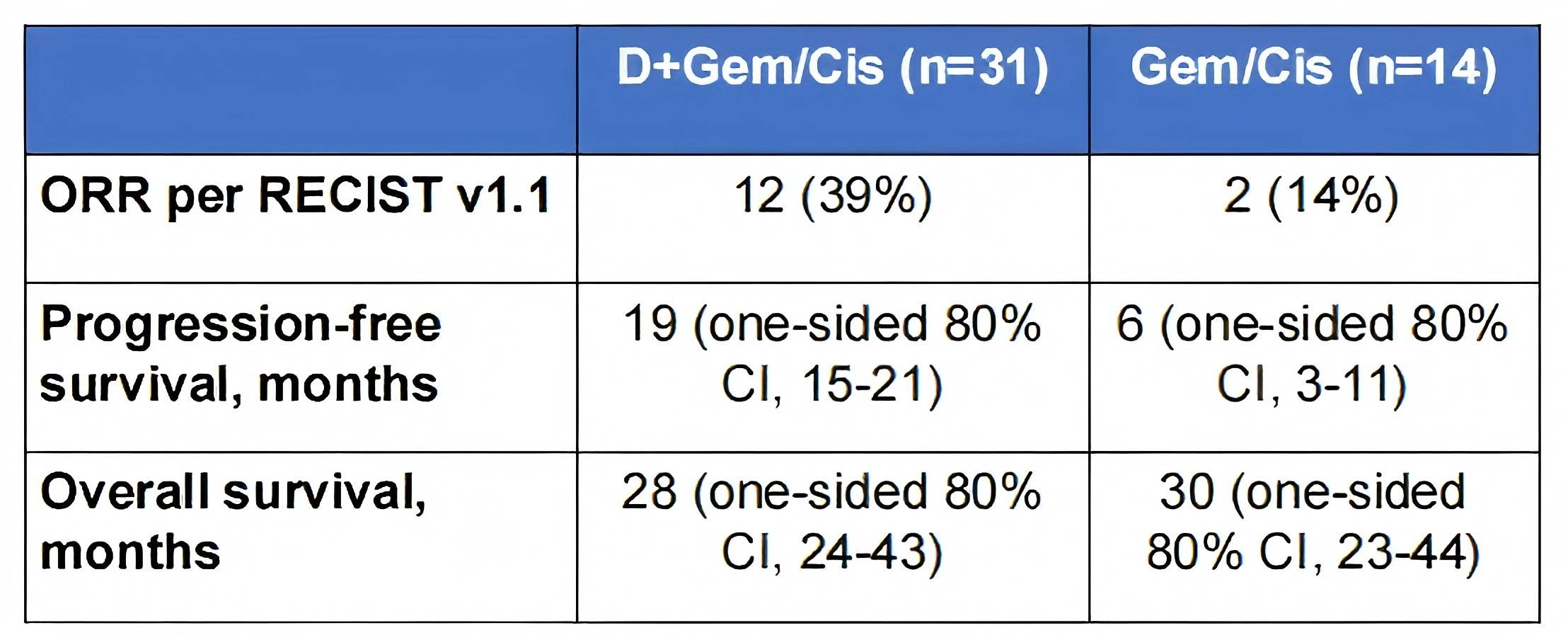
DEBATE是一项多中心、随机、非比较性II期试验,入组了未经治疗的局部晚期胆道恶性肿瘤(BTC)患者7。患者按2:1随机分配,接受4周期新辅助度伐利尤单抗+吉西他滨+顺铂(D+GemCis)或单纯GemCis治疗。接受手术的患者后续接受6周期辅助度伐利尤单抗治疗。主要终点是R0切除率。共入组45例患者(D+GemCis组31例;GemCis组14例)。D+GemCis组和GemCis组的手术切除率分别为64.5% vs. 42.9%,R0切除率分别为48.4% vs. 42.9%。D+GemCis组与GemCis组的客观缓解率(ORR)分别为38.7% vs. 14.3%,mPFS为19个月 vs. 6个月,mOS为28个月 vs. 30个月。 98%的患者(n=44)可获得生物标志物数据。在D+GemCis组,尤其是应答者中,具有促炎特征的传统单核细胞显著富集,CXCL10表达增加。D+GemCis组的应答者还表现出CD8+ T细胞毒性增强、CD4+终末分化效应记忆T细胞增多以及IL12RB2表达上调。研究表明,新辅助D+GemCis方案在局部晚期BTC中可行,并显示出令人鼓舞的疗效。整合的生物标志物分析表明,增强的单核细胞活化和T细胞反应有助于度伐利尤单抗的额外获益。
表2. 关键疗效结果
►三联方案协同优化晚期肝内胆管癌一线治疗
免疫检查点抑制剂联合吉西他滨-顺铂已成为晚期/不可切除肝内胆管癌(ICC)的标准一线方案,但疗效仍有限。虽然药物洗脱微球经动脉化疗栓塞(DEB-TACE)在ICC中可获得较高的初始缓解率,但其生存获益尚未得到证实。一项II期研究评估了DEB-TACE联合GP化疗及替雷利珠单抗作为晚期/不可切除ICC一线治疗的疗效和安全性8。研究入组了初治/不可切除的ICC患者,共筛查17例患者,其中15例被纳入意向治疗人群(ITT)。这些患者接受DEB-TACE、GP化疗和替雷利珠单抗治疗,直至疾病进展、出现不可接受的毒性或退出研究。主要终点是ORR;次要终点包括PFS、OS、疾病控制率(DCR)和安全性。根据Simon两阶段设计,第一阶段需在12例患者中观察到>3例缓解才可进入第二阶段;第二阶段在26例患者中需有>10例缓解者,以证明其优于既往GP对照组。结果显示,在前12例患者中观察到6例缓解者,达到了第一阶段阈值。经确认的ORR为50%,肝脏ORR也为50%。DCR为100%。mPFS和mOS分别为5.2个月和10.5个月。未发生4级不良事件或治疗相关死亡。3级不良事件包括血小板减少、AST升高和皮疹。研究表明,一线DEB-TACE联合GP化疗及替雷利珠单抗在晚期/不可切除ICC中显示出良好的疗效和可控的毒性。
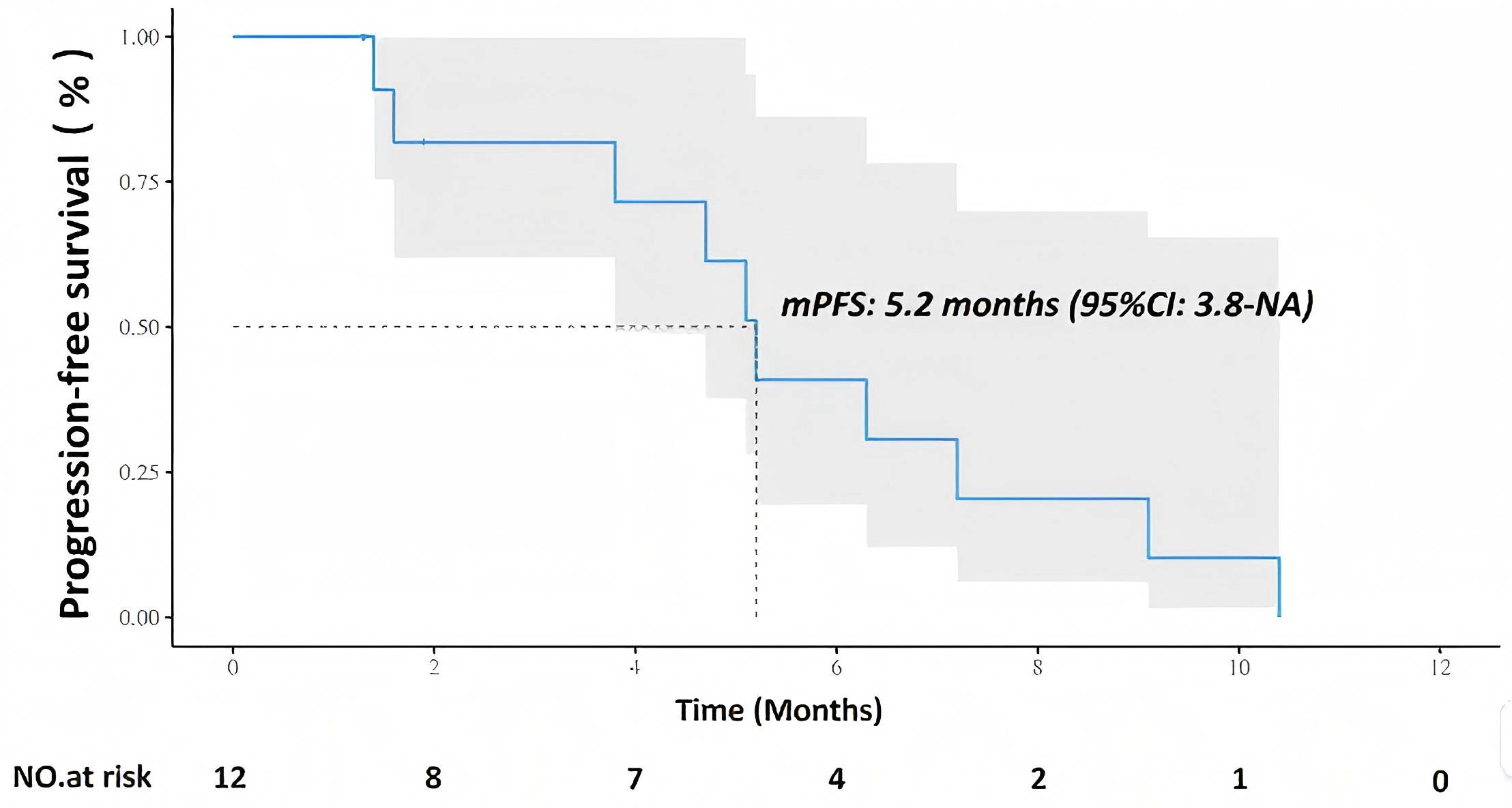
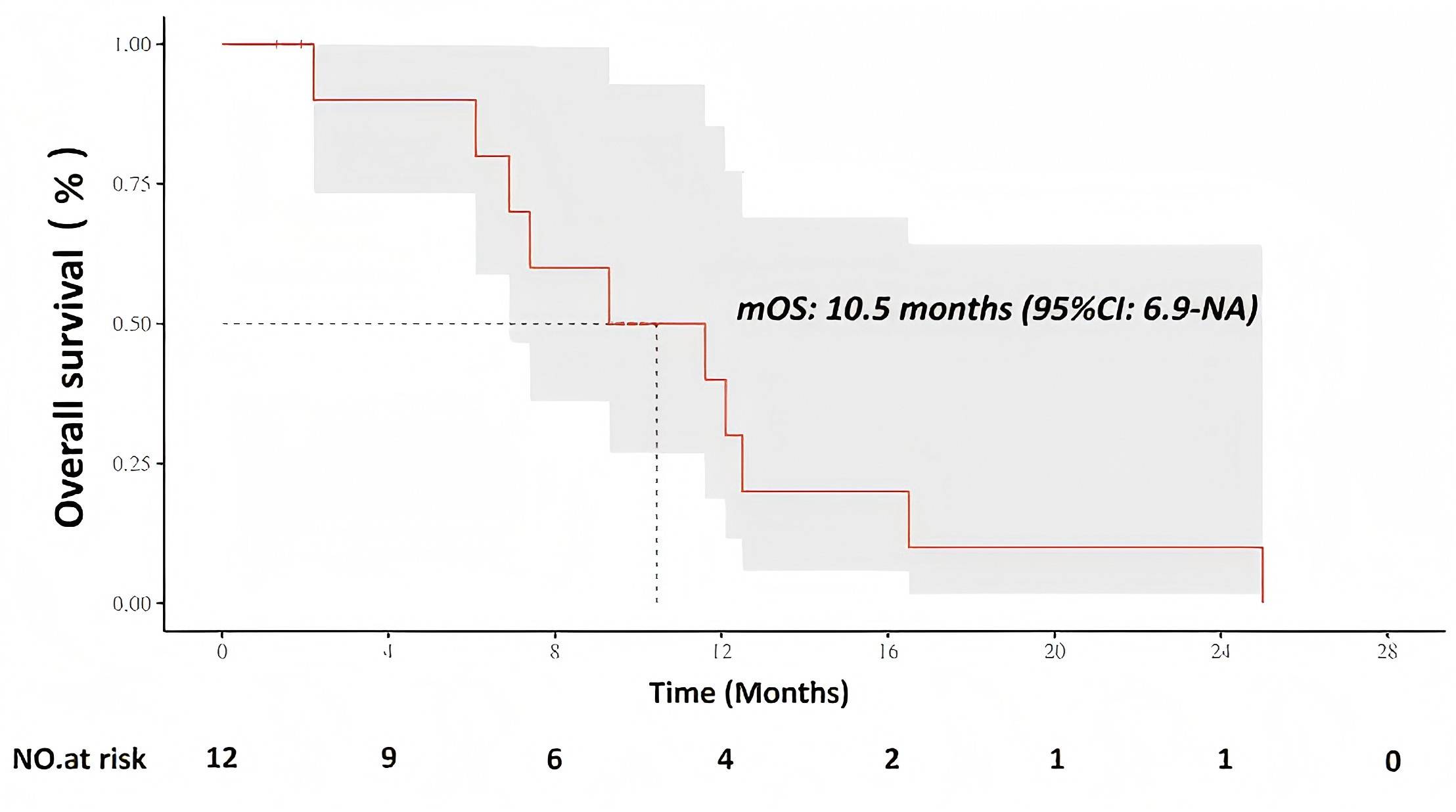
(引自2025 ESMO Asia Poster 361P.)
胰腺癌精准治疗与免疫联合新篇,2025 ESMO Asia前沿解析


胰腺癌作为全球范围内致死率最高的恶性肿瘤之一,具有“难诊断、易转移、预后差”的临床特点。为此,探索有效的治疗策略,改善胰腺癌患者生存预后是临床长期以来亟待攻克的难题,在您看来,2025 ESMO Asia年会上有哪些关于胰腺癌的亮点研究?此外,请您结合本次大会公布的相关研究,谈谈晚期胰腺癌在免疫治疗方面取得了哪些新进展?
刘天舒教授(复旦大学附属中山医院):
►NAPOLEON-2研究确立NFF疗效预测标志物并验证其真实世界有效性
伊立替康脂质体联合氟尿嘧啶和亚叶酸(NFF)是不可切除或复发性胰腺癌(urPC)的标准二线或后线治疗方案;然而,目前尚未建立预后生物标志物。NAPOLEON-2研究旨在识别接受NFF治疗患者PFS的临床预测因素,以便早期预测疗效9。研究前瞻性收集了日本17家医院接受NFF治疗的150例urPC患者的数据。参与者按mPFS分为两组:较长PFS组(≥3.7个月,n=75)和较短PFS组(<3.7个月,n=75)。研究比较了两组的基线特征和OS,并确定了有助于延长PFS的因素。结果显示,较长PFS组的mOS显著优于较短PFS组(10.9个月 vs. 4.2个月;HR=0.17;p<0.01)。多变量逻辑回归分析确定既往化疗持续时间(p<0.01)和C反应蛋白/白蛋白比值(CAR,p=0.03)是PFS的独立预测因素。此外,NAPOLEON-2研究还报告了在真实世界中聚焦于既往治疗的NFF疗效最终结果,研究分析了两项在日本23家医院进行的多中心观察性研究10。在前瞻性队列中,既往使用过伊立替康(IRI)的患者(n=19)和未使用过IRI的患者(n=131)的mOS分别为4.2个月和8.1个月(HR=1.45,p=0.16)。此外,两组的ORR分别为12%和0%。既往使用过氟尿嘧啶(FU)的患者(n=52)和未使用过FU的患者(n=98)的mOS分别为7.8个月和7.3个月(HR=0.89,p=0.53)。在两个队列的整合分析(n=311)中,既往使用过IRI的患者(n=37)与未使用过IRI的患者(n=274)在mOS上无临床差异(7.8个月 vs. 8.1个月;HR=1.14,p=0.51)。关于FU,既往使用过FU的患者(n=104)和未使用过FU的患者(n=207)的mOS分别为9.0个月和7.5个月(HR=0.94,p=0.67)。数据表明,在真实世界中,无论既往是否接触过IRI或FU,NFF都可能是一种有效且可行的治疗方案。
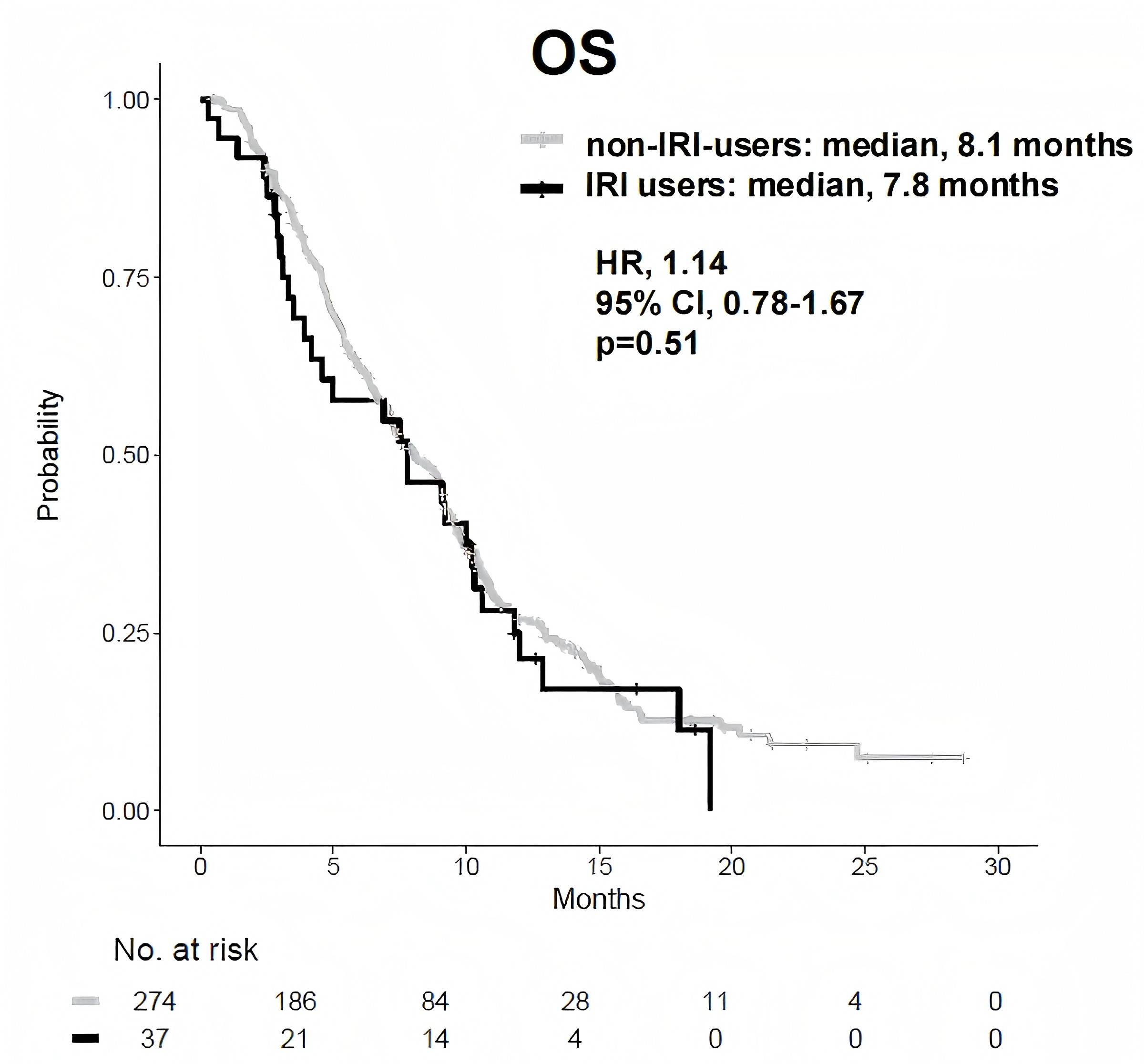
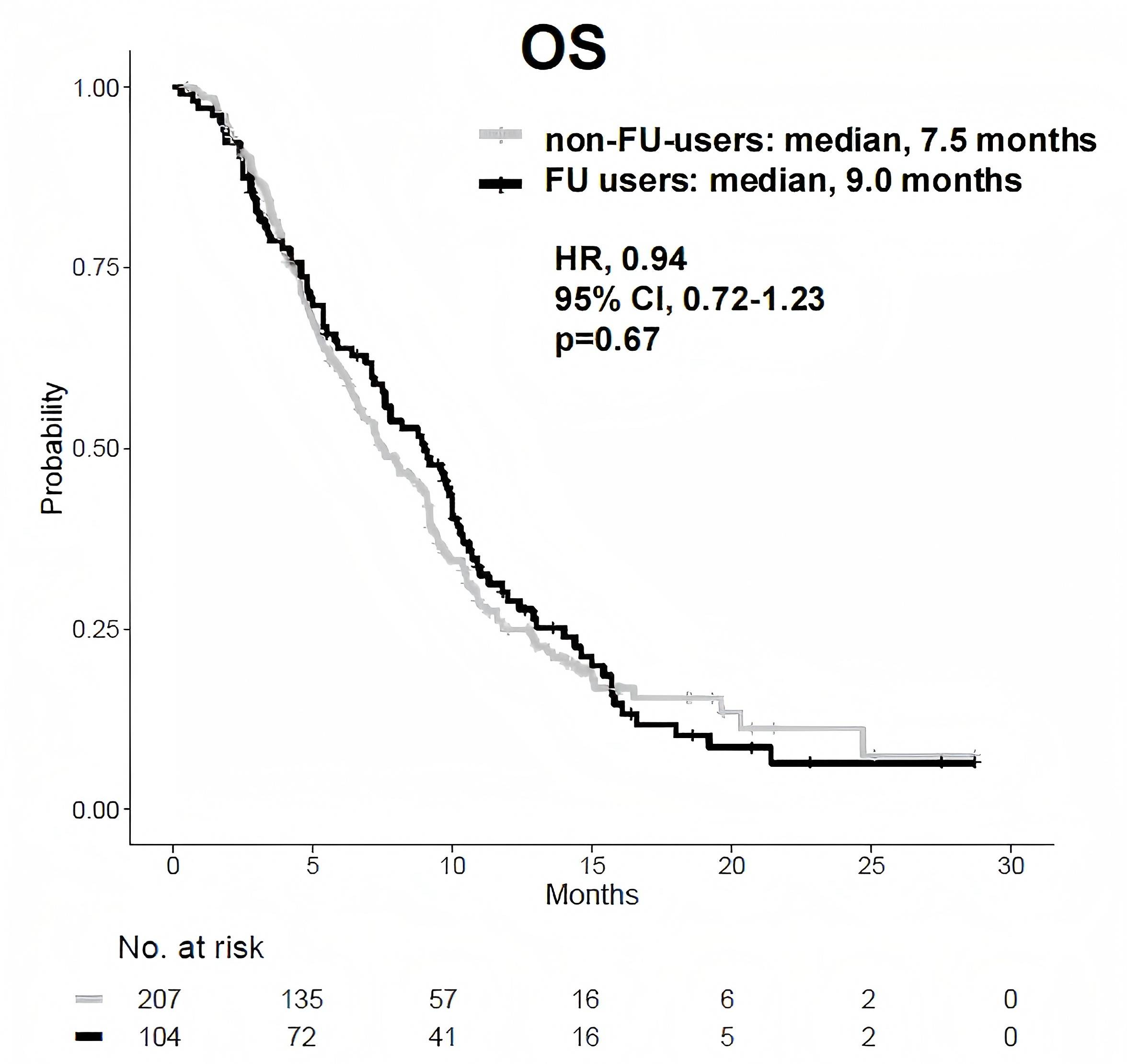
(引自2025 ESMO Asia Poster 388P.)
►nal-IRI在mPDAC人群中展现持久疗效
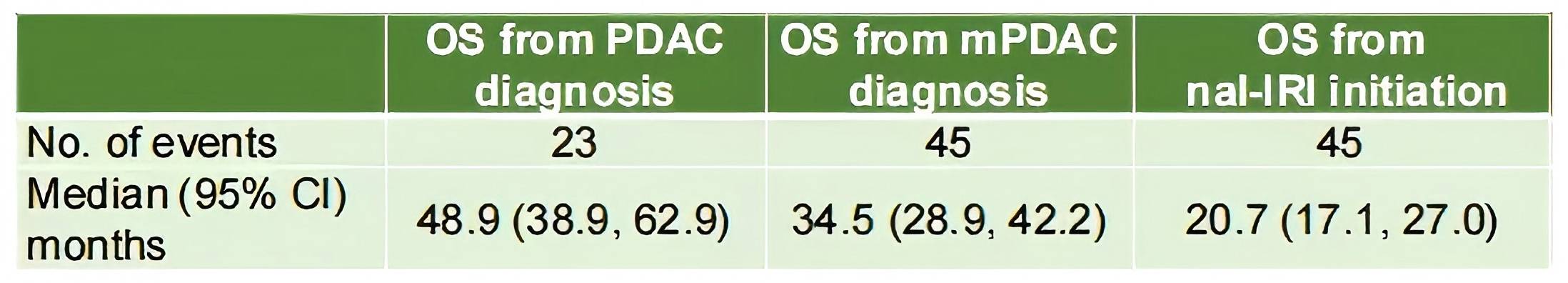
NALLONG研究探索了一组在伊立替康脂质体(nal-IRI)治疗开始后存活≥1年的mPDAC患者的真实世界队列11。这项国际性、纵向、回顾性病历审查研究针对2018年1月至2021年12月期间在接受吉西他滨为基础化疗后接受≥1周期nal-IRI+5-FU/LV治疗、且在治疗开始后存活>1年的成年mPDAC患者。研究分析了来自日本3个中心的58例日本患者的基线人口统计学、疗效和安全性数据。终点数据包括OS和PFS。1例(1.7%)患者在一线治疗中开始使用nal-IRI+5-FU/LV,47例(81.0%)在二线治疗,10例(17.2%)在三线及以上治疗中使用nal-IRI+5-FU/LV。接受nal-IRI治疗的中位周期数为17周期,中位治疗持续时间为9.6个月。从mPDAC诊断和nal-IRI治疗开始计算的mOS分别为34.5个月和20.7个月。nal-IRI治疗(任何线数)的mPFS为11.6个月。在这个日本真实世界mPDAC患者队列中,观察到一个对系统治疗有特殊应答的人群。重要的是,nal-IRI取得了非常有利的结局,并且其疗效与治疗线数无关。
表3. mOS结果
►NALIRIFOX联合免疫放疗,改善LAPC治疗结局
一项前瞻性随机对照试验比较了NALIRIFOX或AG方案分别联合PD-1抑制剂和放疗用于局部晚期胰腺癌(LAPC)的疗效和安全性12。研究入组了初治的LAPC患者。符合条件的患者按1:1随机分配至实验组(PRNFX组:伊立替康脂质体+奥沙利铂+亚叶酸钙+5-FU+特瑞普利单抗)或对照组(PRAG组:吉西他滨+白蛋白紫杉醇+特瑞普利单抗)。从第3周期开始,除非出现疾病进展,患者同时接受立体定向放射治疗。在完成4周期治疗后,通过多学科团队评估切除可行性。同意手术且符合条件的患者接受根治性切除术,并后续接受2个额外周期治疗。其余患者继续治疗至6周期,随后进入维持治疗。主要终点是mPFS。次要终点包括中位OS、安全性、DCR和ORR。共入组35例患者。ORR在PRNFX组为47.1%,在PRAG组为38.9%(p=0.625);DCR分别为100.0%和94.4%(p=1.000)。两组均未达到mPFS和mOS。在PRNFX组中,13例患者完成了可切除性评估,其中6例实现了R0切除(2例达到主要病理学缓解[MPR])。PRAG组所有18例患者均接受了评估,其中3例接受了R0切除(2例达到MPR)。PRNFX组有11例(64.7%)患者发生了3级或以上不良事件,PRAG组有7例(38.9%)(p=0.127)。PRNFX组的腹泻发生率显著更高(70.6% vs. 16.7%,p=0.001),但≥3级腹泻发生率相当(17.6% vs. 0%,p=0.104)。研究表明,与以吉西他滨为基础的方案相比,NALIRIFOX联合PD-1抑制剂后序贯同期加量立体定向放疗(SBRT+SIB)在LAPC治疗中显示出潜在的疗效优势和良好的耐受性。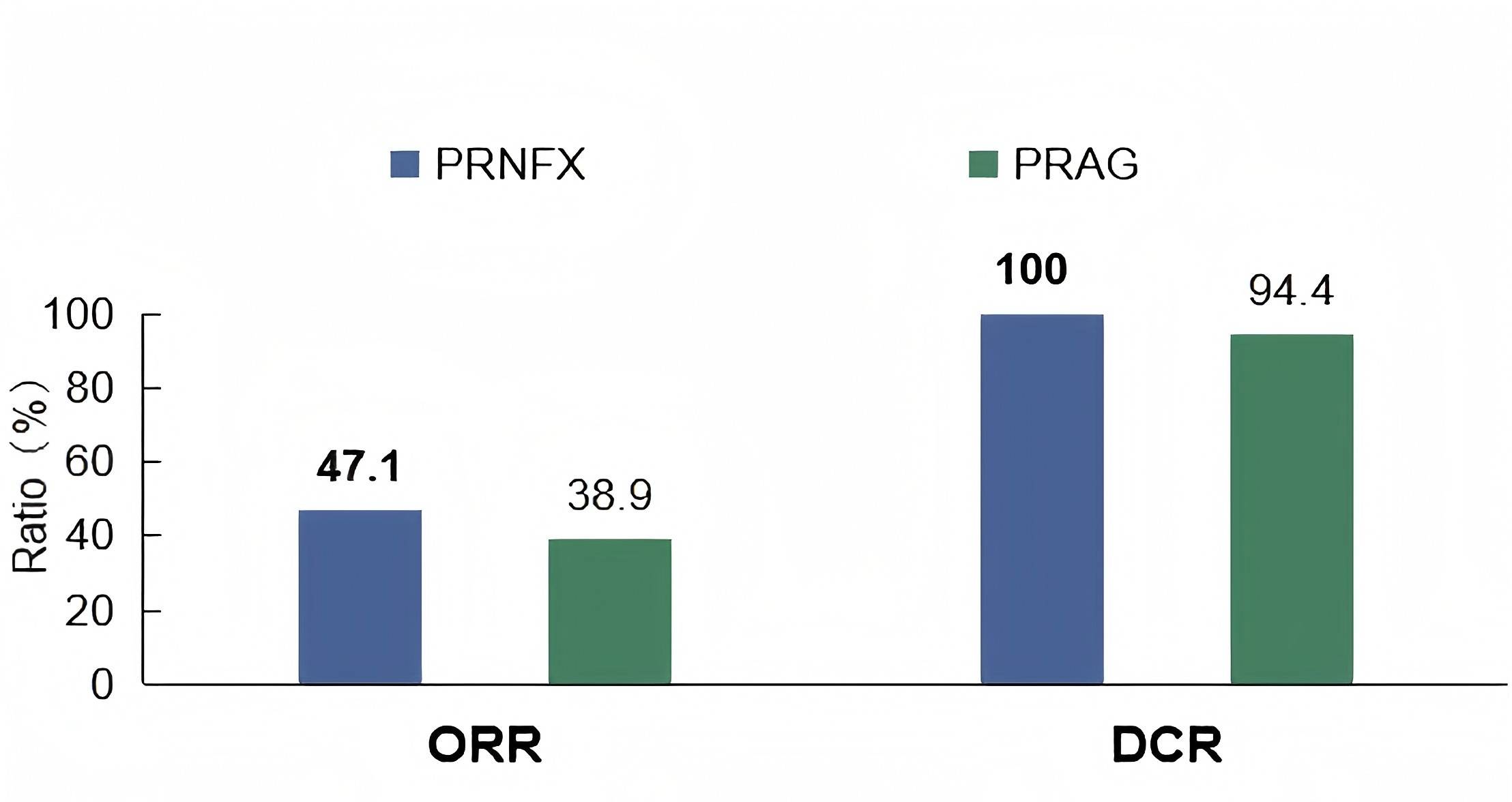
(引自2025 ESMO Asia Poster 386P.)
►四联方案突破转移性胰腺癌一线治疗瓶颈
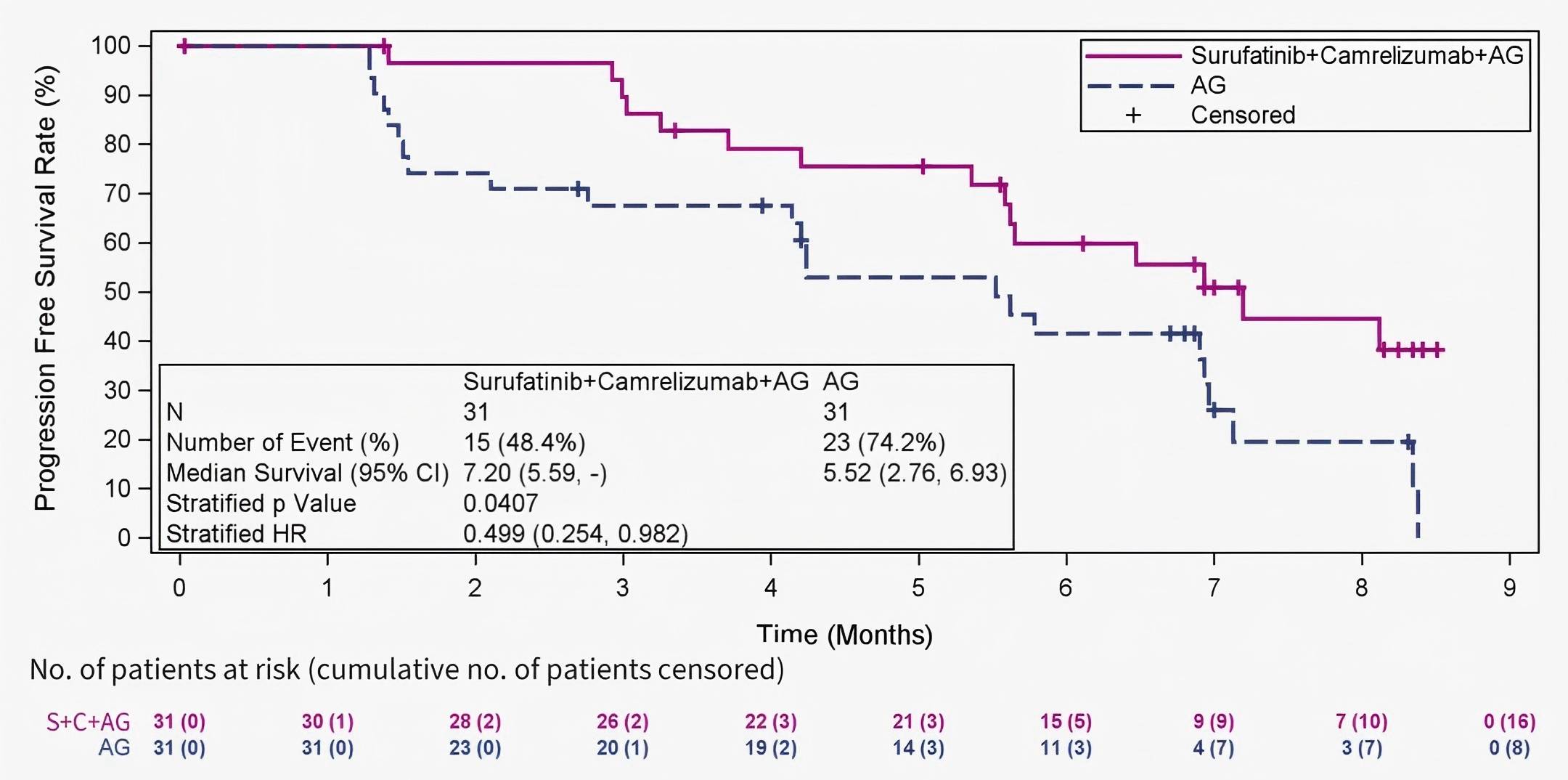
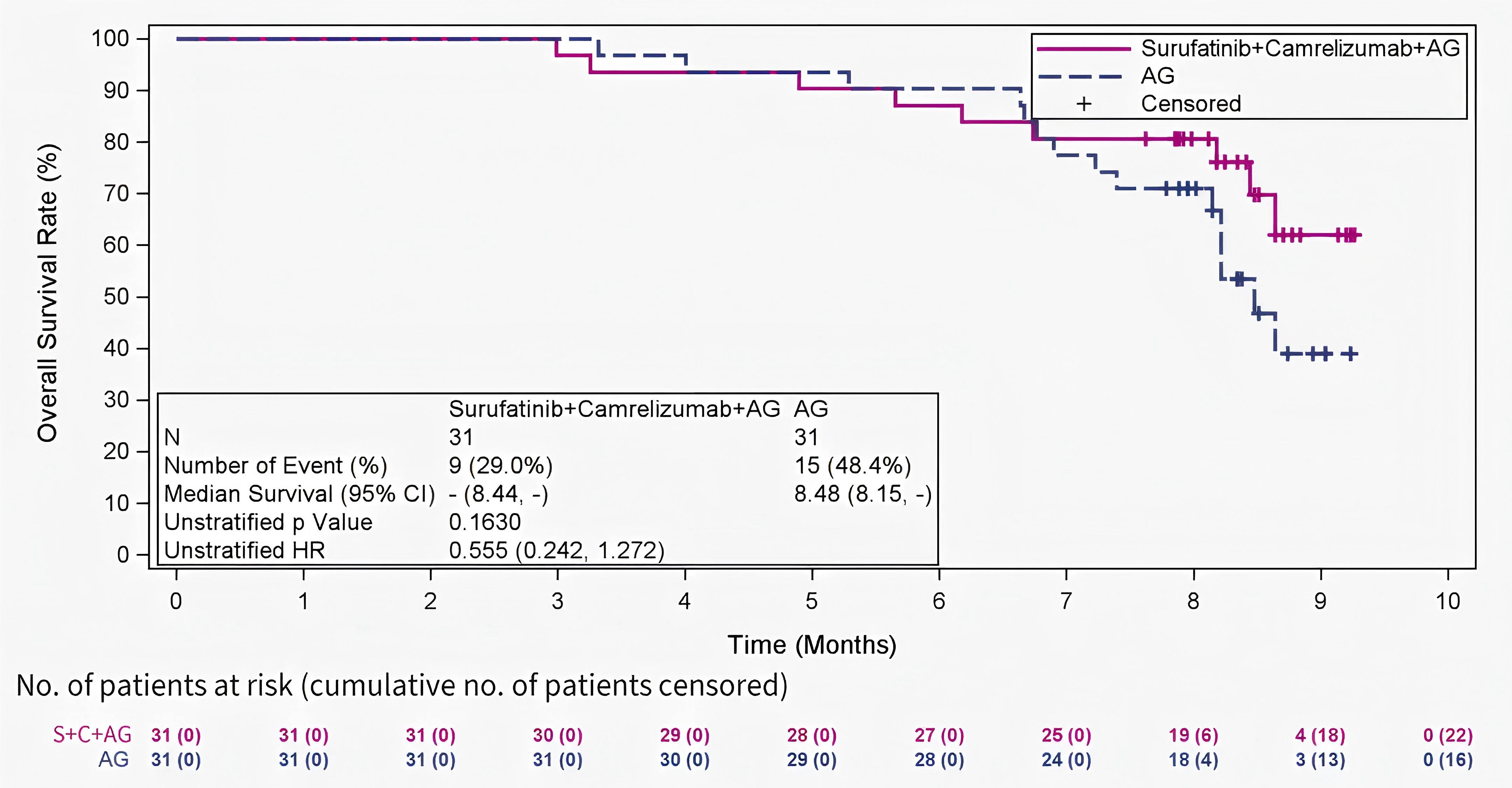
转移性胰腺癌的治疗仍然充满挑战,生存结局有限。一项首个随机II/III期研究评估了一种新型四联方案(索凡替尼联合卡瑞利珠单抗和AG化疗)对比单独AG化疗作为一线治疗的疗效13。本文报告II期研究结果。未经治疗的转移性胰腺癌患者按1:1随机分配接受S+C+AG或单独AG治疗。分层因素包括ECOG PS评分和肝转移状态。主要终点是研究者根据RECIST 1.1评估的PFS。共62例患者被随机分组(S+C+AG组31例 vs. AG组31例),基线特征均衡。大多数患者在基线时存在肝转移(83.9% vs. 83.9%)。中位PFS随访时间为8.15个月,S+C+AG组显示出优于AG组的mPFS(7.20个月 vs. 5.52个月,HR=0.499)。次要终点也支持联合方案。两组mOS分别为未达到 vs. 8.48个月(HR=0.555)。治疗期间≥3级AE发生率在S+C+AG组为80.6%,AG组为61.3%。发生率≥20%的≥3级AE包括中性粒细胞计数降低(45.2% vs. 41.9%)、白细胞计数降低(32.3% vs. 16.1%)和血小板计数降低(22.6% vs. 3.2%)。研究表明,与单独AG方案相比,S+C+AG方案显著改善了mPFS,并在关键疗效终点显示出一致的获益,安全性可管理。该四联方案有望成为目标人群新的前线治疗选择。
(引自2025 ESMO Asia Poster 375P.)
小结
2025 ESMO Asia年会上,胆管癌与胰腺癌领域涌现出多项研究成果,为临床诊疗提供了重要依据。胆管癌领域,IDH1突变靶向药物艾伏尼布通过ProvIDHe等研究证实了其在真实世界中的疗效与耐受性,进一步强化艾伏尼布在IDH1突变胆管癌中的治疗获益。免疫联合化疗方案在局部晚期胆道恶性肿瘤及不可切除肝内胆管癌中均展现出良好的疗效及耐受性,为胆道癌治疗提供更多有力手段。胰腺癌领域,NAPOLEON-2研究确立了PFS的独立预测因素,并揭示NFF方案在真实世界中的有效性。NALLONG研究证实,nal-IRI(任何线数)改善了mPDAC患者的生存结局。此外,NALIRIFOX联合免疫后序贯放疗,免疫联合化疗等多模式方案改善了局部晚期或转移性胰腺癌患者的生存结局。这些进展进一步丰富了胆管癌和胰腺癌的治疗策略,推动其诊疗向精准化、个体化方向深度迈进。
1. 李相成,黄彬,长江.晚期胆道恶性肿瘤免疫与靶向治疗的现状与进展[J].中华消化外科杂志,2025,24(7):832-839.
2. 王岳锟,吴涛. 胆汁微环境改变与胆管癌发生的相关性研究进展[J]. 肝胆胰外科杂志, 2025, 37(4): 283-288.
3. 刘悦泽, 张太平, 赵玉沛. 胰腺癌诊治的进展与思考[J]. 临床肝胆病杂志, 2025, 41(4): 601-604.
4. 李天骄,叶龙云,金凯舟,等. 2023年度胰腺癌研究及诊疗新进展[J]. 中国癌症杂志, 2024, 34 (1): 1-12.
5. 2025 ESMO Asia. Poster 280P.
6. 2025 ESMO Asia. Poster 294P.
7. 2025 ESMO Asia. Poster 278P.
8. 2025 ESMO Asia. Poster 361P.
9. 2025 ESMO Asia. Poster 381P.
10. 2025 ESMO Asia. Poster 388P.
11. 2025 ESMO Asia. Poster 383P.
12. 2025 ESMO Asia. Poster 386P.
13. 2025 ESMO Asia. Poster 375P.
本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批号:M-TIBSO-CN-202512-00022
本文转自:医脉通











 苏公网安备32059002004080号
苏公网安备32059002004080号


