摘滤泡性淋巴瘤(FL)作为最常见的惰性非霍奇金淋巴瘤亚型,其临床特征为反复复发与治疗抵抗。尽管一线化学免疫疗法可诱导高缓解率,但随治疗线数增加,缓解持续时间进行性缩短,患者最终面临治疗选择匮乏的困境。近年来,免疫疗法已成为复发/难治性FL(R/R FL)的主要治疗策略,其中来那度胺联合利妥昔单抗(R)基于AUGMENT研究的阳性结果获美国FDA批准,但远期疗效仍有待改善。
坦昔妥单抗(Tafasitamab)是一款靶向CD19的Fc修饰人源化单克隆抗体,通过直接细胞毒效应及增强自然杀伤(NK)细胞与巨噬细胞介导的免疫效应发挥抗肿瘤作用。该药联合来那度胺已在不适合移植的R/R弥漫大B细胞淋巴瘤(DLBCL)中获批(L-MINC研究)。基于此,inMIND(NCT04680052)III期研究首次评估了在标准免疫化疗基础上加用CD19靶向药物的协同效应,旨在为R/R FL患者提供更持久的治疗选择。
研究方法
研究设计与治疗策略

inMIND是一项国际多中心、双盲、随机对照III期临床试验,共纳入548例R/R FL患者。受试者按1:1比例随机分配至实验组(坦昔妥单抗+来那度胺+利妥昔单抗)或对照组(安慰剂+来那度胺+利妥昔单抗),治疗持续12个4周周期:
坦昔妥单抗:12 mg/kg静脉输注,第1-3周期每周1次,第4-12周期每2周1次
来那度胺:20 mg/天口服,每周期第1-21天
利妥昔单抗:375 mg/m²静脉输注,第1周期每周1次,第2-5周期每4周1次
分层因素包括诊断后24个月内疾病进展(POD24)状态、末次抗CD20单抗治疗缓解情况(难治 vs 非难治)以及既往治疗线数(1线 vs ≥2线)。
入组标准与终点设定
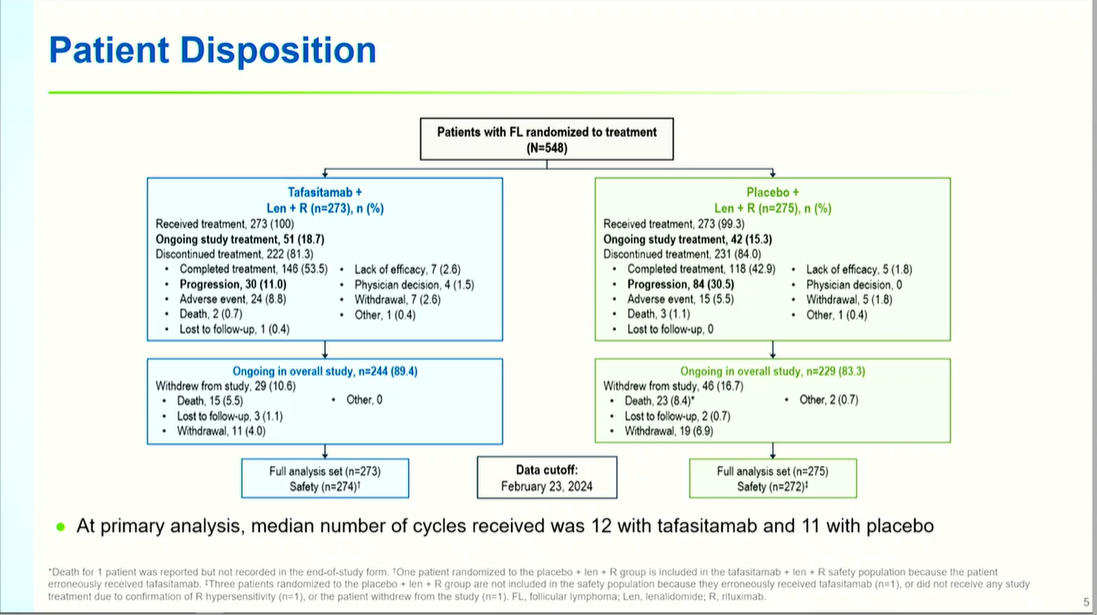
入组患者需满足:年龄≥18岁、组织学确诊FL 1-3A级、既往接受过≥1线含抗CD20单抗的治疗、ECOG体能状态评分0-2分、无来那度胺联合利妥昔单抗用药史。主要终点为由研究者评估的无进展生存期(PFS),关键次要终点包括独立审查委员会(IRC)评估的PFS、PET完全代谢缓解率(PET-CR)、总缓解率(ORR)、缓解持续时间(DoR)、总生存期(OS)及安全性等。
研究结果
患者基线特征
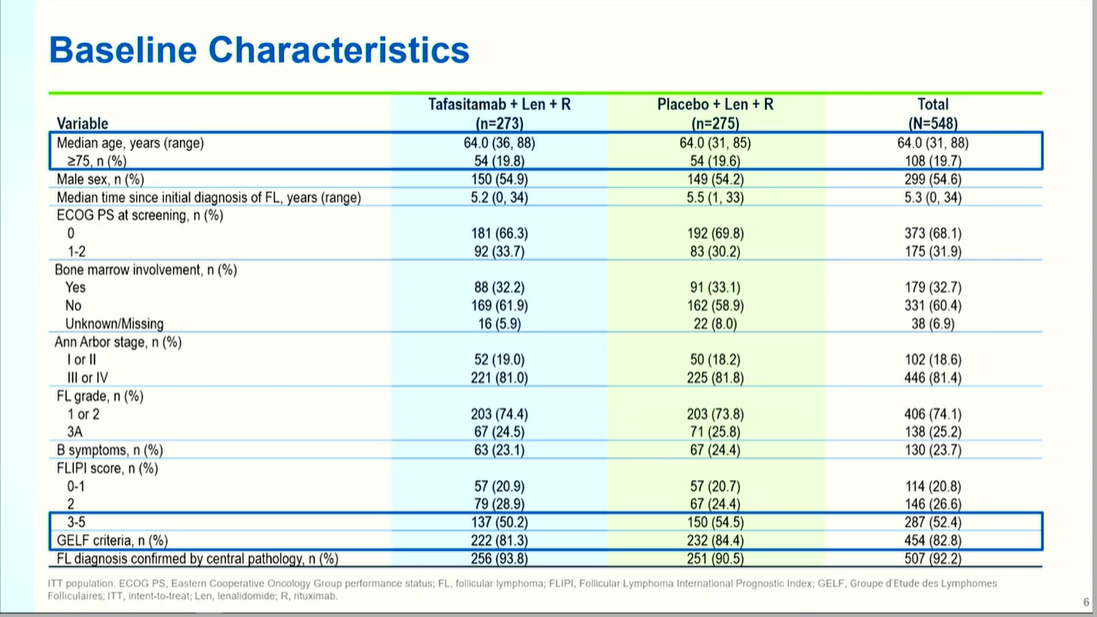
截至2024年2月23日数据截止,研究共纳入548例患者,两组基线特征均衡可比。中位年龄54岁,19.7%患者≥75岁,55%为男性。中位自诊断时间为5.3年,81.4%患者为Ann Arbor III-IV期,74.1%为FL 1-2级,20.8%伴FLIPI高危评分(3-5分)。值得注意的是,55.5%患者存在POD24,56.9%既往接受≥2线治疗,55%曾接受抗CD20联合CHOP方案,提示该队列具有高度难治性特征。
主要终点:无进展生存期
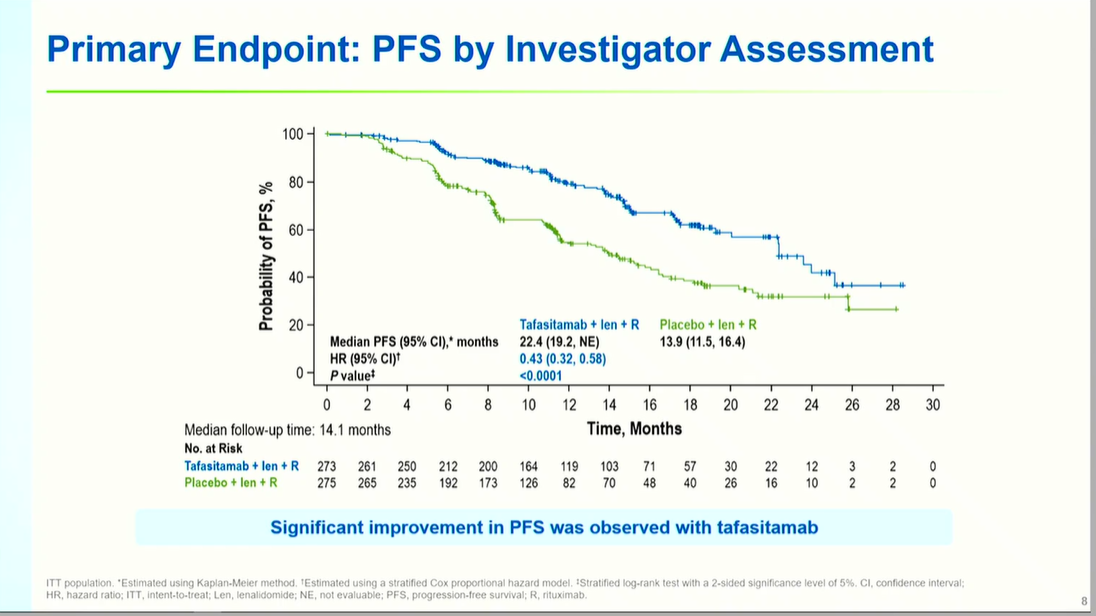
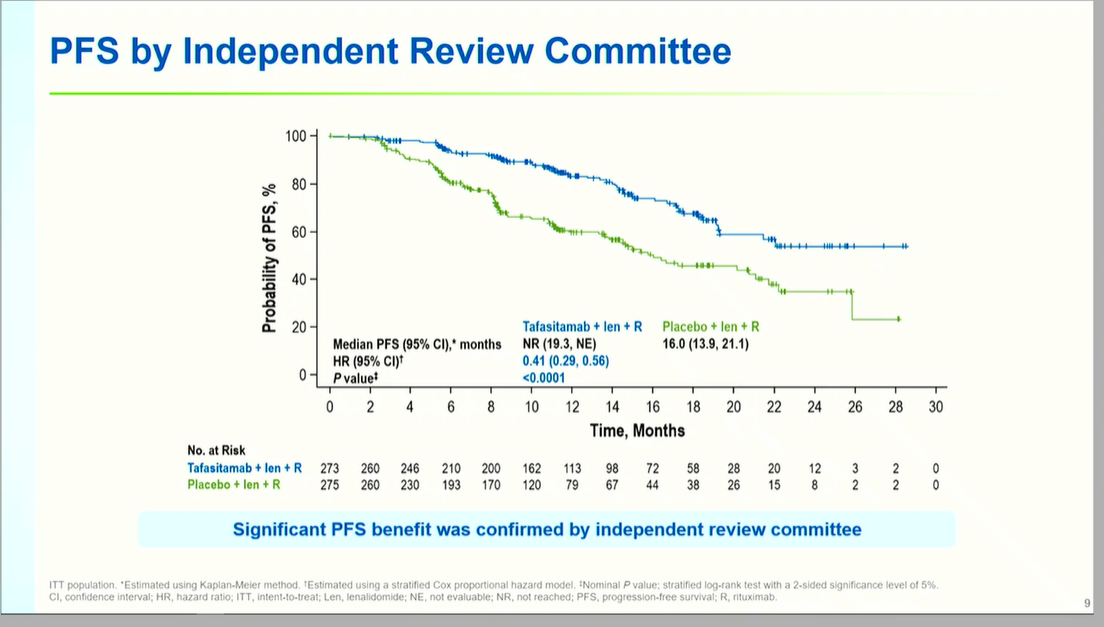
研究达到主要终点,坦昔妥单抗组中位PFS显著延长至24.4个月(95% CI: 19.2-NE),较对照组13.9个月(95% CI: 11.5-16.4)改善显著(HR 0.43, 95% CI: 0.32-0.58, P<0.0001),疾病进展或死亡风险降低57%。IRC评估结果与此一致,中位PFS分别为未达到(NE)vs 16.0个月(HR 0.41, P<0.0001),进一步验证了研究结果的可靠性。
次要疗效终点
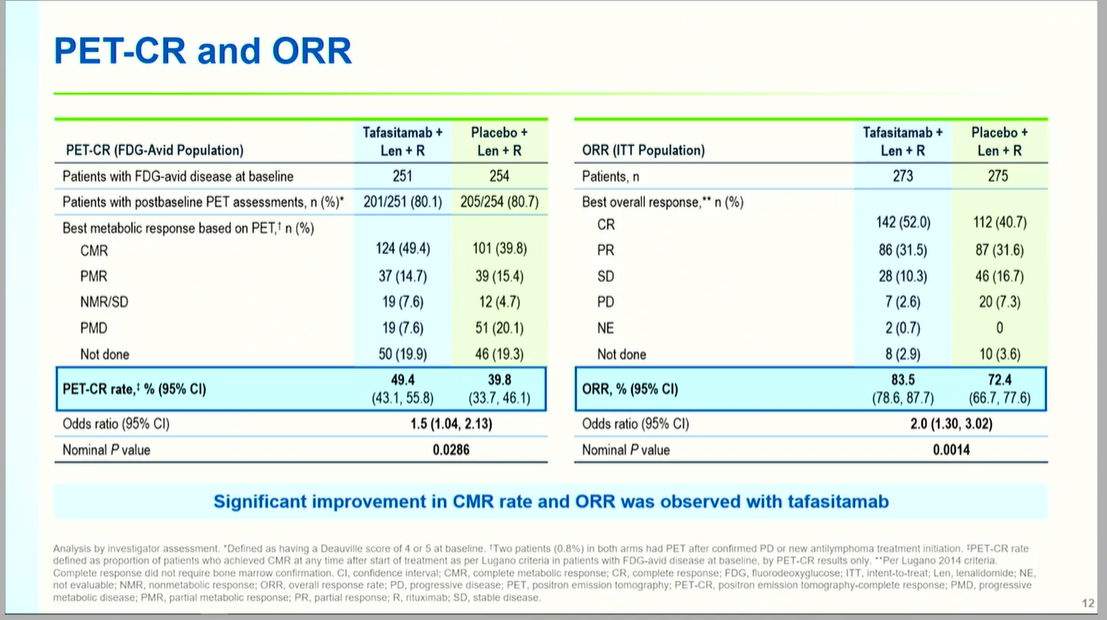
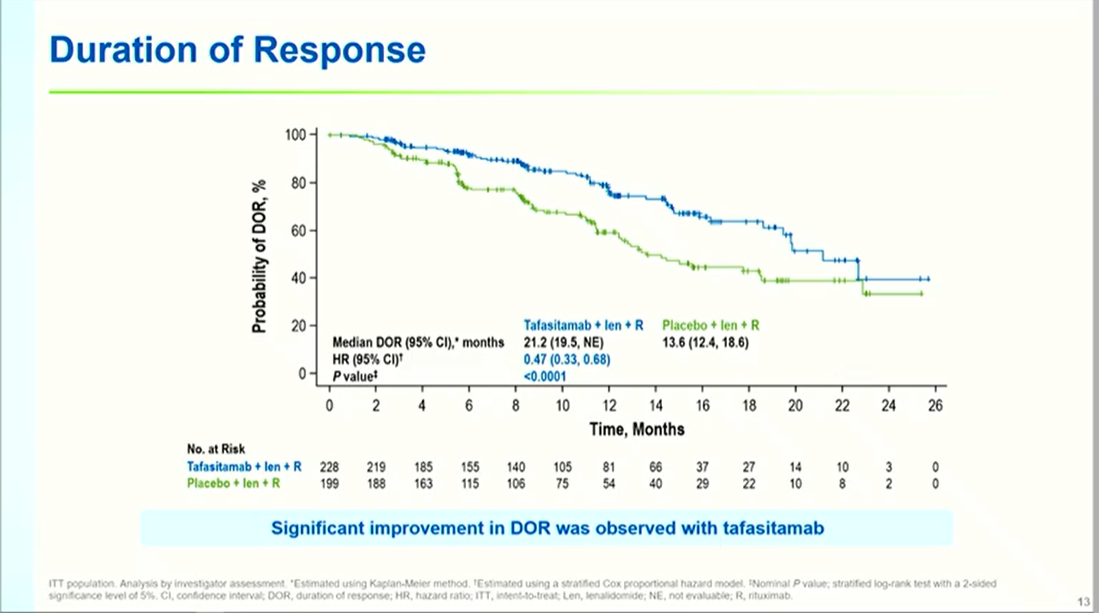
缓解率深度与持久性显著提升:坦昔妥单抗组ORR达83.5%(对照组72.4%,OR 2.0, P=0.0014),完全缓解(CR)率提升至52.0%(对照组40.7%)。PET-CR率分别为39.8%与31.5%(OR 1.5, P=0.0286),显示代谢缓解深度改善。中位DoR延长至21.2个月(对照组13.6个月,HR 0.48, P<0.0001),缓解持续时间延长56%。
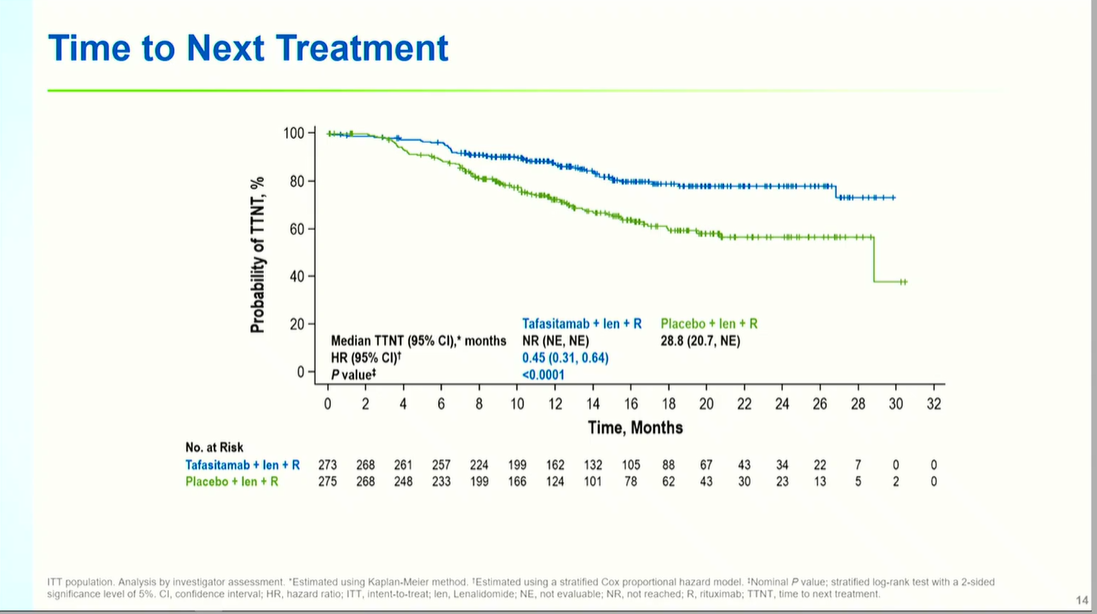
至下次治疗时间(TTNT)延长:坦昔妥单抗组中位TTNT为28.8个月,对照组未到达,风险降低55%(HR 0.45, P<0.0001),预示更长的无治疗间隔期。
总生存期(OS):中位随访15.3个月时OS数据尚未成熟,但已观察到有利于坦昔妥单抗的趋势(HR 0.59, 95% CI: 0.31-1.13),且未达到预设的无效性阈值,后续需长期随访。
组织学转化风险显著降低:坦昔妥单抗组无患者发生向高级别淋巴瘤转化,对照组转化率为3.3%(9例),提示该方案可能抑制疾病生物学演进。
亚组分析
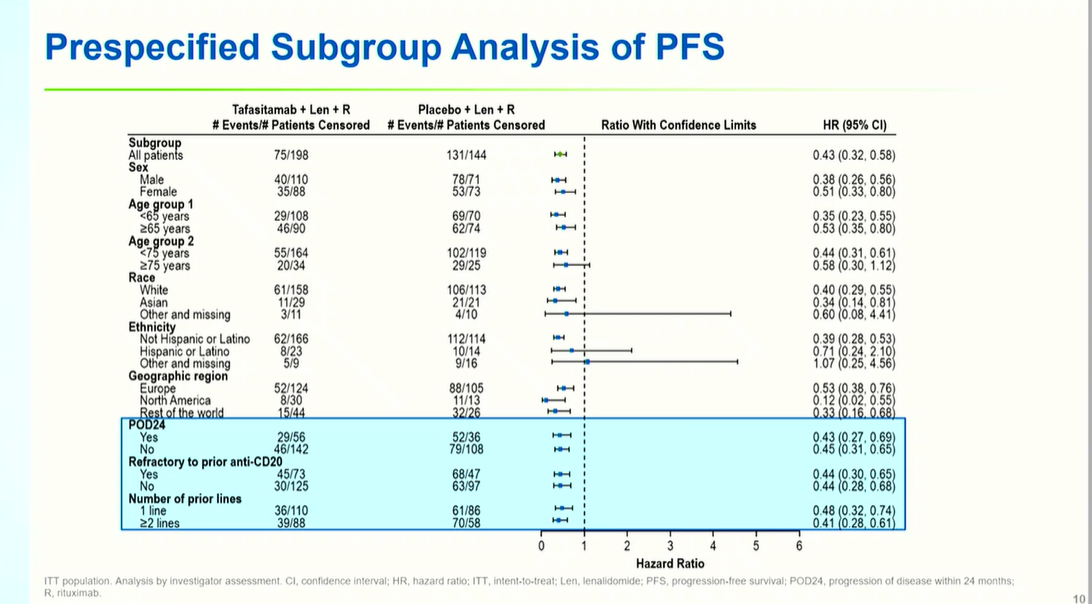
预设亚组分析显示,PFS获益在所有临床亚组中保持一致,不受基线特征影响:POD24患者(HR 0.42)、基线FLIPI高危评分(HR 0.43)、既往接受≥2线治疗(HR 0.45)及抗CD20难治患者(HR 0.38)均显著获益。特别地,既往仅接受抗CD20单药治疗的患者获益更为显著(HR 0.21),尽管样本量较小。
CD19表达动态监测
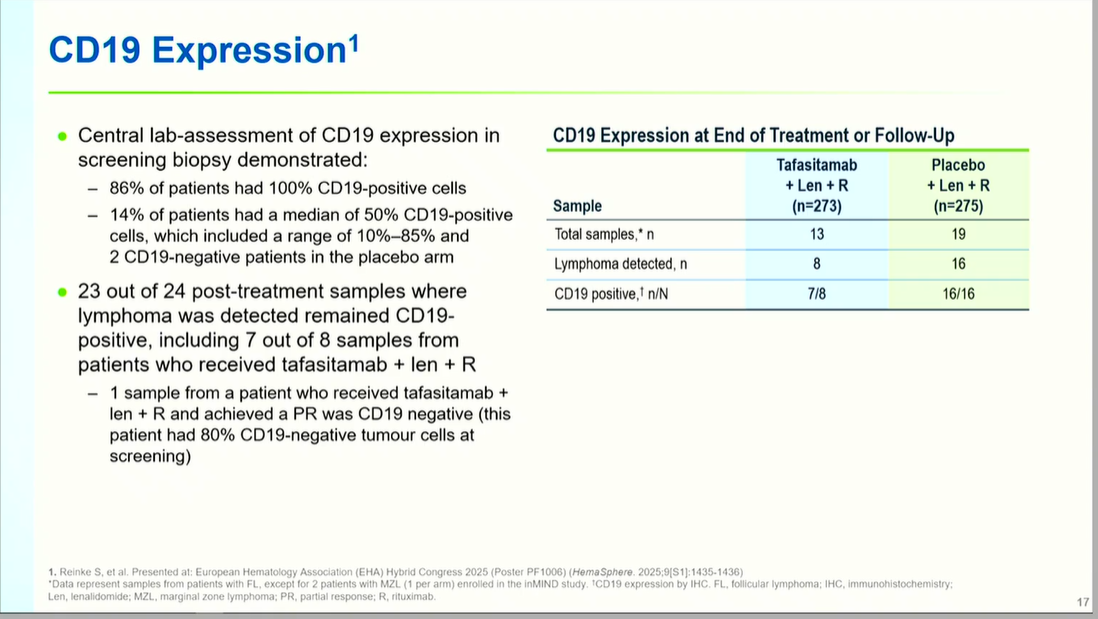
中心实验室检测显示,86%患者基线CD19阳性率100%,14%呈异质性表达(中位50%)。24例治疗后活检样本中,23例仍保持CD19阳性,仅1例获得部分缓解患者转为CD19阴性(该患基线即存在80% CD19阴性肿瘤细胞),证实CD19丢失并非主要耐药机制。
安全性
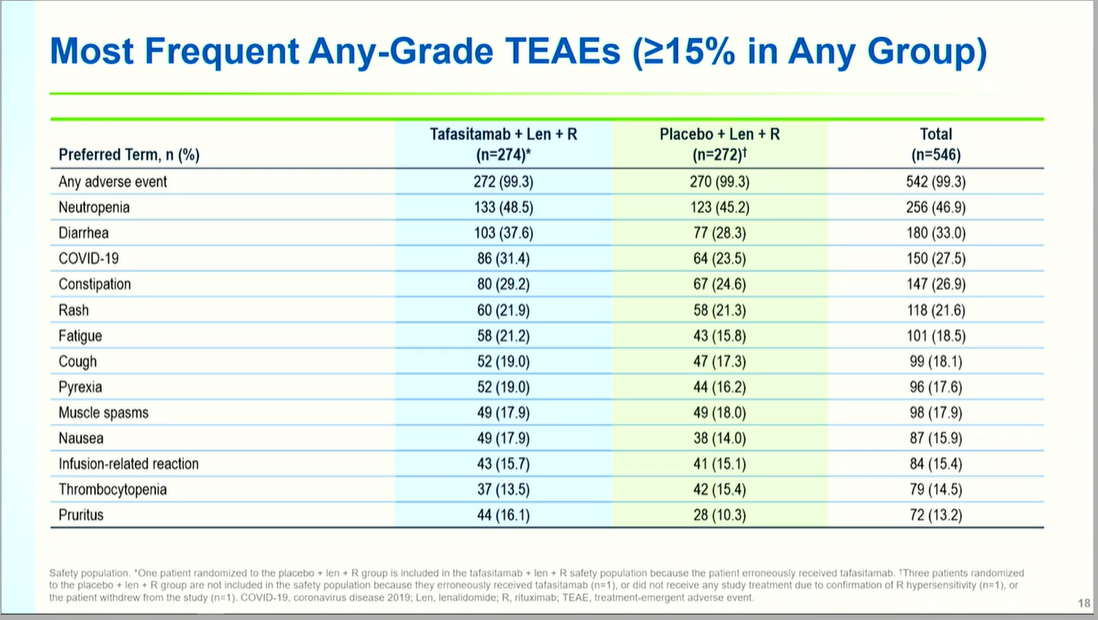

两组安全性特征相似,任意级别治疗期间不良事件(TEAE)发生率均为99.3%。最常见TEAE包括中性粒细胞减少(48.5% vs 45.2%)、腹泻(37.6% vs 28.3%)、COVID-19(31.4% vs 23.5%)及便秘(29.2% vs 24.6%)。≥3级中性粒细胞减少发生率为39.8% vs 37.5%,血小板减少为11.3% vs 7.4%,未超出预期范围。
剂量调整与停药率:因TEAE导致研究治疗中断的比例在坦昔妥单抗组略高(11% vs 7%),但来那度胺剂量中断(74% vs 70%)及减量(14% vs 11%)比例两组相当,提示坦昔妥单抗未显著增加整体治疗毒性。研究期间共46例死亡,疾病进展相关死亡在坦昔妥单抗组更低(2% vs 6%),感染相关死亡各组6例(2%)。
讨论
inMIND研究首次在III期临床试验中证实,CD19与CD20双靶点抗体联合治疗可产生协同增效,为R/R FL确立了新的治疗标准。与RELEVANCE研究中利妥昔单抗联合来那度胺相比(中位PFS 39.4个月),本研究对照组中位PFS仅13.9个月,反映入组人群更具难治性。而坦昔妥单抗的加入将中位PFS延长至24.4个月,使其成为首个在该人群中超越来那度胺-利妥昔单抗骨架的联合方案。
该方案的优势体现在多个维度:深度缓解率提升(CR率52% vs 40%)、缓解持久性增强(DoR延长7.6个月)、疾病生物学行为改善(转化风险降低)以及真实世界适用性(社区与学术中心均可开展)。尽管中性粒细胞减少发生率较高,但可通过标准支持治疗管理,且未转化为更高的感染死亡率。
值得注意的是,CD19表达保留提示该靶点持续有效,为后续治疗线保留CD19导向疗法(如CAR-T细胞)提供可能。未来需探索是否可前移该方案至更早治疗线,或与其他新型药物(如PI3K抑制剂、EZH2抑制剂)序贯使用。
结论
inMIND研究证实,坦昔妥单抗联合来那度胺和利妥昔单抗是首个在高度难治R/R FL人群中证实显著生存获益的CD19/CD20双抗体方案。该组合不仅延长PFS、提升缓解深度与持久性,还降低组织学转化风险,且安全性可控。基于此,该方案已获得FDA批准,并有望成为R/R FL的新标准治疗,重塑当前治疗格局。随着长期OS数据成熟,其临床价值将进一步确立。
1. Leonard JP, Trneny M, Izutsu K, et al. AUGMENT: a phase III study of lenalidomide plus rituximab versus rituximab plus placebo in relapsed/refractory follicular lymphoma. J Clin Oncol. 2019;37(14):1188-1199.
2. Salles G, Duell J, González Barca E, et al. L-MIND: tafasitamab (MOR208) plus lenalidomide in patients with relapsed/refractory diffuse large B-cell lymphoma. Blood. 2019;134(Suppl 1):406.
3. Sehn LH, Hubel K, Luminari S, et al. Outcomes from the phase 3 inMIND study of tafasitamab plus lenalidomide and rituximab in relapsed/refractory follicular lymphoma. Hematol Oncol. 2024;42(S2):Abstract 4.
4. Morschhauser F, Le Gouill S, Feugier P, et al. RELEVANCE: lenalidomide plus rituximab (R²) versus rituximab-chemotherapy followed by rituximab maintenance in untreated advanced follicular lymphoma. J Clin Oncol. 2018;36(15_suppl):7500.
5. Salles G, Schuster SJ, de Vos S, et al. Long-term follow-up of the phase II L-MINC study of tafasitamab plus lenalidomide in relapsed/refractory DLBCL. Blood. 2021;138(Suppl 1):3548.
6. Fowler NH, Samaniego F, Feldman T, et al. Follicular lymphoma: evolving therapeutic landscape. Blood Rev. 2021;48:100789.ile of Nivolumab Monotherapy: A Pooled Analysis of Patients With Advanced Melanoma. Journal of Clinical Oncology , 2016. DOI: 10.1200/JCO.2015.66.1389
排版编辑:肿瘤资讯-Hanna











 苏公网安备32059002004080号
苏公网安备32059002004080号


