在恶性实体瘤中,肺癌的脑转移(BM)发生率高于乳腺癌、肾细胞癌、黑色素瘤和结直肠癌等其他主要瘤种[1]。无论是非小细胞肺癌(NSCLC) 还是小细胞肺癌(SCLC) ,其脑转移患者的临床预后都极为不佳,严重影响患者的生存期和生存质量,因此肺癌脑转移是当前肿瘤临床治疗中一个亟待攻克的重大难题。尤其在HER2突变非小细胞肺癌(NSCLC)患者中,脑转移的发生率近乎一半,严重影响患者生存[2]。传统药物由于血脑屏障(BBB)的存在,颅内疗效有限。然而,随着脑转移病灶处血肿瘤屏障(BTB)通透性增加等机制的阐明,以及ADC药物本身(如高DAR值、强效载荷、旁观者效应及克服外排泵)的优化,新一代ADC药物在临床前和临床研究中均显示出令人鼓舞的颅内抗肿瘤活性[3,4]。基于此,【肿瘤资讯】特邀中山大学肿瘤防治中心蔡修宇教授盘点“魔法子弹”ADC药物在肺癌脑转移中的研究进展,并探讨新型ADC在肺癌脑转移治疗中的潜力。
中山大学肿瘤防治中心
CSCO基金会理事、CSCO理事
“广东特支计划”青年拔尖人才
广东省自然科学基金卓越青年团队
国家卫健委高层次人才评审专家
国家自然科学基金评审专家
国家教育部博士论文评审专家
广东省保健协会免疫治疗分会 主任委员
广州市抗癌协会肿瘤复发与转移委员会 主任委员
广州抗癌协会肿瘤康复专委会 名誉主委
以第一/共一/通讯作者在BMJ/Lancet Oncology/Nat Commun/ EJC/ IJC等期刊发表多篇论文
第一作者论文被NCCN指南收录为2B类证据
肺癌脑转移:严峻的临床挑战
肺癌是最常见的发生BM的原发肿瘤之一,约50%的肺癌患者在病程中会出现脑转移[1]。脑转移不仅会导致患者出现头痛、癫痫、局灶性神经功能缺损等严重症状,显著降低生活质量,同时也是预后不良的关键因素。多项大规模数据库和回顾性研究显示,NSCLC合并BM患者的中位生存期通常仅为5-6个月,远低于无脑转移或仅有体外转移的患者[5-8]。在NSCLC的特定分子亚型中,脑转移问题尤为突出。一项来自纪念斯隆-凯特琳癌症中心的数据显示,在HER2突变的NSCLC患者中,初诊时即有19%的患者发生脑转移,而在后续治疗过程中另有28%的患者出现脑转移,总发生率接近一半[9]。伴随脑转移的HER2突变NSCLC患者,其中位生存期显著缩短,预后极差[9, 10]。一项在中国开展,纳入了183 例 HER2 突变型 NSCLC 患者的回顾性研究结果显示,91 例伴有 BM 患者的中位 OS 显著低于无 BM 的患者(14.8 个月 vs 23.2 个月,p < 0.001)[11]。因此,开发能够有效穿透BBB并控制颅内病灶的药物,是改善这类患者生存的关键。
ADC药物治疗脑转移的潜在机制
传统上,BBB被认为是阻碍大分子药物(如抗体)进入中枢神经系统(CNS)的主要障碍。然而,在肿瘤脑转移病灶处,BBB的结构和功能发生改变,形成了“血肿瘤屏障”(BTB)(图1)[12]。BTB的特点包括内皮细胞紧密连接的丢失、周细胞和星形胶质细胞的缺失、以及肿瘤细胞分泌的VEGF等因子导致的血管通透性增加[12, 13]。这种屏障功能的破坏,反而为大分子ADC药物提供了进入CNS病灶的机会。此外,研究发现脑转移病灶中的靶点表达可能发生变化。有报道指出,NSCLC脑转移灶中的HER2和HER3表达水平有上调趋势[14, 15],这为靶向ADC提供了更丰富的结合位点。
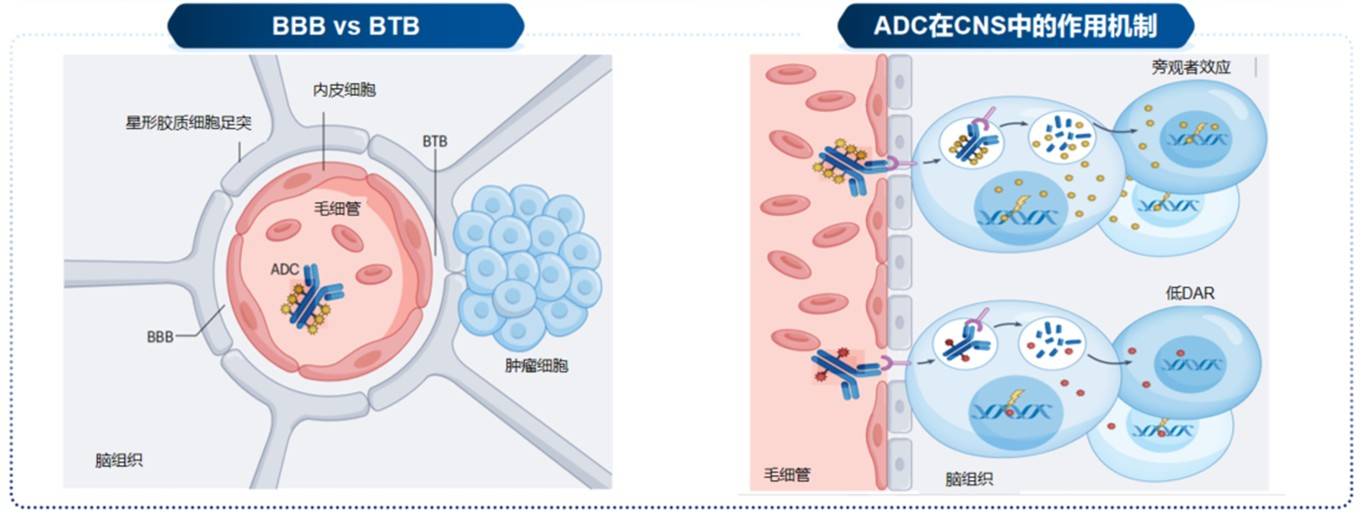
临床前研究为ADC治疗脑转移提供了有力证据。在乳腺癌脑转移(BCBM)的异种移植(PDX)模型中,T-DXd不仅对HER2阳性模型有效,对HER2低表达乃至T-DM1耐药的模型也显示出强大的抗肿瘤活性,并显著延长了小鼠的生存期[16]。一项PET成像研究也证实,放射性核素标记的曲妥珠单抗(T-DXd的抗体骨架)能够聚集在HER2阳性脑转移病灶中,表明抗体确实可以穿透BTB[17]。
ADC药物的独特设计也为其颅内疗效奠定了基础:首先是均一性与高DAR值,均质的ADC(具有一致的药物抗体比,DAR)在脑肿瘤模型中显示出更优的肿瘤积累和治疗效果[18]。以DXd为载荷的ADC(如T-DXd、HER3-DXd)DAR值高达8左右,远高于T-DM1(DAR≈3.5),这带来了更强的杀伤效能[19, 20]。其次是旁观者效应,DXd系列ADC采用可裂解的GGFG四肽连接子,在肿瘤细胞内释放的强效载荷DXd(拓扑异构酶I抑制剂)具有高细胞膜通透性,能够扩散至邻近的肿瘤细胞(包括不表达靶点的细胞)并将其杀伤[19]。此外,克服外排泵是其优势之一。许多化疗药物(如T-DM1的载荷DM1)是MDR1(P-glycoprotein)外排泵的底物,易被泵出细胞导致耐药[21]。而T-DXd的载荷DXd被证实是MDR1的弱底物,不易被外排,因此可能克服脑转移灶中常见的耐药机制[19]。
ADC治疗肺癌脑转移的临床进展
靶向HER2的T-DXd
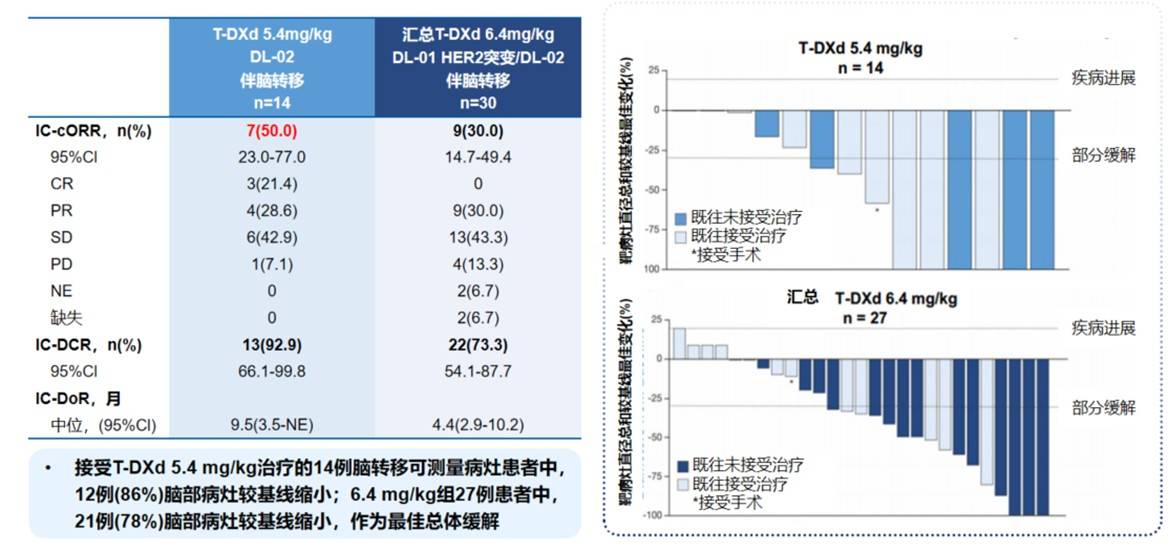
T-DXd是首个在HER2突变NSCLC中证实具有卓越疗效的ADC药物,也是首个获得肺癌适应症的ADC。2023年ESMO大会公布的DESTINY-Lung01和DESTINY-Lung02研究的汇总分析数据(图2),为T-DXd治疗伴有脑转移的HER2突变NSCLC患者提供了关键证据[22]。该分析评估了两个剂量(5.4 mg/kg和6.4 mg/kg)的T-DXd在基线伴有可测量脑转移病灶患者中的颅内(IC)疗效:T-DXd 5.4 mg/kg组(n=14)的颅内确认的客观缓解率(IC-cORR)达到了50.0%(95% CI: 23.0-77.0),其中3例(21.4%)为完全缓解(CR),颅内疾病控制率(IC-DCR)高达92.9%,中位颅内缓解持续时间(IC-DoR)为9.5个月。瀑布图显示,在5.4 mg/kg剂量组中,86%(12/14)的患者脑部病灶较基线缩小。这些数据表明,T-DXd(特别是5.4 mg/kg剂量)对HER2突变NSCLC的脑转移具有强大且持久的控制能力。此外,T-DXd在HER2阳性乳腺癌脑转移中也显示出高达73.3%的IC-ORR(TUXEDO-1研究)和良好的真实世界疗效(ROSET-BM研究),都进一步佐证了其卓越的颅内活性[23-26]。
靶向B7-H3的I-DXd
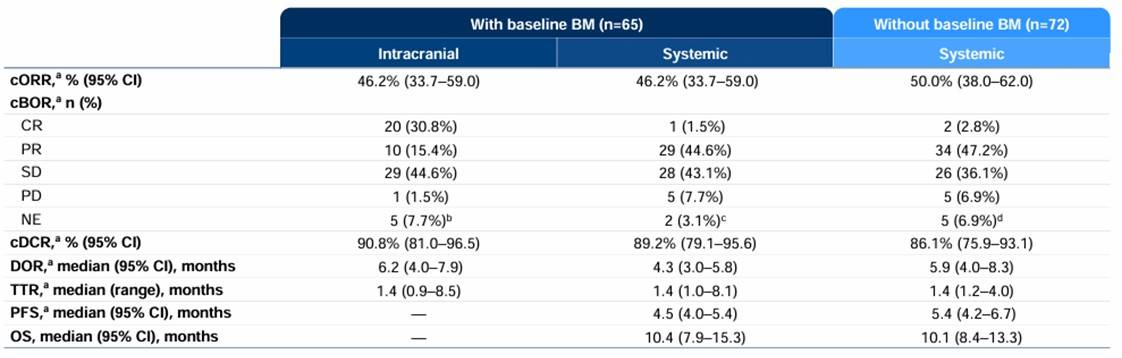
B7-H3在多种实体瘤中高表达,I-DXd是一款靶向B7-H3的ADC。IDeate-Lung01研究探索了I-DXd(12 mg/kg)治疗经治广泛期小细胞肺癌(ES-SCLC)的疗效和安全性。2025 ESMO年会公布了对IDeate-Lung01研究基线中CNS BICR确定的无症状脑转移(既往治疗或未治疗)患者的亚组分析[27]。亚组分析显示,I-DXd 12 mg/kg 的颅内疗效颇具潜力,在65例基线伴有脑转移的患者中,IC-cORR达到46.2%(其中30.8%为CR),IC-DCR高达90.8%(图3)。在29例基线有可测量颅内病灶的患者中,IC-cORR更是达到了65.5%,IC-DCR 达96.6%。此外,基线BM患者无论既往是否接受过治疗,I-DXd均显示出有潜力的颅内疗效,在26例既往未接受过脑放疗的BM患者中,颅内cORR 为57.7%;在39例既往接受过脑放疗的BM患者中,颅内cORR 为38.5%,均显示出I-DXd优异的颅内控制潜力。值得关注的是,在72例基线无脑转移的患者中,颅内进展并不常见,仅为12.5%,这一数据低于流行病学统计呈现的近半数患者发生BM的数据,这提示I-DXd不仅有可观的BM治疗效果,还可能预防BM的发生。
靶向TROP-2的Dato-DXd
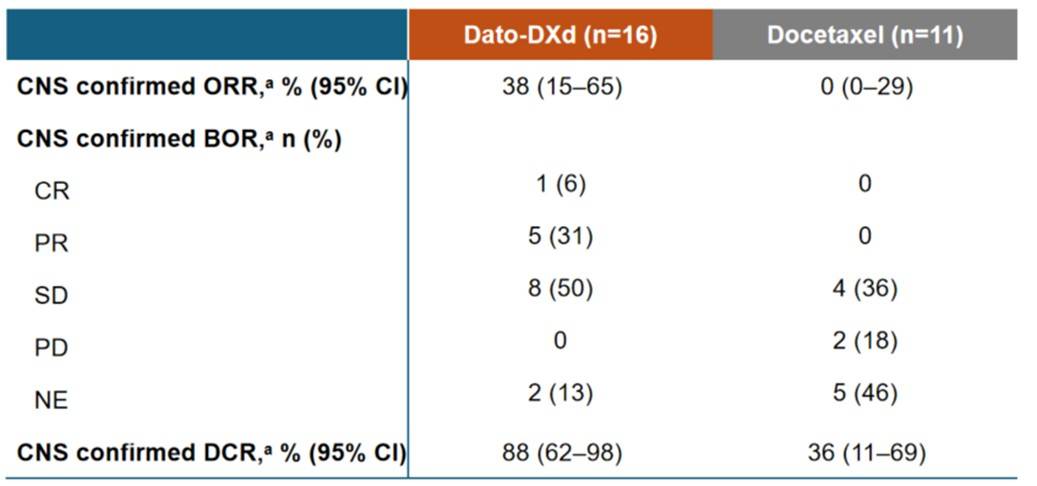
Dato-DXd是一款靶向TROP-2的ADC,一项临床前研究证实了Dato-DXd 在 NSCLC 脑转移模型中能够穿透BBB,独立于BBB的渗漏程度,并定位于颅内植入的肿瘤中[28],这为Dato-DXd在临床研究中的高效颅内活性提供了重要依据。II期TROPION-Lung05研究纳入了经治的、伴有驱动基因变异(包括EGFR、ALK等)的晚期NSCLC患者。在18例基线伴有可测量脑部病灶的患者中,Dato-DXd治疗的IC-ORR为22%,IC-DCR为72%,中位IC-PFS为6.9个月[29]。2025年WCLC公布了TROPION-Lung01 研究中 Dato-DXd 在晚期/转移性 NSCLC 患者颅内疗效的更新数据[30]。研究结果显示,在27 例基线脑转移未经治疗/经放疗后进展且存在可测量病灶的患者中,Dato-DXd 组IC-cORR为38%,其中 6% 的患者实现CR;而多西他赛组为 0。此外,两组的IC-DCR分别为 88% 和 36%(图4)。在生存期方面,在68 例基线脑转移未经治疗/经放疗后进展的患者中,Dato-DXd 组的中位IC-PFS优于多西他赛组,分别为 5.0 个月 vs. 3.0 个月,HR = 0.48(95%CI,0.23 ~ 0.98),降低疾病进展或死亡风险达 52%。
靶向HER3的HER3-DXd
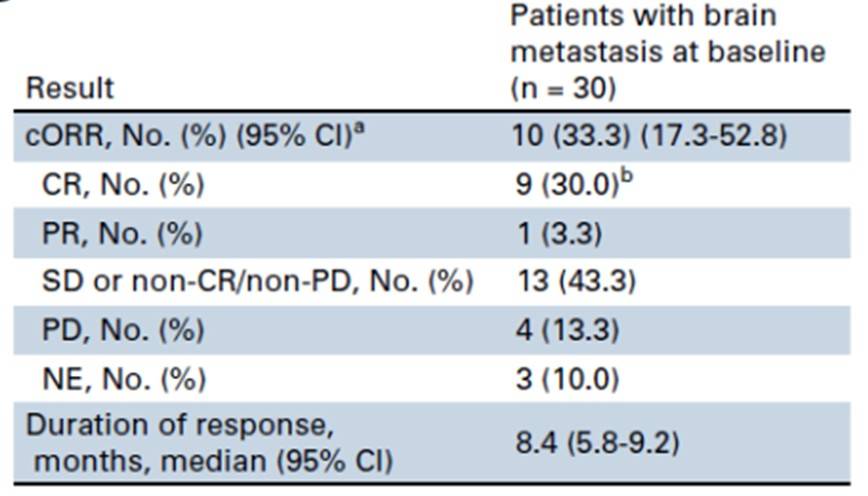
HER3-DXd是另一款以DXd为载荷的ADC。在HERTHENA-Lung01研究中,针对EGFR TKI耐药的EGFR突变NSCLC患者,对于基线有脑转移且未接受过放疗的亚组(n=30),HER3-DXd显示出33.3%的IC-cORR,其中包括30.0%的CR,中位IC-DoR达到8.4个月(图5)[31]。随后的HERTHENA-Lung02研究也证实了其在基线脑转移人群中的颅内疗效(IC-ORR 19.0%)[32]。TUXEDO-3研究在中期分析中报告了NSCLC脑转移队列的IC-ORR为30.0%,IC-PFS为4.8个月[33]。
其他ADC
其他新型ADC如SHR-A1811(靶向 HER2 )、SKB264(靶向TROP2)、Teliso-V(靶向c-MET)和BL-B01D1(靶向EGFR/HER3)等也在肺癌中显示了初步疗效,但尚未公布针对脑转移人群的详细颅内疗效数据[34, 35]。
总结与展望
肺癌脑转移的治疗正迎来变革,以T-DXd为代表的新一代ADC药物,凭借其在脑转移病灶中BTB通透性增加的病理基础,以及自身高DAR值、强效旁观者效应和克服MDR1外排的设计,成功突破了BBB的束缚。T-DXd在HER2突变NSCLC脑转移中已显示出优异的疗效。同时,靶向HER3、TROP-2、B7-H3等其他靶点的ADC药物,也在不同类型的肺癌脑转移患者中展现了巨大的治疗潜力,ADC药物有望成为攻克肺癌脑转移这一临床难题的“魔法子弹”。未来,为进一步优化ADC的颅内疗效和安全性,除了需要致力于开发高效CNS穿透药物和递送系统,深入脑微环境和分子机制研究也有望为这类药物提供更多特异性颅内靶点。此外,非常值得关注的是,优化临床试验设计,以纳入更多脑转移患者,将是未来为肺癌脑转移患者治疗策略提供高级别循证证据的关键所在。总之,随着对ADC研究的不断深入和技术的持续进步,我们有理由相信,在不久的将来,ADC将在肺癌脑转移的治疗领域发挥更加核心和关键的作用,为患者带来更长的生存和更好的生活质量。
[1] Suh JH, et al. Nat Rev Clin Oncol. 2020 May;17(5):279-299.
[2] Zhang Q, Yang Y, Xie M, et al. Lung Cancer (Amsterdam, Netherlands). 2025;205:108616. doi:10.1016/j.lungcan.2025.108616.
[3] Jänne PA, Planchard D, Goto K, et al. JAMA Network Open. 2025;8(11):e2543107.
[4] Fuereder T, Garde-Noguera J, García-Mosquera JJ, et al. The Lancet Oncology. 2025;26(11):1454-1466.
[5] Parker M, Jiang K, Kalluri A, et al. Journal of Neuro-Oncology. 2025;:10.1007/s11060-025-05139-1.
[6] Sharma P, Miller T, Mahadevia H, et al. Journal of Clinical Oncology. 2024;42(Suppl 16):e23299.
[7] Zhang C, Zhang H, Jia W. World Neurosurgery. 2025;:124636.
[8] Ji Q, Yang Z, Kang X, et al. Frontiers in Oncology. 2025;15:1523069.
[9] Offin, Michael et al. Cancer vol. 125,24 (2019): 4380-4387.
[10] Goncalves PH, et al. Cancer. 2016 Jun 15;122(12):1921-7.
[11] Zhang Q, et al. Lung Cancer. 2025 Jul;205:108616.
[12] Steeg, Patricia S. Nature reviews. Clinical oncology vol. 18,11 (2021): 696-714.
[13] Pan K, et al. Nat Rev Clin Oncol. 2023 Oct;20(10):716-732.
[14] Sun M, et al. Clin Cancer Res. 2009 Aug 1;15(15):4829-37.
[15] Zhou H, et al. Transl Lung Cancer Res. 2024;13(12):3778-3794.
[16] Kabraji S, et al. Clin Cancer Res. 2023 Jan 4;29(1):174-182.
[17] Kurihara H,et al.EJNMMI Res. 2015;58. Published 2015 Mar 12.
[18] Anami Y, et al. Cell Rep. 2022 May 24;39(8)110839.
[19] Ogitani Y, et al.Clin Cancer Res. 2016;22(20):5097-5108.
[20] Hashimoto, Yuuri et al. Clin Cancer Res. 2019 Dec 1;25(23):7151-7161.
[21] Kovtun, Yelena V et al. Cancer Res. 2010 Mar 15;70(6):2528-37.
[22] Li BT, et al. 2023 ESMO 1321MO.
[23] Michelon I, et al. Cancer Treat Rev. 2025;133:102882.
[24] Niikura N, et al. NPJ Breast Cancer. 2023;9(1):82. Published 2023 Oct 11.
[25] Nakayama T, et al. Breast Cancer. 2024 Nov;31(6):1184.
[26] Alder L, et al. NPJ Breast Cancer. 2023;9(1):19. Published 2023 Mar 30.
[27] Pedro Rocha, et al. 2025 ESMO 2760MO.
[28] Chetan Rane et al. 2024 AACR Abstract 1911.
[29] Lisberg A, et al. 2024 ASCO. Abstract 8593.
[30] E. Pons-Tostivint, et al. 2025 WCLC. Abstract OA10.01.
[31] Yu H.A., 2023 WCLC abstract OA05.03.
[32] Tony S. K. Mok, et al. 2025 ASCO Oral 8506.
[33] Preusser M, et al. 2025 ASCO Abstract 2005.
[34] Li, Ziming et al. The Lancet. Oncology, S1470-2045(25)00012-9. 25 Feb. 2025.
[35] L. Zhang, et al. 2023ESMO. 1316MO.
本篇内容源自北京康盟慈善基金会支持的“非小细胞肺癌罕见靶点诊疗进展解读项目”。
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


