胃癌是全球范围内严重威胁人类健康的恶性肿瘤,晚期患者预后极差。尽管德曲妥珠单抗(T-DXd)已被批准用于HER2阳性晚期胃癌的后线治疗,但真实世界中的临床应用数据仍显不足。早期肿瘤缩小(ETS)作为反映治疗敏感性的早期指标,在多种癌症中显示出预测长期疗效的价值,但其在T-DXd治疗中的预测作用尚不明确。本研究通过回顾性队列分析,系统评估T-DXd在真实世界中的疗效与安全性,并深入探讨ETS作为预后预测指标的临床价值,为优化治疗决策提供循证依据。相关成果已于2025年发表于Therapeutic Advances in Gastroenterology杂志。
研究背景
胃癌是全球第五大常见恶性肿瘤,也是癌症相关死亡的第三大原因。晚期胃癌(AGC)因无法手术切除,患者5年生存率不足5%,预后极差。系统性化疗虽能延长生存并改善生活质量,但多线治疗失败后选择有限。人表皮生长因子受体2(HER2)在约15%-20%的胃癌病例中过表达,与基因扩增密切相关。基于ToGA研究,曲妥珠单抗联合化疗已成为HER2阳性AGC的一线标准方案。近期KEYNOTE-811研究证实,在曲妥珠单抗联合化疗基础上加用帕博利珠单抗可显著改善生存,确立了新的治疗金标准。
德曲妥珠单抗是一种新型HER2靶向抗体药物偶联物,由抗HER2抗体、可裂解连接子和拓扑异构酶Ⅰ抑制剂有效载荷组成。其独特机制不仅通过抗体阻断HER2信号传导,还能高效递送细胞毒性药物至HER2阳性肿瘤细胞,并通过“旁观者效应”作用于邻近HER2阴性细胞。DESTINY-Gastric01Ⅱ期研究显示,T-DXd在至少接受过二线治疗的HER2阳性AGC患者中,客观缓解率(ORR)达51%,中位无进展生存期(PFS)5.6个月,中位总生存期(OS)12.5个月(HR=0.59;P=0.01),显著优于传统化疗。基于该结果,T-DXd被日本胃癌治疗指南优先推荐为三线治疗方案。
早期肿瘤缩小(ETS)通常定义为治疗开始后8±2周内靶病灶最长径总和缩小≥20%。ETS和反应深度(DpR)已在结直肠癌、非小细胞肺癌等多种实体瘤中被证实可预测长期疗效。在胃癌领域,ETS也被证实可预测一线铂类双药化疗和曲妥珠单抗方案的疗效。然而,T-DXd治疗中ETS的预测价值尚未阐明。鉴于T-DXd具有独特的药物机制和强大的抗肿瘤活性,明确ETS在其治疗中的预测作用对临床决策具有重要意义。
本研究旨在通过真实世界数据,评估T-DXd三线或后线治疗的疗效与安全性,并系统分析ETS对长期生存的预测价值,探索其作为早期疗效标志物的临床应用潜力。
研究方法
1. 研究设计与人群
本研究为单中心回顾性队列研究,纳入2018年3月至2024年5月在日本癌症研究会有明医院接受T-DXd治疗的HER2阳性晚期胃癌患者。入组标准包括:①不可切除的复发/转移性胃腺癌或胃食管结合部腺癌;②组织学证实HER2阳性(IHC 3+或IHC 2+/ISH+);③既往接受过至少二线化疗,包括曲妥珠单抗;④ECOG体能状态评分0-2分。排除标准包括临床试验参与者和HER2状态不明者。研究获伦理委员会批准(IRB号:2023-GB-015),遵循赫尔辛基宣言原则。
2. 治疗方案
T-DXd每3周静脉输注一次,剂量6.4 mg/kg,直至疾病进展、毒性不可耐受或患者要求停药。对于健康状况不佳或前期治疗耐受性差的患者,经医师审慎评估后可采用减量起始。治疗期间根据不良反应严重程度实施剂量中断、减量或支持治疗,并按规定预防性使用止吐药。
3. 评估指标
基线资料包括年龄、性别、转移部位、既往手术史、HER2状态、既往治疗史等。不良事件(AE)按NCI CTCAE 5.0版评估。疗效评估采用RECIST 1.1标准:PFS定义为从首次给药至疾病进展或死亡;OS定义为从首次给药至死亡;ORR为完全缓解(CR)+部分缓解(PR)患者比例;ETS定义为治疗8±2周时靶病灶缩小≥20%;DpR为靶病灶从基线至最低点的最大变化百分比。在可测量病灶患者中评估ORR、ETS和DpR。
4. 统计分析
采用EZR软件进行统计分析。连续变量以中位数和范围表示,组间比较采用Mann-Whitney U检验;分类变量以频数和百分比表示,采用Fisher精确检验。生存分析采用Kaplan-Meier法和log-rank检验,单因素和多因素Cox比例风险模型评估预后因素。所有检验为双侧,P<0.05为统计学显著。
研究结果
1. 患者基线特征
共纳入65例患者,中位年龄66岁(范围31-82岁),男性71%。ECOG PS 0、1、2分者分别占40%、55%和5%。HER2 IHC 3+占77%,IHC 2+/ISH+占23%。71%患者接受T-DXd作为三线治疗,45%既往接受过纳武利尤单抗治疗。32%患者因前期治疗耐受性差而采用初始减量。68%存在≥2个转移器官,常见转移部位为淋巴结(66%)、腹膜(58%)和肝脏(42%)。
表1 患者基线特征
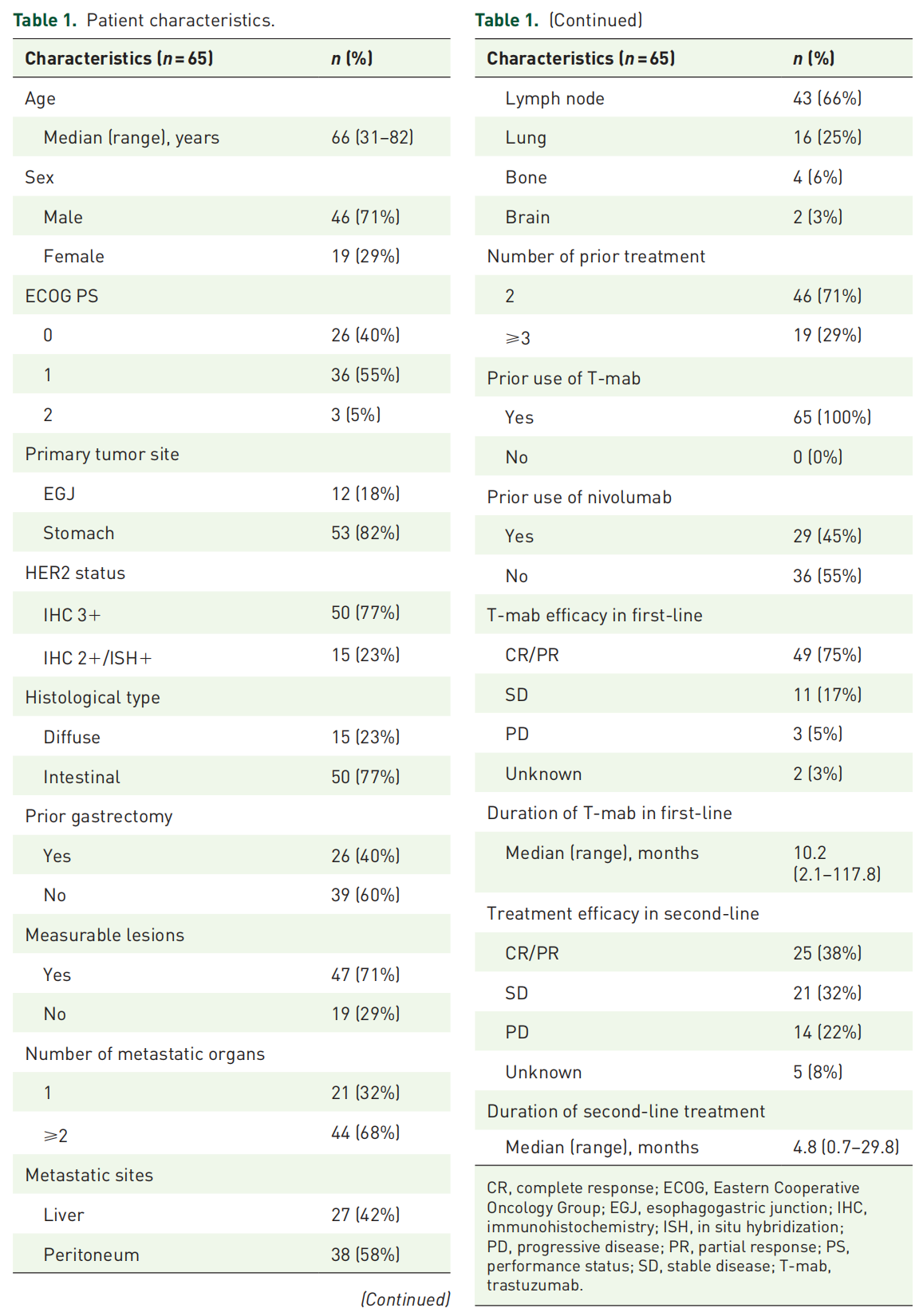
2. 总体疗效与生存
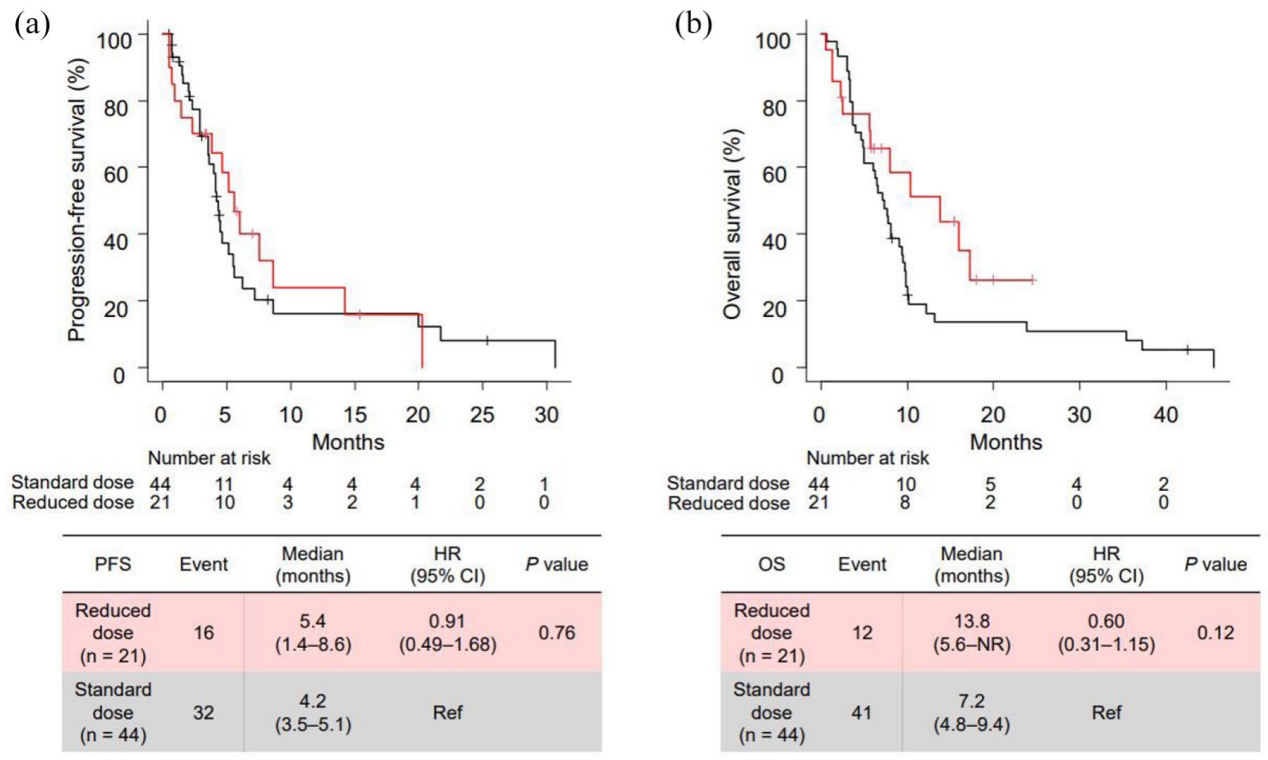
中位随访33.6个月,全组mPFS为4.5个月(95%CI 3.8~5.6),mOS为7.7个月(95%CI 5.7~9.7)。47例可测量病灶患者中,ORR为36.2%,疾病控制率(DCR)87.2%,中位缓解持续时间(mDOR)8.6个月。三线与四线及以上治疗的ORR(35.5% vs 35.7%)和DCR(87.1% vs 85.7%)相当。达CR/PR患者中位OS显著优于SD(13.8 vs 7.7个月,HR=0.25,P=0.01)和PD患者(4.6个月,HR=0.08,P<0.01)。
3. 早期肿瘤缩小与反应深度
可测量病灶患者中,ETS达成率为38.3%(18/47)。ETS组最大肿瘤缩小中位值40.7%,显著高于非ETS组的6.3%,且ETS与DpR呈强相关。DpR≥50%患者均来自ETS组。ETS组ORR高达77.8%,DCR达100%,显著优于非ETS组(10.3%和79.3%)。
生存分析显示,ETS组mPFS显著延长至8.6个月(95%CI 5.1~20.3),而非ETS组仅4.0个月(HR=0.18,P<0.01);ETS组mOS达10.3个月(95%CI 9.5~45.6),亦显著优于非ETS组的6.2个月(HR=0.29,P<0.01)。多因素分析中,ETS是PFS(HR=0.21,95%CI 0.09~0.49)和OS(HR=0.23,95%CI 0.10~0.52)的独立预测因子。DpR分析显示,DpR≥50%患者mOS达45.6个月,30%—50%者为9.9个月,-20%至30%者为7.7个月,而DpR<-20%者仅4.6个月,表明DpR与OS呈显著正相关(P<0.01)。
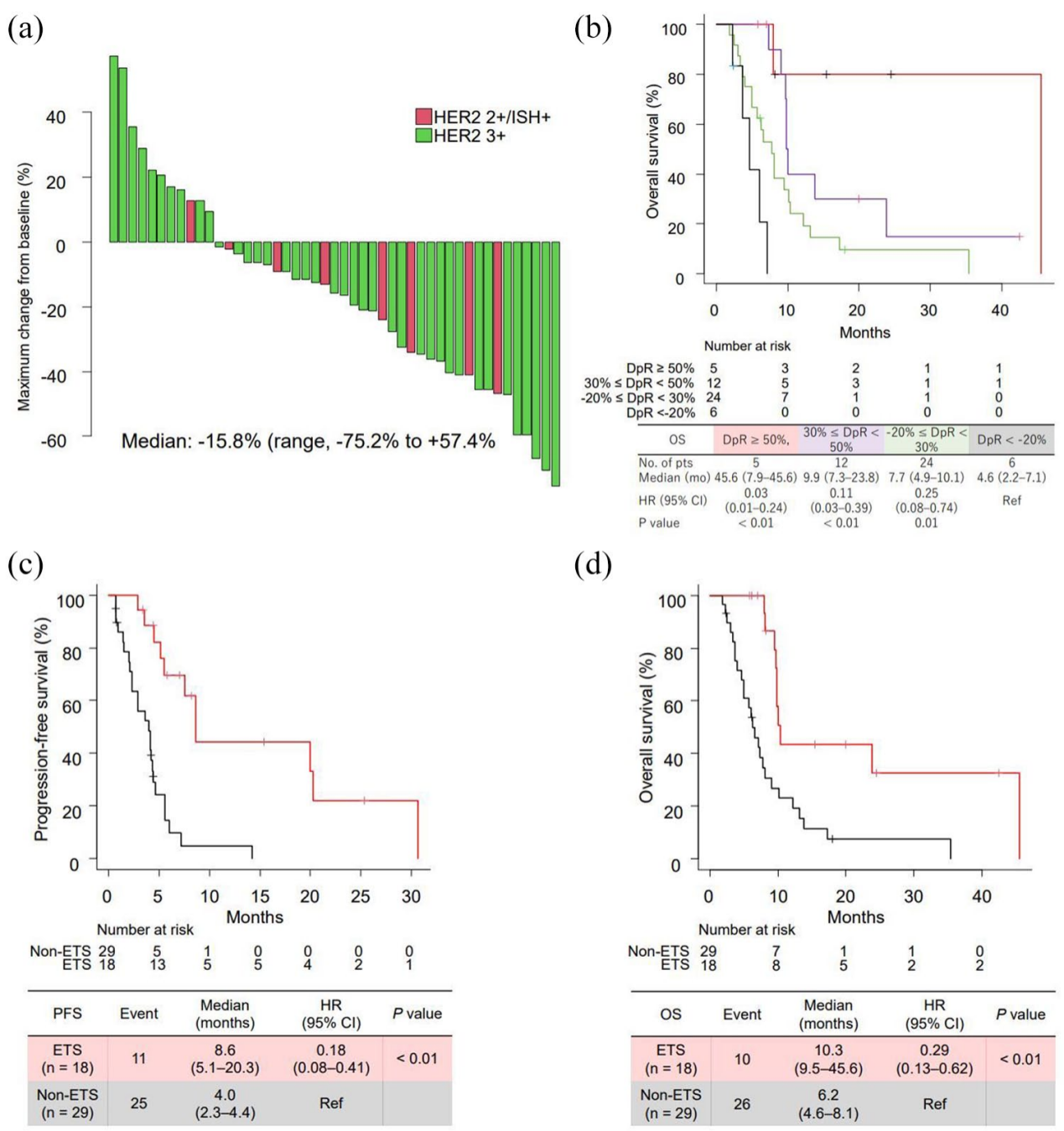
表2 47例可测量病灶患者总生存期的Cox比例风险模型分析
4. 亚组分析
HER2 IHC 3+与IHC 2+/ISH+患者的mPFS无显著差异(4.5 vs 4.1个月,P=0.65),但IHC 3+组呈现OS获益趋势(9.0 vs 5.6个月,P=0.06)。在可测量病灶中,IHC 3+组达深度缓解(DpR≥50%)比例更高(12.8% vs 0%),中位DOR更长(20.0 vs 8.6个月)。
二线治疗持续时间≥4.8个月(中位值)的患者OS显著改善(9.8 vs 6.2个月,HR=0.45,P=0.04),且为多因素分析的独立预后因素。
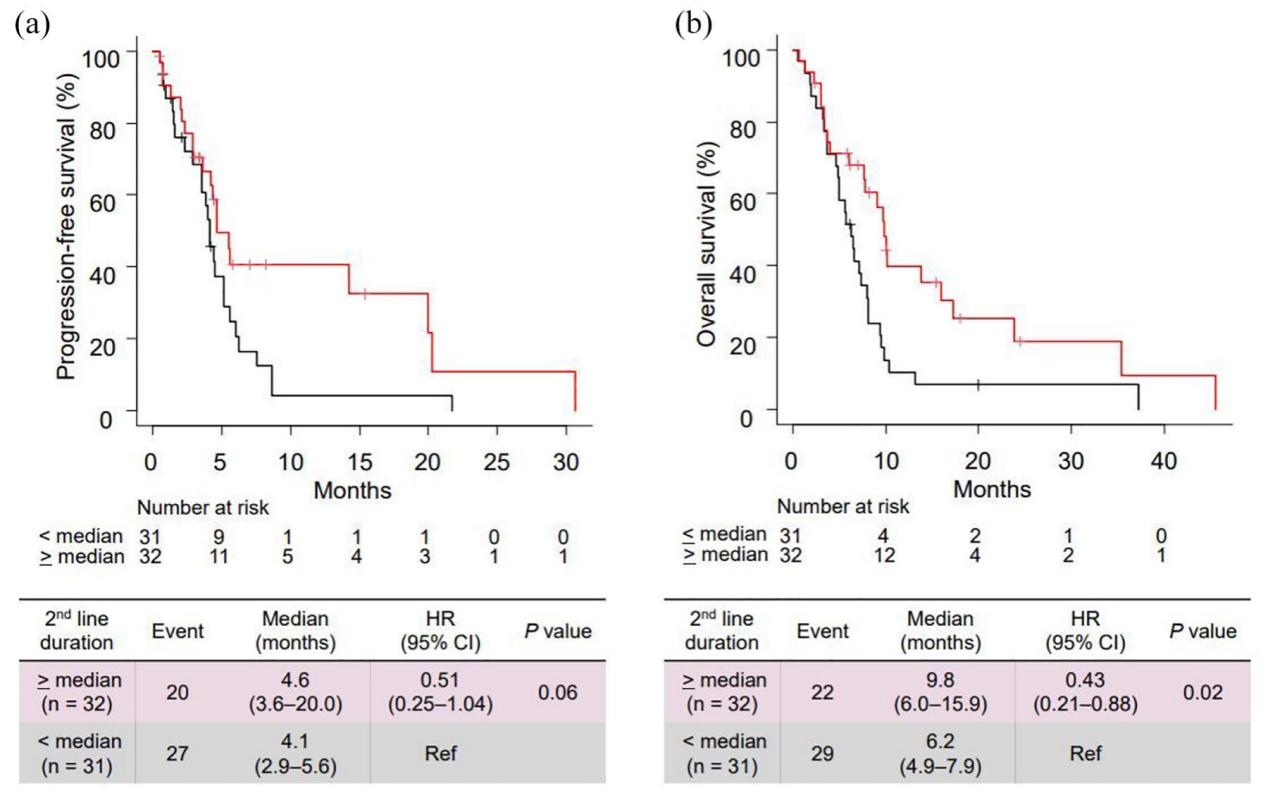
5. 安全性分析
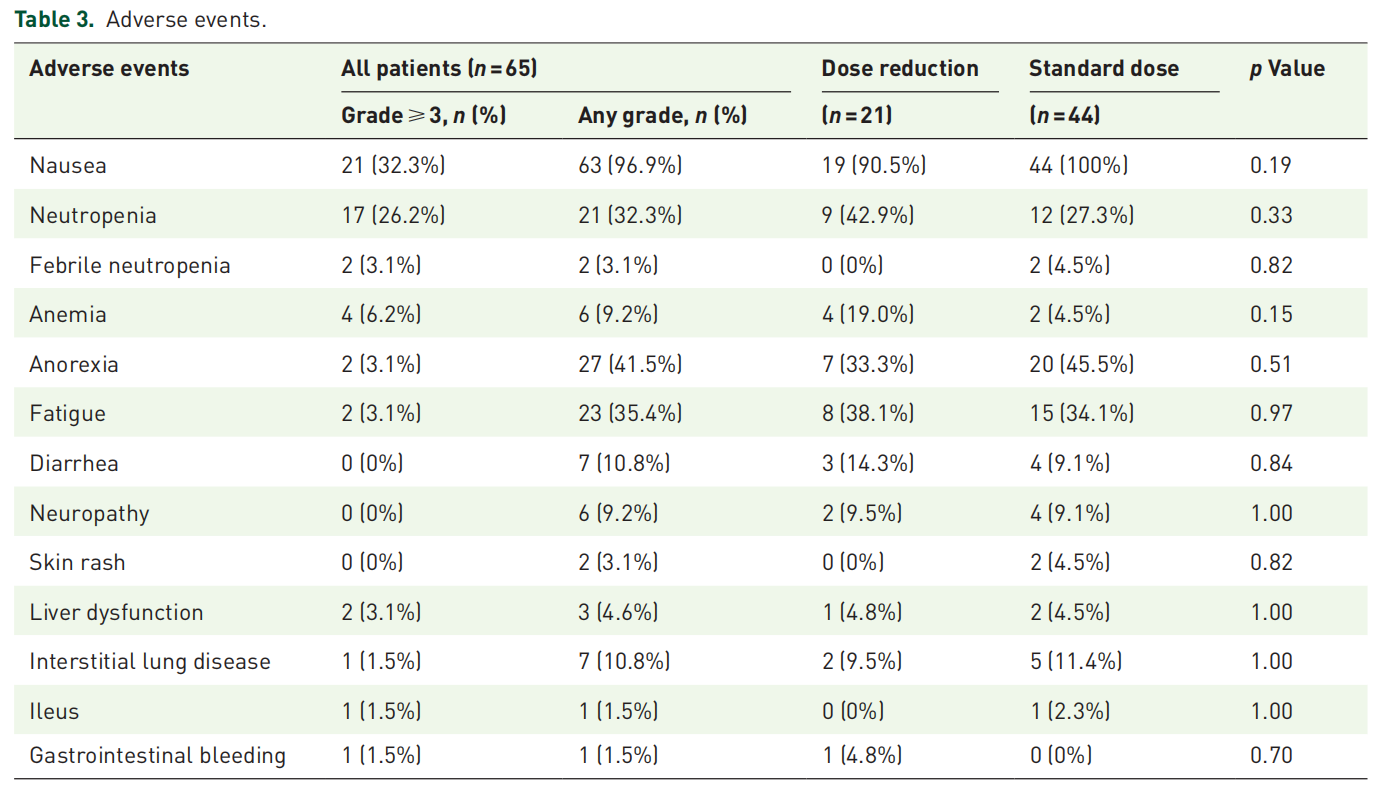
98.5%患者出现任意级别AE,≥3级AE发生率为36.9%。最常见血液学毒性为中性粒细胞减少(32.3%)和贫血(9.2%),≥3级中性粒细胞减少占26.2%。非血液学毒性以恶心(96.9%)、食欲减退(41.5%)和乏力(35.4%)为主,≥3级恶心占32.3%。间质性肺病发生率为10.8%(8例),多数为1-2级。15.3%患者因AE停药。初始减量组与标准剂量组的疗效无显著差异(mOS 13.8 vs 7.2个月,HR=0.60,P=0.12),但减量组因AE停药率显著更低(4.8% vs 18.6%)。多因素分析显示初始减量是OS的独立预测因素(HR=0.31,P=0.02)。
表3 不良事件
结论
本研究通过真实世界数据证实,德曲妥珠单抗在三线或后线治疗HER2阳性晚期胃癌中具有显著疗效和可控的安全性。早期肿瘤缩小(ETS)是预测PFS和OS的强有力早期指标,ETS达成者生存获益显著,中位OS延长至10.3个月。反应深度(DpR)与OS呈正相关,深度缓解者(DpR≥50%)mOS达45.6个月,凸显T-DXd在敏感人群中的持久疗效。
二线治疗持续时间较长提示HER2表达可能恢复,有助于T-DXd起效。初始剂量减量在不降低疗效的前提下显著减少治疗中断,为耐受性差的患者提供可行选择。ETS的临床意义不仅在于预测疗效,更可通过快速缩瘤改善症状、延缓生活质量恶化,为后续治疗创造条件。未来需多中心大样本研究验证ETS的预测价值,并探索ETS与HER2动态表达、循环肿瘤DNA等生物标志物的关联。
然而,研究存在一定局限性:首先,单中心回顾性设计可能存在选择偏倚,限制了研究结果的普适性;其次,由于是回顾性研究,部分非血液学不良事件可能未被电子病历完整记录,且探索性设计限制了结果的可解释性;此外,研究仅纳入65例患者,样本量相对较小,统计学效能有限。
综上所述,早期肿瘤缩小可作为T-DXd治疗HER2阳性晚期胃癌的重要疗效预测指标,指导临床决策和患者管理。T-DXd应作为此类患者三线治疗的优选方案,而ETS的评估有助于早期识别获益人群,实现个体化精准治疗。
Fukuda K, Osumi H, Shimozaki K, et al. Impact of early tumor shrinkage on survival outcomes in patients with HER2-positive advanced gastric cancer treated with trastuzumab deruxtecan in third- or later-line settings. Therap Adv Gastroenterol. 2025;18:17562848251333538. Published 2025 Apr 24. doi:10.1177/17562848251333538
审批编号:CN-173231 有效期:2026/6/2
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


