人表皮生长因子受体2(HER2)作为EGFR家族酪氨酸激酶成员,在20%~25%的乳腺癌和胃癌中因基因扩增或过表达而激活,驱动细胞增殖、存活与血管生成,与晚期疾病和不良预后密切相关。尽管曲妥珠单抗、拉帕替尼等HER2靶向药物显著改善了HER2阳性患者的生存,但原发与获得性耐药不可避免,且HER2低表达(IHC 1+或IHC 2+/ISH-)肿瘤长期缺乏有效治疗手段。
拓扑异构酶抑制剂通过捕获TOP1裂解复合物(TOP1cc)引发DNA单链断裂(SSB),SSB在复制叉碰撞后转化为双链断裂(DSB)。同源重组缺陷(HRD)肿瘤因DSB修复障碍对TOP1抑制剂高度敏感。然而,T-DXd是否通过DNA损伤机制发挥作用,以及HRD状态如何影响其疗效,尚未系统阐明。本研究旨在解析T-DXd在不同HER2表达水平和HRD状态癌细胞中的抗肿瘤机制,为其临床优化应用提供理论支撑。
研究背景
1. HER2靶向治疗的临床困境
HER2阳性肿瘤虽可从抗HER2治疗中获益,但HER2低表达肿瘤因受体密度不足,传统ADC药物难以有效递送细胞毒性载荷。T-DXd的高DAR和膜通透性DXd载荷可产生"旁观者效应",杀伤邻近HER2阴性细胞,但其在HER2低表达细胞中的直接作用机制尚不明确。此外,胃癌与乳腺癌对T-DXd的临床反应存在差异,其生物学基础有待阐明。
2. HRD与TOP1抑制剂的合成致死效应
BRCA1/2、RAD51等HR通路基因突变或表观遗传失活导致HRD,使肿瘤对PARP抑制剂敏感。近年研究发现,HRD肿瘤对TOP1抑制剂亦高度敏感,因其无法有效修复TOP1cc诱导的DSB。T-DXd的DXd载荷为依喜替康衍生物,属TOP1抑制剂,理论上应与HRD状态存在协同致死效应。前期研究提示,T-DXd在BRCA2突变胰腺癌细胞中活性增强,但缺乏系统性评估。
3. DNA损伤诱导的核异型与染色体不稳定性
DNA损伤若未在G2期完全修复,细胞带伤进入有丝分裂将导致染色体分配异常,表现为核体积增大、形态不规则等核异型特征。这种核异常不仅是恶性表型标志,更可能反映DNA损伤修复失败。T-DXd是否诱导核异型及其与DNA损伤的关联,是理解其抗肿瘤机制的重要环节。
研究方法
1. 细胞模型构建与分组
本研究纳入10株人源癌细胞系,包括乳腺癌(SK-BR-3、HCC1419、ZR-75-1、MDA-MB-231)、胃癌(NCI-N87、SNU-216、SNU-484、SNU-601、SNU-638、SNU-668)及胰腺癌(Capan-1)。依据ASCO/CAP 2023指南,通过免疫组化(IHC)和ERBB2拷贝数检测,将细胞分为三组:HER2阳性(IHC 3+或IHC 2+/ISH+)、HER2低表达(IHC 1+或IHC 2+/ISH-)及HER2阴性(IHC 0)。同时分析同源重组修复(HRR)相关基因状态,识别BRCA2突变(Capan-1)和RAD51C启动子甲基化(SNU-601)的HRD细胞系。
2. 抗肿瘤活性评估
采用集落形成实验测定T-DXd(0-500 ng/mL处理2周)的半数抑制浓度(IC50)。通过Annexin V-FITC/PI双染流式细胞术检测5天处理后的凋亡率,Western blot检测PARP和caspase-3裂解。体内实验选用HER2低表达SNU-601细胞(5×10⁷)建立BALB/c裸鼠皮下移植瘤,待瘤体达200 mm³后单次静脉注射T-DXd(0, 4, 10 mg/kg),每周测量瘤体积及体重。
3. 药物内化与信号通路分析
将细胞与10 μg/mL T-DXd冰上孵育1小时后转入37℃,通过Alexa Fluor 488标记人IgG抗体,流式细胞术动态检测细胞膜结合T-DXd的平均荧光强度(MFI),计算内化率。Western blot检测120小时处理后HER2、p-HER2(Y1221/1222)、p-AKT(S473)及p-ERK(T202/Y204)表达。
4. DNA损伤检测
Western blot检测DNA损伤应答分子γH2AX、p-RPA32(S4/8)及p-Chk1(S345)。碱性彗星实验评估单细胞DNA碎片(尾矩),至少计数50个细胞。免疫荧光共定位分析RAD51与γH2AX焦点形成。
5. 细胞周期与核形态分析
乙醇固定细胞后,PI染色流式细胞术分析细胞周期分布。Western blot检测G2/M调控蛋白cyclin B1和p-CDK1(Y15)。DAPI染色后共聚焦显微镜观察核形态,定义核面积增大、形状不规则为核异型,定量异常核比例。患者组织样本(IRB No. 2310-165-1480)H&E染色对比T-DXd治疗前后核形态变化。
6. TOP1活性检测
核蛋白提取后,使用TOP1试剂盒将超螺旋DNA与核蛋白共孵育,琼脂糖凝胶电泳分离超螺旋与松弛态DNA,UV成像定量TOP1活性抑制率。
7. 统计学分析
计量资料以均值±标准差(SE)表示,组间比较采用单因素方差分析或Mann-Whitney U检验。体内肿瘤体积采用重复测量双因素方差分析。P<0.05为差异有统计学意义。
研究结果
1. T-DXd在广泛HER2表达谱癌细胞中抑制增殖并诱导凋亡
集落形成实验显示,T-DXd对HER2阳性乳腺癌细胞高度敏感(SK-BR-3: IC50=1.94±0.01 ng/mL;HCC1419: 18.3±0.54 ng/mL),对HER2低表达ZR-75-1细胞中等敏感(30.25±3.96 ng/mL),而对HER2阴性MDA-MB-231细胞无效(IC50>100 ng/mL)。胃癌细胞整体敏感性低于乳腺癌,HER2阳性NCI-N87和SNU-216的IC50分别为15.3±0.16和102±2.49 ng/mL,HER2低表达细胞IC50介于143.8->500 ng/mL。
值得注意的是,HRD细胞显示更高敏感性:BRCA2突变胰腺癌细胞Capan-1(IC50=143.8±33 ng/mL)比野生型SNU-484(219.8±24.2 ng/mL)更敏感;RAD51C甲基化胃癌细胞SNU-601(IC50=244.7±18.8 ng/mL)敏感性与其HER2表达水平不匹配。Annexin V检测显示,经T-DXd处理后,HER2阳性细胞及SNU-601、Capan-1等HRD细胞的早期+晚期凋亡比例显著增加(P<0.001),伴随PARP和caspase-3裂解(图1)。
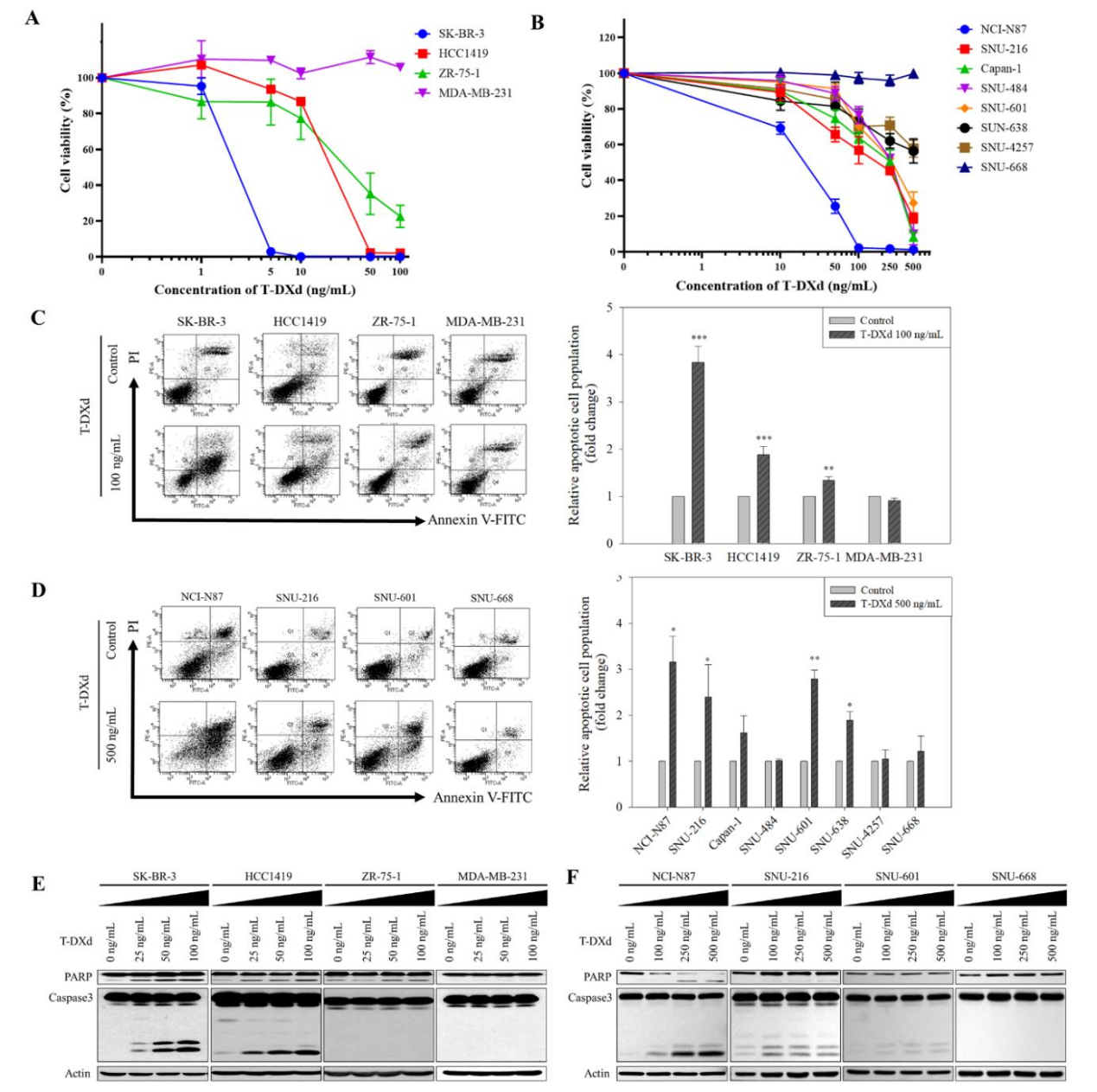
2. T-DXd内化不依赖HER2表达水平但选择性抑制HER2信号
流式检测显示,HER2阳性细胞膜结合T-DXd的MFI最高,HER2阴性最低,但所有HER2表达阳性细胞(包括低表达)均显示T-DXd随时间内化,120分钟内内化率达60%~80%(图2A-B)。Western blot证实,T-DXd仅在HER2阳性细胞中显著抑制p-HER2、p-AKT和p-ERK,而在HER2低表达细胞中不影响这些通路(图2C-D)。这表明T-DXd的抗体组分通过抑制HER2信号参与抗肿瘤,但该效应仅限于HER2阳性细胞。
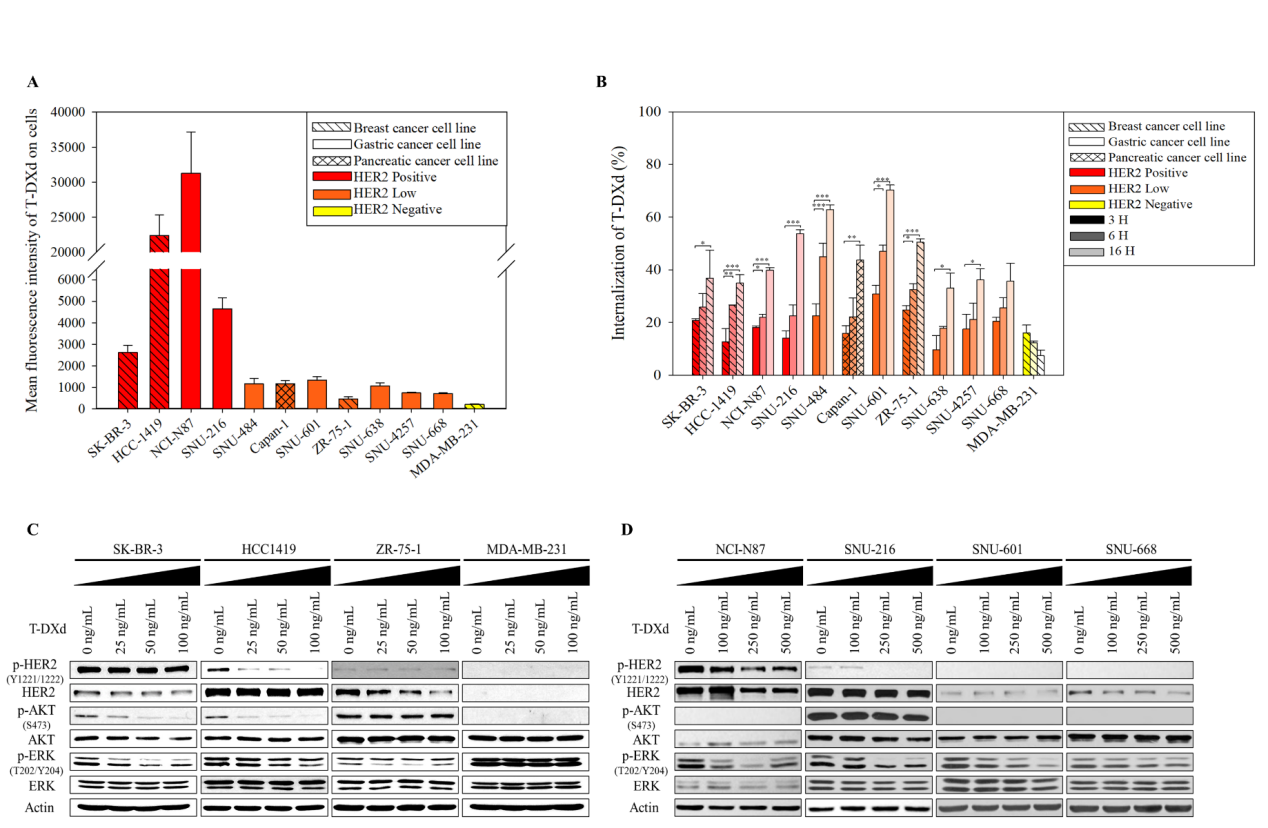
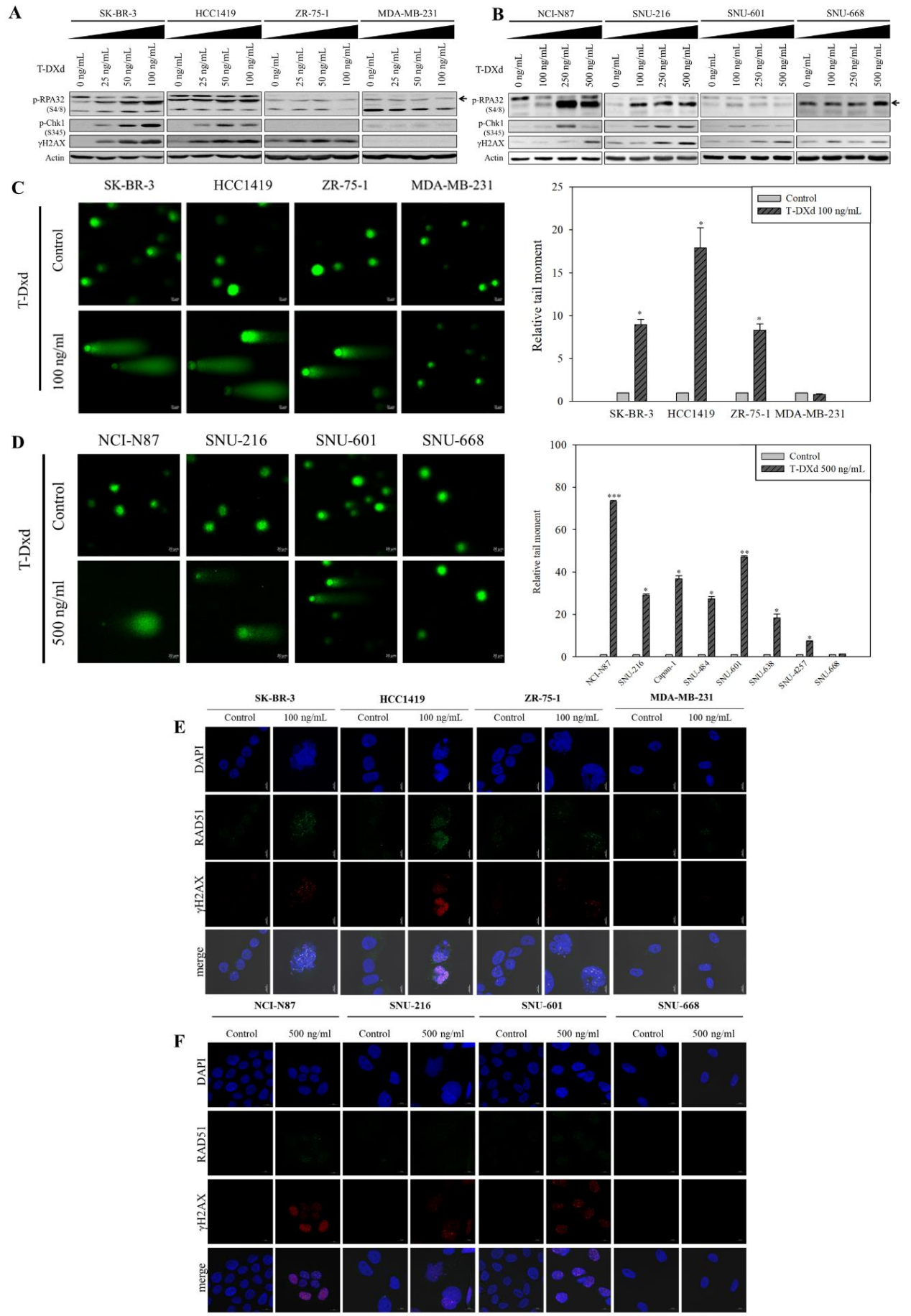
3. T-DXd诱导DNA损伤累积且HRD细胞更敏感
机制研究表明,T-DXd处理后,HER2阳性及HRD的HER2低表达细胞中γH2AX、p-RPA和p-Chk1表达显著上调(图3A-B)。碱性彗星实验显示,这些细胞的尾矩增加2-5倍,反映DNA碎片增加(P<0.001)(图3C-D)。免疫荧光显示,SK-BR-3、NCI-N87等细胞出现RAD51与γH2AX共定位焦点,提示HR修复启动;而SNU-601因RAD51C缺陷缺乏共定位,DSB持续累积(图3E-F)。该结果证实HRD状态是T-DXd疗效的重要决定因素。
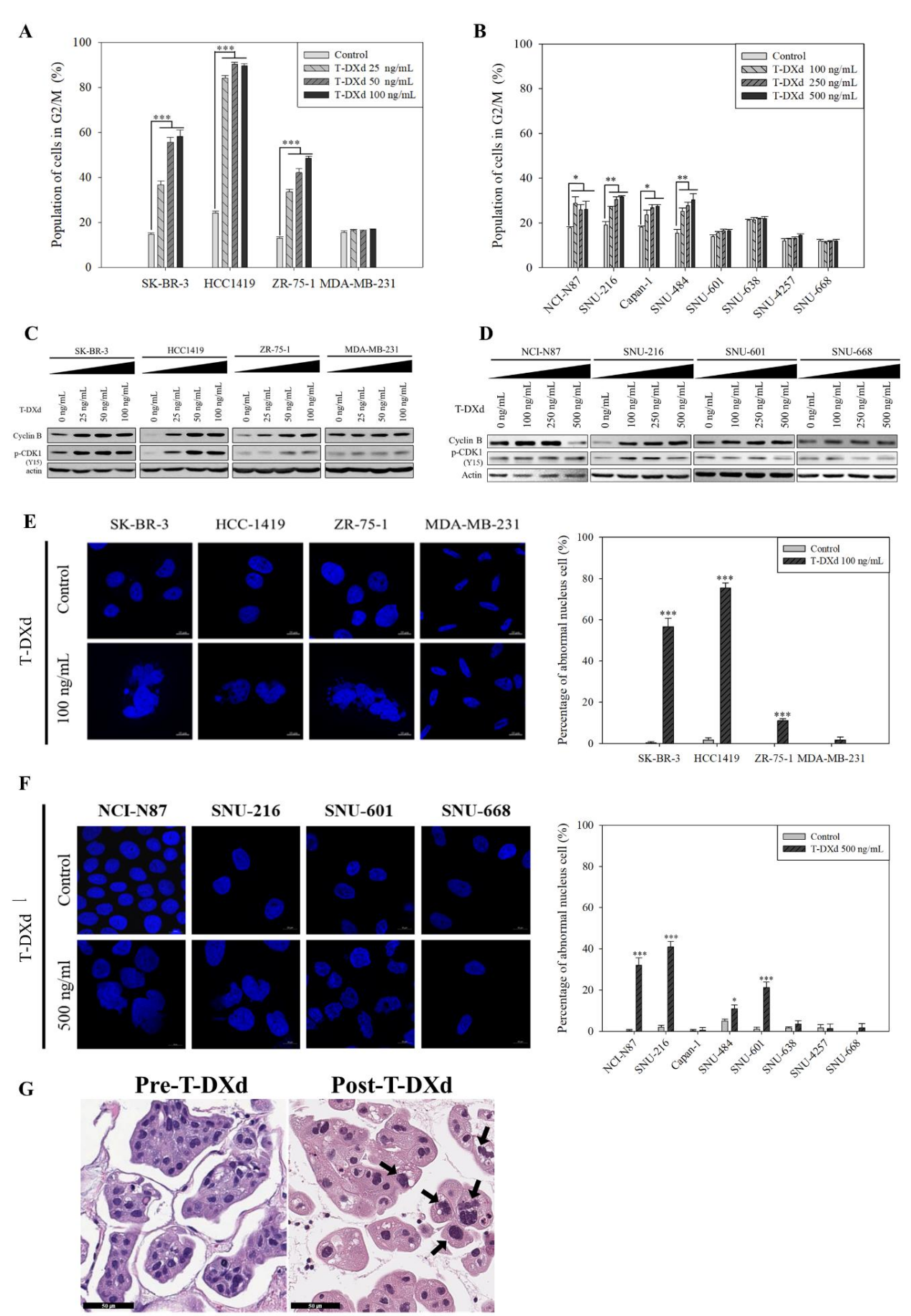
4. T-DXd导致G2/M期阻滞与显著核异型
细胞周期分析显示,T-DXd使HER2阳性及敏感的低表达细胞G2/M期比例增加20%~40%(P<0.001),伴随cyclin B1和p-CDK1上调(图4A-D)。值得注意的是,SNU-601需持续处理10天才出现显著G2/M阻滞,提示HRD细胞周期检查点激活延迟。DAPI染色揭示,T-DXd诱导细胞核体积增大2-3倍,出现多分叶、不规则核膜等异型特征,异常核比例达30%~60%(P<0.001)(图4E-F)。对1例接受T-DXd治疗的HER2阳性乳腺癌患者治疗前后组织分析显示,治疗后肿瘤细胞核异型更显著(图4G)。流式检测还发现非整倍体细胞比例升高,证实染色体不稳定性增加。
5. T-DXd抑制TOP1活性
Western blot显示T-DXd下调TDP1(酪氨酸DNA磷酸二酯酶1)表达,但不影响TOP1总蛋白。TOP1活性检测证实,T-DXd处理后超螺旋DNA残留增加,松弛态DNA减少50%~70%(P<0.001),表明TOP1cc形成导致酶活性抑制。这为DNA损伤机制提供了直接证据。
6. T-DXd在HER2低表达异种移植模型中显示强效抗肿瘤活性
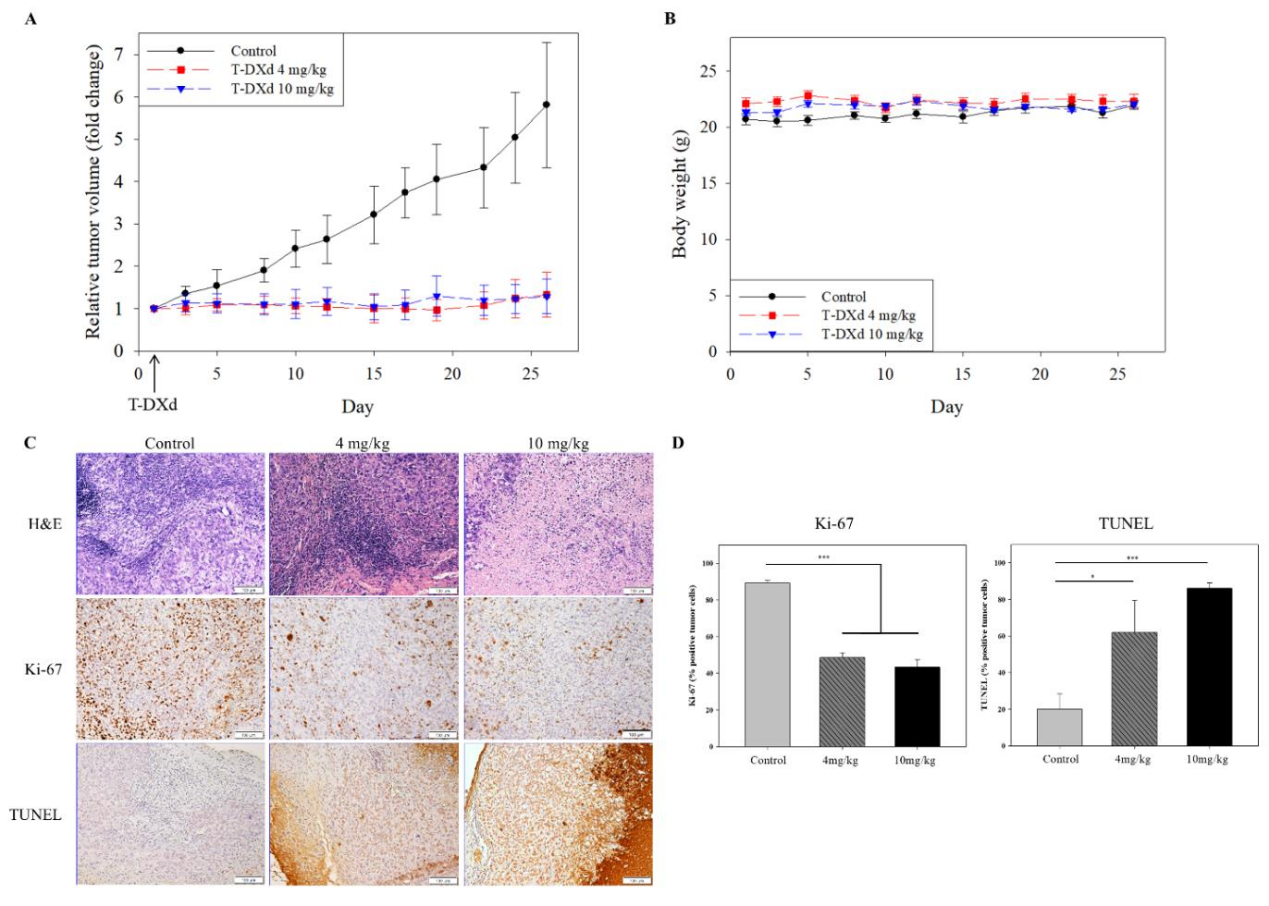
SNU-601移植瘤模型中,单次4 mg/kg T-DXd治疗使肿瘤体积缩小80%(P<0.001),效果持续3周,10 mg/kg剂量效应更强(图5A)。治疗期间小鼠体重无显著下降,未见明显毒性(图5B)。免疫组化显示Ki-67阳性率由60%降至20%(P<0.001),TUNEL阳性凋亡细胞增加3倍(P<0.001)(图5C-D),证实体内抗肿瘤活性。
结论
本研究系统阐明了T-DXd在HER2阳性细胞中,抗体组分通过抑制HER2/AKT/ERK信号发挥抗肿瘤作用;更重要的是,其拓扑异构酶I抑制剂载荷在所有敏感细胞中诱导DNA损伤累积、G2/M期阻滞及核异型,最终导致凋亡。研究为T-DXd获批用于HER2低表达肿瘤提供了机制解释。然而,研究存在一定局限性:首先,研究仅使用了单一HER2低表达细胞系(SNU-601)构建的异种移植模型,可能无法全面反映HER2低表达肿瘤的异质性;其次,尽管研究数据提示T-DXd与DNA损伤反应抑制剂可能存在协同效应,但并未直接开展联合用药的实验验证;此外,体内研究采用单次给药方案,限制了对长期毒性、耐受性或重复给药效果的理解。未来需扩大模型谱、探索联合策略并优化给药方案。综上所述,T-DXd通过独特的作用机制桥接HER2靶向治疗与DNA损伤应答。
Kim SH, Park Y, Min A, et al. DNA damage and Nuclear Anaplasia Induced by Trastuzumab Deruxtecan in Cancer Cells with Variable HER2 Expression and Homologous Recombination Deficiency Status. Cancer Res Treat. Published online August 4, 2025. doi:10.4143/crt.2025.201
审批编号:CN-173229 有效期:2026/12/2
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


