2025年欧洲肿瘤内科学会亚洲年会(ESMO Asia 2025)将于2025年12月5日至7日在新加坡盛大举行。届时,多项重磅研究将于会议期间公布,备受领域关注。当地时间2025年12月1日,会议官网公布了摘要内容(LBA除外),【肿瘤资讯】特此整理消化道肿瘤领域的优选论文专场(Proffered Paper Session)中的Oral研究,以飨读者!
英文标题:Efficacy and safety of perioperative durvalumab plus 5-fluorouracil, leucovorin, oxaliplatin and docetaxel (FLOT) in resectable gastric/gastroesophageal junction (G/GEJ) adenocarcinoma in Asia: A subgroup analysis of the MATTERHORN trial
中文标题:亚洲可切除胃/胃食管结合部(G/GEJ)腺癌患者围手术期度伐利尤单抗联合氟尿嘧啶、亚叶酸钙、奥沙利铂和多西他赛(FLOT)治疗的疗效和安全性:MATTERHORN 研究亚组分析
讲者:Yelena Y. Janjigian (纽约, 美国)
研究背景
胃癌(GC)在亚洲地区非常普遍,需要更好的治疗方法。MATTERHORN(NCT04592913)研究显示,在可切除G/GEJ腺癌患者中,围手术期度伐利尤单抗(D)+FLOT相比安慰剂(P)+FLOT治疗显著改善了无事件生存期(EFS)(Janjigian et al. NEJM 2025)。本报告旨在呈现该试验中亚洲入组患者亚组的D+FLOT对比P+FLOT的疗效和安全性结果。
研究方法
这项全球性、III期、随机、双盲研究纳入了经组织学证实、可切除(II~IVa期)、未经治疗的G/GEJ腺癌患者。患者以1:1的比例随机分配,接受D 1500mg或P(Q4W;每个周期第1天)联合FLOT(Q2W;每个周期第1天和第15天)治疗4个周期(新辅助/辅助各2个周期),随后接受D 1500mg或P Q4W治疗10个周期。在亚洲患者(日本、韩国和中国台湾)中评估了EFS(从随机化到疾病进展、局部或远处复发或死亡的时间)、经中心审查的病理完全缓解(pCR)(改良Ryan标准)和安全性。
研究结果
在948例随机患者中,180例(19.0%)患者在亚洲入组。与全分析集(FAS)中的患者相比,亚洲患者的ECOG体能状态0分的比例更高(92.8% vs 74.2%)、T4期疾病(57.2% vs 24.7%)、胃癌(GC)(87.2% vs 67.5%)和临床淋巴结阳性(77.8% vs 70.4%)的比例更高。
在亚洲患者中,D+FLOT相比P+FLOT改善了EFS(HR,0.74;95% CI,0.44~1.22),这与FAS的结果一致(见下表);D+FLOT组的24个月EFS率更高(72.1%) vs P+FLOT组(64.2%)。亚洲患者的pCR率与FAS的结果一致(见下表)。在亚洲患者中,两治疗组间任何最大等级3/4的不良事件(AE)和导致任何研究治疗中止的任何AE发生率相当。

研究结论
与全球MATTERHORN研究结果一致,D+FLOT相比P+FLOT在亚洲可切除G/GEJ腺癌患者中改善了疗效,并具有可控的安全性。
英文标题:Final analysis and biomarker evaluation of JUPITER-06: A phase III trial of toripalimab plus chemotherapy in advanced or metastatic esophageal squamous cell carcinoma
中文标题:JUPITER-06研究最终分析及生物标志物评估:特瑞普利单抗联合化疗一线治疗晚期或转移性食管鳞状细胞癌的III期临床试验
讲者:Yanxing Chen(中国广州)
研究背景
JUPITER-06研究(NCT03829969)的中期分析显示,特瑞普利单抗联合化疗作为晚期或转移性食管鳞状细胞癌(ESCC)的一线治疗,显著改善了患者的无进展生存期(PFS)和总生存期(OS)。在此,我们报告该研究的最终结果,并探索预测长期生存的潜在基因组生物标志物。
研究方法
研究共纳入514例既往未接受过治疗的晚期或转移性ESCC患者,按1∶1的比例随机分配接受特瑞普利单抗或安慰剂,联合紫杉醇和顺铂治疗。主要终点是由盲态独立中心审查(BICR)评估的PFS和OS。研究对486例患者进行了全外显子组测序(WES),以表征其基因组特征。
研究结果
截至2023年2月23日,中位随访时间为14.2个月。与安慰剂组相比,特瑞普利单抗组的总生存期(OS)显著改善:17.7个月(95% CI 14.6~20.8个月)vs 12.9个月(95% CI 11.6~14.1个月),风险比(HR)为0.72(95% CI 0.58~0.88);双侧P=0.002。两组的3年OS率分别为29.7%和19.9%。在特瑞普利单抗组中,PD-L1表达和肿瘤突变负荷(TMB)均与长期生存获益无关。在接受特瑞普利单抗治疗的患者中,拷贝数变异校正肿瘤突变负荷(ccTMB)较高的患者3年OS率显著高于ccTMB较低的患者(43.6% vs 24.6%)。已建立的基于基因组的免疫肿瘤学分类(EGIC)方案能够有效识别接受抗PD-1联合化疗的长期生存者(特瑞普利单抗组3年OS率为48.9%,安慰剂组为16.8%)。在延长的随访期内未发现新的安全性信号。
研究结论
JUPITER-06研究的最终分析证实,特瑞普利单抗联合化疗作为晚期/转移性ESCC的一线治疗具有持续的OS获益,且安全性可控。ccTMB和扩展的EGIC方案在抗PD-1联合治疗中显示出对长期生存具有良好的预测价值。
英文标题:TOURMALINE study of durvalumab (D) in combination with gemcitabine (G)-based chemotherapy in advanced biliary tract cancer (aBTC): early safety and efficacy results in participants (pts) from Asia
中文标题:度伐利尤单抗(D)联合吉西他滨(G)为基础化疗治疗晚期胆道癌(aBTC)的TOURMALINE研究:亚洲参与者的早期安全性和有效性结果
讲者:Do-Youn Oh(首尔,韩国)
研究背景
正在进行的全球性、单臂、IIIb期TOURMALINE研究(NCT05771480)评估了D+G为基础化疗作为aBTC一线治疗的安全性和有效性。本研究报告了亚洲亚组患者的早期安全性和有效性数据。
研究方法
患者接受D 1500 mg(首次输注:60分钟;后续输注:30分钟)联合研究者选择的G为基础化疗[D+G单药或联合奥沙利铂(O)、卡铂(C)、顺铂(cis)、替加氟-吉美拉西-奥替拉西(S-1)、cis+S-1或cis+白蛋白结合型紫杉醇(P)]。主要终点是治疗开始后6个月内可能与任何研究治疗相关的3/4级不良事件(AEs)发生率。当全球≥60例患者随访≥6个月时进行中期分析[数据截止日期(DCO):2024年8月7日]。本研究评估了亚洲患者的安全性和客观缓解率(ORR;根据实体瘤疗效评价标准1.1版)。
研究结果
在本次中期分析中,121例患者接受了治疗,其中90例来自亚洲[韩国(n=49);日本(n=36);新加坡(n=5)]。亚洲患者的中位年龄为66.5岁,接受了中位6.0个周期的D治疗;中位安全性随访时间为6.0个月。在亚洲患者中,治疗开始后6个月内发生任何研究治疗相关的3/4级不良事件(PRAEs)的比例为53.3%(95%Cl 42.51%~63.93%)(表)。总体而言,2例亚洲患者发生了导致死亡的不良事件,但被评估为与任何研究治疗无关;11例患者因不良事件导致任何研究治疗停药。亚洲患者(n=90)的中期ORR为26.7%(95%CI,17.9%~37.0%)。
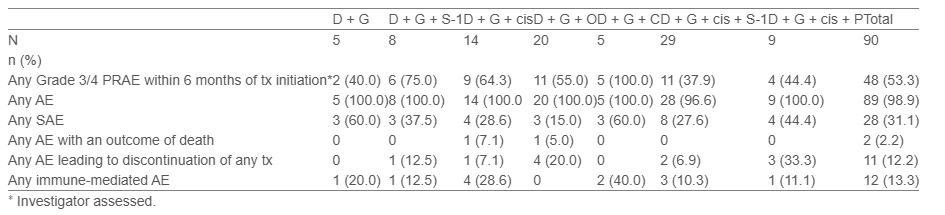
研究结论
在亚洲患者中,所有研究治疗的安全性特征均可控。亚洲患者的安全性结果与全球TOURMALINE人群和TOPAZ-1研究相当。中期ORR结果令人鼓舞。
排版编辑:QTT











 苏公网安备32059002004080号
苏公网安备32059002004080号


