孟冬跨津湘,越蓉宁,会师京邑
五地巡回传薪火
盛会邀泰斗,析进展,直面挑战
群贤系统论慢淋
加州大学圣地亚哥分校摩尔斯癌症中心杰出医学教授、血液恶性肿瘤项目联合 主任、新型治疗中心主任
Evelyn 和 Edwin Tasch 癌症研究中心教授
UCSD 癌症研究中心副主任(2000-2023)
慢性淋巴细胞白血病研究联盟(CLLRC)首席研究员
国际慢性淋巴细胞白血病研讨会(iwCLL)主席(2024)
两度荣获白血病与淋巴瘤协会SCOR研究基金和NIH杰出研究奖( MERIT Award )
Rai/Binet白血病研究杰出贡献奖和血液肿瘤学会Michael J. Keating杰出成就奖
发表600+篇论文,包括《 NEJM》《 Nature》《Blood》等顶级期刊;参编《Williams Hematology》权威教材
致力于推动全球CLL诊疗进展与患者预后改善
国际间的临床经验分享与科研协作,对于持续提升慢性淋巴细胞白血病(CLL)的临床管理水平及改善患者预后具有重要意义。秉承此宗旨,由北京健康促进会策划并主办的“淋听新思路”淋巴瘤中外巡讲系列活动于2025年11月11日~16日,在天津、长沙、成都、南京及北京五地成功巡回举办。
本次巡讲荣幸邀请到加州大学圣地亚哥分校的Thomas J. Kipps教授,其围绕CLL诊疗领域的最新进展与临床挑战进行了系统性的阐述。Kipps教授还与国内顶尖专家学者们展开了深度交流,共同致力于构建一个高水平的学术平台,旨在促进中外专家间的深入研讨与未来合作。【肿瘤资讯】现将此次系列活动的核心学术精粹整理如下。
跨海对话
共寻临床难题破局之道

深入解析CLL
从生物学机制到耐药治疗策略的演进
CLL从其生物学特性来看是一种独特的疾病。得益于对CLL生物学机制的深入理解,其诊断和治疗在过去十年间取得了显著的进展。研究者基于这些理解开发出新的治疗工具,从而更有效地治疗CLL患者,极大改善了其生存质量。尽管如此,CLL临床治疗仍面临诸多挑战。
🌟 CLL的生物学基础:从细胞起源到“自主信号”
CLL的临床异质性源于其深刻的生物学差异。
1. CLL生物学异质性:细胞起源与表观遗传学
CLL的起源细胞可分为两大亚群:
● 生发中心前B细胞(Pre-GC):免疫球蛋白(Ig)基因未发生突变,即U-CLL。
● 生发中心后B细胞(Post-GC):Ig基因经历了体细胞高频突变(SHM),即M-CLL。
IGHV突变状态是CLL重要的预后标志物之一,并可作为细胞起源的替代标记。CLL B细胞表达的Ig受到了高度限制,表明存在针对“具有最佳Ig受体信号”的B细胞的选择压力。进一步研究发现,CLL可根据DNA甲基化图谱聚类为三个截然不同的表观遗传学亚群:
● LP-CLL(低程序化CLL):与IGHV未突变(U-CLL)相关。
● HP-CLL(高程序化CLL):与IGHV突变型(M-CLL)相关。
● IP-CLL(中程序化CLL):与轻度突变的IGHV相关。
2. 刻板型BCR与“自主信号”
CLL的一个核心特征是B细胞受体(BCR)的高度“刻板化”(Stereotyped)。尽管Ig的潜在多样性高达数亿种,但近30%的CLL患者表达具有保守特征(尤其是HCDR3区域)的刻板型BCR。特定的刻板型亚群与CLL的临床预后密切相关。例如:
● Subset #6:通常使用IGHV1-69基因(>98%同源性),常与IGKV3-20、VL3-09或VK1-39轻链配对。
● Subset #2:通常使用IGHV3-21基因,伴有有限的体细胞突变(通常为97-98%同源性)。 值得注意的是,IGHV3-21(Subset #2)虽然存在轻度突变,但其临床表现却如同U-CLL一样具有侵袭性。
3. 信号通路:非抗原依赖的“自主信号”
CLL细胞的BCR信号通路激活存在两种模式:抗原诱导的信号传导和非抗原依赖的“自主信号”。研究发现,许多CLL(尤其是刻板型CLL)的BCR具有不依赖外部抗原的自主信号激活能力。
Subset #2(IGHV3-21/IGLV3-21)是自主信号的典型代表,其关键机制在于IGLV3-21轻链J-C区交界处的一个特定体细胞突变——R110(第110位甘氨酸突变为精氨酸)。研究证实,获得R110突变足以通过同型BCR-BCR相互作用,产生强大的、不依赖配体(抗原)的自主BCR信号。使用钙流(Ca-flux)模型(TKO细胞系)的实验清晰地显示,表达R110的BCR(IGLV3-21 R110)在加入4-OHT(激活SLP65)后立刻产生强烈的钙流信号,而野生型G110则无此反应。这种自主信号解释了为何IGHV3-21(Subset #2)患者的临床进程更具侵袭性。
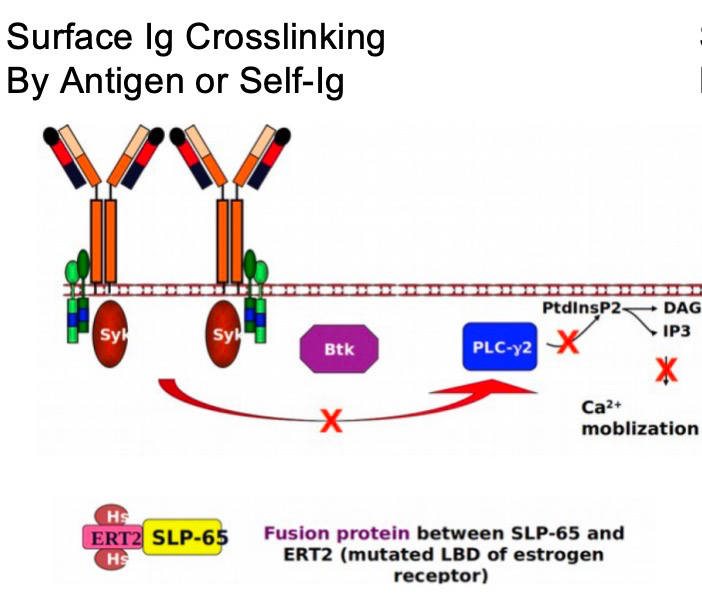
4. 案例分享(一):IVIG与自主信号抑制的新启示
Kipps教授接诊过的1例U-CLL患者伴有IGHV5-51未突变和IGLV3-25未突变。该患者因低丙种球蛋白血症接受了静脉注射免疫球蛋白(IVIG)治疗(每4周给药30克)。在未接受任何其他抗肿瘤治疗的情况下,该患者的绝对淋巴细胞计数(ALC)在IVIG治疗开始后持续下降。
● 骨髓活检(BM Bx)#1(2020年2月): 骨髓高度增生,CLL细胞浸润达70-80%,伴有假性增殖中心。
● BM Bx #2(2021年2月): 仅有少量淋巴样聚集,流式细胞术检测CLL细胞占0.62%。
● BM Bx #3(2022年3月): 流式细胞术检测达到MRD阴性(uMRD4,<10-4),且无淋巴样聚集。
该患者仅凭IVIG治疗就达到了uMRD4的完全缓解(CR)。为了探究这一现象,Kipps教授团队使用患者CLL细胞构建了TKO细胞模型。在未添加IgG的情况下,TJK1195细胞在4-OHT诱导下显示出强烈的自主信号(钙流)。然而,当在分析前向细胞中加入可溶性IgG(模拟IVIG)后,这种自主BCR信号被显著抑制。计算显示,该信号强度从0.61(100%)降至0.37(61%)。这种抑制在R110(Subset #2)模型中也得到了验证。并且,这种抑制对于表面Ig(sIg)表达水平较低的细胞(CLL的共同特征)效果最强。
总体而言,CLL B细胞常表达刻板型Ig受体,表明存在选择压力。而可溶性IgG或IVIG可以抑制这种自主BCR信号。因此,Kipps教授团队提出一个假说,即CLL患者中常见的低丙种球蛋白血症,可能通过“解除抑制”来增强自主BCR信号,从而加速疾病进展。因此,IVIG的使用可能不仅是预防感染,还具有独立的抗肿瘤治疗益处。
🌟 CLL治疗的进展:BTKi的突破与优化
BCR信号通路在CLL的发病机制中至关重要,而BTK抑制剂(BTKi)正是通过抑制该通路中的关键蛋白BTK来发挥作用。
1. 一代BTKi的卓越疗效
● 一代BTKi治疗CLL已显示出卓越疗效。在RESONATE-2研究中,相较于接受苯丁酸氮芥治疗的患者,接受一代BTKi一线治疗的CLL患者预后显著改善。7年随访数据显示,一代BTKi组预估的7年无进展生存(PFS)率为59%(苯丁酸氮芥组为9%),预估的7年总生存(OS)率为78%。值得注意的是,与化学免疫疗法不同,无论CLL患者的免疫球蛋白(IG)基因突变状态如何(IGHV突变型或未突变型),其对一代BTKi的应答同样良好。
● 后续汇总分析(RESONATE-2、ECOG-1912、iLLUMINATE研究)数据显示,接受一代BTKi一线治疗的CLL患者,其OS与年龄匹配的正常人群(≥65岁)相近,这无疑是BTKi治疗的巨大成功。
2. 新一代BTKi的确证与超越
初治CLL(1L)
● 在初治CLL患者中,ELEVATE-TN试验显示,中位随访74.5个月时,新一代共价BTKi+CD20单抗组和新一代共价BTKi组的中位PFS均未达到(NR),显著优于化学免疫治疗组的27.8个月(均P<0.0001)。72个月PFS率方面,新一代共价BTKi+CD20单抗组为78%,新一代共价BTKi组为62%,化学免疫治疗组仅17%。与化学免疫治疗组相比,新一代共价BTKi+CD20单抗组和新一代共价BTKi组患者的疾病进展或死亡风险分别降低86%(风险比HR=0.14)和76%(HR=0.24)。
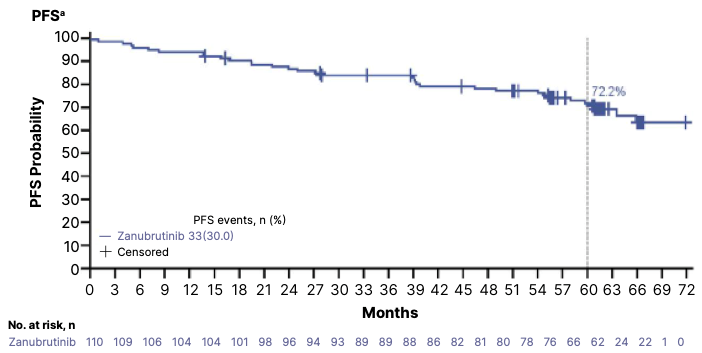
● 新一代共价BTKi泽布替尼在初治高危CLL患者中也显示了持久的疗效。SEQUOIA研究的数据显示,在110例接受泽布替尼治疗的伴有del(17p)的初治CLL患者中,中位随访68个月时,5年(60个月)PFS率达到了72.2%。
复发/难治性CLL(R/R CLL)
● 在R/R CLL患者中,ELEVATE-R/R研究头对头比较了新一代共价BTKi与一代共价BTKi的疗效。该研究结果显示,在R/R CLL患者中,两者的PFS获益相似,但新一代BTKi组的多种不良事件(如腹泻、高血压、房颤)发生率在数值上更低。
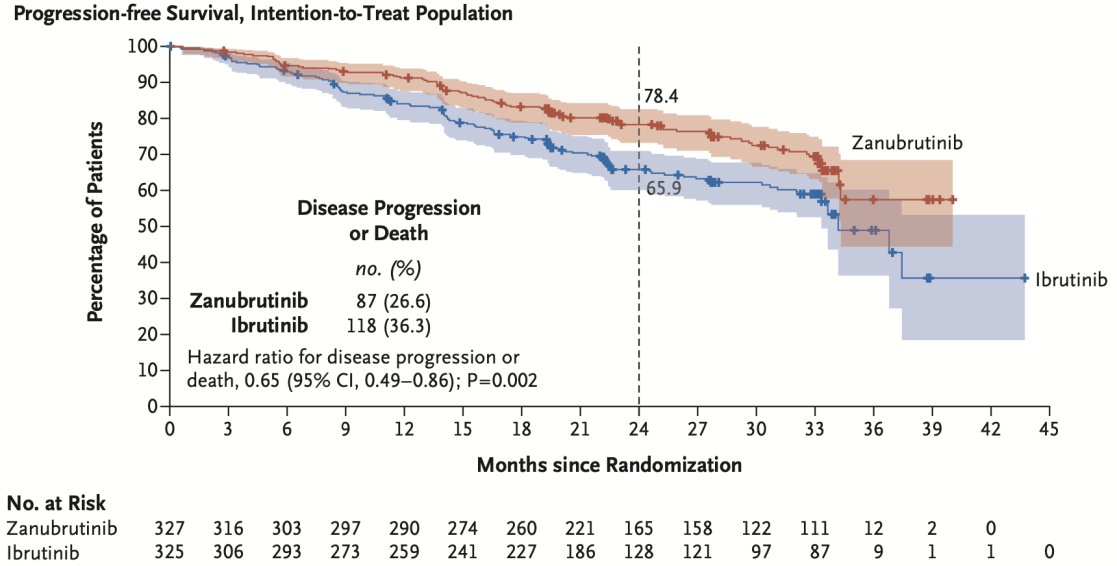
● III期ALPINE研究在652例既往接受过≥1线治疗的R/R CLL/SLL患者中,头对头比较了新一代共价BTKi泽布替尼与一代BTKi的疗效。两组患者的基线特征均衡,中位既往治疗线数为1,约73%的患者为IGHV未突变,超20%的患者携带del(17p)或TP53突变。结果显示,泽布替尼组的PFS显著优于一代BTKi组。在中位随访24个月时,泽布替尼组的PFS率为78.4%,而一代BTKi组为65.9%(HR=0.65,P=0.002)。
🌟 临床核心挑战:靶向治疗的耐药机制
1. 案例分享(二):一个揭示连续耐药的典型病例
在此次巡讲中,Kipps教授分享了另1例其诊治过的病例,该病例凸显了目前在临床实践中面临的挑战。该例患者在66岁时确诊CLL伴 IGHV1-69未突变和 trisomy 12。
该患者首先接受了苯达莫司汀联合利妥昔单抗的化学免疫疗法(BR方案),并获得CR。然而,该患者在两年后复发,并检测到TP53基因的新发突变(G244S)。TP53是一个非常重要的抑癌基因,该突变的出现通常预示着CLL患者的预后不良,疾病更具侵袭性。
随后,该患者接受了BCL-2抑制剂维奈克拉联合CD20单抗奥妥珠单抗方案的治疗,达到了部分缓解(PR)但MRD阳性。该患者后续继续使用维奈克拉单药进行维持治疗,直至出现耐药并进展。
鉴于TP53突变,中心医生为该患者换用了共价BTKi治疗,该患者获得了良好的缓解,白血病细胞计数下降。但随后,患者在BTK基因的C481S位点出现了突变,导致共价BTKi失效,疾病再次进展。
对此,中心医生换用新一代非共价BTKi,该患者再次获得良好缓解。然而,短时间内,患者的BTK又出现了新的T474I位点突变,导致疾病进展。最后,中心医生尝试了BTK降解剂对患者进行治疗。虽然患者有所缓解,但很快又出现了A428D位点的新突变。
Kipps教授总结道,在此病例中,每当中心医生对其进行一次治疗,患者就会产生新的突变,且这些突变发生在不同的亚克隆中。这正是临床医生在处理伴有del(17p)或TP53突变的侵袭性白血病时所面临的困境——CLL可不断产生赋予治疗耐药性的新突变。
2. 探究BTKi治疗疗效不佳的根本原因:从依从性到生物学突变
在CLL中,谈及BTKi治疗失败或PFS获益不理想,主要有两大类原因。
● 第一类可能导致CLL BTKi治疗失败或效果不理想的原因是患者依从性不佳或药物耐受性不佳,例如出于不良反应(如一代BTKi治疗相关的瘀伤、高血压或心律失常)或经济成本的考虑,导致患者漏服或停药。而新一代BTKi(如泽布替尼)的不良反应通常更少。在药代动力学方面,泽布替尼的中位达峰时间(Tmax)为2小时,半衰期为2-4小时,其BTK抑制的IC50约为2nM,且无活性代谢产物。
● 第二类可能导致CLL BTKi治疗失败或效果不理想的原因为耐药,即白血病细胞内部发生了体细胞突变,导致药物无法发挥良好的疗效。在共价BTKi耐药患者中,约80%的患者可检测到BTK和/或PLCG2突变。
█ 共价BTKi耐药: 共价BTKi主要依赖于BTK蛋白C481位点形成共价键,而其治疗中最常见的耐药突变即C481S突变。此外,不同的共价BTKi可能诱导产生不同的耐药突变谱。此外,伴有del(17p)/TP53突变的CLL,其BTK突变亚克隆似乎扩增得更快。
█ 非共价BTKi耐药: 针对C481S突变,新一代非共价(可逆)BTKi应运而生,其不依赖C481位点,因此能有效治疗C481S突变耐药的CLL患者。然而,如前述病例所示,非共价BTKi仍可能因T474或L528等位点突变而耐药。
█ BTK降解剂耐药: 对于耐药的CLL患者,研究者尝试清除BTK蛋白,即PROTACs(蛋白水解靶向嵌合体)或BTK降解剂(如BGB-16673)的治疗策略。BGB-16673的早期研究显示,即使在既往BTKi治疗失败的CLL患者中,BTK降解剂治疗的总缓解率(ORR)也达到了67%,且未观察到高血压或房颤。然而,由于BTK降解剂也需要与BTK的结合位点相结合,而这个位点恰好在A428附近。基于前述病例,该患者在接受BTK降解剂治疗后,A428D突变导致了空间位阻,使得降解剂无法钩住BTK,从而产生耐药。
3. BCL2抑制剂的耐药机制
在CLL治疗中,另一类重要药物是可促使细胞凋亡的BCL-2抑制剂如维奈克拉。通过研究发现,BCL-2抑制剂维奈克拉耐药的机制主要包括BCL2家族其他抗凋亡成员(如MCL1, BCL-XL)的表达上调,或在维奈克拉与BCL-2结合的BH3结合槽区域发生突变如最常见为G101V和D103Y。
🌟 未来展望:MRD指导下的联合治疗策略
1. MRD未来可作为指导治疗的灯塔
在CLL联合治疗中,微小残留病(MRD)监测正被用作PFS的替代终点。CAPTIVATE研究发现,治疗结束时(EOT)CLL患者的MRD状态比治疗过程中的MRD状态(如C7)具有更强的预后预测价值。
具体而言,EOT时达到MRD阴性(uMRD,如uMRD4 <10-4)的CLL患者,其5.5年PFS率显著更优(uMRD4组71% vs dMRD组47%)。这种预测价值在不同亚组中均成立,即使是携带del(17p)/TP53突变的高危CLL患者,EOT时达到uMRD4也能带来更好的PFS(5.5年PFS率 47% vs MRD阳性组 0%)。对于IGHV未突变(uIGHV)的患者,EOT时uMRD4患者的5.5年PFS率为66%,而MRD阳性者仅为29%。此外,患者EOT的外周血MRD状态对长期PFS的预测价值强于C7时的MRD状态。在外周血单个核细胞(PBMC)中,C7时有54%的患者达到了uMRD,EOT时该比例为69%;在EOT,骨髓uMRD4率同为69%。
这引出了MRD指导的CLL治疗策略。FLAIR研究探索了MRD指导的共价BTKi+BCL-2抑制剂方案对比FCR方案或一代BTKi单药治疗CLL的疗效。结果显示,共价BTKi+BCL-2抑制剂组(采用MRD指导停药)的PFS显著优于FCR方案组和一代BTKi单药组(5年PFS率:93.9% vs 58.1% vs 79.0%)。
2. 联合治疗:减少耐药突变的新途径
当BTKi与维奈克拉联合使用时,BH3结合槽区域(BCL2)突变的发生率有所降低。在CAPTIVATE研究固定疗程(FD)治疗后发生复发性疾病进展(PD)且可评估的40例CLL患者中,仅1例患者携带获得性耐药相关突变。该突变为BCL-2基因突变,具体为A113G,未在BTK或PLCG2中检测到临床相关的突变。而MD Anderson癌症中心开展的研究中,中位随访38.9个月时,25例发生PD且样本可分析的CLL患者中,未在BTK、PLCG2或BCL2中检测到既往报道的耐药相关突变。
🌟 总结与未来展望
在当前的CLL治疗中,新一代BTKi泽布替尼已占据重要地位。根据NCCN指南,泽布替尼单药已被列为初治患者的1类优选方案之一。而在既往提出的CLL治疗逻辑中,无论患者是否携带del(17p)或TP53突变,以及IGHV突变状态如何,泽布替尼均是活动性疾病的一线治疗选择之一。对于CLL耐药风险的管理,未来的重要探索方向包括优化联合治疗(BTKi+BCL2抑制剂)、合理的药物测序,以及通过实时监测突变来指导治疗。
激荡新思
中外专家共探临床挑战
2025/11/11|天津站
本次巡讲首场会议在天津举行。会议伊始,大会主席、中国医学科学院血液病医院(中国医学科学院血液学研究所)邱录贵教授进行了开场致辞。随后的主旨报告环节,首先, Thomas J. Kipps 教授带来了题为《CLL 治疗研究新进展》的权威报告,系统回顾了 CLL 领域的国际前沿进展与关键数据。在此基础上,为实现国际前沿与本土进展的紧密结合,在中国医学科学院血液病医院(中国医学科学院血液学研究所)易树华教授的主持下,中国医学科学院血液病医院(中国医学科学院血液学研究所)阎禹廷医生紧接着分享了中心在 CLL 领域的最新科研成果。在最后的讨论环节,与会专家们针对两位教授的精彩分享,并紧密围绕CLL临床实践中的核心重难点问题展开了热烈而深入的学术研讨,在思想的碰撞中激荡出了新的火花。

2025/11/12|长沙站
继首站会议圆满成功后,CLL学术巡讲的热潮延续至长沙。会议之初,大会主席、中南大学湘雅二医院的吕奔院长与彭宏凌教授联袂致开幕辞。在随后的主旨报告环节,彭宏凌教授亲自担纲主持。国际学者 Thomas J. Kipps教授带来了题为《CLL治疗的研究新进展》的精彩报告。为了实现国际前沿与本土数据的深度对话,在中南大学湘雅二医院盛岳教授的主持下,中南大学湘雅二医院的李姮教授进行了中心数据分享。在学术研讨环节,由彭宏凌教授和盛岳教授主持,与会专家们围绕Kipps教授的国际前沿报告与李姮教授的本土数据,针对CLL临床实践中亟待解决的难题展开了精彩的讨论,现场学术氛围浓厚,互动频频。

2025/11/13|成都站
CLL学术巡讲的第三场高水平的学术研讨会在成都隆重召开。首先,大会主席、四川大学华西医院的牛挺教授致开幕辞。在随后的主旨报告环节,牛挺教授亲自担纲主持。国际学者Thomas J. Kipps教授带来了题为《CLL生物学进展》的重磅报告。四川大学华西医院的沈恺教授紧接着分享了《华西中心CLL诊疗经验》。在最后的学术研讨环节,成都市第三人民医院的谭竞教授受邀主持。与会专家们的热情被充分点燃,大家紧密围绕Kipps教授报告中的CLL生物学洞见与沈恺教授分享的诊疗经验,展开了精彩纷呈的讨论。现场提问踊跃,学术氛围浓郁,在思想的碰撞中为CLL的精准诊疗带来了新的启迪。

2025/11/14|南京站
CLL学术巡讲的第四站学术盛会,近日在南京隆重召开。会议伊始,大会主席、南京医科大学第一附属医院(江苏省人民医院)范磊教授与李建勇教授共同致开幕辞,为本次高水平的学术交流奠定了基调。在随后的主旨报告环节,两位国际顶尖学者联袂登场。首先,在范磊教授的主持下,国际学者Thomas J. Kipps教授带来了题为《CLL生物学进展》的重磅报告。紧接着,在南京医科大学第一附属医院(江苏省人民医院)徐卫教授的主持下,来自意大利圣拉斐尔生命健康大学的Paolo Ghia教授分享了《CLL治疗新进展》。
随后,本土经验分享环节同样精彩。在南京医科大学第一附属医院(江苏省人民医院)朱华渊教授的主持下,南京医科大学第一附属医院(江苏省人民医院)的缪祎教授和梁金花教授代表中心,分享了淋巴瘤专科宝贵的学术成果。会议最后的讨论环节将学术氛围推向高潮。与会专家们的热情被充分点燃,大家紧密围绕当日教授们分享的生物学洞见与临床前沿策略,展开了精彩纷呈的讨论,现场互动热烈。

2025/11/16|北京站
CLL学术巡讲迎来了其收官之站——北京站。会议伊始,大会联合主席、北京大学血液病研究所的杨申淼教授与中国医学科学院肿瘤医院的应志涛教授联袂致开幕辞。在随后的主旨报告环节,首先由杨申淼教授担纲主持,Thomas J. Kipps教授带来了题为《CLL的治疗进展》的重磅报告,系统梳理了全球前沿的CLL诊疗策略。紧接着,为了实现国际视野与本土实践的深度融合,杨申淼教授也登台分享了《BTKi在中国治疗CLL的十年》研究数据,展现了中国学者的临床智慧与宝贵探索。会议的讨论环节由应志涛教授主持。与会专家们热情高涨,大家紧密围绕Kipps教授的国际进展与杨申淼教授的本土经验,就CLL临床核心难题展开了深入探讨,为整个巡讲系列画上了圆满的句号。

智慧交锋
全球经验共解诊疗困局
洞察一
面对CLL患者BTKi早期耐药,临床医生的首要步骤是必须严格甄别耐药的根本原因,这直接决定了后续的治疗路径。首先,必须通过深入且坦诚的沟通,排除因药物不耐受、经济负担高昂或个人因素导致的依从性不佳;如果根本的依从性问题未解决,即便换用BCL-2抑制剂也可能再次治疗失败。若排除了依从性因素,则必须假定为生物学耐药,并立即对CLL患者进行全面的生物学再评估,包括NGS和细胞遗传学检测,以明确突变类型。尤其需要警惕的是,激活型PLCG2突变位于BTK信号通路的下游,其出现将导致包括共价、非共价BTKi及BTK降解剂在内的药物失效,此时必须转换其他机制的治疗(如BCL-2抑制剂或免疫疗法)。对于已确认生物学耐药的CLL,后续的挽救治疗策略包括CAR-T细胞疗法、双特异性抗体或异基因造血干细胞移植。但必须强调,CAR-T细胞疗法等不应被用作“最后的治疗手段”,因为在疾病完全失控时,CLL患者的T细胞往往处于“耗竭”状态,导致疗效不佳;因此,在T细胞采集前,有必要通过“桥接治疗”来有效控制肿瘤负荷,以确保CLL患者的T细胞健康度与最终的治疗效果。
洞察二
AI(人工智能)在新药研发领域可提供很多帮助,尤其是在加速对蛋白晶体结构的了解和认识方面,这能够推动整个新药的研发进度,目前也的确有团队和公司正在利用AI技术开展相关工作。除此之外,一个非常重要的应用点在于理解蛋白突变及其耐药机制。研究者需要持续关注的重点是,突变虽然可能导致CLL耐药,但在出现耐药后,并不一定意味着信号通路完全失效,BTK信号仍可能通过,使通路保留部分功能。AI可以帮助研究这些复杂的机制,比如探索需要达到何种突变阈值才会导致信号通路彻底失去作用,或者在何种程度上信号通路仍保留功能。此外,AI技术也能支持研究者深入理解抑制机制,从而帮助其设计更精准的靶向药物,同时需要警惕AI所带来的"幻觉",避免被虚假的信息干扰。
洞察三
针对CLL中del(17p)和TP53突变的VAF(变异等位基因频率),并非所有del(17p)都具有相同的预后意义,其VAF阈值是关键因素。在早期的研究中已认识到,VAF高于20%的del(17p)与CLL不良预后显著相关,而VAF低于此阈值的CLL患者预后似乎没有非常差;这背后的生物学机制可能在于,高VAF的del(17p)(如>80%)往往与TP53突变高度相关(即“双重打击”),而低VAF(如<10%-20%)的del(17p)则很少伴有TP53突变。因此,临床研究在报告时必须明确区分VAF高低,以避免因混入大量低VAF患者而得出误导性的结论。
洞察四
在BTKi耐药后选择后续治疗时,Kipps教授建议先明确CLL患者的具体突变类型。因此,进行NGS检测至关重要,这可以让临床医生快速预测出CLL患者可能会对哪种药物耐药。
洞察五
B细胞抗体的表达是一个高度随机的过程,涉及基因重排、体细胞高频突变和组合多样性,使其能识别多种物质。然而,一个值得关注的真实生物学现象是“自主BCR信号”。一种假说是(“独特型网络理论”,由诺贝尔奖得主N.K.Jerne于1974年提出),在B细胞谱系形成过程中,部分抗体可能获得了识别细胞表面其他抗体的能力,从而提供一种不依赖于抗原的持续性刺激信号;只要这种刺激不过高,其可能足以维持该B细胞克隆的存活。目前,研究尚不清楚有多少正常的B细胞在骨髓中会进行自主信号传导,这或许是其在微环境中维持刺激的一种方式。同时,微环境中的其他因素也可能通过受体间的“串扰”(crosstalk)来调节Ig信号,使其更有效地在微环境中激活B细胞。这一概念对CLL Subset 2(R110)亚群尤为重要,该亚群具有强大的自主信号,因此对BTKi反应良好。
总结
此次“淋听新思路”中外巡讲为中国CLL诊疗带来了深刻的临床启示,其核心价值在于实现了国际顶尖生物学洞见与中国本土临床经验的深度融合。会议一方面从BCR“自主信号”等前沿机制出发,结合ALPINE、SEQUOIA等关键研究,系统论证了新一代BTKi如泽布替尼在CLL治疗中的地位。另一方面,通过贯穿全程的典型病例,生动揭示了高危CLL(TP53+)面对多代BTKi(共价、非共价、降解剂)时不断演进的序贯耐药机制。
此外,会议不仅为中国学者提供了分享本土数据、验证一线治疗新标准的宝贵平台,更明确了临床未来必须通过NGS动态监测以指导后续治疗,并积极探索MRD指导下的联合用药,以优化中国患者的全程管理并克服耐药挑战。展望未来,这种国际对话与本土实践的结合,将极大推动中国CLL个体化治疗的发展,为患者带来更长期的生存获益。
排版编辑:肿瘤资讯-Vickey











 苏公网安备32059002004080号
苏公网安备32059002004080号


