
专家简历
复旦大学附属中山医院
肺癌亚专科成员
CSCO成员、IASLC会员
目前负责中山医院肺癌免疫专科门诊
参与多项基金研究及国际多中心临床试验
发表多篇SCI及核心期刊论文
引言
肺癌是我国发病率和死亡率均居首位的恶性肿瘤,而骨是肺癌常见的转移部位之一1,2。既往我们对骨转移的认知主要聚焦在引发骨痛等症状,以及严重的骨并发症,影响患者生活质量和生存预后2,但这一认知已经逐渐被新观点迭代。
传统上,骨转移被视为由“核因子-κB受体活化因子配体(RANKL)恶性循环”驱动的局部骨骼问题3。然而,免疫治疗时代的新研究揭示了其全身性本质:骨转移的影响远超骨骼局部,已然是全身问题,骨转移可通过系统性免疫抑制影响全身治疗效果4。随着免疫治疗等新疗法的发展,晚期肺癌患者生存期不断延长,骨转移的累积发生率也随之升高。值得注意的是,尽管发生率升高,多项研究却报告伴有临床症状的患者比例呈现下降趋势,这一反差为肺癌骨转移的临床管理带来了新的挑战与机遇5-8。基于对骨转移认识的升级和骨转移疾病现状的变化,对于无症状患者进行规范化诊疗、系统性干预显得至关重要,这也将是未来实现骨转移患者“全身获益”的重要保障。
我们有幸邀请到复旦大学附属中山医院丁宁教授,深入探讨肺癌骨转移规范化诊疗之道。CCMTV现将丁宁教授对于如何预防骨相关事件、如何让骨保护治疗带来生存获益等经验总结整理成文,以飨读者。


肺癌骨转移的主要病理生理机制是什么?一旦发生骨转移通常会引发哪些典型的临床表现?
恶性肿瘤骨转移按病理特征可分为:溶骨型、成骨型和混合型。其中肺癌骨转移以溶骨性病变为主,核心机制为破骨细胞介导的骨吸收过度活跃9。随着研究的推进,学界逐渐认识到肺癌骨转移在发病机制上兼具“局部破坏”与“全身影响”的双重特性。
在局部层面,肺癌骨转移的核心是“RANKL恶性循环”。肿瘤细胞释放细胞因子激活骨骼中的成骨细胞,使其分泌大量RANKL,RANKL与核因子-κB受体活化因子受体(RANK)结合后,激活破骨细胞导致骨破坏;而骨破坏所释放的生长因子及破骨细胞分泌的细胞因子,又进一步促进肿瘤增殖,由此形成自我强化的恶性循环3,9,10。该循环持续改变骨骼微环境,最终导致进行性骨结构破坏6。
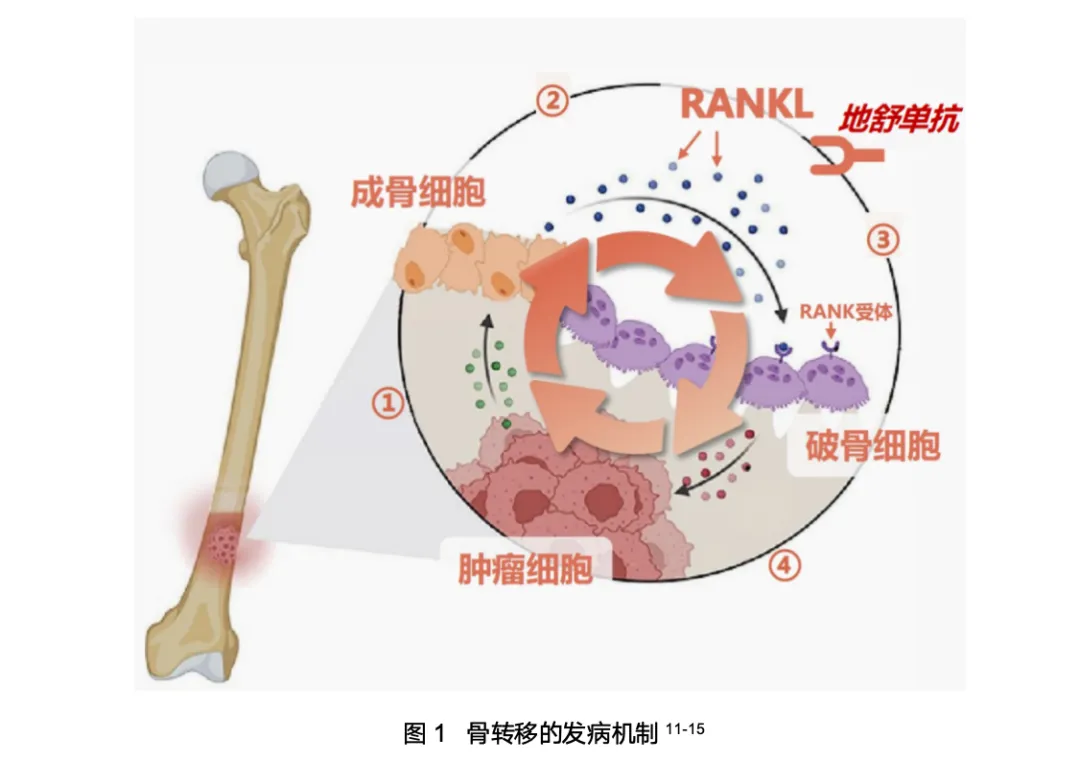
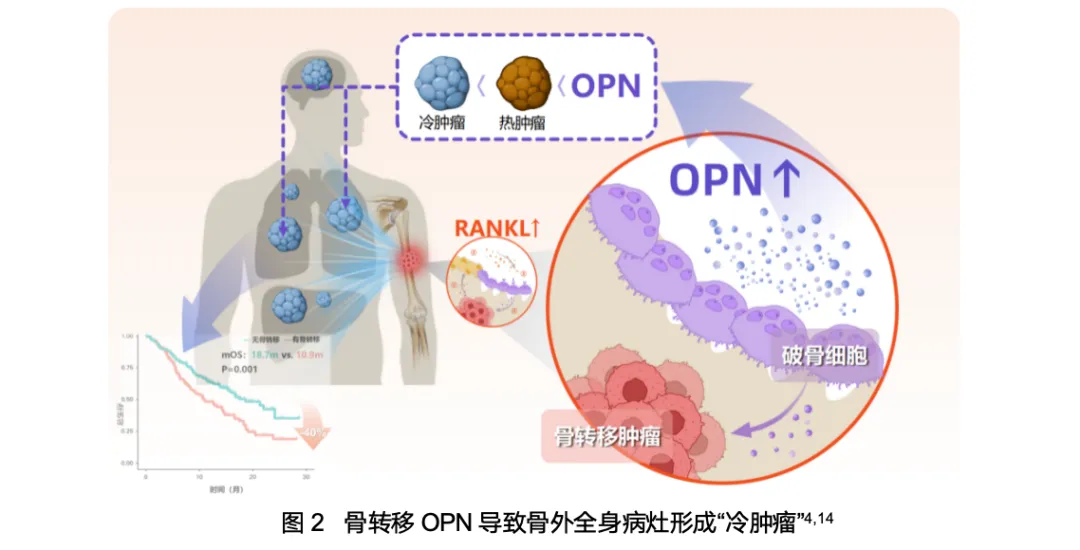
在全身层面,《Cancer Cell》发表的研究进一步揭示了其系统性危害。骨内的“RANKL恶性循环”使得过度活跃的破骨细胞分泌并释放大量骨桥蛋白(OPN),OPN随血液循环全身,改变骨外肿瘤微环境,导致抗肿瘤免疫细胞浸润大幅减少,而促肿瘤免疫细胞浸润大幅增加,进而诱导全身骨外病灶形成免疫“冷肿瘤”,最终削弱全身免疫治疗的整体疗效4,14,临床目前把这一新发现的机制称为“RANKL-OPN全身免疫抑制链”。值得注意的是,该免疫抑制作用与是否出现骨转移症状无关,就和RANKL恶性循环一样,只要骨转移存在,活跃的破骨细胞就在持续释放OPN,因此无论患者处于何种阶段,均应积极干预骨转移的OPN释放进程。
回归到临床表现,尽管骨痛是骨转移最典型的症状,但也仅有50%的骨转移患者会表现出明显临床症状。肺癌骨转移好发于脊柱和躯干骨近端9,一旦开始出现症状,多表现为固定部位、持续性加重,夜间尤为明显。病理性骨折或先兆骨折常为骨转移的首发并发症,约1/3患者以此为首发并发症而无原发癌症状。晚期还可出现乏力、消瘦、贫血、低热等全身症状,严重影响患者睡眠、情绪、日常生活能力和生存9。


并非所有骨转移患者都会出现临床表现,针对骨转移患者,尤其是无症状患者,您建议临床遵循怎样的诊断与治疗路径?
肺癌骨转移具有高度隐匿性,约半数患者早期无症状,这也是其危险性所在9。无论是长骨还是锥体转移的症状都有滞后性。长骨的神经多分布于骨骼外部的骨膜,等骨转移由内至外侵蚀到骨膜,产生明显痛觉,距离病理性骨折已经近在咫尺;脊柱骨转移痛觉多由椎管压迫导致,也需要转移瘤发展一段时间才会出现,一旦出现可能意味着椎体压缩性骨折与脊髓压迫即将发生,干预窗口期有限。综上,由于缺乏典型表现,无症状骨转移患者易被忽视,导致干预延迟,待出现明显骨痛或功能障碍时,骨骼结构多已严重破坏,甚至濒临病理性骨折与脊髓压迫等严重骨并发症16。因此,等待症状出现后再干预的传统模式存在明显局限性,可谓是“亡羊补牢”,但常常徒劳无功。同时,鉴于骨转移的全身性影响,无症状的骨转移仍在影响全身免疫系统,其对生存、对骨健康的威胁在无症状阶段就已经存在,因此我们认为对于骨转移诊疗应该改变对症驱动的“亡羊补牢”模式,向对因驱动的“防患于未然”模式转变,通过建立规范的诊疗路径向骨转移患者、尤其是无症状患者提供规范化的诊疗服务。
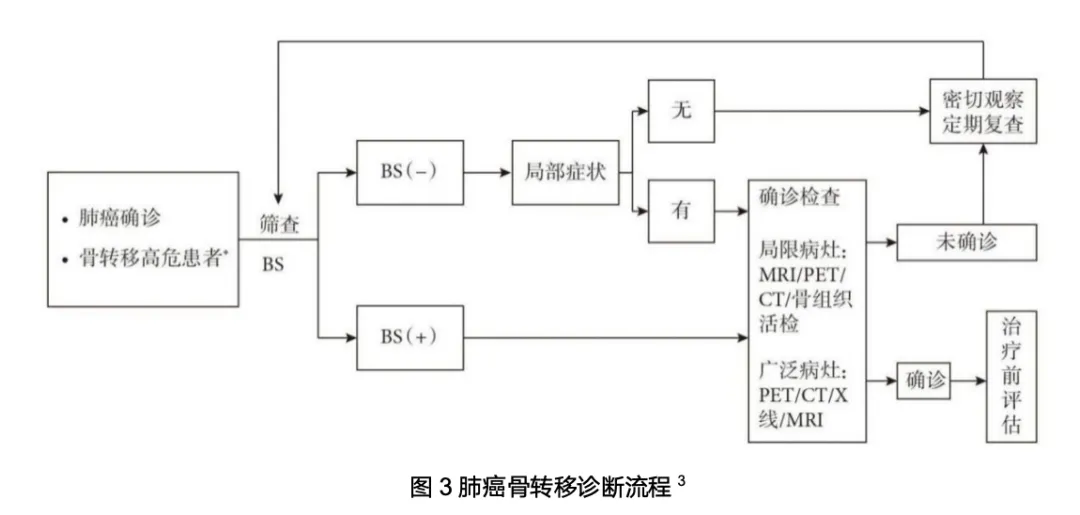
临床上对于肺癌骨转移的诊断主要采用“临床-影像-病理”三结合的模式。对于已确诊肺癌的患者,若出现骨痛、病理性骨折、脊髓或神经受压、碱性磷酸酶升高、高钙血症等症状,应当警惕肺癌骨转移的发生,并及时展开影像学检查9。对于无症状患者的筛查与监测,由于缺乏临床典型表现,规范的周期性影像学检查是核心手段。放射性核素骨显像(BS),又称骨扫描,因其兼具较高敏感性与特异性,常作为优选初筛方法,但其假阳性率值得关注,需联合其他影像技术提高诊断准确性。但考虑到骨转移对肺癌患者的危害,作为唯一针对骨的全身性检查,既往专家共识仍建议肺癌患者每年接受1~2次骨扫描,以确保及时发现、及时干预肺癌骨转移。PET/CT具有更高空间分辨率,不仅能全面评估骨骼受累状况,还能发现更小病灶,其诊断特异性显著优于BS。PET/MRI作为目前最高端的融合影像设备,虽性能优越,但价格限制了其常规应用。CT在显示骨皮质细节、识别骨质破坏及周围软组织肿块方面表现精准,但使用时切换到CT骨窗会更为精准,这点需要注意。MRI作为唯一能直接显示骨髓腔结构的成像方法,是检测骨髓病变最敏感的技术。X线检查则以其操作简便、费用低廉的特点,常用于有症状患者的初步评估3。此外,尽管临床主要通过影像学检查发现、确诊骨转移,但如果存在怀疑,病理活检仍是确诊的金标准2。总体而言,无症状骨转移需要临床更多关注,其从诊断到治疗的综合策略制定应得到重视,尤其是无症状骨转移面临确诊不及时、干预不及时的问题值得关注,特别是我们认识到骨转移对全身治疗都可能带来负面影响的当下,对骨转移治疗从对症到对因的转变是推动患者获益进一步提升的大趋势。


针对骨转移患者,特别是无症状患者,临床上如何干预?地舒单抗作为骨保护药物,如何发挥预防作用?除了药物治疗,在日常生活中还需注意哪些事项?
骨转移的治疗通常是在控制肺癌的基础上(如化疗、靶向或免疫治疗),联合放疗、手术、镇痛、骨保护药物及心理支持等多种手段9,以实现骨转移疾病控制、预防或延缓SREs、改善症状、提高患者生活质量、延长患者生存期的治疗目标2。
我们既往主要关注骨相关事件的预防,骨保护药物是预防SRE的基石。无论患者是否有症状,确诊骨转移后第一时间启用地舒单抗或双膦酸盐可有效控制骨破坏、推迟、减少SRE的发生,其中RANKL抑制剂地舒单抗在既往多项三期临床研究中取得了优于双膦酸盐的SRE预防效果3。
需要指出的是,对于无症状患者,及时骨保护治疗同样至关重要。我们前面已经提到,无症状并不代表没有骨破坏,可能只是骨破坏的阶段不同。此外,无症状并不代表骨转移灶对全身的免疫抑制就停止了,只要骨转移存在,就应该及时、规范使用骨保护药物在骨保护的同时逆转骨转移导致的骨外免疫抑制。
回到治疗方案上,传统的双磷酸盐和新一代的RANKL抑制剂地舒单抗都是主要的骨转移治疗药物,可有效缓解症状、控制骨破坏。临床指南也建议患者一旦确诊骨转移,无论有无症状,都应立即启动以地舒单抗为代表的骨保护药物治疗,而非待症状出现后再进行干预。
地舒单抗作为骨保护药物,具有局部和全身的双重作用。在局部对症治疗上,它可精准靶向RANKL,抑制破骨细胞的分化、活化,从源头上打破RANKL恶性循环3。相较于传统的双膦酸盐药物,地舒单抗靶点更上游,作用更直接,标本兼治,在延迟或降低实体瘤骨转移患者的SREs方面显示出更优的疗效14,17,18。并能延缓病理性骨折、脊髓压迫的发生时间,对无症、轻症人群同样带来获益3。
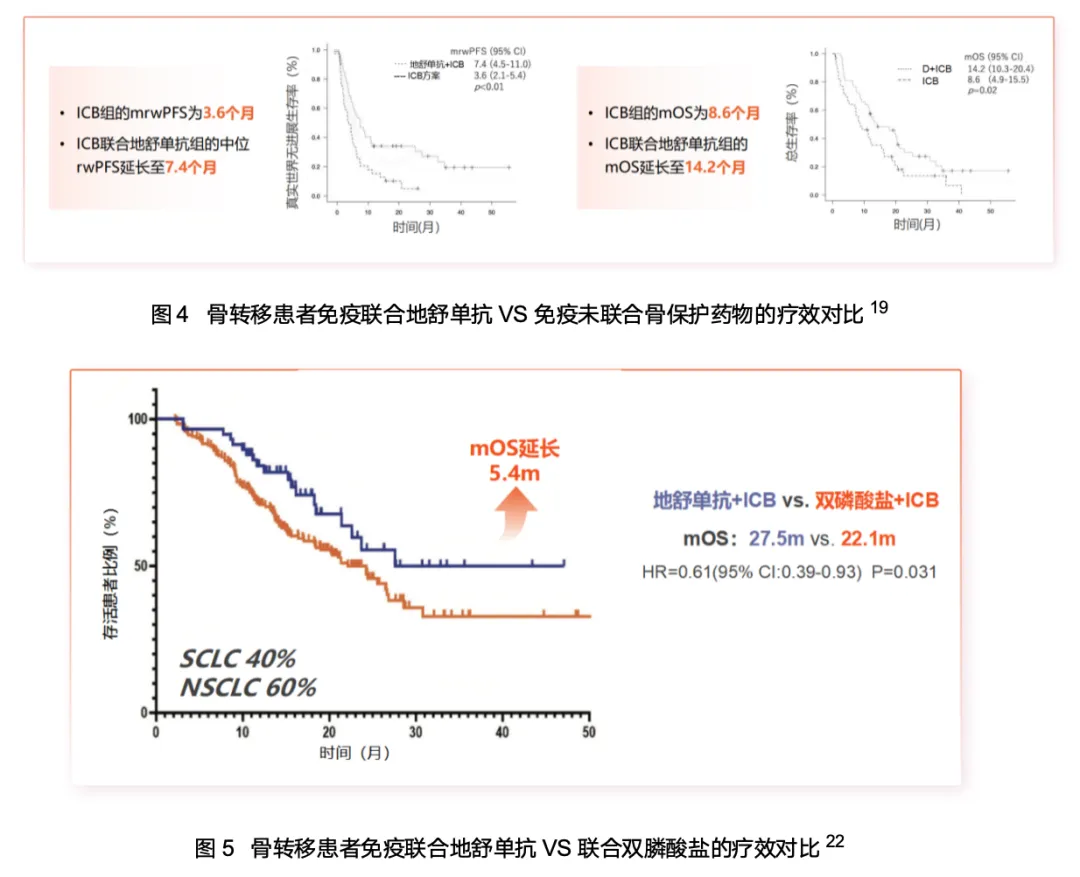
在全身免疫调节方面,免疫治疗联合地舒单抗展现出协同增效的潜力。多项前瞻性与回顾性研究均提示,该联合策略有望从源头阻断“RANKL-OPN全身免疫抑制链”,从而逆转免疫抑制、增强整体免疫疗效4,14,17。具体而言,与未使用骨保护药物或使用双膦酸盐的患者相比,联合地舒单抗可提升客观缓解率(ORR)、无进展生存期(PFS)和总生存期(OS)16,19-22;这也提示我们,对接受免疫治疗的骨转移患者,确诊骨转移后联合地舒单抗有助于更有效地控制由骨转移引发的全身性免疫抑制,从而实现逆转免疫抑制、协同增效的治疗目标,形成更为优化的临床治疗路径。
除了规范的药物治疗,综合干预与生活支持也同样重要。数据显示,癌症患者心理痛苦的总患病率达35.1%,其中肺癌患者的心理痛苦患病率最高9,因此,临床上除了常规治疗外,有效的心理支持,如认知-行为学、家庭支持以及 CALM(managing cancer and living meaningfully)治疗等,对于肺癌骨转移综合干预非常必要。这需要肿瘤临床医生与心理精神科医生建立好一个多学科合作团队,共同提升骨转移患者的生存质量9。
总结
肺癌作为全球范围内发病率和死亡率极高的恶性肿瘤,其进展至晚期常发生骨转移1。患者一旦发生骨转移,不仅整体治疗效果和预后变差,还会出现症状和骨并发症,影响患者生存的同时严重损害患者生活质量23。因此,积极的早期干预、早期发现至关重要。
骨转移自身难治、骨转移患者全身免疫治疗难治背后的核心机制,在于RANKL/RANK信号通路异常激活所驱动的局部恶性循环3,以及骨转移通过“RANKL-OPN全身免疫抑制链”引发的全身免疫抑制4。在此背景下,地舒单抗等骨保护药物不仅能从上游阻断RANKL/RANK信号通路,打破局部骨转移的恶性循环、逆转系统性免疫抑制,实现疾病的局部控制3,14,17,18;其与免疫治疗联合应用,还有望从源头阻断“RANKL-OPN免疫抑制链”,为无症状、有症状骨转移患者带来症状缓解与生存延长的全身性获益4,14,17。
在强化药物治疗基础上,结合心理支持等综合措施,构建多学科协作的全程化管理体系,可有效预防和延缓SREs发生,为患者建立坚实的骨骼保护屏障,最终实现长期生活质量的整体提升9。
1. 周鹏飞,周杰,张洪伟.肺癌骨转移的分子机制、生物标志物及治疗研究进展.中国胸心血管外科临床杂志,2025:1-7
2. 曹森,李文,张跃华,等. 肺癌骨转移诊疗新进展. 河北医科大学学报,2025,46(1):113-119.
3. 支修益,王洁,刘伦旭,等.中国肺癌骨转移临床诊疗指南(2024版).中国胸心血管外科临床杂志,2024,31(05):643-653.
4. Cheng JN, Jin Z, Su C, et al. Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts. Cancer Cell. 2025 , 43(6): 1093-1107.
5. Schirrmeister H, Glatting G, Hetzel J, et al. Prospective evaluation of the clinical value of planar bone scans, SPECT, and (18)F-labeled NaF PET in newly diagnosed lung cancer. J Nucl Med. 2001, 42(12): 1800-1804.
6. Kuchuk M, Kuchuk I, Sabri E, et al. The incidence and clinical impact of bone metastases in non-small cell lung cancer. Lung Cancer. 2015, 89(2): 197-202.
7. Kosteva J, Langer C. The changing landscape of the medical management of skeletal metastases in nonsmall cell lung cancer. Curr Opin Oncol. 2008, 20(2):155-161.
8. Saito M, Kage H, Ando T, et a. Prevalence of bone pain decreases as lymph node stage increases in nonsmall cell lung cancer patients. Curr Probl Cancer. 2019, 43(1): 86-91.
9. 董智,赵军,柳晨,等.肺癌骨转移诊疗专家共识(2019版).中国肺癌杂志,2019,22(04):187-207.
10. Coleman R. Bone-targeted agents and metastasis prevention.Cancers (Basel), 2022, 14(15): 3640.
11. Charles, Julia F., and Antonios O. Aliprantis. Trends in molecular medicine, 2014, 20(8): 449-459.
12. Wang M, Xia F, Wei Y, et al. Molecular mechanisms and clinical management of cancer bone metastasis. Bone research, 2020, 8(1): 30.
13. Gong Y, Qiu J, Ye J, et al. AZ-628 delays osteoarthritis progression via inhibiting the TNF-α-induced chondrocyte necroptosis and regulating osteoclast formation. International Immunopharmacology, 2022, 111: 109085.
14. Tae, Jong Hyun, and In Ho Chang. Investigative and Clinical Urology 64.3 (2023): 219.
15. Maurizi, Antonio, and Nadia Rucci. Cancers 10.7 (2018): 218
16. Zhen G, Fu Y, Zhang C, et al. Mechanisms of bone pain: Progress in research from bench to bedside. Bone Res. 2022, 10(1): 44.
17. Baron R, Ferrari S, Russell RG. Denosumab and bisphosphonates: different mechanisms of action and effects. Bone. 2011, 48(4): 677-692.
18. Roudier MP, Morrissey C, True LD, et al. Histopathological assessment of prostate cancer bone osteoblastic metastases. J Urol. 2008, 180(3):1154-60.
19. Asano Y, Yamamoto N, Demura S, et al. Combination therapy with immune checkpoint inhibitors and denosumab improves clinical outcomes in non-small cell lung cancer with bone metastases. Lung Cancer. 2024, 193: 107858.
20. Jing Zheng, et al. Impact of bone Metastases on the efficacy of first-line immunotherapy in advanced NSCLC: an analysis from a prospective real-world study. IASLC 2025 WCLC.
21. Li HS, Lei SY, Li JL, et al. Efficacy and safety of concomitant immunotherapy and denosumab in patients with advanced non-small cell lung cancer carrying bone metastases: A retrospective chart review. Front Immunol. 2022, 13: 908436.
22. Sun D, Zhu H, Xu Q, et al. Comparative efficacy of bone-modifying agents in the treatment of lung cancer bone metastases: immunotherapy era. Future Oncol. 2025, 21(19): 2483-2493.
Bessa CMD, Silva LMD, Zamboni MM, et al. Bone metastasis after stage ⅢA non-small cell lung cancer: risks and prognosis. J Bras Pneumol, 2022, 48(5): e20220211.
排版编辑:肿瘤资讯-Vickey











 苏公网安备32059002004080号
苏公网安备32059002004080号


