

2025年欧洲肿瘤内科学会(ESMO)年会于10月17至21日在德国柏林举行,会议期间胰腺癌领域公布了多项重磅研究进展。值此盛会,【肿瘤资讯】特邀上海交通大学医学院附属仁济医院王理伟教授与来自美国弗吉尼亚梅森医疗中心的Vincent J. Picozzi教授展开中外对谈,围绕肿瘤电场、靶向及免疫治疗的最新突破,共同解读胰腺癌诊疗现状与未来格局的演进。
Q1:在您所在的国家,晚期胰腺癌当前的诊治困境与未来方向是什么?
王理伟教授:
胰腺癌的发病率正在快速上升,但约80%的胰腺癌患者在确诊时已经失去手术机会,60%存在远处转移。因此,胰腺癌的5年生存率长期徘徊在5%到7%,即使在顶尖医疗中心也仅10%左右。所以,胰腺癌的诊断和治疗仍面临着很多的问题和挑战。
首先,早期诊断十分困难。正如之前提到的,60%的患者在发现时已经出现远处转移,能够手术切除的患者不到20%。
第二,复杂的肿瘤微环境。约70%的胰腺癌属于致密型,肿瘤组织里含有大量的纤维成分,所以形成了一个物理的或生物的屏障,导致药物难以深入肿瘤内部,因而疗效非常有限。
第三,治疗药物相对匮乏。尽管免疫治疗和靶向治疗在其他肿瘤领域的进展如火如荼,但目前胰腺癌的主要药物治疗手段仍以化疗为主。尽管近几年,一些靶向药物的研究获得成功,例如NOTABLE研究中针对KRAS野生型患者应用EGFR单克隆抗体取得了积极结果,以及KRAS G12C抑制剂已显示出初步疗效,但这类患者仅占全部胰腺癌患者的12%(KRAS野生型约5%~10%,KRAS G12C约1%~2%),所以仍需临床进一步的探索。
此外,患者的生活质量普遍较差。由于胰腺癌具有嗜神经性,术后病理显示很多患者存在神经侵犯,因此疼痛症状非常明显。另外,约65%到70%的胰腺癌发生在胰头颈部,这类患者通常会出现黄疸,在治疗初期或过程中常需进行退黄处理。所以,黄疸是胰腺癌一个特殊的临床表现。而一旦出现黄疸及相关梗阻,还可能引发胆道感染。因此,感染问题,尤其是在晚期胰腺癌患者中,是临床诊断和治疗过程中的一个重要挑战。
那么,未来我们应该如何去解决这些问题?
首先,是早期诊断和发现。目前已有一系列的研究正在进行,但尚未看到突破性进展。希望我们做基础研究和临床研究的医生共同努力,探索出有效的早期筛查与诊断方法。
第二,需要推动更精准化的个性化治疗。我们要对胰腺癌进行精准的分子分型,近年来这一方向逐渐受到重视。例如,对于KRAS野生型患者可使用EGFR单克隆抗体;对于KRAS G12C突变的患者可采用已上市的抑制剂。另外,我在此次ESMO大会上报告了一款中国原研的针对KRAS G12D的抑制剂(HRS-4642),我们知道,约1/3的胰腺癌患者存在该位点突变,通过靶向治疗联合标准化疗取得了良好疗效,因此该研究被大会选为优先发言。
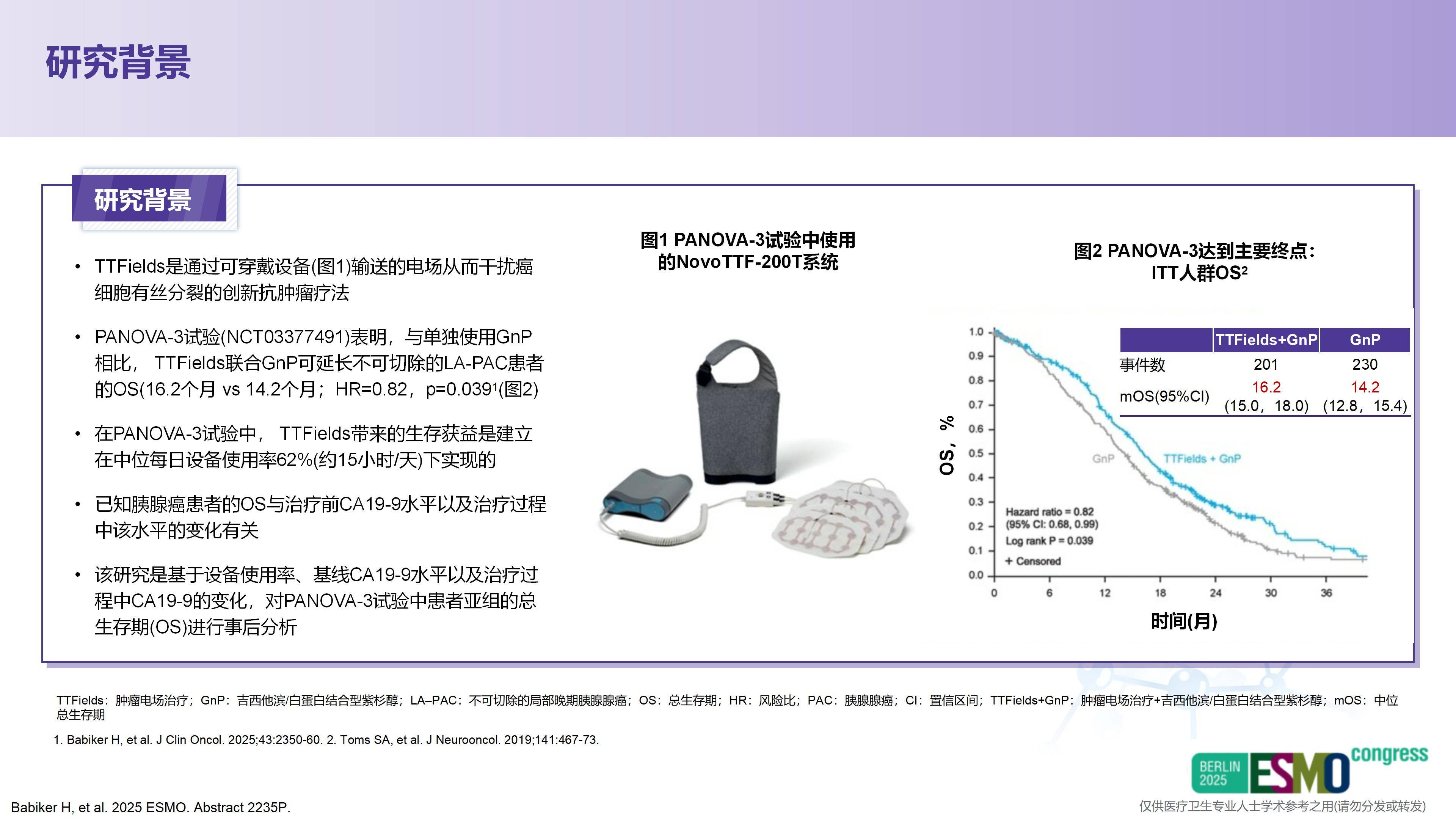
第三,期待新方法和新技术的应用。例如PANOVA-3研究中,对局部晚期胰腺癌患者应用肿瘤电场治疗(TTFields)联合标准化疗,未来是否进一步联合免疫或靶向治疗以提高疗效,值得深入探索。
Vincent J. Picozzi教授:
我完全同意王教授的观点。无论在美国还是全球范围内,胰腺癌都是最难治疗、预后最差的主要癌症之一。正如王教授指出的,这背后存在多重复杂因素。
首先,胰腺癌在生物学上极为复杂。除了与周围间质组织存在复杂的相互作用,其基因层面也同样复杂。
其次,胰腺癌对患者造成的诸多全身性影响。例如体重减轻,并且对免疫疗法的反应相对不敏感。在临床层面也存在许多挑战,以美国为例,患者年龄普遍较大,平均年龄为71岁,因此他们通常合并多种其他健康问题。治疗过程本身对患者来说也较为困难,常伴随明显的副作用及多种临床挑战。
然而,在所有这些挑战中,或许最大的问题是弥漫在患者和医生群体中的悲观情绪,这是由于胰腺癌长期以来令人沮丧的预后所导致的。这种悲观不仅存在于公众认知中,也使得来自政府和私营部门的科研资金支持相对有限。因此,胰腺癌在治疗进展道路上确实面临重重挑战。
但我相信,如今我们正迈入一个全新的时代,胰腺癌领域即将迎来新的局面。随着多种新疗法的应用,我们实际上可能正在看到治疗效果的转变。我们期待,随着疗效的提升,将提升患者的乐观情绪、提高社会参与度,以及跨机构和疗法之间更强的协同潜力和对患者支持体系更深入的建设,结合王教授所强调的对早期检测的重新重视,我相信必将为胰腺癌的诊疗带来更好的临床结果。
Q2:PANOVA-3研究达到了主要研究终点(OS),您认为这一突破对于局部晚期胰腺癌患者和临床实践有何具体意义?这对未来胰腺癌治疗格局会产生怎样的影响?
王理伟教授:
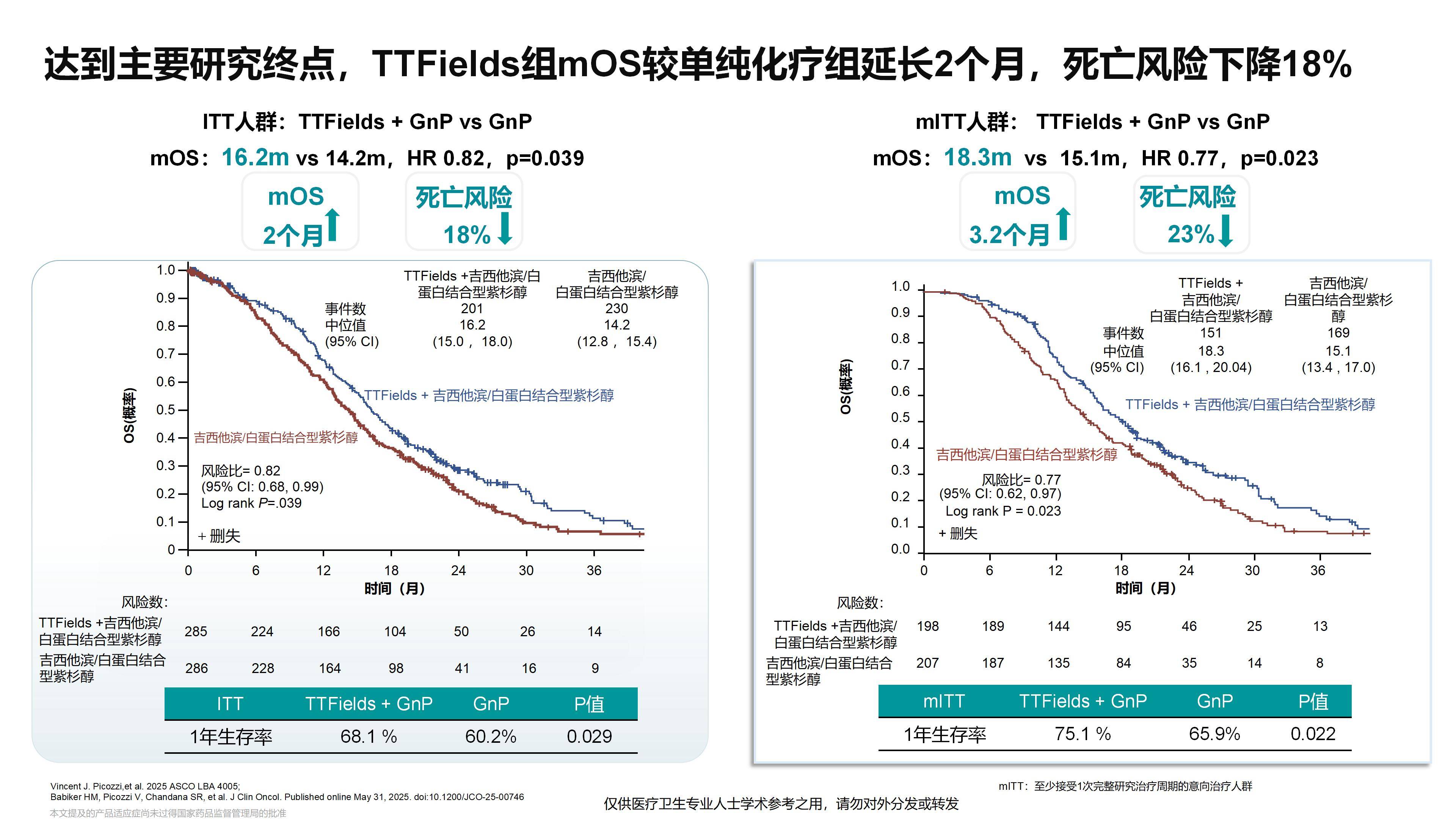
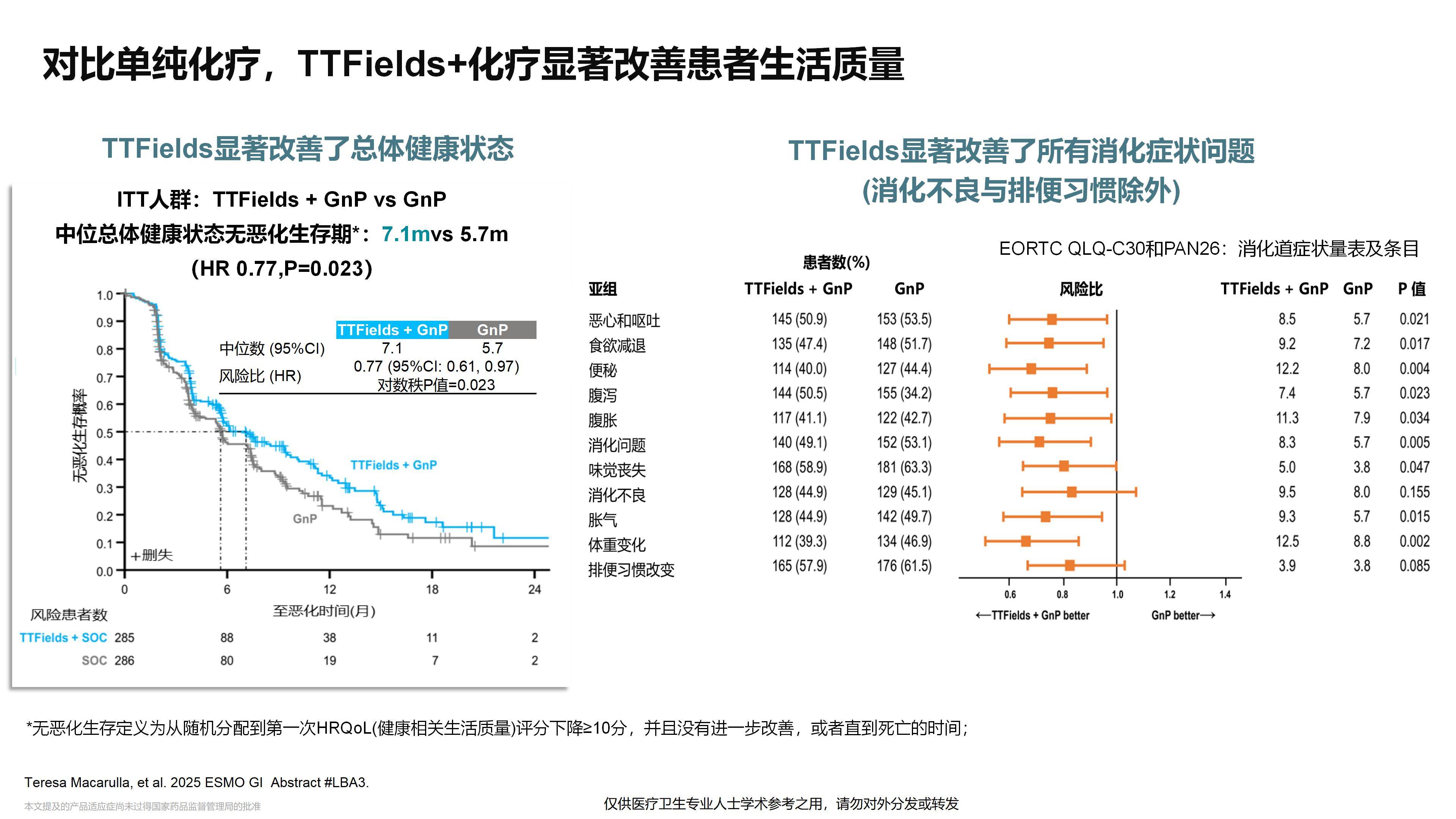
2025年ASCO大会报告了PANOVA-3的突破性研究结果。该研究显示,这一疗法不仅显著改善了患者的总生存期(OS),同时提高了患者的生活质量,尤其在疼痛控制方面表现出更好的效果。
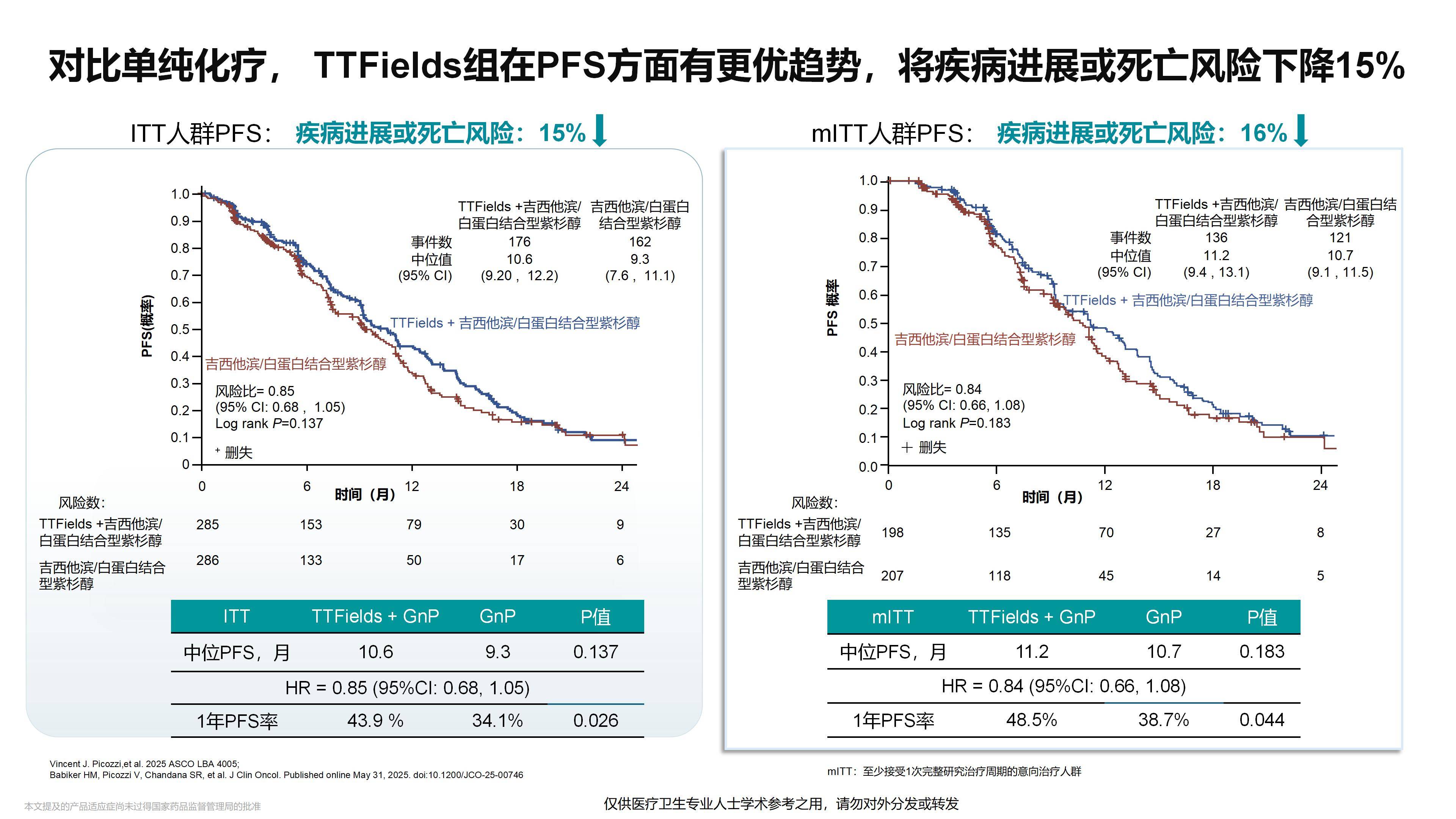
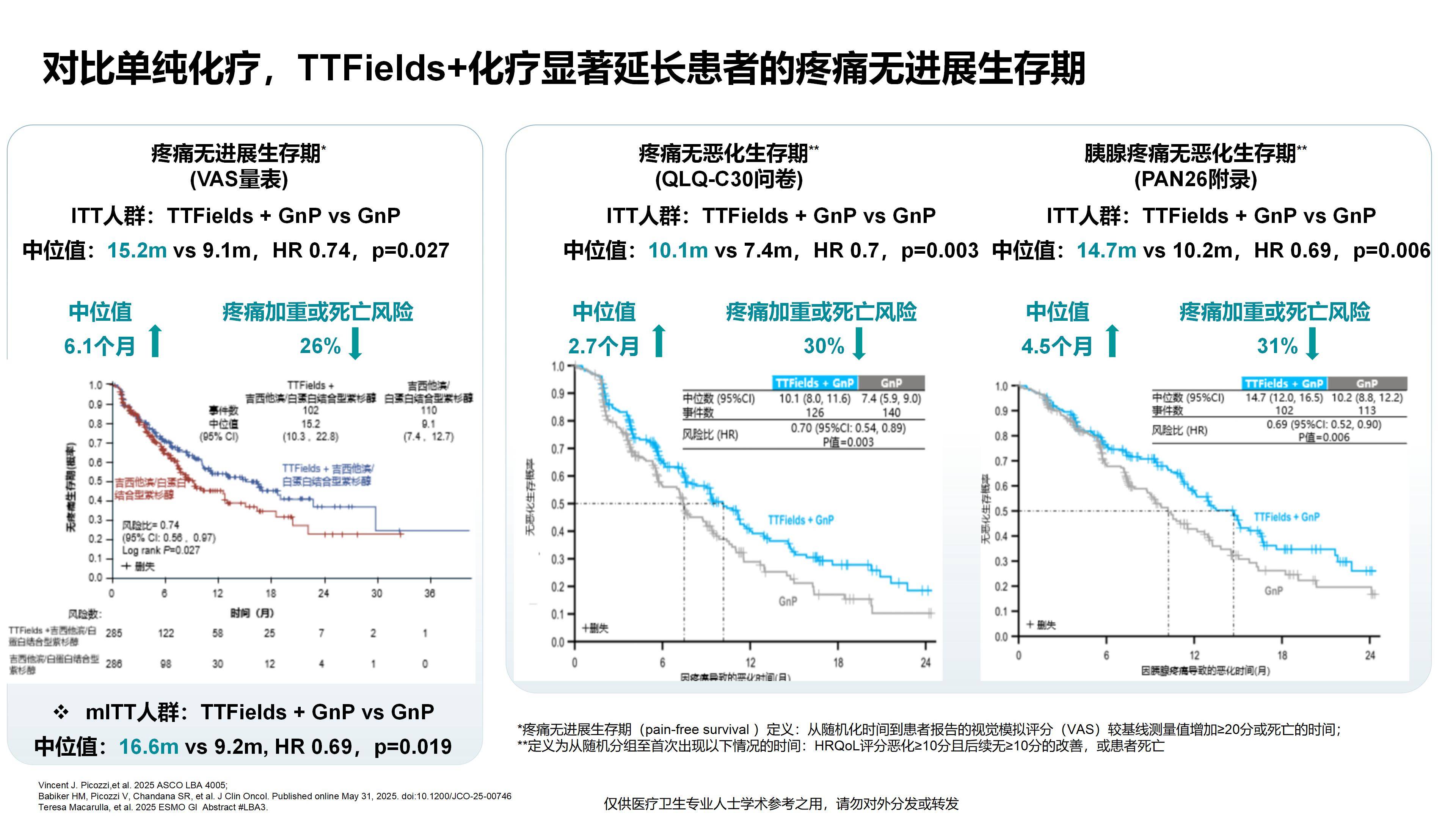
众所周知,约25%的胰腺癌患者首次就诊时已为局部晚期,这类患者治疗难度大,往往无法及时接受手术。而药物治疗,特别是化疗,效果十分有限,导致胰腺癌预后较差,成为临床治疗的一大难点。TTFields联合标准化疗方案,使患者中位OS延长了2个月(从14.2个月提升至16.2个月)。这是首个在局部晚期胰腺癌人群中显示OS获益的III期阳性研究,具有重要的临床价值和意义。
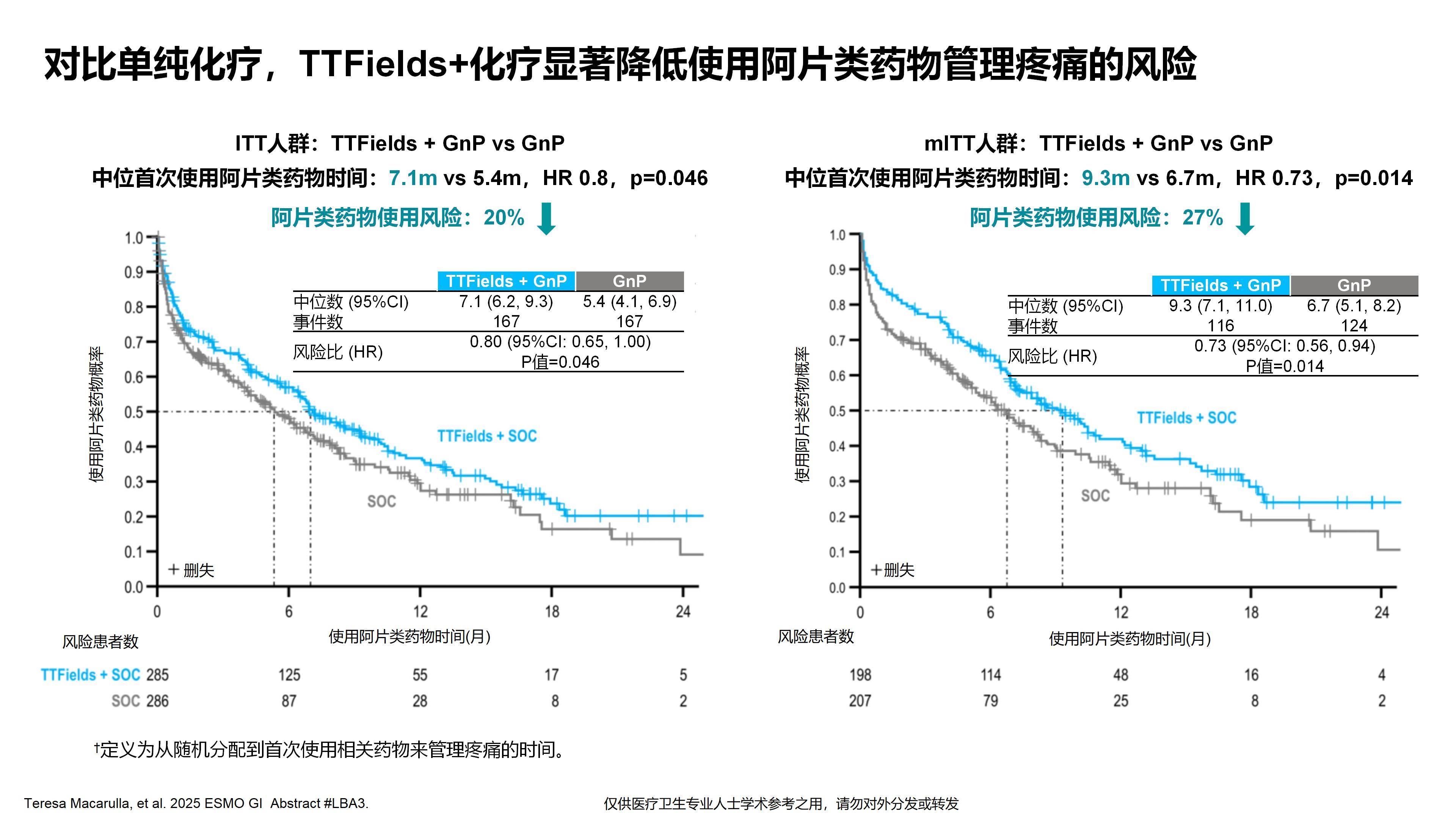
正如我们之前提到的,胰腺癌患者生活质量较差,疼痛症状尤为明显。TTFields的研究已证实该设备能够有效改善胰腺癌相关疼痛,使疼痛无进展生存期*延长6.1个月(中位时间达15.2个月),并延迟阿片类止痛药物的使用,从而显著提高患者的生活质量。
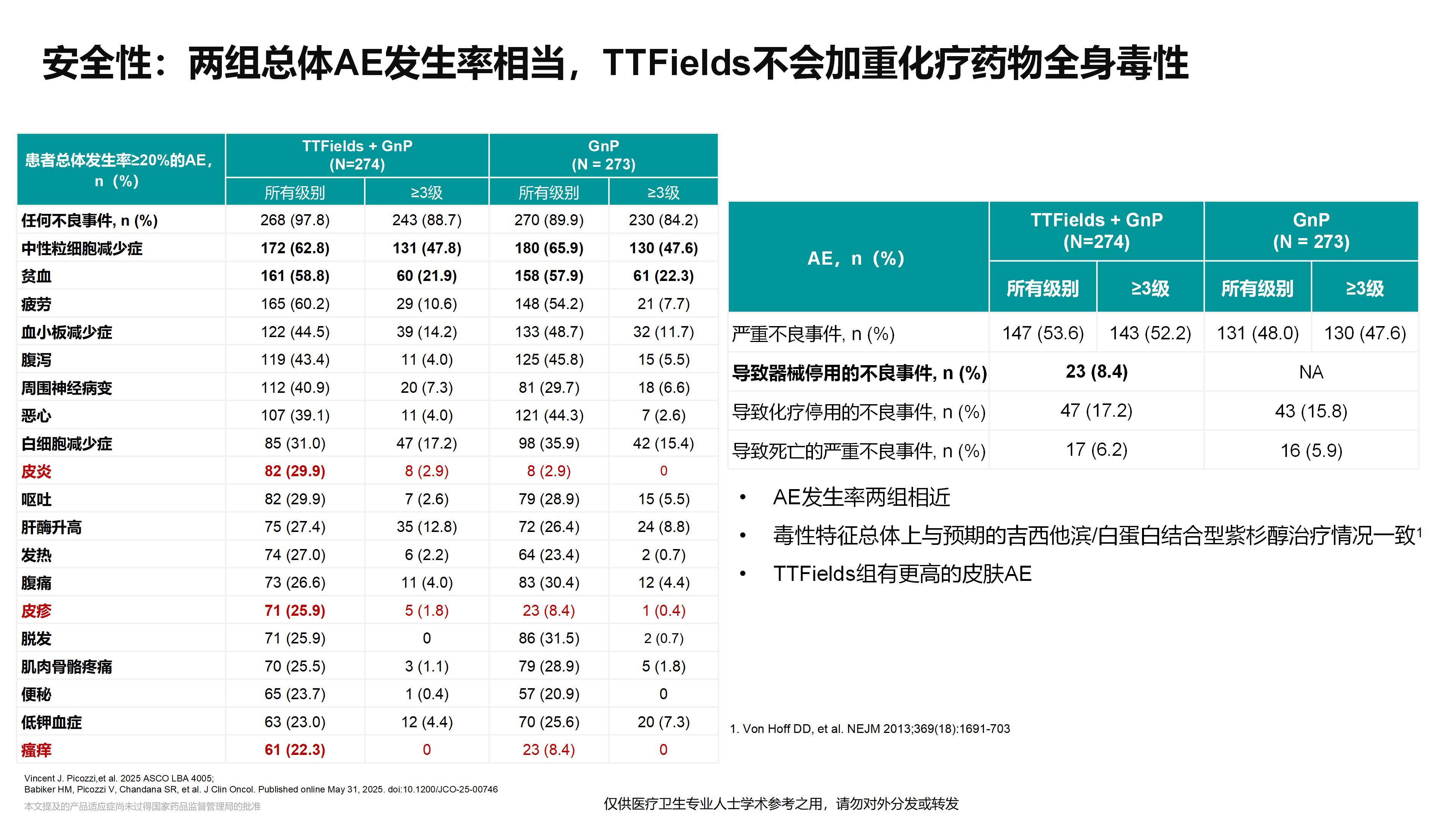
TTFields是一种非侵入性的物理治疗方式,代表了一种全新的治疗模式,且该疗法安全性良好。未来,这一疗法是否能够与靶向治疗、特别是免疫治疗相结合,从而进一步提高晚期及局部晚期胰腺癌的疗效,非常值得我们期待。
Vincent J. Picozzi教授:
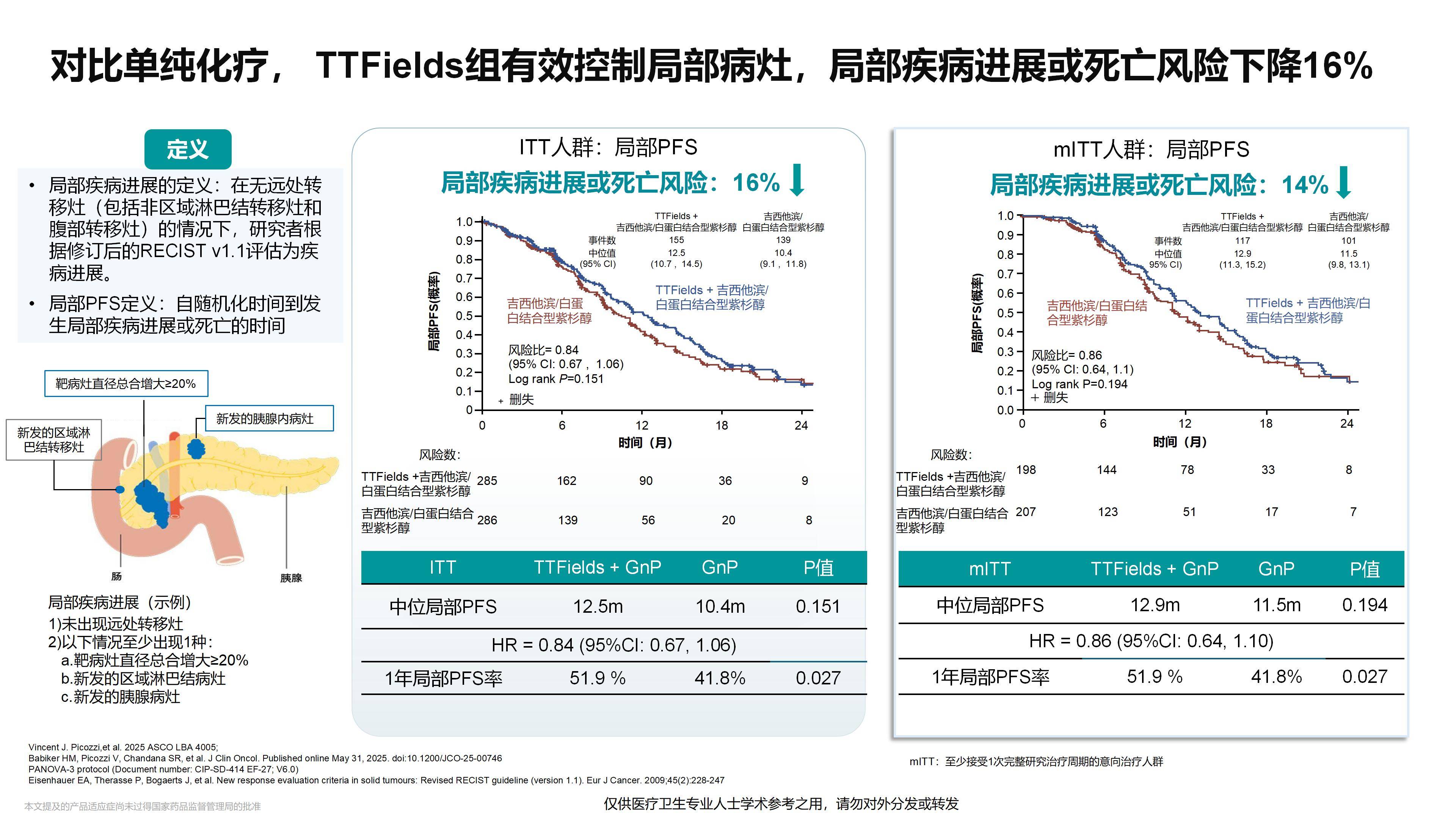
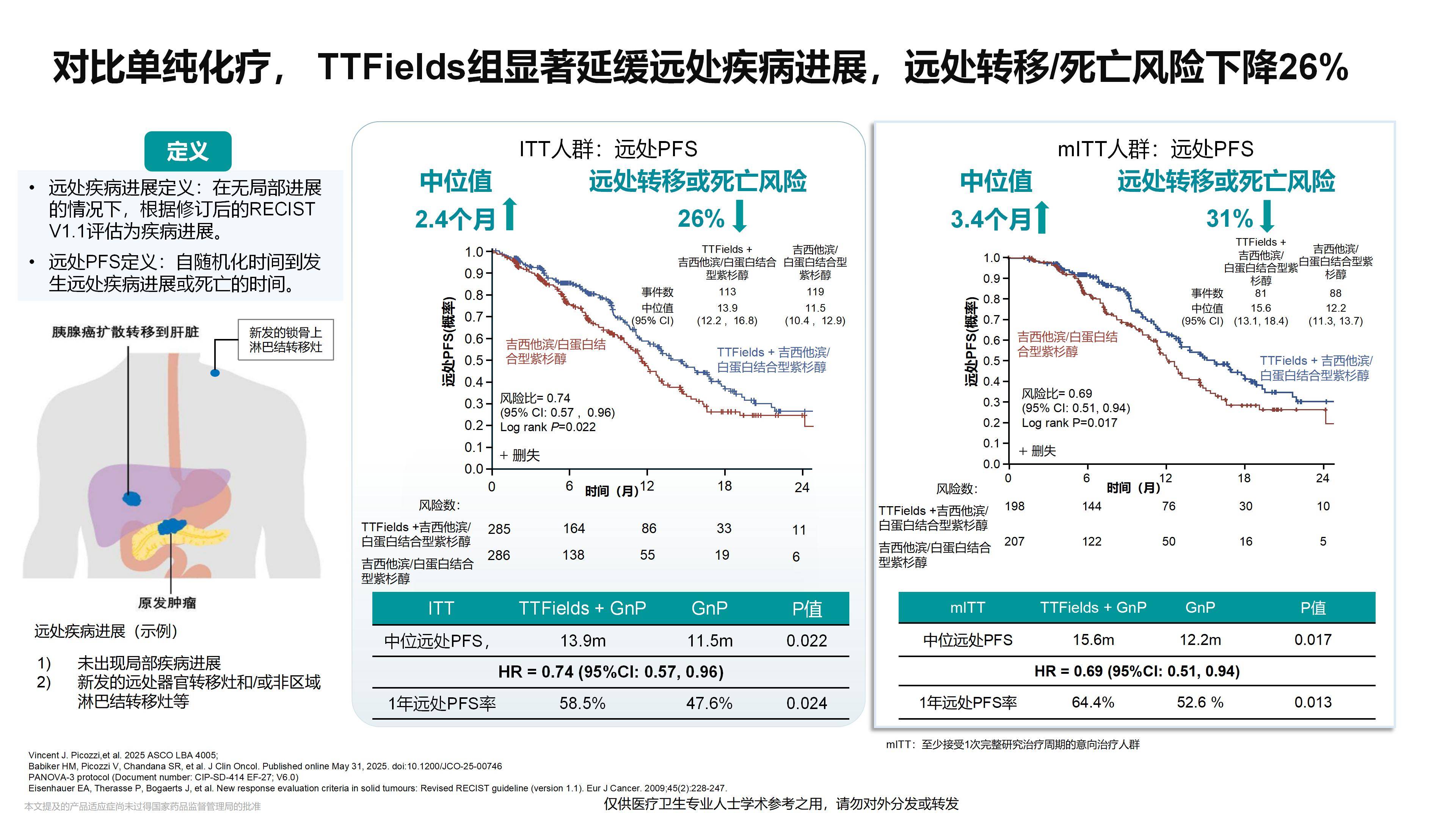
PANOVA-3研究在局部晚期胰腺癌治疗领域取得了首个积极成果。该研究不仅证实了其在控制胰腺原发病灶进展方面的作用,更显示出其能有效抑制其他部位的疾病进展——即我们通常所说的局部与远处转移——从而显著改善患者的生存期。此外,PANOVA-3研究证实TTFields在改善生存期的同时也提高了患者的生活质量,这对于预期生存有限的胰腺癌患者来说尤为重要。
我认为,该研究所展现的TTFields技术,将成为推动局部晚期乃至潜在转移性胰腺癌治疗进展的基石。由于其能有效抑制远处转移,特别是这种抑制作用可能增强肿瘤对免疫治疗的敏感性,这为TTFields与各类新型疗法的协同应用开辟了广阔前景。

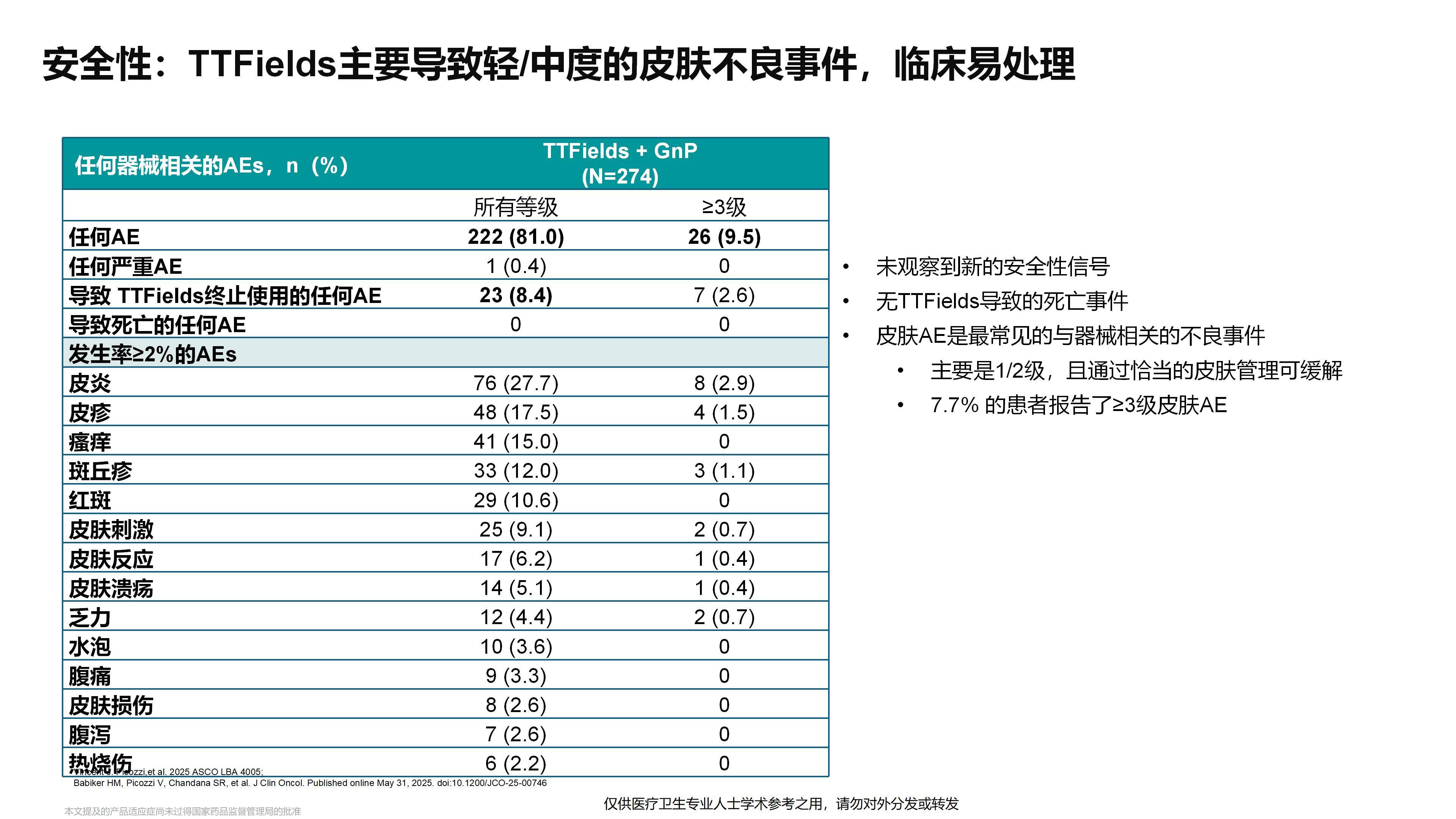
Q3:在本次ESMO的PANOVA-3研究事后分析中,研究者发现设备使用时间(Device Usage)与疗效的关系,以及 CA19-9水平的变化能否作为治疗反应的预测指标,对此您有何看法?
王理伟教授:
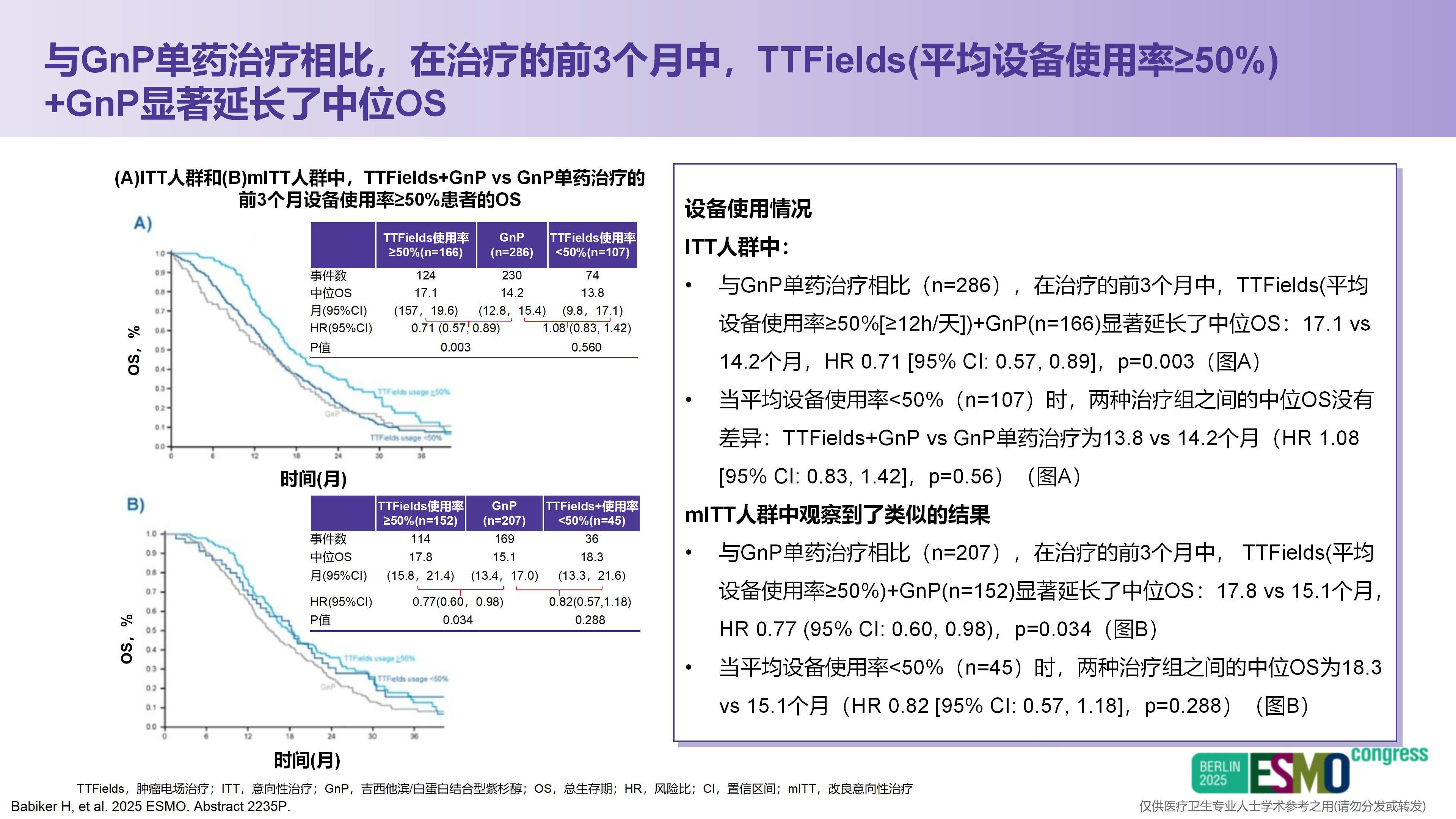
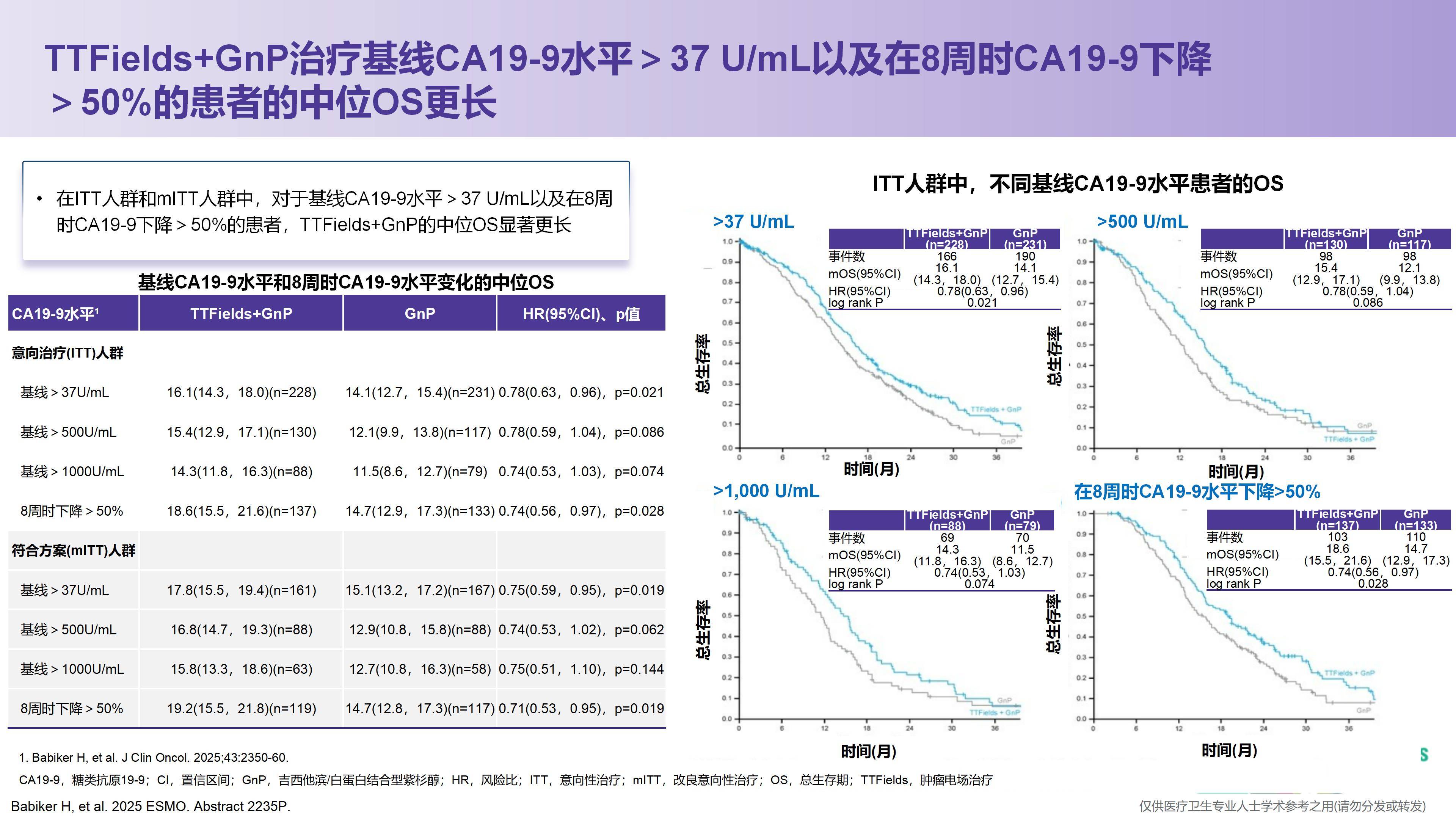
我已经关注到本次ESMO大会上发布的PANOVA-3研究后续分析结果。研究发现,在前3个月内,设备使用率≥50%的患者相比使用率<50%的患者可以显著延长中位OS,提示患者接受电场治疗的时间越长,可能获得的疗效越好。因此,未来如何尽可能延长患者接受电场治疗的持续时间,将是一个非常重要的方向。
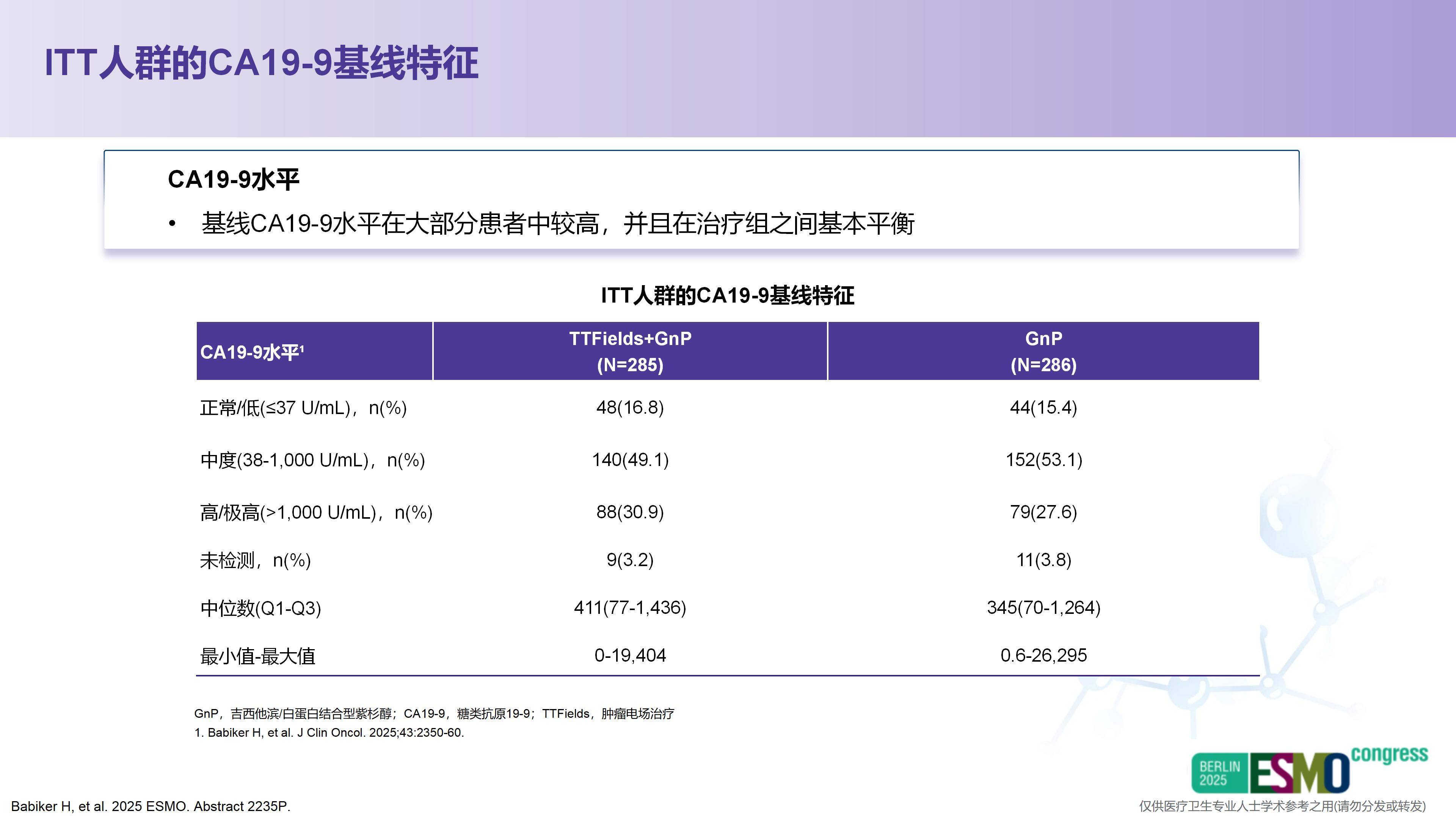
其次,众所周知,CA19-9是胰腺癌中特异性相对较高的肿瘤标志物。除炎症因素外,基本能反映对CA19-9敏感的胰腺癌患者的疗效变化。研究中观察到,当患者CA19-9下降幅度较大时,疗效往往更佳。据报告,在8周时CA19-9下降超过50%的患者,OS可能获得更好的改善。因此我认为,未来或可将CA19-9作为TTFields联合系统治疗过程中的生物标志物,用于动态评估疗效,其是否也能用于预测预后,同样值得进一步关注。
Vincent J. Picozzi教授:
TTFields中设备的推荐使用时长是基于其在胶质母细胞瘤等脑肿瘤中的应用经验,即每天18小时,达到75%的使用率。而在本项研究中,患者的实际平均使用时间为62%,约为每天14~15小时。
研究显示使用时长与疗效之间存在相关性。特别是在胶质母细胞瘤的化疗中,最常用的药物替莫唑胺是每日口服的化疗药。而本研究中的设备是与间歇性给药的吉西他滨和白蛋白紫杉醇联合使用。因此,关于设备的最佳总使用时长及其与化疗方案间的协同关系,仍有诸多值得探索的空间。这对于尽可能提高患者对设备的接受度、同时最大限度降低其主要毒性反应(即皮肤毒性)至关重要。关于使用时间的记录,该设备配有专门的计时器,具备自动追踪功能,可供实时查看使用情况。其能准确记录设备处于使用与非使用状态的时间,并生成详细的时间日志。因此,当设备交回时,研究人员可精确分析总使用时长及每日具体使用时段,所有数据的记录均由设备自动完成。
关于CA19-9指标的下降,此前在转移性胰腺癌中已证实其为重要的预后因素,无论是基于MPACT试验采用的AG方案,还是在FOLFIRINOX方案中,这一结论均得到了验证。考虑到胰腺癌本身具有侵袭性强、进展快的特点,我们亟需尽早判断治疗是否起效。CA19-9在8周内即出现大幅下降,说明该疗法从初始使用阶段就展现出显著活性,这也为预测哪些患者可能从持续治疗中获益提供了重要参考。因此,这两方面均为关键议题,相信在未来肿瘤电场治疗的相关研究中会得到更深入的探讨。

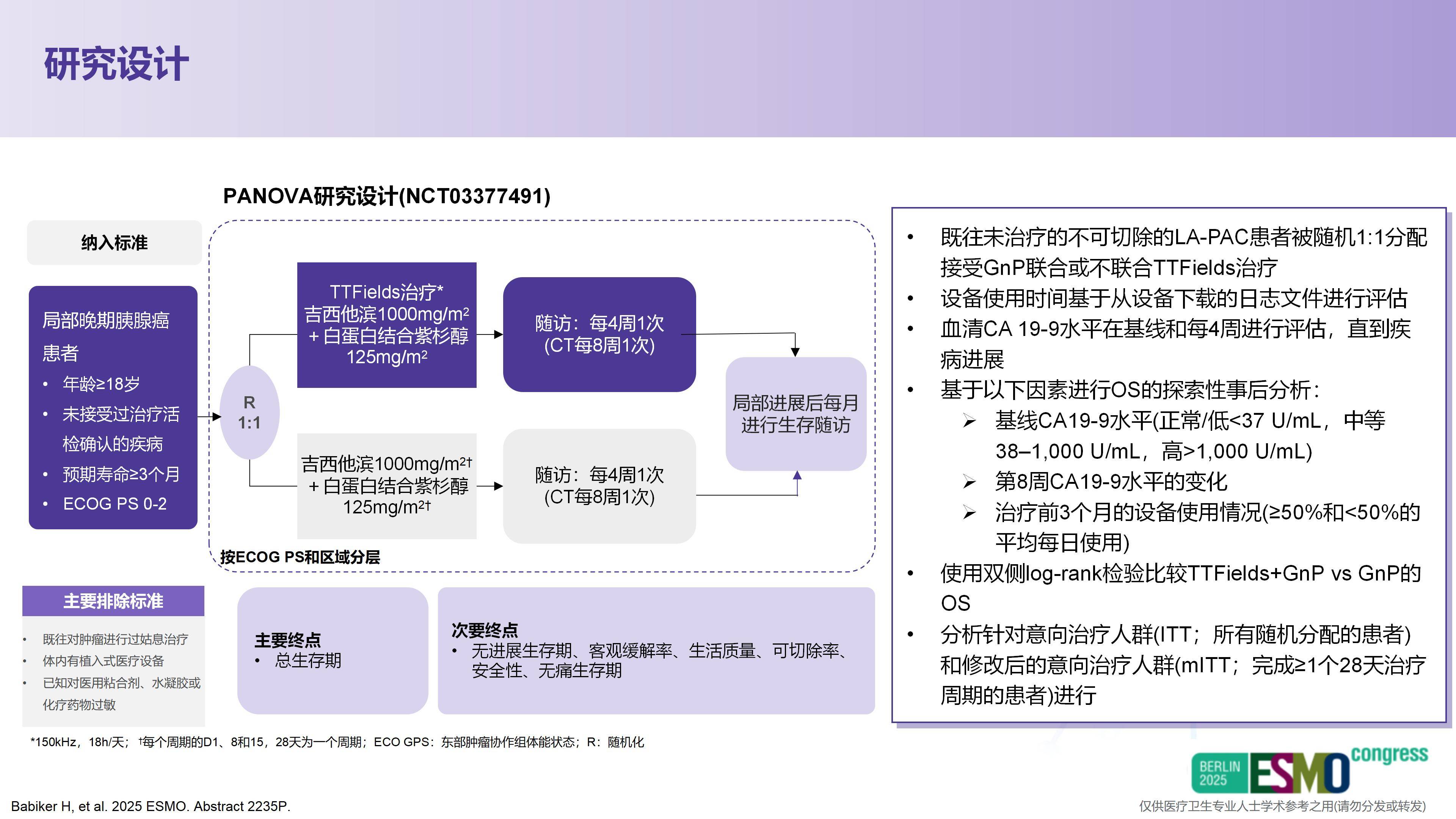

Q4:本届ESMO大会公布了多项胰腺癌靶向/免疫治疗与放/化疗优化研究。您如何看待这些疗法在胰腺癌综合治疗中的定位与挑战?
王理伟教授:
正如我们之前所讨论的,胰腺癌具有一个显著特征,约70%患者的肿瘤属于致密型,这类肿瘤含有大量纤维组织,导致药物难以渗透。然而,还有20%至30%患者的肿瘤为松散型,可能对免疫治疗相对敏感,药物也更容易渗透。那么,我们应如何进一步区分这两种类型胰腺癌的特征?这很可能将成为我们未来的研究方向——建立基于组织病理学和分子生物学的精准分型体系。通过精准分型,我们如何将现有的各种治疗方法和技术,更科学、合理地应用于每一位患者,或许是我们当前面临的最大挑战,也是我们未来需要应对的重要课题。
无论如何,在早期诊断问题尚未解决之前,多学科综合治疗与多种方法的联合应用,是未来的发展方向和必然趋势。
Vincent J. Picozzi教授:
延长胰腺癌患者生存期的关键在于控制癌细胞的全身性扩散,即实现有效的全身性疾病控制。
目前,采用化疗方案时,单一化疗药物的有效率甚至不足20%,而联合化疗方案的有效率实际上也难以超过30%~40%。因此,KRAS抑制剂(包括泛RAS抑制剂和KRAS G12C选择性抑制剂)的引入具有革命性意义,其单药疗效已能与传统化疗相媲美。我们正在进入一个以KRAS抑制剂为基础构建治疗方案的新时代,这将改变现有的主要治疗模式。
通过多项重要研究,例如王教授团队开展的工作,我们看到了这一方向的潜力:在标准化疗基础上联合使用选择性KRAS抑制剂,可使肿瘤缓解率达到单纯化疗的2倍。这一突破对控制全身癌细胞扩散至关重要,也为其他药物在此基础上进行补充和标准化应用奠定了基础。
值得关注的候选药物很多:PARP抑制剂、抗CD73药物,以及其他一些正在探讨中的新药。但我认为特别重要的是,这一进展将重新激发人们对免疫治疗的关注,因为KRAS抑制剂的作用机制之一就是增强肿瘤对免疫治疗的敏感性。值得注意的是,TTFields也表现出类似的增效作用,我们也正在开展一项TTFields联合免疫药物治疗转移性胰腺癌的临床研究,预计明年将会公布初步结果。因此,我们将重新聚焦免疫治疗领域,特别是新一代的创新方案,如双特异性T细胞结合剂疗法、PROTAC蛋白靶向降解技术,以及抗体-偶联药物等。我相信这些突破将共同开创胰腺癌治疗的新纪元,首次实现免疫治疗与其他疗法的有效协同。随之而来的不仅是对可见转移灶的治疗策略更新,更将加强对微转移灶的防治,通过KRAS抑制剂与癌症疫苗等免疫治疗手段的联合应用,我们有望借此显著提升胰腺癌的治愈率。
通过整合所有这些系统性治疗进展,再结合TTFields等新型局部治疗手段,我们有理由期待,一个全新的胰腺癌治疗时代正在到来。
*疼痛无进展生存期(pain-free survival):PANOVA-3研究中定义为疼痛由基线水平发展至VAS评分增加20分及以上或者出现死亡的时间。
上海交通大学医学院附属仁济医院肿瘤科主任
MDT专家委员会主任委员
上海交通大学胰腺癌诊治中心主任
中华医学会肿瘤学分会委员兼胰腺肿瘤学组组长
中国医师协会肿瘤医师分会常务委员
中国临床肿瘤学会(CSCO)理事
CSCO胰腺癌专家委员会首届主任委员
中国抗癌协会理事兼整合肿瘤肾脏病专委会主任委员
上海市抗癌协会副理事长兼疑难肿瘤专委会主任委员
上海市医学会理事兼肿瘤内科专科分会主任委员
长三角肿瘤专科联盟 会长
上海市领军人才、上海市优秀学科带头人
主要从事消化系统肿瘤临床诊治和转化研究;2001至2004年美国加州大学洛杉矶分校(UCLA)和MD Anderson肿瘤中心访问研究。主持制定了我国首个《胰腺癌综合诊治中国专家共识》、中国临床肿瘤学会首个《CSCO胰腺癌诊疗指南》和首个中国抗癌协会《肿瘤肾脏病保护技术指南》,主持包括自然基金重大研究计划在内的 7项国家自然基金项目、2项重大新药创制项目和10 多项各类基金项目;现为《Journal ofPancreatology》《肿瘤》副主编、《CancerResearch》《JHO》《临床肿瘤学》等杂志编委,发表SCI论文100余篇,他引1000余次 。
弗吉尼亚梅森医疗中心 胆胰科主任
担任美国临床肿瘤学会(ASCO)、美国血液学会(ASH)、美国外科医师学会肿瘤学组(ACOSOG)、胰腺癌行动网络科学与医学顾问委员会成员
连续十七年(2008-2024)被评为西雅图最佳医生和美国顶尖癌症医生之一
*以上信息涉及尚未在中国获批的产品/适应症。此信息仅作信息分享用途,不应被理解为这些产品/适应症在中国获批或注册。
相关文章回顾(点击可查看详情):
1.研究者说丨TTFields联合化疗为局部晚期胰腺癌治疗带来新突破
2.曹丹教授:肿瘤电场治疗为“癌王”困境带来新突破,点亮局晚期胰腺癌患者的生命之光
3.王理伟教授权威解析PANOVA-3研究 | 从生存绝地到生命高原,肿瘤电场重绘局部晚期胰腺癌生存曲线
4.秦叔逵教授 | 肿瘤电场治疗破局“癌王”困局,PANOVA-3研究的全球突破与中国使命:照亮局晚期胰腺癌至暗时刻
5.2025 ASCO | 胰腺癌治疗格局打破!郝纯毅教授解读 III 期PANOVA-3:TTFields联合化疗带来生存获益!
排版编辑:肿瘤资讯-Shiro












 苏公网安备32059002004080号
苏公网安备32059002004080号


