尿路上皮癌(Urothelial Carcinoma, UC)是泌尿系统最常见的恶性肿瘤[1],晚期患者预后较差,传统化疗效果有限,免疫治疗进入瓶颈期,迫切需要更多更好的治疗选择。随着抗体偶联药物(ADC)等新型靶向治疗的发展,人表皮生长因子受体2(HER2)又成为尿路上皮癌治疗的重要生物标志物和靶点,HER2在UC的扩增率仅次于乳腺癌、胃癌[2],针对HER2靶点治疗正在逐渐改变尿路上皮癌的治疗格局。本文将从HER2靶点的重要性、研究进展、当前困境和未来展望三个方面全面综述尿路上皮癌的HER2靶向治疗概况。
本期特邀专家——曾 宇 教授
辽宁省肿瘤医院 泌尿外科 二病区主任
主任医师
美国约翰霍普金斯大学博士后、讲师
中华医学会泌尿外科分会基础学组委员
中国抗癌协会青年常务理事
中国抗癌协会内分泌专委会委员
中国抗癌协会中西整合肾癌专委会委员
中国老年学会老年医学会肿瘤分会委员
辽宁省抗癌协会理事
辽宁省医学会泌尿分会委员,肿瘤学组副组长
辽宁省医师学会泌尿外科专委会副会长
“辽宁省高校攀登学者”
主持国自然面上项目2项,省市课题3项
发表SCI论文50余篇,其中第一作者/通讯作者20篇
1、HER2靶点在尿路上皮癌中的重要地位
1.1 HER2的生物学特性与临床意义
HER2是ERBB受体酪氨酸激酶家族的成员,在调控细胞生长、分化和存活中起关键作用。在尿路上皮癌中,HER2过表达(免疫组化IHC 2+/3+)的比例为20%-40%[2]。研究表明,与乳腺癌与胃癌一样, HER2过表达与尿路上皮癌的疾病进展和不良预后相关[3]。HER2的表达表现出明显的肿瘤异质性,这种异质性体现在原发灶和转移灶之间的差异,以及不同组织学类型之间的差异——微乳头型尿路上皮癌以及浆细胞样尿路上皮癌都有更高的HER2蛋白过表达率[18]。
1.2 HER2与分子分型及临床病理特征的关系
研究发现HER2过表达与尿路上皮癌的分子分型密切相关。管腔型患者HER2过表达率高达52.6%,显著高于基底型的3.4%(P<0.001)。多因素分析显示,肿瘤多发性和管腔型是HER2过表达的独立危险因素,HER2过表达还与肿瘤部位、浸润性、高级别显著相关,但与年龄、淋巴结转移无关[18]。这一发现具有重要临床价值,一方面为HER2检测划定重点人群(局部晚期、多发性、管腔型),避免盲目筛查;另一方面为HER2的精准治疗提供依据。
2、HER2治疗在尿路上皮癌中的研究进展
2.1 HER2 ADC类
抗体偶联药物通过将靶向HER2的单抗与强效细胞毒性药物连接,实现了对肿瘤细胞的精准杀伤。与传统抗HER2靶向治疗相比,ADC药物在HER2低表达也可以通过旁杀伤展现一定疗效,扩大了潜在获益患者范围[4]。

2.2 HER2 TKI类
酪氨酸激酶抑制剂 (TKI) 是一类小分子化合物,通过竞争性抑制受体胞内结构域中酪氨酸激酶的活性,阻断酪氨酸残基磷酸化过程,从而干扰下游信号通路传导。目前针对HER2的TKIs主要包括拉帕替尼、阿法替尼、奈拉替尼等药物[5]。
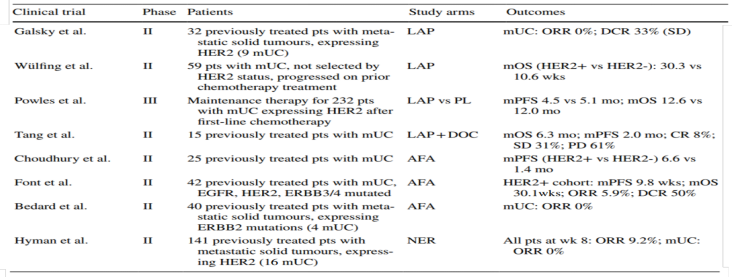
拉帕替尼用于HER1/2阳性mUBC一线化疗后维持治疗的III期研究,较安慰剂未显著改善生存:mPFS 4.5 vs 5.1个月,mOS 12.6 vs 12.0个月。TKI疗效不佳的原因可能是由于TKI作用于酪氨酸激酶,是针对HER2突变的患者存在胞内的酪氨酸激酶结构域变化,因此TKI更适用于HER2突变的患者[6, 7]。
2.3 HER2 单抗类
随着HER2治疗的探索加深,一些研究显示单抗类药物在HER2阳性尿路上皮癌中逐渐展现潜力。一项研究显示[8],曲妥珠单抗生物类似药联合紫杉醇后线治疗HER2阳性 (IHC 3+) 复发或转移性尿路上皮癌患者 (N=26) 的II期KCSG GU18-18临床试验:ORR 48.1% (1例CR, 12例PR),中位DOR 6.9个月,中位PFS 8.4个月,中位OS 13.5个月;AI评估IHC 3+患者 (8例):ORR 62.5%。另一项研究显示[9],曲妥珠单抗联合紫杉醇、卡铂、吉西他滨 (TPCG方案) 一线治疗HER2阳性晚期尿路上皮癌 (N=44) 的多中心II期临床试验:ORR 70% (5例CR, 26例PR),中位PFS 9.3个月,中位OS 14.1个月。但是也有一些研究显示单抗无法产生获益,一项对比吉西他滨+铂类和吉西他滨+铂类+曲妥珠单抗一线治疗HER2过表达晚期或转移性尿路上皮癌的多中心、随机、II期临床试验显示[10]:ORR:65.5% vs 53.2% (P=0.39);中位PFS:10.2 vs 8.2个月 (P=0.689);中位OS:15.7 vs 14.1个月 (P=0.684)。该研究的对于HER2过表达发生率低于预期,导致未能显示联用曲妥珠单抗的显著疗效差异。
MyPathway研究是一项探索不同瘤种HER2扩增和/或过表达患者使用曲妥珠联合帕妥珠单抗疗效的研究[11],纳入了263例不同瘤种的患者,最终分析了22例HER2扩增或过表达UC患者,其中5例达到客观缓解,ORR 22.7%。
NCI-MATCH ECOG-ACRIN临床试验 (EAY131) J组中[12],曲妥珠单抗+帕妥珠单抗用于后线治疗非乳腺/胃食管的HER2扩增肿瘤:25例经中心实验室NGS或NCI指定实验室检测证实存在高水平HER2扩增 (拷贝数[CN]≥7) 的患者中,ORR 12% (3例PR:结直肠癌、胆管癌、尿路上皮癌)。另1例ERBB2拷贝数未确认的尿路上皮癌患者也达到部分缓解。中位PFS为3.3个月,中位OS为9.4个月。
关于保膀胱领域也有HER2相关研究探索,其中一项研究显示[13],不适合膀胱切除的HER2阳性患者 (IHC 2+/3+)肌层浸润性膀胱癌 (MIBC) 患者经尿道手术后接受紫杉醇+放疗+曲妥珠单抗方案的1年完全缓解率达72% (13/18);HER2阴性患者接受紫杉醇+放疗方案的1年完全缓解率达68% (25/37)。
一项基因组学研究发现[14],尿路上皮癌具有高体细胞突变率和基因改变发生率,爱尔兰人群中转移性尿路上皮癌 (N=111) 真实世界研究显示:66例 (59%) 接受了肿瘤组织NGS检测,35例患者中检出36种潜在可靶向治疗改变,最常见为PIK3CA突变、FGFR3突变/融合及ERBB2体细胞突变。15例 (13.5%) 患者接受了针对基因改变的靶向治疗,最常用为厄达替尼 (60%),其次为曲妥珠单抗 (33%)。ERBB2突变发生率约11%,涉及曲妥珠单抗方案的疗效有限。
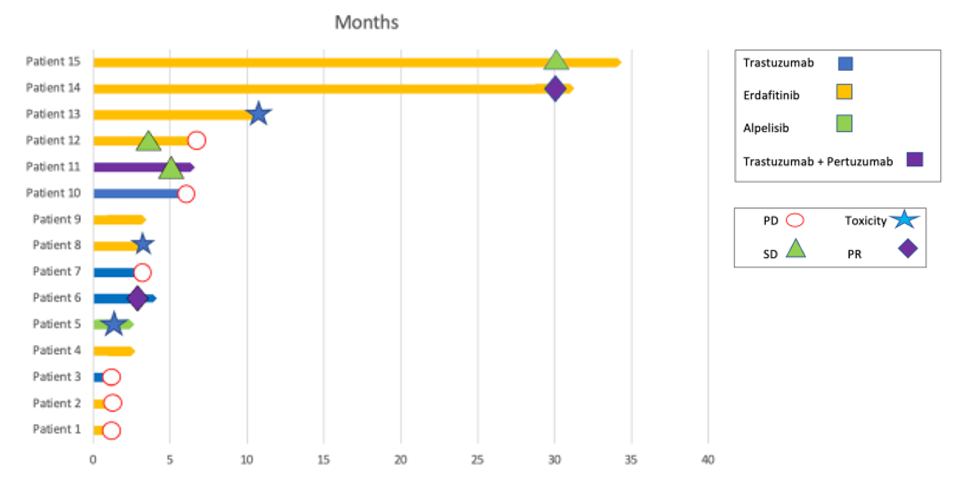
2.4 基于单抗类治疗疗效不同引发的思考
(1)HER2基因扩增但无突变,可能是曲妥珠单抗长期有效的关键因素。
一篇病例报告显示[15],一名患者通过NGS明确HER2基因扩增且未检出突变,使用曲妥珠单抗+顺铂,持续完全缓解,这提示HER2基因扩增的复发性UBC患者可能从曲妥珠单抗靶向治疗中获益。
(2)关注HER2的mRNA表达及下游致癌性信号通路的富集可能是单抗靶向治疗获益的提示。
另一篇病例报告显示[16],一名患者基因检测显示HER2基因扩增和过表达 (无突变),使用曲妥珠单抗+多西他赛后持续完全缓解。原发灶和转移灶外显子组和RNA测序的整合分析提示,该患者的肿瘤表现出显著升高的ERBB2 mRNA表达及下游致癌性ERBB2信号通路的富集。该患者对曲妥珠单抗治疗产生了持续显著的应答,提示该特征可能是靶向治疗的目标人群。
3、HER2靶向治疗面临的挑战
3.1 UC暂无标准化HER2评估
UC患者HER2评估标准化仍是临床实践中的主要挑战,目前仍沿用乳腺癌指南对HER2的检测与判读[17, 18],国际上尚无针对尿路上皮癌HER2蛋白表达状态的标准化检测流程和判读标准,导致不同临床中心尿路上皮癌HER2表达水平的判读存在相当大差异。
由于尿路上皮癌HER2表达存在明显的空间异质性和时间异质性,原发灶和转移灶HER2蛋白的表达可能存在差异,不同切片位置的HER2评估结果也可能存在较大差异,目前也迫切需要对尿路上皮癌HER2的统一评估标准。
3.2 对特殊类型患者的检测率不够
(1)HER2过表达与基因扩增特异性在管腔亚型中更常见[19],提示这类患者可能对曲妥珠单抗等HER2靶向治疗产生应答。
(2)HER2过表达更常见于高级别的肾盂尿路上皮癌男性患者[20],尤其伴内翻性生长模式者。基于HER2过表达状态对肾盂尿路上皮癌进行分层有助探索HER2单抗的潜在适用人群。
(3)HER2基因过表达和基因扩增在微乳头状癌、浆细胞样癌患者中更常见[18]。
4、HER2治疗未来的展望
通过一系列的研究发现,HER2靶向治疗的总体疗效不佳是由于没有对人群进行精准分类,对于HER2过表达与基因扩增的患者是可以展示出一定疗效,同时我们也看到在尿路上皮癌中HER2基因并非像乳腺癌一样是主要驱动基因,因此靶向治疗的同时联合化疗、放疗、免疫治疗可以提升更高的疗效。一系列相关研究正在开展中[21]。

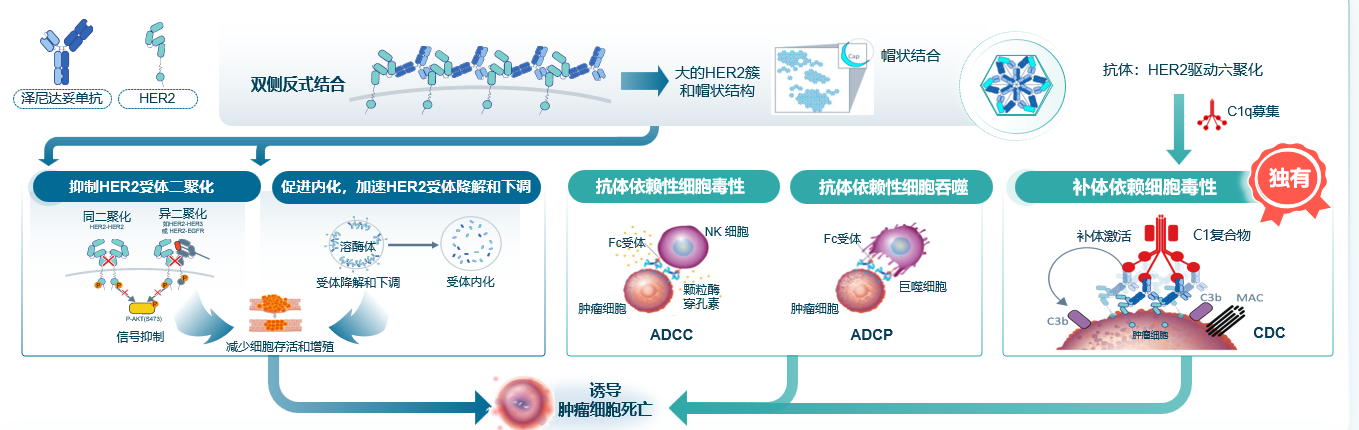
不同机制创新药的问世也是未来可能提高疗效的选择之一,泽尼达妥单抗是HER2靶点双特异性抗体,主要抗肿瘤机制包括:1.反式结构,更强亲和力。2.更强抑制HER2受体二聚化,促进内化,加速下调。3.ADCC、ADCP效应。4.独有的强效CDC(补体依赖的细胞毒作用)效应,这种多机制的杀伤给联合方案更多选择[22]。
挑战与机遇并存,CITELINE数据库显示,抗HER2治疗已成为尿路上皮癌研究新趋势,研究数量逐年递增。随着对HER2和肿瘤微环境相互作用的深入理解,以及新型药物和联合策略的不断涌现,尿路上皮癌HER2靶向治疗前景广阔,有望继续谱写精准治疗的新蓝图。
[1] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71 ( 3) : 209 - 249. DOI: 10. 3322 /caac. 21660.
[2] Atlas N C G .The Cancer Genome Atlas Research Network. Comprehensive molecular characterization of urothelial bladder carcinoma[J].Nature, 2014, 507:315-322.
[3] Qu M, Advances in HER2-Targeted Treatment for Advanced/Metastatic Urothelial Carcinoma. et al. Bladder (San Franc). 2023;10:e21200012.
[4] Ciciriello F, et al. HER2-Positive Urothelial Carcinoma: Current Evidence on Targeted Agents and Immunotherapy-Based Combinations. Target Oncol. Published online July 3, 2025.
[5] Powles T, et al. Phase III, Double-Blind, Randomized Trial That Compared Maintenance Lapatinib Versus Placebo After First-Line Chemotherapy in Patients With Human Epidermal Growth Factor Receptor 1/2-Positive Metastatic Bladder Cancer. J Clin Oncol. 2017;35(1):48-55.
[6] Font A, et al. Phase II trial of afatinib in patients with advanced urothelial carcinoma with genetic alterations in ERBB1-3 (LUX-Bladder 1). Br J Cancer. 2024;130(3):434-441.
[7] Hyman DM, et al. HER kinase inhibition in patients with HER2- and HER3-mutant cancers. Nature. 2018;554(7691):189-194.
[8] Kim M, et al. ESMO Open. 2023;8(4):101588.
[9] Hussain MH, et al. Trastuzumab, paclitaxel, carboplatin, and gemcitabine in advanced human epidermal growth factor receptor-2/neu-positive urothelial carcinoma: results of a multicenter phase II National Cancer Institute trial. J Clin Oncol. 2007;25(16):2218-2224.
[10] Oudard S, et al. Oudard S, et al. Eur J Cancer. 2015;51(1):45-54. Eur J Cancer. 2015;51(1):45-54.
[11] Sweeney CJ, et al. MyPathway Human Epidermal Growth Factor Receptor 2 Basket Study: Pertuzumab + Trastuzumab Treatment of a Tissue-Agnostic Cohort of Patients With Human Epidermal Growth Factor Receptor 2-Altered Advanced Solid Tumors. J Clin Oncol. 2024;42(3):258-265.
[12] Connolly RM, et al. Trastuzumab and Pertuzumab in Patients with Non-Breast/Gastroesophageal HER2-Amplified Tumors: Results from the NCI-MATCH ECOG-ACRIN Trial (EAY131) Subprotocol J. Clin Cancer Res. 2024;30(7):1273-1280.
[13] Michaelson MD, et al. A Phase 1/2 Trial of a Combination of Paclitaxel and Trastuzumab With Daily Irradiation or Paclitaxel Alone With Daily Irradiation After Transurethral Surgery for Noncystectomy Candidates With Muscle-Invasive Bladder Cancer (Trial NRG Oncology RTOG 0524). Int J Radiat Oncol Biol Phys. 2017;97(5):995-1001.
[14] Ronan K, et al. Frequency of next-generation sequencing, prevalence of targetable mutations and response to targeted therapies amongst patients with metastatic urothelial cancer in Ireland: a multi-centre retrospective study of real-world data. Ir J Med Sci. 2024;193(3):1155-1161.
[15] Jiang Q, et al. Complete response to trastuzumab and chemotherapy in recurrent urothelial bladder carcinoma with HER2 gene amplification: A case report. World J Clin Cases. 2020;8(3):594-599.
[16] Karass M, et al. Oncogenic Addiction to ERBB2 Signaling Predicts Response to Trastuzumab in Urothelial Cancer. J Natl Compr Canc Netw. 2019;17(3):194-200.
[17] CSCO 乳腺癌诊疗指南
[18]中国尿路上皮癌人表皮生长因子受体2检测临床病理专家共识. 中华肿瘤杂志. 2021;43(10):1001-1006.
[19] Takashi Yorozu, et al. HER2 Status in Molecular Subtypes of Urothelial Carcinoma of the Renal Pelvis and Ureter. Clin Genitourin Cancer. 2020 Aug;18(4):e443-e449.
[20] Laleh Ehsani, et al. Human epidermal growth factor receptor 2 expression in urothelial carcinoma of the renal pelvis: correlation with clinicopathologic parameters. Int J Clin Exp Pathol. 2014 Apr 15;7(5):2544-50.
[21] https://clinicaltrials.gov/study.
[22] Weisser NE, et al. An anti-HER2 biparatopic antibody that induces unique HER2 clustering and complement-dependent cytotoxicity. Nat Commun. 2023 Mar 13;14(1):1394.
排版编辑:肿瘤资讯-zly











 苏公网安备32059002004080号
苏公网安备32059002004080号


