结直肠癌作为高发恶性肿瘤,现有治疗手段常面临肿瘤特异性不足、副作用明显等问题。本文聚焦一种创新的双特异性抗体药物偶联物(ADC),该药物同时靶向结直肠癌中高表达的 pCAD 和 CDH17 两种细胞表面蛋白。研究通过独特的亲和力驱动筛选策略,成功研发出能精准识别双抗原阳性肿瘤细胞的抗体,并结合细胞毒性 payload MMAE,在动物模型中实现了对双抗原表达肿瘤的特异性杀伤,且对单抗原表达组织无显著影响。本文将从研究背景、技术路线、实验结果及临床前景等方面,全面解析这一突破性疗法的研发过程与应用价值,为结直肠癌精准治疗提供新方向。

引言:结直肠癌治疗的困境与 ADC 技术的崛起
在全球范围内,结直肠癌(CRC)是发病率和死亡率居高不下的恶性肿瘤之一。尽管手术、化疗、靶向治疗等手段不断发展,但肿瘤细胞的异质性和治疗靶向性不足仍是临床难题。传统化疗药物在杀伤肿瘤细胞的同时,常对正常组织造成损伤,导致严重副作用;而单一靶点的靶向药物则易因肿瘤细胞的抗原丢失或突变产生耐药性。
抗体药物偶联物(ADC) 的出现为解决这一困境带来了希望。ADC 由单克隆抗体、细胞毒性 payload(药物)和连接子三部分组成,其核心优势在于:借助抗体对肿瘤细胞表面抗原的特异性识别,将高毒性 payload 精准递送至肿瘤部位,实现 “精准爆破”。截至目前,已有多款 ADC 药物获批用于乳腺癌、淋巴瘤等恶性肿瘤治疗,但其在结直肠癌中的应用仍存在挑战 —— 关键在于找到兼具高肿瘤特异性和高表达的靶抗原。
近年来,研究发现pCAD(P - 钙粘蛋白)和CDH17(肝肠钙粘蛋白) 在结直肠癌中存在高频共表达,而在正常组织中极少同时出现。这一独特的表达模式,使其成为双靶点 ADC 研发的理想候选。本文将详细介绍针对这两个靶点的双特异性 ADC 的研发过程及其显著的抗肿瘤效果。
靶抗原的 “特殊身份”:pCAD 与 CDH17 的生物学特性
(一)pCAD:肿瘤侵袭与转移的 “助推器”
pCAD 属于经典钙粘蛋白家族,是一种依赖钙离子的细胞间粘附分子,主要参与上皮细胞的连接与维持。在生理状态下,pCAD 的表达局限于胎盘、皮肤等少数组织;但在病理状态下,它在结直肠癌、乳腺癌等多种肿瘤中异常高表达。
研究证实,pCAD 的过表达与肿瘤细胞的侵袭、转移密切相关。它可通过调控细胞骨架重组、促进上皮 - 间质转化(EMT)等机制,增强肿瘤细胞的运动能力和侵袭性。此外,pCAD 还能抑制肿瘤细胞凋亡,加速肿瘤生长。由于其在肿瘤组织中的特异性表达,pCAD 已成为 ADC 研发的热门靶点,如临床在研药物 PCA062、BC3195 均以 pCAD 为靶标,展现出一定的抗肿瘤活性。
(二)CDH17:消化道肿瘤的 “特异性标志物”
CDH17 同样属于钙粘蛋白家族,主要在胃肠道上皮细胞中表达,参与肠道黏膜的结构维持和功能调节。与 pCAD 类似,CDH17 在结直肠癌、胃癌、胰腺癌等消化道肿瘤中呈现高表达,而在正常组织中仅局限于小肠和大肠的少数细胞。
在结直肠癌中,CDH17 通过激活整合素信号通路促进细胞增殖,同时抑制凋亡,为肿瘤细胞的存活和扩散提供 “便利”。临床研究发现,CDH17 的表达水平与结直肠癌患者的预后密切相关,高表达者往往预后较差。基于这一特性,CDH17 已成为消化道肿瘤诊断和治疗的潜在靶点,目前已有抗体、光免疫偶联物等相关药物处于研发阶段。(三)共表达模式:双靶点策略的 “核心依据”
通过分析TCGA(癌症基因组图谱) 和GTEx(基因型 - 组织表达) 数据库的公开数据,研究团队发现:pCAD(由 CDH3 基因编码)和 CDH17 在结直肠癌中均呈现高表达,且二者的共表达主要集中在肿瘤细胞中;而在正常组织中,即使两者单独存在,共表达的情况也极为罕见(图 1)。
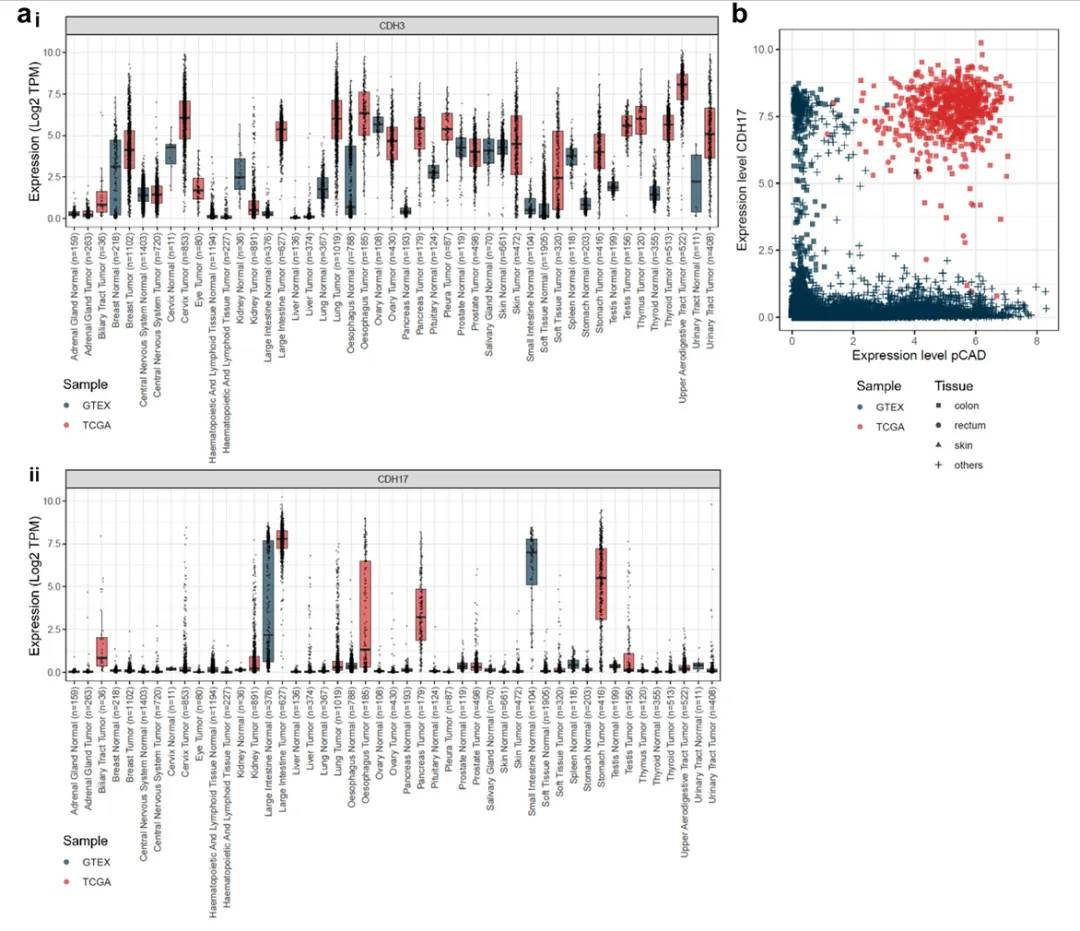
(a)CDH3(pCAD)和 CDH17 在不同肿瘤及正常组织中的 mRNA 表达水平;(b)结直肠癌与正常组织中 CDH3 和 CDH17 的共表达相关性分析
这一发现为双靶点策略提供了关键依据:通过同时靶向 pCAD 和 CDH17,理论上可使药物仅识别并攻击双抗原阳性的肿瘤细胞,而避免对单一抗原表达的正常组织造成损伤,从而大幅提高治疗的特异性和安全性。
双特异性 ADC 的 “诞生之路”:从抗体筛选到药物偶联
(一)核心设计理念:亲和力驱动的双靶点识别
传统单靶点 ADC 依赖抗体与单一抗原的结合,若靶抗原在正常组织中存在低表达,易导致 “脱靶” 毒性。为解决这一问题,研究团队提出 **“双抗原依赖”** 的设计思路:研发同时识别 pCAD 和 CDH17 的双特异性抗体,仅在两种抗原同时存在时,抗体才能通过“交叉臂亲和力”高效结合肿瘤细胞,进而释放 payload。
这种设计的关键在于:双特异性抗体对单抗原的亲和力较低,而对双抗原的亲和力显著增强(即 “亲和力驱动”),从而实现对双阳性肿瘤细胞的选择性靶向。
(二)Phase I:筛选高亲和力的 CDH17 抗体臂
研发的第一步是获得能特异性结合 CDH17 的抗体臂。研究团队构建了 24 种抗 CDH17 的单克隆抗体,并通过 “单价 vs 双价” 对比实验筛选高亲和力候选者:
单价抗体:仅含一个抗原结合位点,亲和力较低;
双价抗体:含两个抗原结合位点,通过多价结合增强与抗原的相互作用。
通过检测这些抗体对 CDH17 阳性细胞(如胃癌细胞系 SNU16、结直肠癌细胞系 HT29<sup>CDH17+</sup>)的增殖抑制能力,计算单价与双价抗体的 IC<sub>50</sub>比值 —— 比值越高,说明双价抗体的亲和力优势越显著(即 “亲和力驱动” 效应越强)。最终,7 种 CDH17 抗体臂脱颖而出,其中CDH17 11因在两种细胞系中均表现出最强的亲和力驱动效应,被选为最优候选(图 2)。
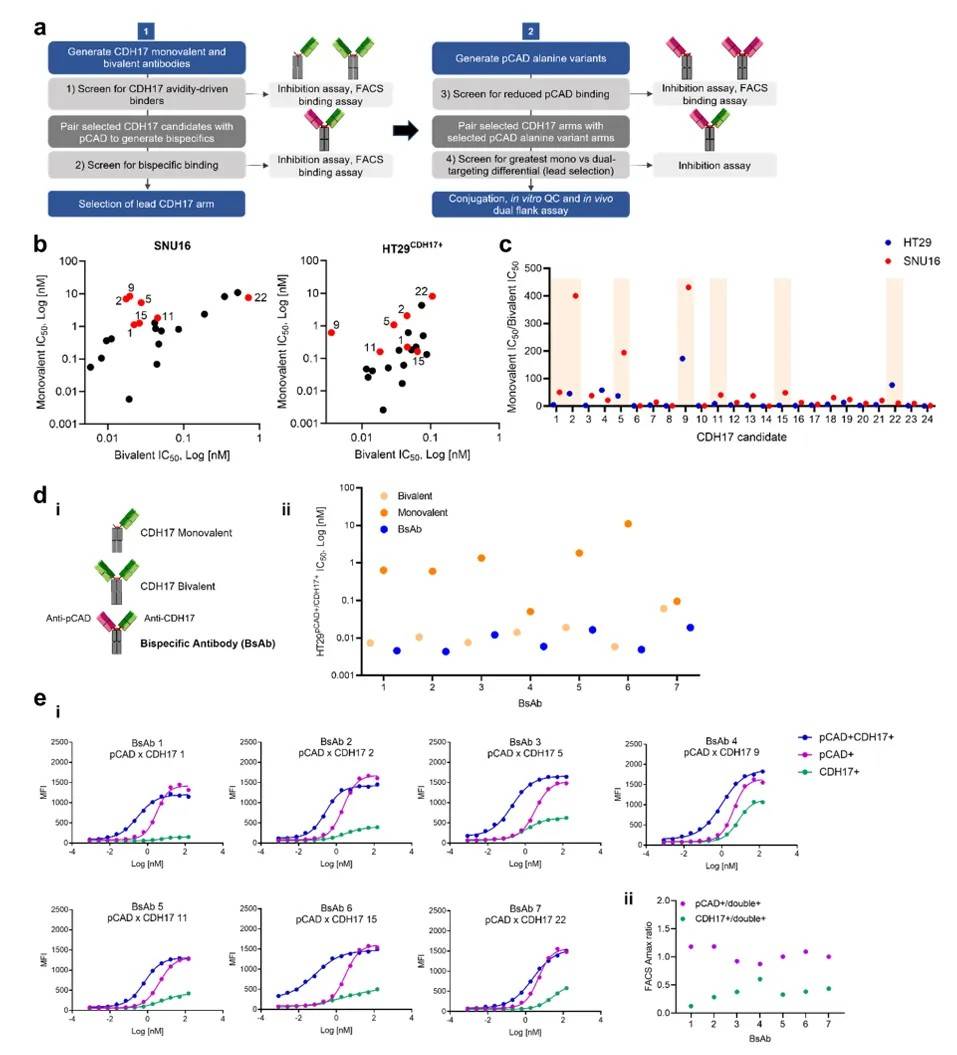
(a)筛选策略示意图;(b)不同 CDH17 抗体对 SNU16 和 HT29<sup>CDH17+</sup>细胞的增殖抑制曲线;(c)单价与双价抗体的 IC<sub>50</sub>比值,红色标记为入选的 7 种抗体
(三)Phase II:优化 pCAD 抗体臂的亲和力
为进一步提高双特异性抗体对 “双抗原阳性” 细胞的选择性,研究团队对 pCAD 抗体臂进行了 **“亲和力调谐”**:通过丙氨酸扫描技术,对 pCAD 抗体的轻链互补决定区 3(CDR3)进行氨基酸突变,构建 8 种亲和力不同的 pCAD 变异体。
筛选标准为:变异体对 pCAD 单阳性细胞的亲和力降低,但对双阳性细胞的亲和力仍保持较高水平。通过流式细胞术检测抗体与 pCAD 阳性细胞(HT29<sup>pCAD+</sup>)的结合能力,最终选择 3 种变异体(pCAD var1、var6、var2)与 CDH17 11 组成双特异性抗体(命名为 bsAb 8、9、10)。其中,bsAb10表现最优:对双阳性细胞(HT29<sup>pCAD+CDH17+</sup>)的增殖抑制能力强,而对 pCAD 单阳性细胞的抑制显著减弱(图 3)。
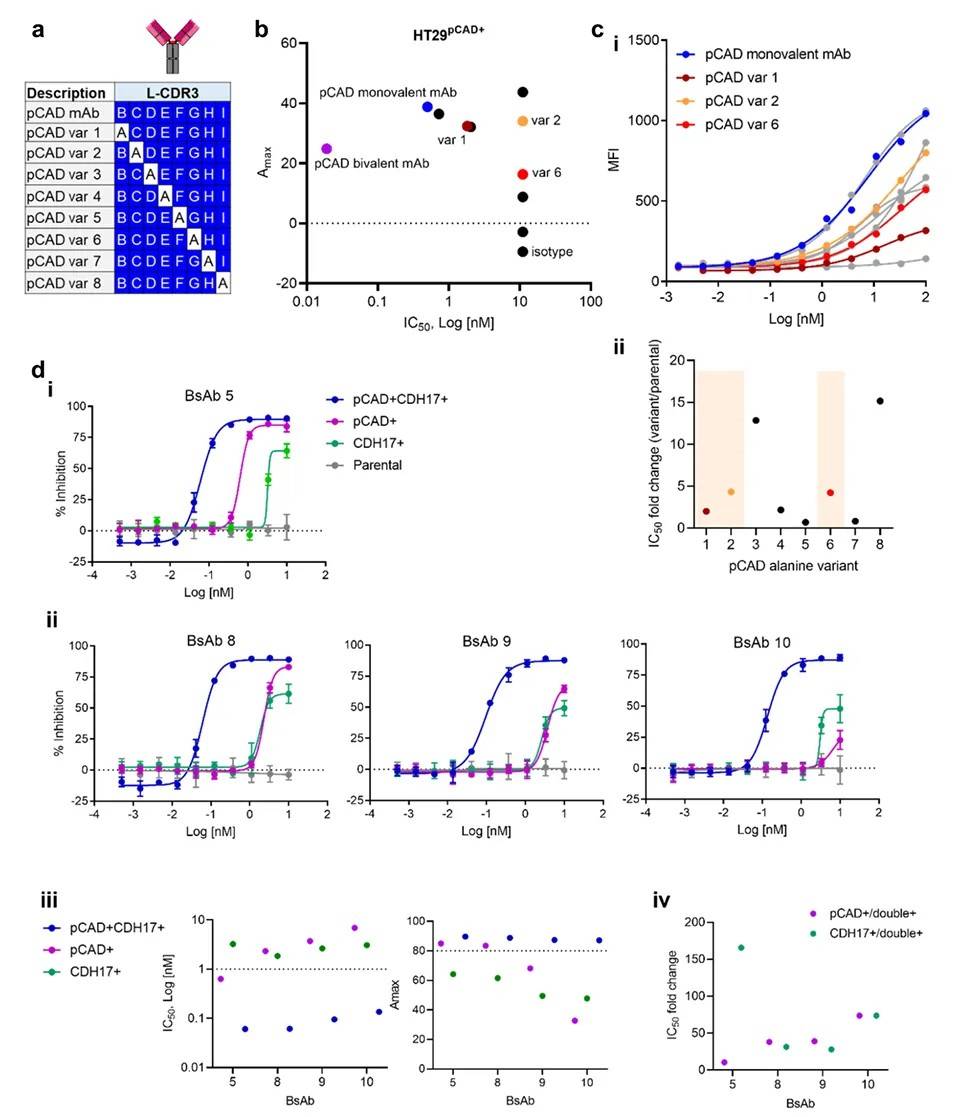
(a)丙氨酸扫描突变示意图;(b)不同 pCAD 变异体对 HT29<sup>pCAD+</sup>细胞的增殖抑制曲线;(c)bsAb 8、9、10 对单阳性和双阳性细胞的选择性抑制效果
(四)偶联细胞毒性 payload:MMAE 的 “精准投递”
选定最优双特异性抗体(bsAb 10)后,研究团队将其与MMAE(单甲基奥瑞他汀 E)偶联 ——MMAE 是一种高效微管抑制剂,可通过破坏细胞骨架诱导肿瘤细胞凋亡,是临床常用的 ADC payload 之一。
偶联过程通过 “硫醚键” 实现:在抗体的特定位点引入半胱氨酸残基,与 MMAE 的连接子(MC-VC)反应,形成稳定的 ADC。最终产物经检测,药物抗体比率(DAR)约为 2.0,满足临床应用的稳定性和有效性要求。
实验验证:双特异性 ADC 的 “精准打击” 能力
(一)体外实验:只杀 “双阳性”,不伤 “单阳性”
在细胞水平,研究团队测试了 pCAD×CDH17 双特异性 ADC 对四种细胞系的杀伤效果:
HT29 parental:pCAD 和 CDH17 均低表达(阴性对照);
HT29<sup>pCAD+</sup>:仅 pCAD 高表达;
HT29<sup>CDH17+</sup>:仅 CDH17 高表达;
HT29<sup>pCAD+CDH17+</sup>:双抗原高表达。
结果显示:ADC 对双阳性细胞的 IC<sub>50</sub>值(半抑制浓度)低至 0.01 nM,抑制率超过 90%;而对单阳性细胞的 IC<sub>50</sub>值超过 10 nM,抑制率不足 20%;对阴性细胞则几乎无影响。这表明,该 ADC 能通过双抗原识别,实现对肿瘤细胞的选择性杀伤。
(二)体内实验:双 flank 模型中的 “精准疗效”
为模拟临床场景,研究团队构建了两种双 flank 小鼠模型:
CDH17 双 flank 模型:右侧 flank 接种 HT29<sup>pCAD+CDH17+</sup>(双阳性),左侧接种 HT29<sup>CDH17+</sup>(单阳性);
pCAD 双 flank 模型:右侧 flank 接种 HT29<sup>pCAD+CDH17+</sup>(双阳性),左侧接种 HT29<sup>pCAD+</sup>(单阳性)。
给小鼠静脉注射 2.5 mg/kg 的双特异性 ADC 后,观察到:
在两种模型中,右侧双阳性肿瘤均出现显著缩小,部分小鼠实现完全缓解;
左侧单阳性肿瘤的生长几乎不受影响,与对照组(注射溶剂)无显著差异(图 4)。
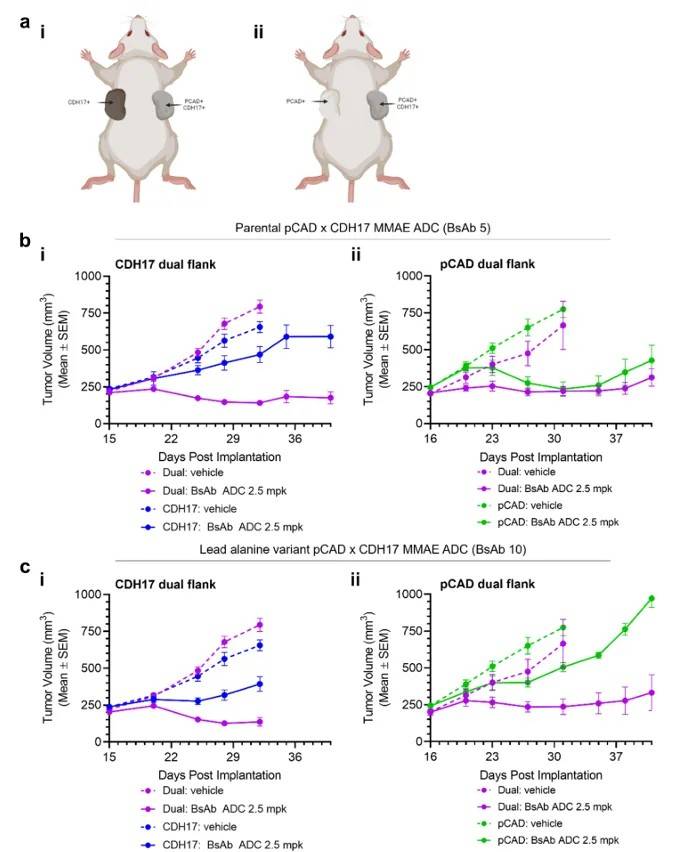
(a)CDH17 双 flank 模型中,双阳性肿瘤(右)被抑制,CDH17 单阳性肿瘤(左)继续生长;(b)pCAD 双 flank 模型中,双阳性肿瘤(右)被抑制,pCAD 单阳性肿瘤(左)继续生长
此外,药代动力学研究显示:ADC 在小鼠体内的半衰期约为 40 小时,能在肿瘤部位有效蓄积,且未观察到明显的全身毒性,进一步验证了其安全性和靶向性。
讨论与展望:双特异性 ADC 的临床潜力与挑战
(一)突破传统 ADC 的局限性
与传统单靶点 ADC 相比,该双特异性 ADC 的优势体现在:
更高的肿瘤特异性:依赖双抗原共表达实现靶向,降低对正常组织的损伤;
更强的耐药性克服能力:双靶点同时丢失的概率远低于单靶点,减少肿瘤逃逸;
更广泛的适用人群:针对 pCAD 和 CDH17 共表达的结直肠癌患者,覆盖人群较单一靶点更广泛。
(二)待解决的挑战
尽管研究结果令人鼓舞,该疗法仍需面对以下问题:
肿瘤异质性:部分结直肠癌组织中 pCAD 和 CDH17 的共表达比例较低,可能影响疗效;
旁观者效应:MMAE 释放后可能扩散至邻近细胞,对单阳性正常组织造成潜在毒性;
临床转化差异:动物模型与人类肿瘤微环境存在差异,需在临床试验中进一步验证安全性和有效性。
(三)未来研究方向
为推动该疗法的临床转化,研究团队提出以下计划:
扩大细胞系验证:在更多结直肠癌原代细胞或患者来源异种移植(PDX)模型中测试疗效;
优化给药方案:通过调整剂量、给药频率等,平衡疗效与毒性;
联合治疗探索:与免疫检查点抑制剂、化疗药物等联合使用,增强抗肿瘤效果。
结语
pCAD×CDH17 双特异性 ADC 的研发,是结直肠癌精准治疗领域的一次重要突破。其基于双抗原共表达的靶向策略,为解决传统 ADC 的 “脱靶” 问题提供了新思路。从靶抗原筛选、抗体优化到体内外验证,每一步都体现了 “理性设计” 与 “实验验证”的紧密结合。
随着研究的深入,我们有理由相信,这种双特异性 ADC 有望成为结直肠癌治疗的新选择,为患者带来更高的生存质量和更长的生存期。同时,其研发思路也为其他实体瘤的靶向治疗提供了宝贵的借鉴,推动 ADC 技术向更精准、更安全的方向发展。
排版编辑:肿瘤资讯-as











 苏公网安备32059002004080号
苏公网安备32059002004080号


