神经内分泌癌(NEC)作为神经内分泌肿瘤中分化差、恶性度高的亚型,其进展迅速、治疗棘手,对临床医生的诊断和治疗策略提出了严峻的挑战。本文分享一例广泛转移性肺大细胞神经内分泌癌(LCNEC)病例,详细介绍其诊断、多学科讨论及治疗的全过程,旨在探讨此类高度恶性肿瘤的治疗难点、生物标记物指导意义,以期为后续研究方向提供启示。
病例介绍
患者基本情况:患者,男性,58岁。
外院诊疗经过:患者于2020年12月因发现背部肿物3个月就诊,肿物存在按压痛。进一步对背部肿物行超声检查,提示为肋骨来源的实质性占位,考虑恶性肿瘤转移。
彩超示:背部肋骨距体表10mm探及椭圆低回声包块,大小约71mm×26mm×39mm,边界不清,回声增强,内部回声欠均,包绕肋骨,骨皮质回声中断。考虑:背部肋骨实性占位,考虑恶性肿瘤(转移性?)并肋骨破坏可能。
超声引导下肿物穿刺活检,病理示:(背部肿物穿刺组织)低分化癌,结合免疫组化结果倾向大细胞神经内分泌癌,免疫组化:Ki-67(约90%+),CK、Villin、EMA、CD56、Syn、CgA(+),TTF-1(个别弱+),CEA(少许弱+),CK7、CK18、CK19(部分弱+),NapsinA、Vim、CK20、CK5/6、P40(-),原位杂交结果:EBER(-)。

为求进一步诊治,患者于2021年1月至广州中山一院就诊。
CT示:左侧第9至11后肋、右侧第1肋骨头、上纵隔及右侧肺门处均可见肿块。同时,右侧锁骨下、纵隔及左侧肺门亦可见多发肿大淋巴结,考虑为恶性肿瘤性病变合并多发淋巴结转移。
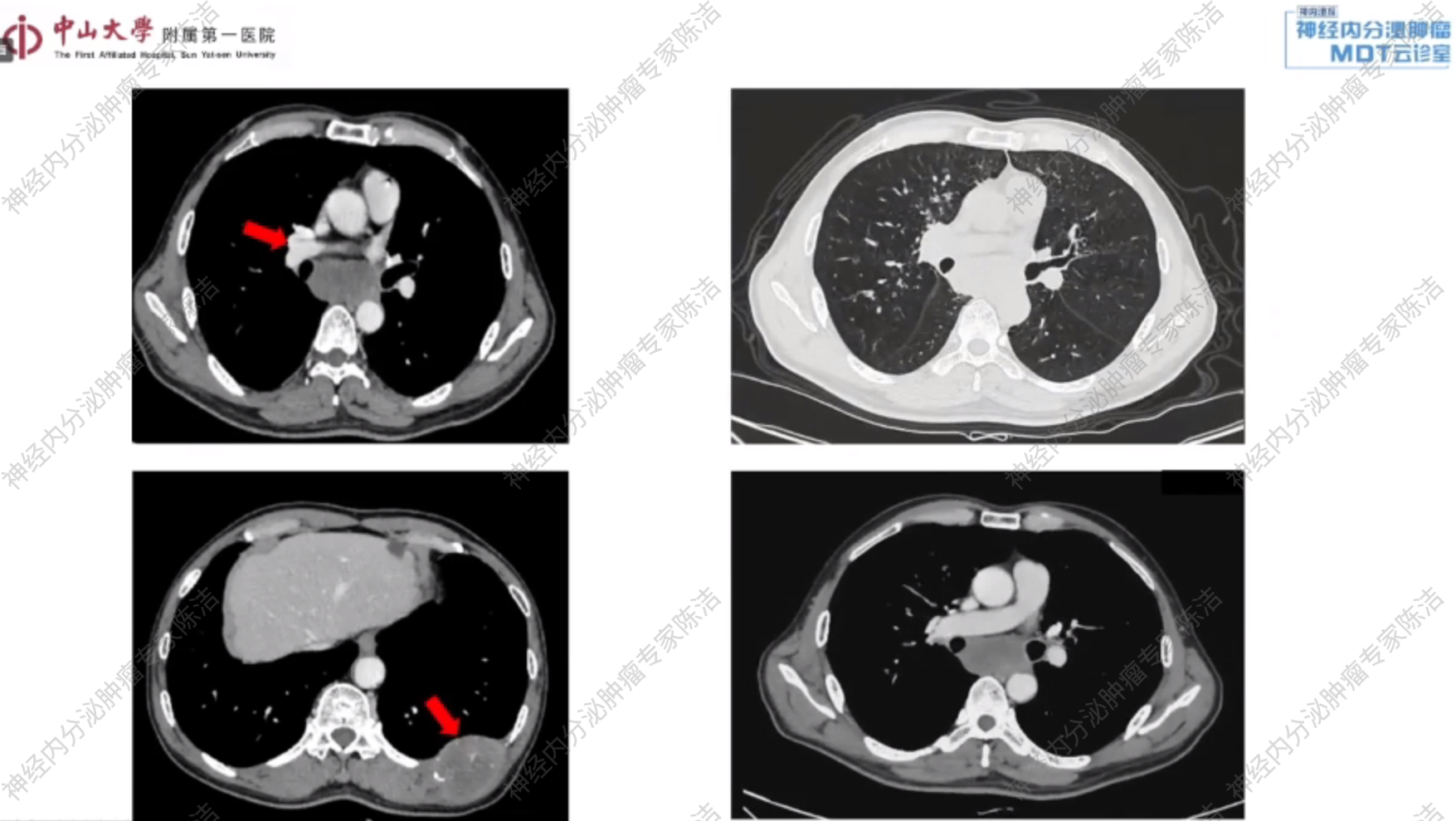
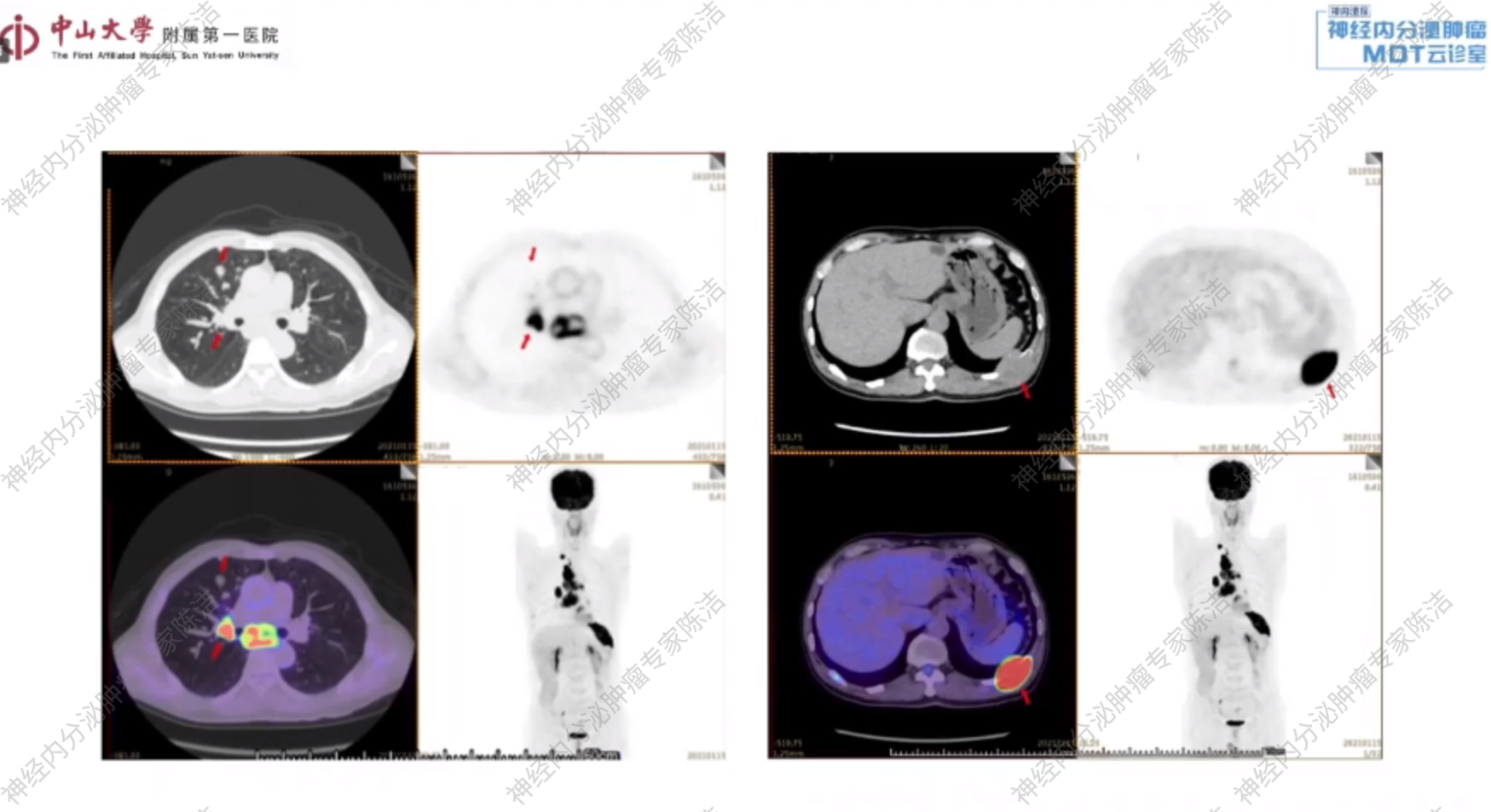
全身18F-FDG PET-CT:右肺上叶支气管近肺门处软组织肿物,代谢活跃,考虑恶性肿瘤(结合外院病理,可符合神经内分泌癌);右侧锁骨上窝、纵隔(2R、3A、4R、4L、5、6、7组)、胸骨右旁(内乳区)多发淋巴结转移,糖代谢活跃;左侧第10后肋骨质破坏并周围软组织肿物形成,代谢活跃,考虑骨转移。
病理会诊:原单位免疫组化结果:异型细胞CK(+), CD56(+), Syn(+), CgA(+), EMA(+), Villin(+), TTF-1少数弱(+), CEA部分(+), CK7部分(+), CK18部分(+), CK19部分(+), NapsinA(-), Vimentin(-), CK20(-), CK5/6(-), P40(-), Ki-67约90%(+)。原单位原位杂交结果:异型细胞EBER(-)。加做免疫组化结果:异型细胞CDX-2(-), SSTR2(-), MGMT(-),肿瘤间质内见数个CD8阳性细胞(热点区3个/HPF)。结合HE形态及免疫组化结果,病变符合低分化癌,考虑为神经内分泌癌,大细胞型。
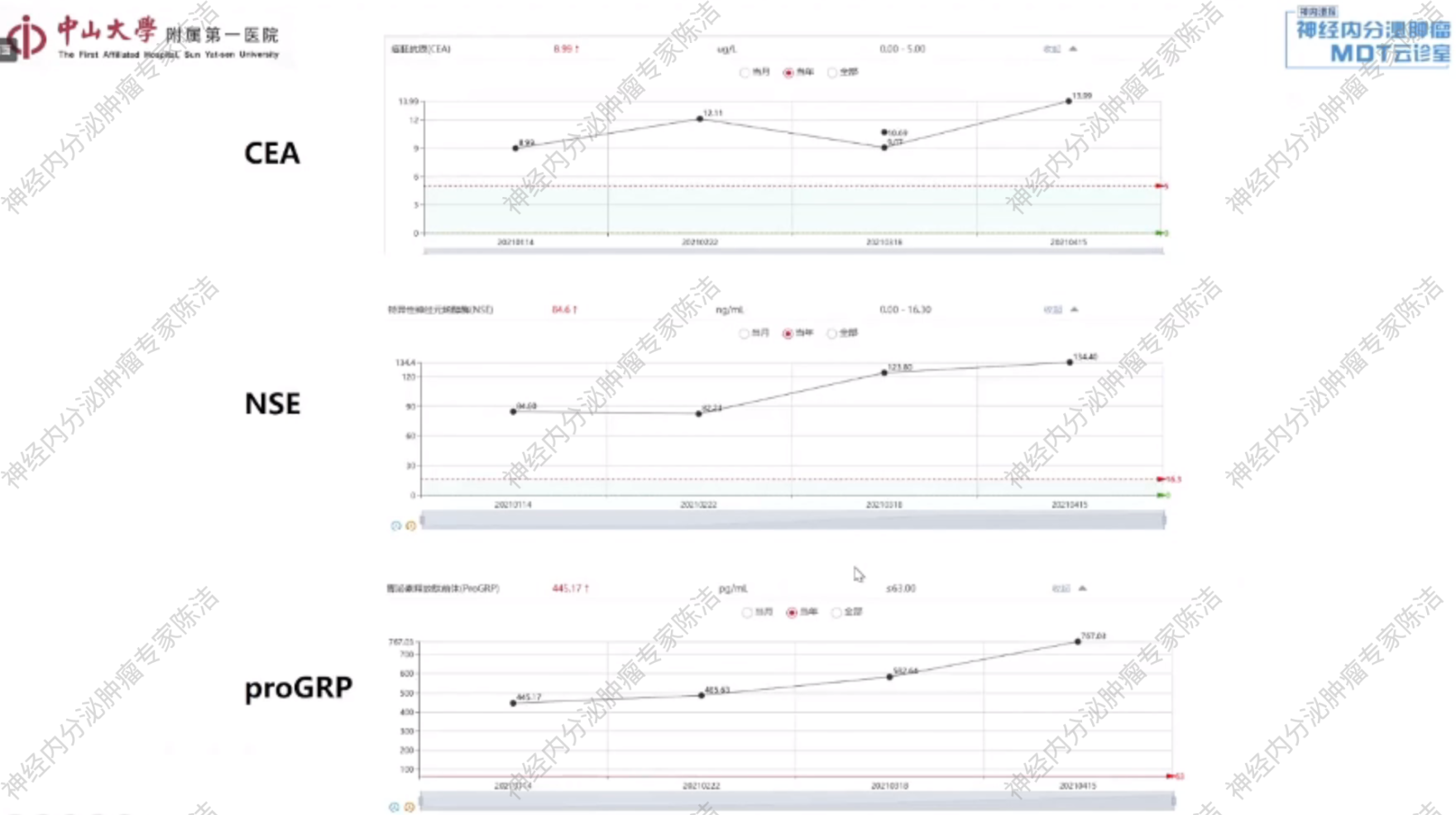
肿瘤标志物:癌胚抗原(CEA) 8.99 ug/L,神经元特异性烯醇化酶(NSE) 84.6ng/ml,胃泌素释放肽前体(ProGRP) 445.17 pg/ml。

分子检测:为指导后续治疗,进行了免疫治疗相关生物标记物筛查,结果显示:微卫星状态(MSI):MSI-L 5.07%。PD-L1 TPS<1%。CD8阳性浸润T淋巴细胞:数量较低。肿瘤突变负荷(TMB):高(16.77 Muts/Mb)。HLA LOH:强阳性(提示免疫治疗效果可能不佳)。基因检测发现TP53、RB1和POLD1基因突变。

治疗方案:综合考虑患者为肺神经内分泌癌,且TMB较高,经讨论后决定采用EP方案(依托泊苷+铂类)化疗联合PD-1单抗(特瑞普利单抗)治疗。

疗效评估(2021年4月,治疗3周期后):
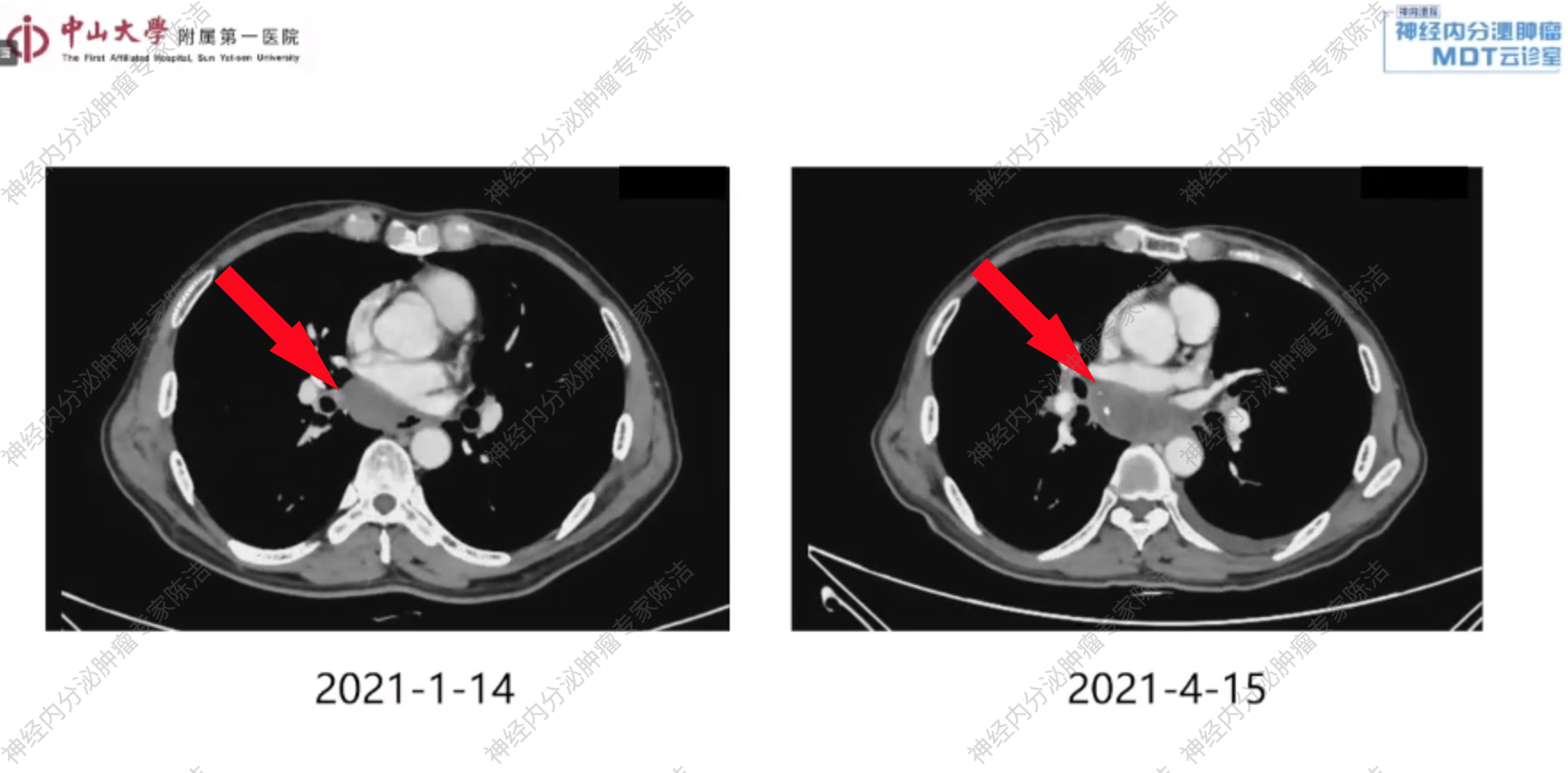
胸、腹、盆CT示:左侧9-11后肋处肿块较前增大,右侧第一肋骨头-上纵隔及右侧肺门处肿块较前缩小,右侧锁骨下、纵隔及左侧肺门肿大淋巴结较前相仿,考虑恶性肿瘤性病变并淋巴结转移。左侧肾上腺内侧肢结节,较前增大,考虑转移瘤。

肿瘤标记物:相较于治疗前均有所升高。
更换治疗方案:由于一线方案无效,与患者沟通后,将化疗方案更换为FOLFIRI方案,并保留PD-1单抗治疗,期望能观察到免疫治疗的延迟效应。患者在我院接受一周期治疗后,返回当地医院继续治疗。经电话随访得知,患者后续在当地尝试了多种治疗方案,但效果均不佳。最终,患者于2022年2月不幸离世。

多学科团队(MDT)讨论
病理科李媛教授:本病例的Ki-67指数高达90%,从形态学和免疫组化标记来看,诊断为大细胞神经内分泌癌是明确的。值得注意的是,如此高的Ki-67指数,结合基因检测发现的RB1和P53突变,强烈提示这是一个大细胞神经内分泌癌中的“小细胞亚型”。这类亚型的生物学行为与典型的小细胞肺癌高度相似,恶性程度极高。此外,尽管目前缺乏预测神经内分泌癌免疫疗效的完美生物标记物,但CD8阳性T细胞的浸润数量可能是一个有潜力的指标。本例患者的CD8细胞浸润不多,这或许也预示了其免疫治疗效果不佳。
放射诊断科汤伟教授:从基线CT影像上看,左侧肋骨的骨质破坏伴软组织肿块是典型的骨转移表现。纵隔内的多发巨大肿块,已对气管造成明显压迫,考虑为转移性淋巴结。在3周期治疗后的复查CT中,可以清晰地看到肋骨转移灶和部分纵隔淋巴结的显著增大,这为评估疾病进展提供了明确的影像学依据。
核医学科徐俊彦教授:对于Ki-67指数高达90%的神经内分泌癌,其生物学行为高度侵袭,肿瘤细胞增殖活跃,对葡萄糖的摄取极高。因此,单独进行FDG-PET/CT检查以评估全身肿瘤负荷和病变范围是完全足够的。这类患者的生长抑素受体(SSTR)通常为阴性,即便有少数表达,其疾病进展速度也远非生长抑素类似物等温和疗法所能控制,故无需进行68Ga-生长抑素受体扫描。本例患者的FDG-PET影像也证实了这一点,全身各处病灶均呈高度代谢状态。
陈洁教授总结
这是一个极具挑战性的病例,考虑是“小细胞亚型的大细胞神经内分泌癌”,这意味着它兼具了大细胞癌的形态和与小细胞癌相似的分子特征及侵袭性。
在治疗决策上,我们基于患者较高的肿瘤突变负荷(TMB-H),选择了化疗联合免疫治疗的策略,这是当时有据可循的尝试。我们选择特瑞普利单抗,是考虑到其在国内神经内分泌肿瘤领域有一定的临床试验数据支持,且对患者的经济负担较小。
然而,令人遗憾的是,患者对一线标准化疗和免疫治疗均未表现出应有的反应。这提示我们,肿瘤本身的极高恶性度可能超越了治疗所能带来的效果。在这种快速进展的疾病中,化疗的作用是“摁住”肿瘤,为起效较慢的免疫治疗争取时间。但当化疗本身都无效时,免疫治疗也很难扭转局面。
患者的总生存期为14个月,虽然略长于典型小细胞肺癌10-12个月的中位生存期,但这是在治疗节节败退的情况下取得的,提示现有治疗手段的局限性。此病例深刻地提醒我们,对于高度恶性的神经内分泌癌,即便有TMB-H等潜在的有利标记物,其治疗效果仍存在较大的不确定性。如何为这部分患者找到更有效的治疗靶点和联合策略,是我们未来需要不断探索和研究的重要课题。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-神经内分泌肿瘤免疫治疗专场回放:
https://doctor.liangyihui.net/#/doc/113808

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


