世界卫生组织国际癌症研究机构发布的2020年全球最新癌症负担数据显示,2020年,女性乳腺癌发病人数首次超过肺癌,成为全球最常见癌症。2020年,全球新确诊乳腺癌病例高达226万,约占所有新确诊癌症病例的11.7%,占女性新确诊癌症病例的24.5%,居于女性癌症发病首位。
同时,乳腺癌也是中国女性发病率最高的癌种。随着临床诊疗水平的提高,近年来乳腺癌的早期发现及治疗预后均有较大改善。但仍有很多乳腺癌患者初诊时即为晚期,确诊时伴有骨转移,严重影响预后。乳腺癌是最常见骨转移的实体瘤之一,65%~75%晚期乳腺癌会出现骨转移。乳腺癌骨转移常引起高钙血症、病理性骨折、功能障碍等一系列骨相关事件(SREs),严重影响生活质量,严重者甚至导致死亡。乳腺癌骨转移的倾向性及发生骨转移对预后影响的重要性均提示抗骨转移治疗可以使患者得到临床获益。
本文通过详细病例分析,呈现了多个合并骨转移的乳腺癌案例。病例在选择良好骨改良药物联合系统抗肿瘤治疗后取得持续稳定疗效,且生活质量良好。以期为乳腺癌骨转移病例的临床诊疗提供参考。
病例一
病例信息
基本信息及发病情况:
患者,年轻女性,32岁
2020年6月患者无意中发现右侧乳腺质硬肿块,1×1cm,未诊治,右乳肿块进行性增大。
半年后患者右乳肿块增大至5×4cm,并出现右乳皮肤红肿,皮温升高,伴右侧乳头凹陷、固定,2020年12月入院就诊。
辅助检查:
(1)乳腺及引流淋巴结超声:右侧乳腺皮肤水肿、增厚,可见多个低回声团块影,形状不规则,较大者位于外上象限,4.1×3.7cm,BI-RADS 4C类;右侧腋窝可见多个肿大淋巴结,皮质厚,部分淋巴门结构消失,较大者1.2×0.8cm,考虑转移;双侧锁骨区可见肿大淋巴结,皮质增厚,较大者1.6×1.0cm。
(2)胸部MR:右乳弥漫性异常强化影,范围约7.7×3.1cm,考虑乳腺癌,侵及右侧乳头、乳晕及皮肤;右侧腋窝多发肿大淋巴结,部分淋巴门结构消失,考虑转移可能;胸骨可见异常信号,增强扫描明显强化,考虑转移。(图1)
(3)胸腹盆腔CT及头颅MR:未见明确内脏及脑转移。
(4)骨扫描:胸骨、双侧肋骨、脊柱、骨盆多处骨代谢活跃,考虑多发骨转移。(图2)
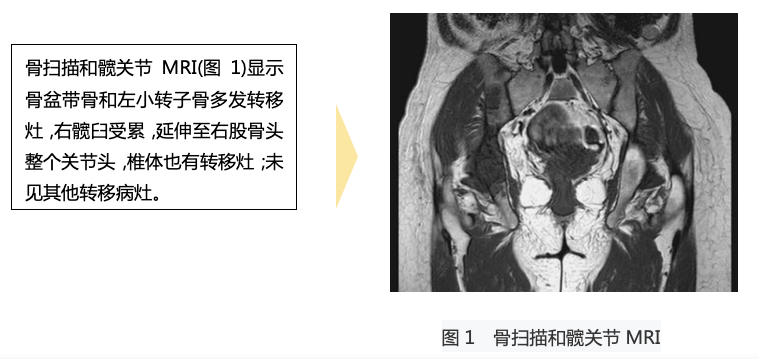
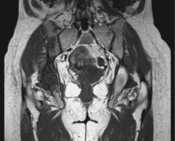
(5)全脊柱及盆腔MR:颈6、胸1/2/4/5/7/9/11/12、腰2-5、骶1/2椎体、双侧髂骨、髋臼、耻骨及左侧股骨上段异常信号影,考虑多发骨转移,未见明确病理性骨折及脊髓压迫。(图3)
(6)穿刺活检病理:右侧乳腺非特殊类型浸润性癌;右侧腋窝、双侧锁骨区淋巴结查见癌转移。免疫组化:ER(+,80%),PR(+,40%),HER-2(2+),FISH基因扩增阴性,Ki-67(+30%)。
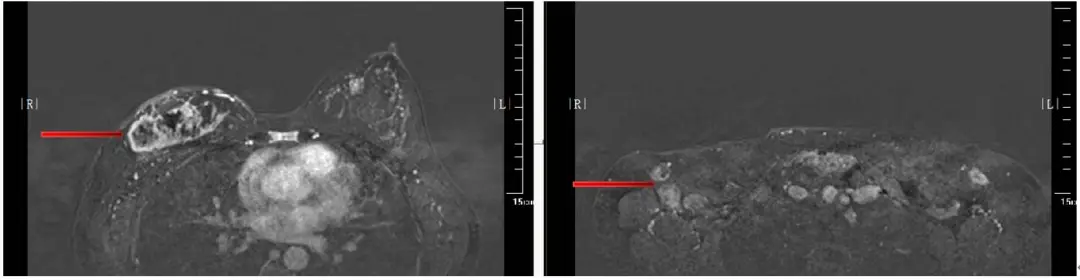
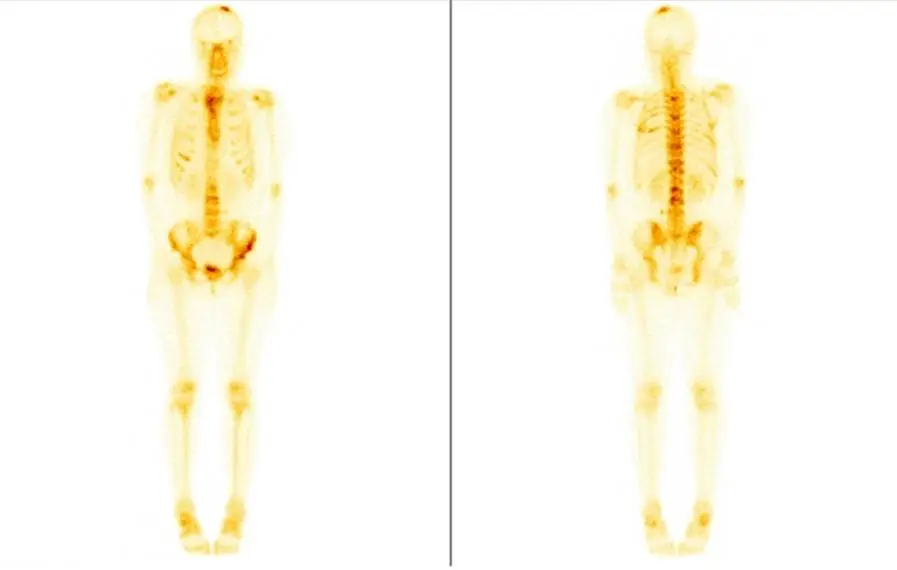
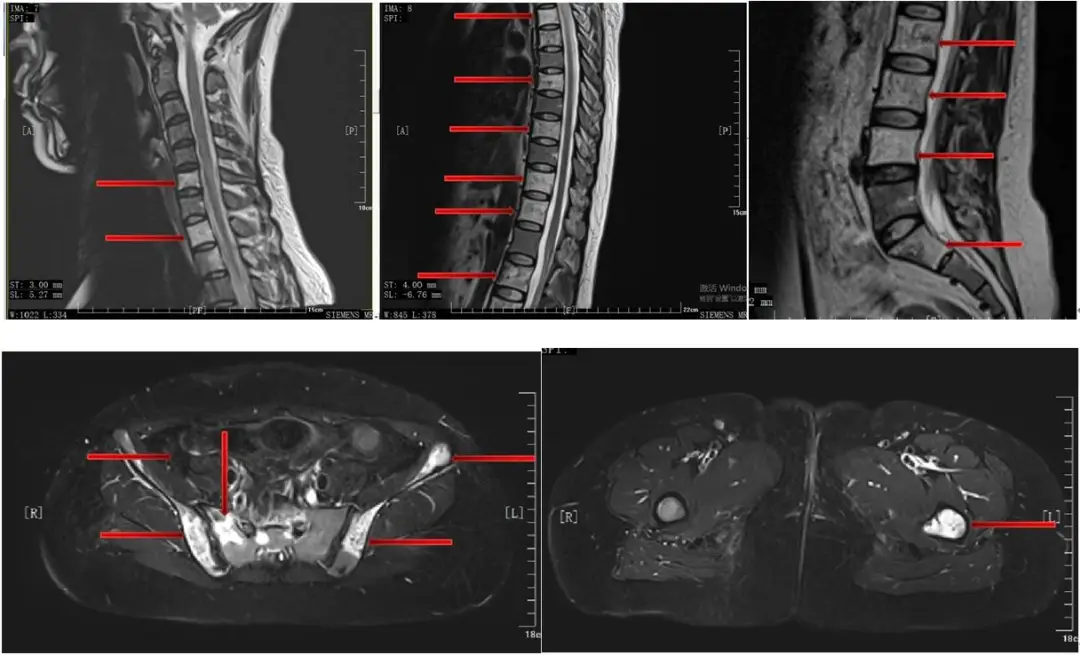
临床诊断及治疗
临床诊断:
1. 右侧乳腺浸润性导管癌(cT4dN3M1 初诊IV期 HR+/HER2-)
2. 多发淋巴结转移(右侧腋窝、双侧锁骨区)
3. 多发骨转移(颈胸腰骶椎、骨盆、股骨)
晚期阶段治疗:
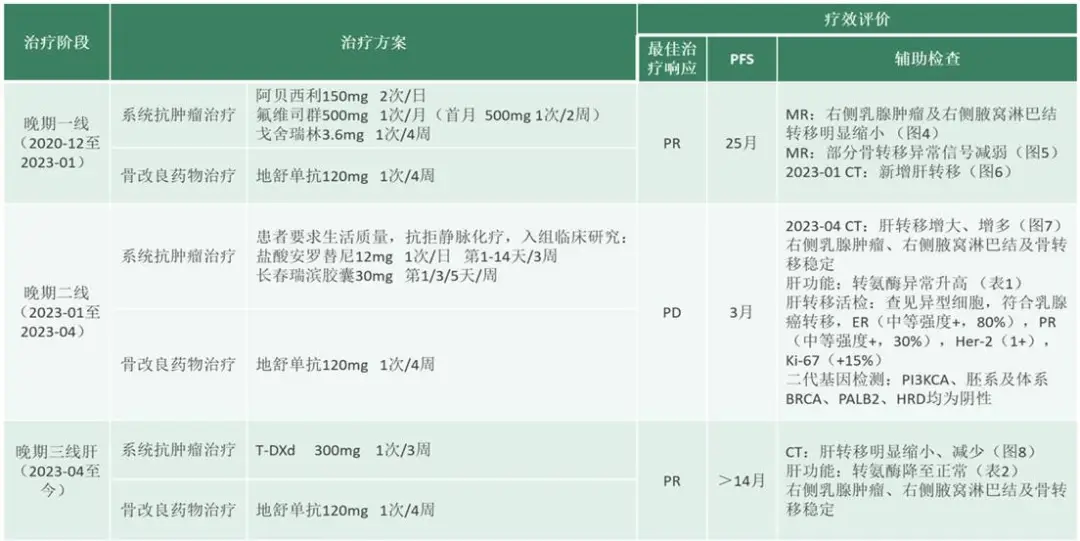
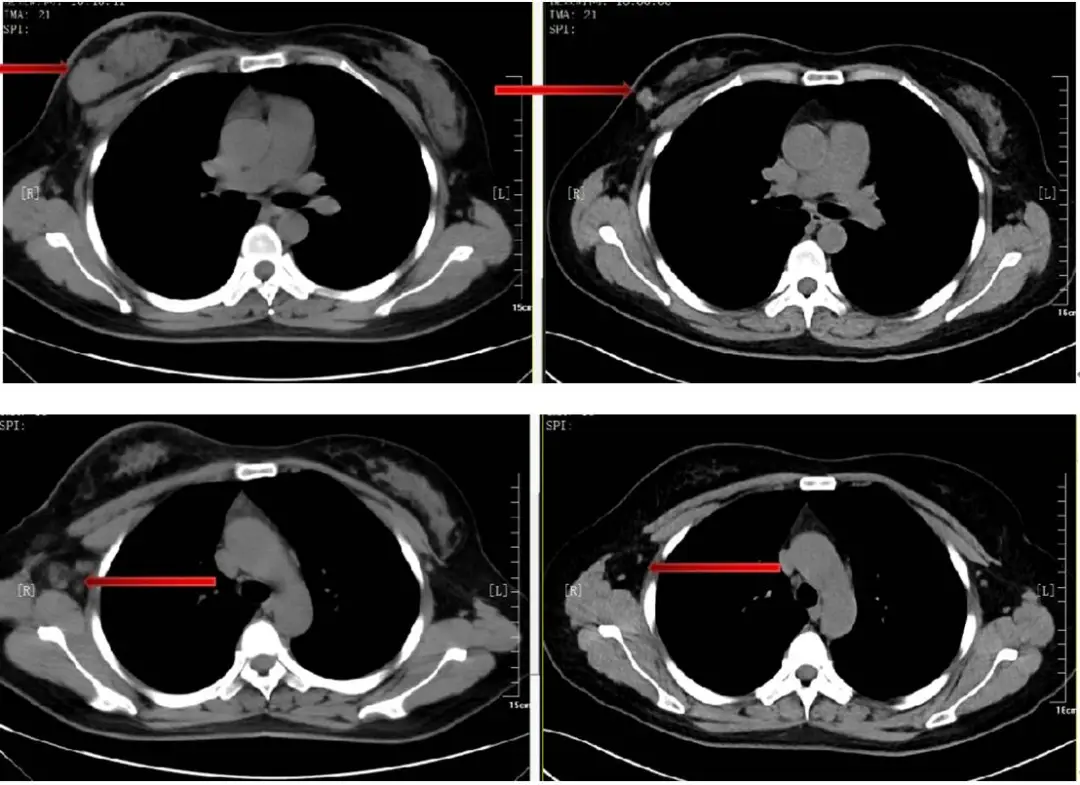
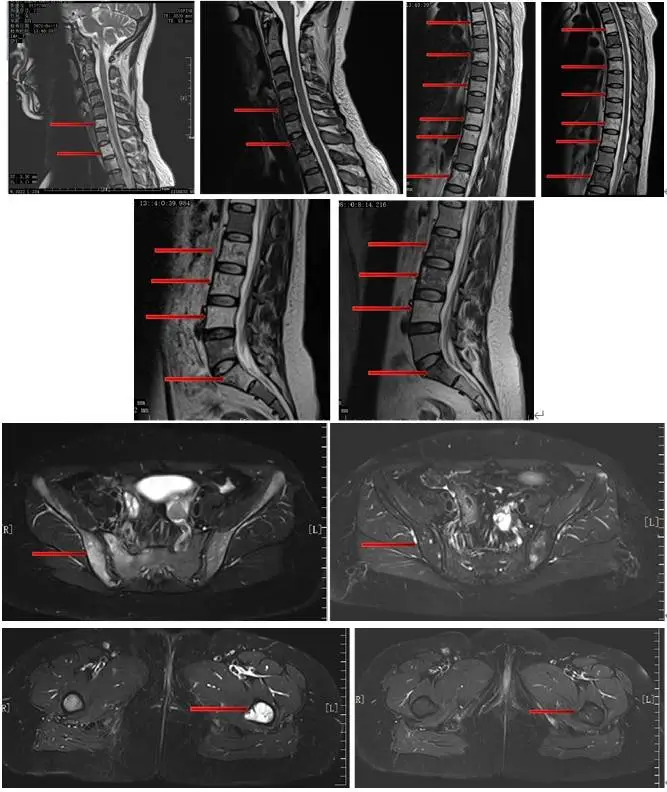
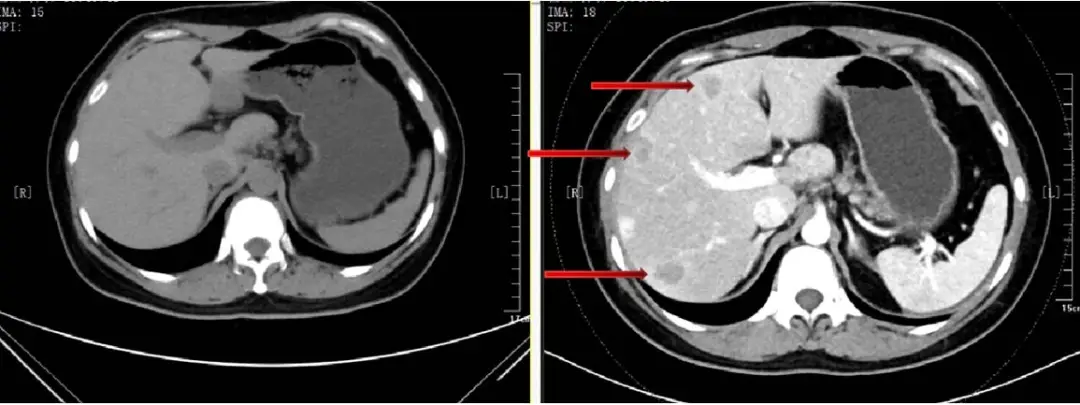
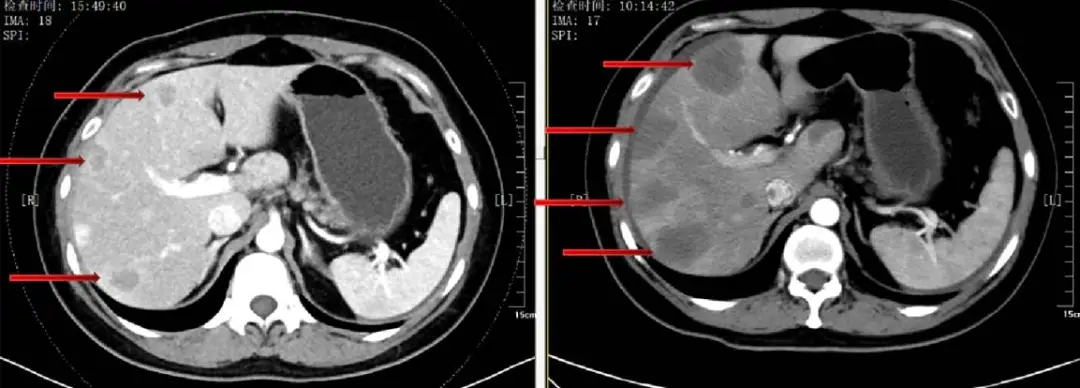
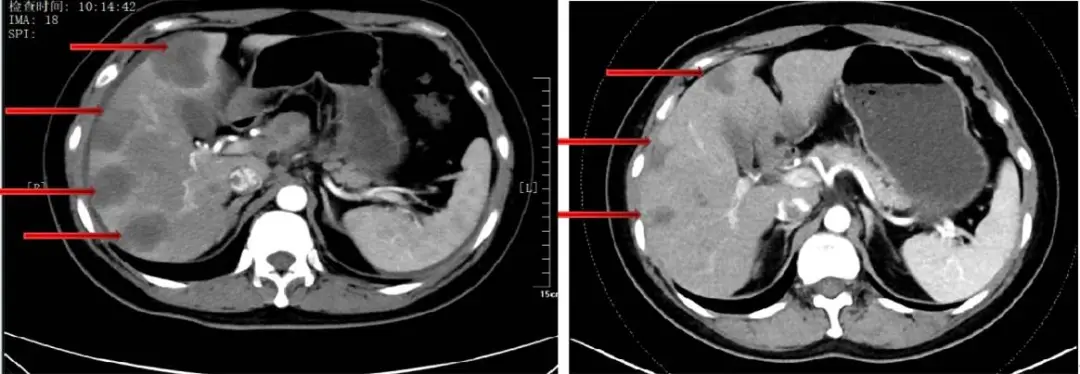
图8 三线治疗后腹部CT:肝转移缩小、减少
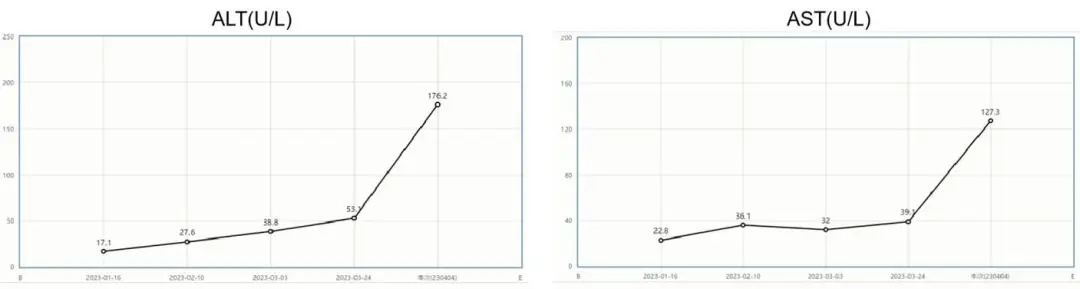
表1 二线治疗后肝功能:转氨酶异常升高

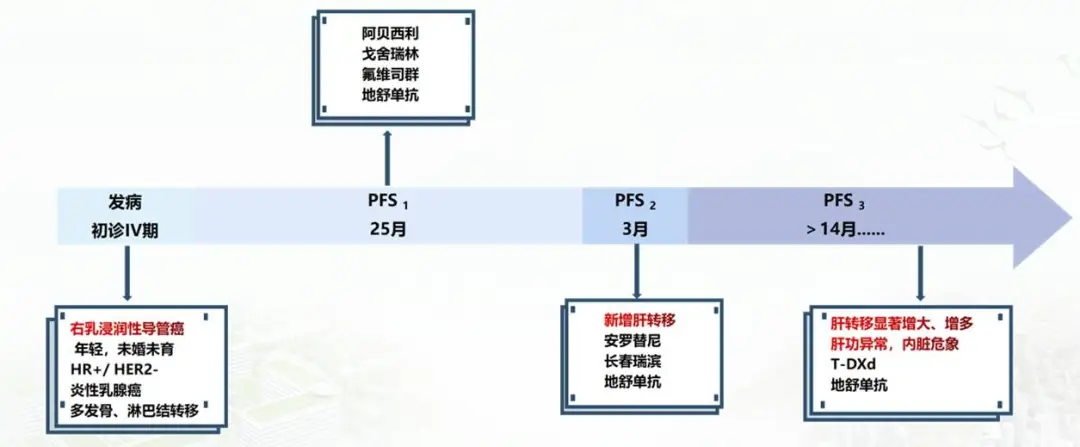
病程回顾
讨论与思考
1.骨转移局部治疗指征
乳腺癌是最常见骨转移的实体瘤之一,65%~75%晚期乳腺癌会出现骨转移[1],尤其是激素受体阳性患者更易出现骨转移[2],除了系统性治疗,抗骨转移治疗应贯穿于抗肿瘤治疗全程。对于一些存在骨转移并发症的病例还需要评估局部治疗指征。
(1)SINS评分系统可以用来评价脊柱稳定性,判断是否需要手术干预
根据骨转移位置、疼痛、骨损伤类型、有无脱位或畸形、椎体塌陷程度及后外侧结构累及程度进行评分,总分18分,分数越高则骨不稳定程度越大:

(2)使用Mirels评分系统评价四肢骨骨折风险
根据转移灶部位、疼痛程度、影像学表现、皮质累及范围进行评分,总分12分,得分越高提示骨折风险越大:

该患者SINS评分6分,整体脊柱稳定可,虽存在左侧股骨转移,但Mirels评分7分,骨折风险较小。且患者无明显骨痛症状,也没有即将/已发生的病理性骨折、脊髓压迫。综合考虑暂无需局部手术/放疗指征。在临床实践中,提倡对于伴骨转移患者,应该进行脊柱稳定性及四肢骨骨折风险评估,并可进行多学科讨论以决策是否联合局部干预。
2.地舒单抗:乳腺癌骨转移治疗的首选
在乳腺癌骨转移的初始治疗中,骨改良药物(Bone-modifying agents, BMAs)的选择至关重要。Study 136[3]是一项纳入2046例乳腺癌骨转移患者的大型研究,结果显示,与唑来膦酸相比,地舒单抗能显著延迟首次骨相关事件(SREs)的发生时间(未达到 vs 26.4个月;风险比 HR=0.82,95%CI 0.71-0.95,P<0.001),并将首次骨并发症的风险降低18%。
此外,地舒单抗还显著改善了患者的生活质量(P<0.05),且能减少需要强效镇痛药物的患者比例(P<0.05)。基于这些大样本临床研究的卓越结果,地舒单抗已改变了骨改良药物的治疗格局,并被包括NCCN 指南、ESMO及ASCO所制定的多项相关权威指南[4-6]推荐为乳腺癌骨转移患者的优先用药。
在本病例中,患者初诊时即确诊为多发性骨转移。鉴于地舒单抗在降低SREs风险方面的优越性,我们初始便选择了地舒单抗进行治疗。在系统性抗肿瘤治疗联合地舒单抗后,患者的骨转移范围和异常活性均得到显著改善。尽管后续出现了新的内脏转移甚至内脏危象,但骨转移病灶持续稳定,未出现病理性骨折等不良事件,患者的生活质量也因此得以维持。再次夯实了地舒单抗的卓越疗效。
3.骨改良药物长期使用的安全性管理
长期使用骨改良药物时,安全性管理是不可忽视的。Study 136[3]的数据显示,与唑来膦酸相比,地舒单抗组的肾脏损害和急性期反应发生率显著更低。然而,低钙血症在地舒单抗组中更为常见,因此,建议患者在治疗期间常规补充钙剂和维生素D。
另一个备受关注的不良反应是下颌骨坏死(ONJ)。在地舒单抗组中的发生率为2%,而唑来膦酸组为1.4%,二者无统计学差异。尽管ONJ的整体发生率较低,但由于其对患者生活质量的严重影响,仍然是临床最顾虑的不良反应之一。真实世界研究[7]观察到,更高的ONJ发生率与牙科治疗、既往使用双膦酸盐、以及接受抗血管生成治疗等因素相关。
一项探讨地舒单抗长期用药安全性的研究[8]对652例乳腺癌骨转移患者进行了中位时间为19.1个月(最长5年)的给药随访,结果表明地舒单抗的长期安全性良好。然而,该研究的开放标签延伸试验也提示,随着治疗时间的延长,ONJ的发生率会略有增加(2.5%)。
本病例中,患者接受地舒单抗治疗已超过3年,整体耐受性良好。通过常规补充钙剂,未发生低钙血症。每月一次的皮下注射方式也显著提高了患者的治疗依从性。在治疗过程中,我们反复强调口腔卫生,并避免了任何侵入性口腔操作,目前患者未出现ONJ。对于需要长期接受地舒单抗治疗、尤其合并上述风险因素的患者,仍需密切关注ONJ的发生,以便及早发现并干预,从而改善预后。
4.骨改良药物用药周期调整
关于骨改良药物的用药周期,OPTIMIZE-2研究[9]显示,对于接受唑来膦酸标准每4周(Q4W)给药1年后的患者,调整为每12周(Q12W)给药与Q4W相比,其抗骨转移疗效相当,但安全性更高。
这引发了一个问题:地舒单抗是否也能采用类似的间歇给药模式?一项回顾性研究[10]将地舒单抗的给药间隔分为短间隔组(<5周)、中间隔组(5-11周)和长间隔组(≥12周)。结果发现,较长的给药间隔并未影响患者首次SRE的发生时间(33.2% vs. 29.1% vs. 32.2%),同时还降低了ONJ(2.49% vs. 8.69% vs. 0%)和低钙血症(31.5% vs. 23.4% vs. 17.4%)的发生率。
尽管有此回顾性研究,但目前仍缺乏高级别的前瞻性临床试验证据来验证地舒单抗的间歇给药疗效。因此,国内外指南依然推荐地舒单抗维持每4周一次的给药间隔。临床上是否能进行周期调整,需结合患者的具体情况进行综合考量,如肿瘤原发灶的治疗效果、骨病灶的反应、以及血钙管理和口腔健康等因素,制定个体化的治疗方案。未来,需要更多前瞻性、大样本研究来进一步明确地舒单抗间歇给药的疗效和安全性,以更好地指导临床实践。
专家点评
1. 地舒单抗与唑来膦酸的药理学差异
在骨改良药物领域,地舒单抗与唑来膦酸的药理机制和代谢途径存在根本性差异,这也直接决定了它们在临床应用中的优劣。
地舒单抗是一种全人源化的IgG2单克隆抗体。它的作用机制是特异性地与核因子受体激活剂-κB配体(RANKL)结合,从而阻止RANKL与破骨细胞表面受体RANK的结合,同时抑制其与破骨细胞前体的结合。这种靶向性结合有效抑制了破骨细胞的活性和成熟。更重要的是,地舒单抗主要通过与RANKL形成复合物、非特异性细胞吞噬作用以及非特异性Fc受体介导的途径被清除,不通过肾脏直接代谢,因此不会造成肾毒性[11]。
相比之下,唑来膦酸通过抑制破骨细胞活性并诱导其凋亡来发挥作用。它主要通过被动的肾小球滤过和近端肾小管的主动转运排出体外。这种代谢方式使其具有潜在的肾毒性,且随着双膦酸盐治疗时间的延长,肾功能损害的风险会递增[12,13]。
基于这些药理学差异,西班牙医学肿瘤学会(SEOM)指南明确指出,对于肾功能不全的患者,地舒单抗应作为首选的骨改良药物,且无需调整剂量。也有研究[14]已证实,对于既往因唑来膦酸导致肾功能恶化的患者,改用地舒单抗后,肾功能可以得到一定程度的改善,这为临床实践提供了重要指导。
2. 从双膦酸盐到地舒单抗的序贯治疗策略
在临床实践中,当患者接受双膦酸盐治疗后出现SRE或骨骼疾病进展时,转换治疗方案是一种越来越普遍的模式。一项纳入255例伴骨转移实体瘤患者的回顾性队列研究[15]显示,从双膦酸盐转换为地舒单抗治疗,能显著延缓后续SRE的发生时间(HR=0.47,95%CI 0.25-0.88,P=0.019)。
这一发现提示我们,地舒单抗不仅是初始治疗的优选,也是双膦酸盐治疗失败或进展后的有效“补救”方案,能够进一步降低SRE风险。
3. 地舒单抗的优越性与SRE风险预测
一项对三个大样本临床研究的汇总分析[16]再次证实,地舒单抗可以显著延迟伴骨转移实体瘤患者首次SRE的出现。
更进一步,一项针对伴骨转移乳腺癌患者的多中心III期临床研究[17]通过单变量分析,识别出多个与SRE发生相关的风险因素:
· 黑人或非裔美国人血统
· 美国东部肿瘤协作组体能状况(ECOG)> 0
· 人表皮生长因子受体 2(HER2)阳性
· 尿N-端肽交联/肌酐比值(NTx/Cre)高
· 血清碱性磷酸酶(ALP)升高
在临床实践中,我们可以利用这些风险因素,更早地识别出SRE高风险人群,即使他们正在接受双膦酸盐治疗,也可以优先考虑转换为地舒单抗,以更有效地延缓SRE的发生。未来,我们期待能够开发出更精准的SRE评估工具,帮助我们筛选出那些能从地舒单抗治疗中最大获益的患者群体。
4. 专家点评与临床实践启示
本病例点评: 本例患者初诊时即为晚期并伴有广泛骨转移,我们从一线治疗开始便同步使用了地舒单抗来预防SREs的发生。这完全符合地舒单抗“早期使用、贯穿全程”的原则。治疗至今已超过3年,患者获益显著,不仅骨转移病灶得到有效控制,也未发生骨痛、病理性骨折等严重事件。
临床启示: 尽管美国临床肿瘤学会(ASCO)指南建议持续使用包括地舒单抗在内的骨改良药物,但由于缺乏更长期的安全性数据,临床决策仍需高度个体化。特别是对于ONJ高风险人群,需要加强监测和管理。关于地舒单抗能否像唑来膦酸一样采用间歇给药模式,以降低不良反应风险,目前仍缺乏大样本前瞻性研究的验证。因此,在未来,仍需更多高级别证据来指导我们优化地舒单抗的长期用药策略。同时,也期待未来有预测SRE的评估工具开发出来,可以帮助我们臻选出更能从地舒单抗骨改良治疗获益的人群。
病例二
患者基本情况
诊断:
45岁女性,2010年5月诊断位浸润性乳腺癌(ER+、PR+、HER2-);乳腺MRI显示右乳上外象限乳房实质不对称,轻度分叶,最大约2cm;无远处转移。
病史:
儿童时期诊断为肝肾多囊病,慢性肾衰竭期(血清肌酐水平:3.64 mg/dl;肌酐清除率:17 ml/min);同时患有继发性血小板减少症(血小板计数:80000 /mm3)和动脉性高血压,需要定期治疗。
治疗经过
1.一线抗癌治疗与进展:
· 2010年6月,患者成功接受肿瘤切除和前哨淋巴结活检。切除边缘无病灶,淋巴结未见瘤变,术后病理分级为pT1cN0。
· 给予局部放疗(全乳50 Gy +提高10 Gy)结合辅助激素治疗(他莫西芬20 mg/24h +曲普瑞林一季度一次)。
· 在接下来的3年里,患者继续接受内分泌治疗,临床耐受性良好。
· 2013年5月,患者出现肾功能衰竭,需要开始透析(每周3次)。
2.骨转移的诊断和治疗:
2013年6月,患者右髋关节疼痛逐渐加重,需要止痛。
2013年9月:行髋臼成形术,局部放疗(5次20 Gy右骨盆)。
2013年9月:开始使用来曲唑和曲普瑞林一季度一次进行一线激素治疗。
镇痛治疗:接受芬太尼透皮贴剂,由于耐受性差,芬太尼转用美沙酮;同时接受了非甾体抗炎药和对乙酰氨基酚的镇痛。
骨骼支持治疗:
· 2013年11月,由于当时地舒单抗不可及,给与患者帕米膦酸钠治疗,密切监测PTH、血清钙、磷。90mg, 28天静脉注射一次,与患者下午进行血液透析的时间一致,以确保适当的清除和避免潜在的药物毒性。
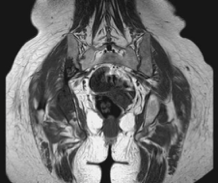
· 2013年12月观测到帕米膦酸钠后1个月骨组织病变稳定(图2)。
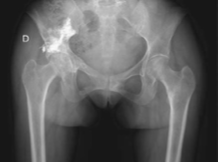
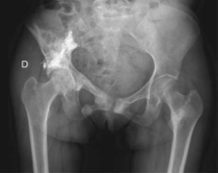
· 2014年2月X线片示右坐骨支、髂支骨折,右髂内侧未移位骨折(图3) 。
· 2014年3月,开始地舒单抗治疗,并继续接受激素治疗。地舒单抗120mg皮下注射,28天一次;同时口服钙补充。按常规监测血清钙、磷蛋白调整和每3个月监测PTH水平
3.地舒单抗治疗过程
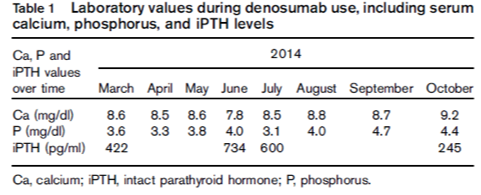
· 血清磷保持在正常范围内(表1)。
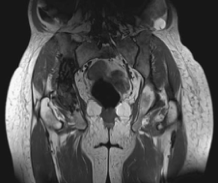
· 2014年4月,在地舒单抗治疗5周后,MRI显示出治疗效果和稳定性(图4)。
· 症状逐渐改善,美沙酮和止痛剂的使用剂量减少。
· 目前患者生活正常、Karnosfy评分:90%,对激素治疗加地舒单抗耐受性好。开始使用地舒单抗以来,没有观察到电解质或CKD的变化。
· 2014年9月:地舒单抗治疗7个月后,最后一次MRI及临床重新评估对地舒单抗治疗反应很好,骨病变稳定、无恶化(图5、6)。
医生诊疗经过小结
1.转移性骨病与肾功能不全患者的用药考量
对于同时患有转移性骨病和肾功能不全的患者,其抗肿瘤和支持性治疗药物的选择应高度个性化。在制定治疗方案时,我们优先考虑选择肾毒性较低、甚至无肾毒性的药物,以避免加重患者的肾脏负担,这是治疗决策的首要原则。
2.帕米膦酸的选择与考量
在本病例中,尽管帕米膦酸(Pamidronate)的输注时间相对较长,但考虑到当时它是本中心唯一可用的骨靶向药物,我们仍选择将其作为过渡期的治疗方案。此后4个月的治疗,我们观察到其在控制骨相关事件(SRE)方面取得了一定成效。
3. 双膦酸盐在肾功能不全患者中的应用风险
3.1 帕米膦酸的透析安全性
我们查阅文献[18]发现,一项研究显示在血液透析前给予帕米膦酸是安全的,因为其透析清除率与正常肾清除率相似,且生理状态下的透析时间与药物的正常清除半衰期相近。在乳腺癌患者中,帕米膦酸已被证实能显著降低骨相关事件的发生率(超过三分之一),并将首次SRE的中位发生时间延长了近50%。
3.2 双膦酸盐的肾毒性风险
然而,我们也认识到,这种用药方案存在潜在风险。双膦酸盐类药物通常与肾毒性相关,这可能导致患者的肾功能进一步恶化。其他双膦酸盐也同样观察到此类肾脏并发症。一项评估唑来膦酸治疗实体瘤或多发性骨髓瘤患者肾损伤风险因素的研究[19]发现,在338名参与者中,有8%出现了肾脏损害。该研究确定了以下几个显著的危险因素:
· 首次注射时的血清肌酐水平 > 1.4 mg/dl
· 糖尿病
· 高血压
· 使用沙利度胺(Thalidomide)
· 多发性骨髓瘤诊断
· 既往使用过帕米膦酸钠
4. 治疗方案的调整与效果
基于上述风险评估,以及考虑到最大化治疗效果并最小化肾毒性风险的考量,我们在地舒单抗获准进入本研究中心后,立即为患者调整了治疗方案。在随后的7个月中,患者接受了地舒单抗治疗。治疗期间,我们未观察到患者出现明显的电解质紊乱或慢性肾病(CKD)加重的情况,表明新方案在控制病情的同时,显著降低了对肾功能的潜在影响。
专家点评
1.乳腺癌骨转移的临床挑战
在乳腺癌患者中,骨转移极为常见。随之而来的骨痛、病理性骨折等骨相关事件(SRE)严重影响患者的生活质量。因此,SRE的预防和治疗是乳腺癌骨转移管理中的关键。
2.骨靶向药物的选择
根据欧洲肿瘤学会2014年发布的《癌症患者骨健康指南》[20],一旦诊断出骨转移,应立即启动骨靶向药物治疗。该指南明确推荐唑来膦酸和地舒单抗作为骨改良药物,因其在减少和延缓SRE方面显示出良好的疗效和便捷性。研究[19]进一步表明,与唑来膦酸相比,地舒单抗在乳腺癌、前列腺癌及其他实体瘤患者中,能将首次SRE的风险降低17%。
3. 肾功能不全的挑战与用药考量
对晚期癌症患者而言,严重的肾功能不全是一个复杂的临床挑战。据统计,约50%的癌症患者肾小球滤过率(GFR)低于90 mL/min。如果同时存在骨转移,这一比例会更高,约50%的患者GFR小于60 mL/min [21,22]。这可能是由于肾毒性化疗药物(如卡培他滨或铂类)的使用[23,24],或由恶性高钙血症(通常与肿瘤分泌甲状旁腺激素相关蛋白或溶骨性转移有关)所导致。
4. 地舒单抗在透析患者中的应用
该病例报告了地舒单抗在一位接受透析治疗的骨转移患者中的应用。由于存在大块骨骼受累和高骨折风险,我们必须选择一种个性化的治疗方案,优先考虑肾毒性低甚至无肾毒性的药物。
不同于主要通过肾脏代谢的双膦酸盐,后者通常被列为透析患者的禁忌药物。地舒单抗是一种大分子量的全人源单克隆抗体,其靶向作用于RANKL,不经肾脏清除[24]。多项研究[26,27]证实,地舒单抗的安全性和有效性不受肾功能不全的影响,因此无需根据患者的肾功能状况进行剂量调整,这确保了最大的治疗效果和最小的肾毒性风险。
在本病例中,患者在启动地舒单抗治疗7个月后,骨痛症状几乎完全缓解,影像学检查也显示骨转移病灶得到改善。患者耐受性良好,未出现任何相关不良事件。这一结果再次证明,地舒单抗可有效预防骨转移患者的SRE,即使是那些伴有严重肾功能损害甚至需要透析的患者。
5. 地舒单抗与钙稳态管理
值得注意的是,肾功能受损可能改变钙稳态。一项针对慢性肾病(CKD)患者使用地舒单抗的研究[25]显示,在包括16名透析患者在内的研究对象中,仅有12%的患者出现了低钙血症(有症状或蛋白校正钙 < 7.0 mg/dL)。通过补充钙和维生素D,大部分患者的低钙血症仅是短暂的轻度症状,且在密切监测下可自行缓解。地舒单抗在CKD患者中表现出良好的耐受性。
6.结论
综上所述,肾功能不全在癌症患者中并不少见。对于晚期骨转移并伴有肾功能不全的乳腺癌患者而言,地舒单抗因其独特的代谢途径和优越的疗效,是防治SRE的理想治疗选择。它不仅能有效控制骨转移进展,同时也能最大程度地保护患者的肾功能。
病例三
病史简介
患者为70岁女性。
主诉:因“右乳癌术后2年,胸骨疼痛3周”2021年5月11日入院。
既往史:既往“高血压病病史”5年,“过敏性哮喘”50年,无烟酒嗜好。
查体:右乳缺如,右胸壁见长20cm术痕,愈合好,胸骨压痛,东部肿瘤协作组(ECOG)体能状态(PS)评分1分,数字疼痛分级法(NRS)评分6分。
外院治疗经过如下:
2019-5-16,患者在某三甲医院进行右乳腺改良根治术;术后病理:(右乳)非特殊型浸润性乳腺癌3级(大小2*2*1cm)伴高级别导管原位癌,间质TIL低浸润,查见脉管侵犯,乳突、乳腺表面皮肤、基底及周围手术切缘内均未见癌累及,送检同侧腋窝淋巴结内查见癌转移(1/20),送检的“胸大小肌之间淋巴结”镜下为脂肪纤维组织,未见癌累及。
免疫组化:ER(-),PR(-),Her-2(0),Ki-67阳性率约20%。
术后分期:pT1cN1aM0,II期。
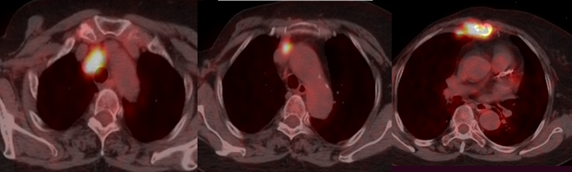
2021-1-11 PET-CT:
1.右侧内乳区、纵隔内血管前间隙、气管前腔静脉后、右上气管旁淋巴结代谢增高,考虑转移;
2.胸骨体溶骨性骨质破坏伴软组织密度,代谢增高,考虑胸骨转移瘤(图1)。
入院诊断
右乳癌术后化疗后、右侧内乳区淋巴结转移、纵隔淋巴结转移、胸骨转移瘤、pT1cN1aM0,II期→cT0N2bM1,IV期、非特殊型浸润性乳腺癌3级伴高级别导管原位癌三阴型(TNBC)。
入院后治疗经过
2021-5-15至2021-7-29四周期化疗:紫杉醇(白蛋白结合型)200mg d1,100mg d2 ,q3w,(第1周期200mg)。
2021-5-17至2021-8-12行地舒单抗注射液(安加维)120mg ih(皮下注射) q4w,4周期。
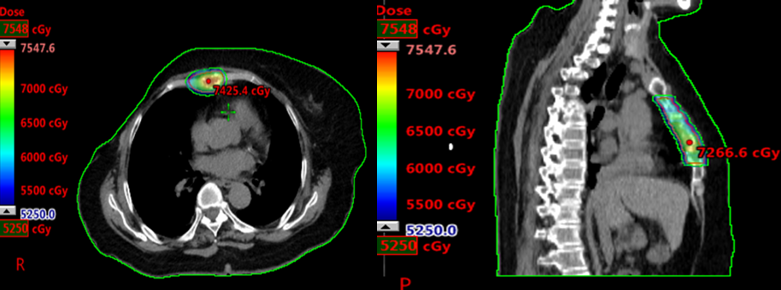
2021-7-12至2021-7-30行胸骨转移区放疗98%PTV 52.5Gy/3.5Gy/15Fx。
地舒单抗使用期间,转移淋巴结和骨转移疗效评价达PR
影像学评估:患者两周期(2021-6-30)以及四周期(2021-8-19)化疗联合地舒单抗治疗后,胸部CT纵隔窗显示纵隔2R区转移淋巴结较治疗前明显缩小,转移淋巴结疗效评价PR。
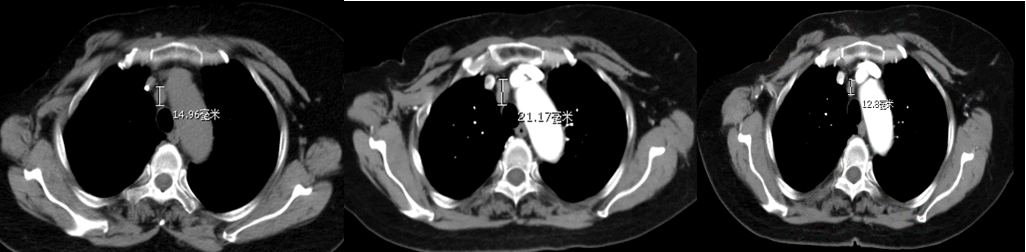
影像学评估:胸部CT纵隔窗显示胸骨转移病灶较治疗前明显缩小,溶骨性骨质破坏减轻,并成骨改变,骨转移疗效评价PR。

影像学评估:胸部CT骨窗也显示胸骨转移病灶较治疗前明显缩小,溶骨性骨质破坏减轻,并成骨改变,骨转移疗效评价PR。
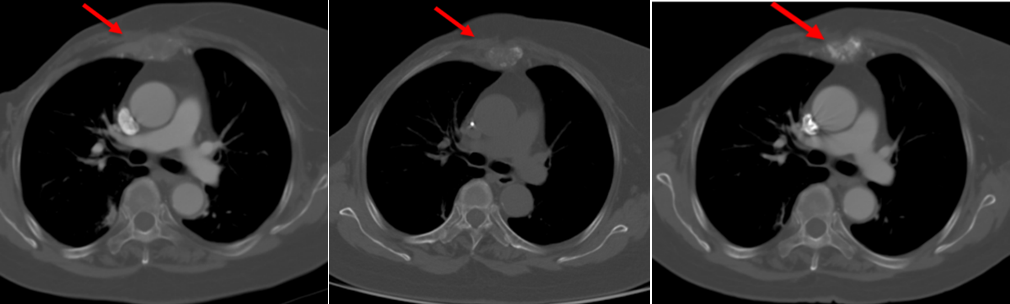
地舒单抗使用期间,疼痛明显缓解
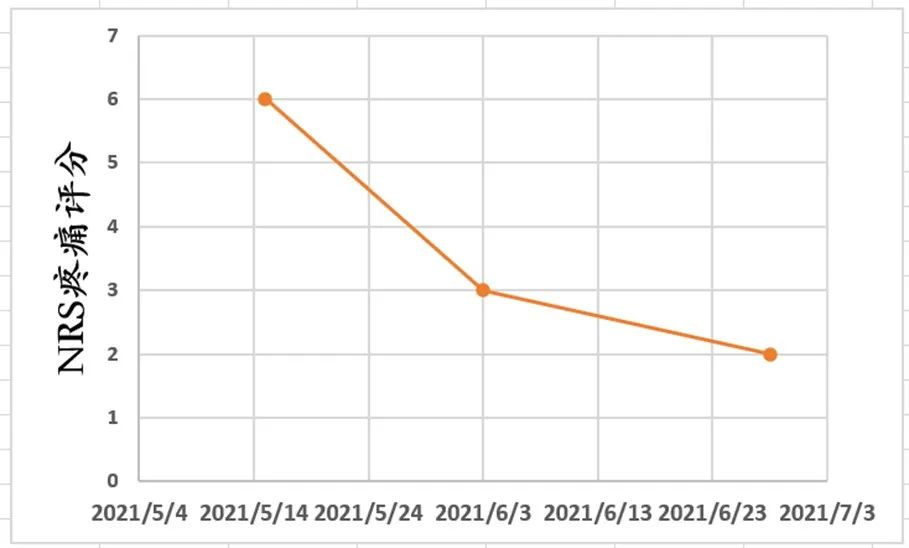
地舒单抗治疗前,骨转移疼痛评分(NRS 6分),治疗后NRS评分显著下降,为2分。
治疗小结及思考
乳腺癌骨转移的综合治疗,核心目标在于恢复功能、控制肿瘤进展、预防及治疗骨相关事件(SREs)、缓解疼痛并改善患者生活质量[28]。在这一过程中,骨靶向药物的应用应遵循“早期起始、贯穿全程”的原则,这已成为2014年欧洲肿瘤内科学会(ESMO)《肿瘤患者骨健康指南》[29]中的共识。本病例完美地诠释了这一治疗理念。患者为晚期三阴性乳腺癌(TNBC),在接受一线化疗的同时,我们同步使用了地舒单抗来预防SREs的发生。值得关注的是,在仅使用了两次地舒单抗后,患者的症状就得到了显著缓解,其NRS评分从6分降至2分。同时,骨转移病灶的影像学评估也达到了部分缓解(PR)。这一显著的早期疗效令人鼓舞,充分印证了地舒单抗在早期干预中的卓越价值。
此外,该案例也为我们提供了重要的临床启示:地舒单抗与放疗,尤其是与大分割放射治疗(包括立体定向放射治疗,SBRT)的联合,有望成为改善骨转移相关SREs的最佳组合,从而进一步提升治疗效果。地舒单抗独特的直接和间接抗肿瘤作用也值得我们深入探索和关注。
专家点评
乳腺癌是女性最常见的恶性肿瘤,其中晚期患者骨转移的发生率可高达75%。由此引发的病理性骨折等SREs严重影响患者的生存质量[30]。骨改良药物可以预防和治疗SREs,应作为乳腺癌骨转移治疗的基本用药。因此,骨改良药物作为晚期乳腺癌骨转移治疗的基础用药,其选择至关重要,一般建议每月一次给药[28]。
本案例中,患者为晚期TNBC,其一线全身治疗方案采用了化疗同步联合地舒单抗。地舒单抗仅使用两次、不到两个周期的时间,就使骨转移病灶达到PR,骨痛评分显著下降,其迅速而显著的SREs预防效果令人印象深刻。
地舒单抗之所以能取得如此优异的临床表现,与其独特的作用机制密不可分。作为一种人免疫球蛋白G2(IgG2)单克隆抗体,它对RANKL具有高度特异性和亲和性。通过与RANKL结合,地舒单抗能够有效阻断破骨细胞中RANK信号通路的激活,从而打破肿瘤骨转移的恶性循环” [31]。这一机制使其在治疗骨转移和抑制肿瘤生长方面都具备显著优势。
一项纳入5723例恶性实体瘤骨转移及多发性骨髓瘤患者的Meta分析[31]显示,与唑来膦酸相比,地舒单抗将首次SREs的发生时间显著延迟了4.3个月,并将风险比降低了17%(P<0.0001)。此外,地舒单抗的贫血、肾毒性及急性期不良反应发生率均明显低于唑来膦酸。
另一项针对乳腺癌骨转移患者的研究[32]进一步证实了其优越性:地舒单抗能够延长首次SREs发生的中位时间(32.4个月 vs. 27.4个月),降低SREs发生率(31% vs. 36%),且肾毒性发生率更低(4.9% vs. 8.5%)。
除了卓越的疗效和安全性,地舒单抗的皮下注射给药方式也提供了极大的便利性,显著提高了患者的依从性。基于这些优异的临床表现,《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》[33]同样对地舒单抗予以了推荐。这一权威指南的更新充分肯定了地舒单抗在预防骨转移SREs中的核心地位。随着其在国内获批相关适应症及医保目录的纳入,相信将有更多乳腺癌骨转移患者从中获益。
[1] Ibrahim T, Mercatali L, Amadori D,et al. A new emergency in oncology: Bone metastases in breast cancer patients (Review). Oncol Lett. 2013;6:306-10.
[2] Ye LJ, Suo HD, Liang CY, et al. Nomogram for predicting the risk of bone metastasis in breast cancer: a SEER population-based study. TRANSL CANCER RES. 2020-11-01;9(11):6710-6719.
[3] Stopeck AT, Lipton A, Body JJ,et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol. 2010 Dec 10;28(35):5132-9.
[4] NCCN Clinical Practice Guidelines in Oncology, Breast Cancer,Versdon 1.2024.
[5] Coleman R, Hadji P, Body JJ, et al. Bone health in cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2020;31(12):1650-1663.
[6] 2024年 CSCO乳腺癌诊疗指南.
[7] Bracchi P, Zecca E, Brunelli C, et al. A real-world study on the prevalence and risk factors of medication related osteonecrosis of the jaw in cancer patients with bone metastases treated with Denosumab. Cancer Med. 2023-09-01;12(17):18317-18326.
[8] Stopeck AT, Fizazi K, Body JJ, et al. Safety of long-term denosumab therapy: results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer. SUPPORT CARE CANCER. 2016-01-01;24(1):447-455.
[9] Hortobagyi GN, Van Poznak C, Harker WG, Gradishar WJ, Chew H, Dakhil SR, Haley BB, Sauter N, Mohanlal R, Zheng M, Lipton A. Continued Treatment Effect of Zoledronic Acid Dosing Every 12 vs 4 Weeks in Women With Breast Cancer Metastatic to Bone: The OPTIMIZE-2 Randomized Clinical Trial. JAMA Oncol. 2017 Jul 1;3(7):906-912.
[10] Abousaud AI, Barbee MS, Davis CC, et al. Safety and efficacy of extended dosing intervals of denosumab in patients with solid cancers and bone metastases: a retrospective study. THER ADV MED ONCOL. 2020-12-23;12:1758835920982859.
[11] Gibiansky L, Sutjandra L, Doshi S, et al. Population pharmacokinetic analysis of denosumab in patients with bone metastases from solid tumours.CLIN PHARMACOKINET. DOI:2012-04-01;51(4):247-60.10.2165/11598090-000000000-00000.
[12] Miller PD, Jamal SA, Evenepoel P, et al. Renal safety in patients treated with bisphosphonates for osteoporosis: a review. J BONE MINER RES. 2013-10-01;28(10):2049-59.
[13] Oh WK, Proctor K, Nakabayashi M, et al.The risk of renal impairment in hormone-refractory prostate cancer patients with bone metastases treated with zoledronic acid. CANCER-AM CANCER SOC. 2007-03-15;109(6):1090-6.
[14] Yamasaki M, Yuasa T, Uehara S, et al. Improvement of renal function by changing the bone-modifying agent from zoledronic acid to denosumab. INT J CLIN ONCOL. 2016-12-01;21(6):1191-1195.
[15] Mjelstad A, Zakariasson G, Valachis A, et al. Optimizing antiresorptive treatment in patients with bone metastases: time to initiation, switching strategies, and treatment duration. SUPPORT CARE CANCER. 2019-10-01;27(10):3859-3867.
[16] Lipton A, Fizazi K, Stopeck A, et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. EUR J CANCER. 2012-11-01;48(16):3082-92.
[17] Miyashita H, Cruz C, Malamud S. Risk factors for skeletal-related events in patients with bone metastasis from breast cancer undergoing treatment with zoledronate. BREAST CANCER RES TR. 2020-07-01;182(2):381-388.
[18] Buttazzoni M, Rosa Diez GJ, Jager V, Crucelegui MS, Algranati SL,Plantalech L. Elimination and clearance of pamidronate by haemodialysis. Nephrology (Carlton) 2006; 11:197–200.
[19] Chen KS, Hernandez RK, Quigley JM, Pirolli MA, Quach D, Liede A, et al.Prevalence of renal insufficiency (RI) in cancer (Ca) patients (pts) with bone metastases (BM). J Clin Oncol 2013; 31:e12508.
[20] ESMO Guidelines Working Group, Coleman R, Body JJ, Aapro M, Hadji P,Herrstedt J. Bone health in cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2014; 25:124–137.
[21] Lipton A, Fizazi K, Stopeck AT, Henry DH, Brown JE, Yardley DA, et al.Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer 2012; 48:3082–3092
[22] Launay-Vacher V, Gligorov J, Le Tourneau C, Janus N, Spano J-P, Ray- Coquard I, et al. Prevalence of renal insufficiency in breast cancer patients and related pharmacological issues. Breast Cancer Res Treat 2010;124:745–753.
[23] Launay-Vacher V, Oudard S, Janus N, Gligorov J, Pourrat X, Rixe O, et al.Prevalence of renal insufficiency in cancer patients and implications for anticancer drug management: the renal insufficiency and anticancer medications (IRMA) study. Cancer 2007; 110:1376–1384.
[24] Cha YJ, Lee YJ. Risk factors for renal impairment in patients with solid tumors or multiple myeloma treated with zoledronic acid. Int J Clin Pharmacol Ther 2013; 51:274–282.
[25] Mould DR, Green B. Pharmacokinetics and pharmacodynamics of monoclonal antibodies: concepts and lessons for drug development.BioDrugs 2010; 24:23–39.
[26] Block G, Egbuna O, Zeig S, Pergola PE, Singh B, Braun AH, et al. The evaluation of denosumab safety in patients with chronic kidney disease: an open-label study. J Clin Oncol 2014; 32:e20649.
[27] Amgen SA. XGEVA® (denosumab) summary of product characteristics (SmPC); 2014. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002173/WC500110381.pdf.
[28]国家肿瘤质控中心乳腺癌专家委员会. 中国晚期乳腺癌规范诊疗指南(2020版)[J]. 中华肿瘤杂志. 2020.42(10):781-797.
[29]Coleman, R, Body, et al. Bone health in cancer patients: ESMO Clinical Practice Guidelines†.[J]. Annals of Oncology, 2014.
[30]王如良, 江泽飞. 骨改良药物在乳腺癌骨转移治疗中的应用进展. 临床肿瘤学杂志, 2016, 21(005):458-461.
[31]谢晓娟, 佟仲生. 乳腺癌骨转移的内科治疗[J]. 国际肿瘤学杂志, 2015.
[32]Stopeck AT,Lipton A,Body JJ,et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer:A randomized,double-blind study[J]. J Clin Oncol,2010,28(35):5132-5139.
[33] 中国临床肿瘤学会指南工作委员会. 《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》.
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


