2025年8月26日,备受瞩目的学术盛会“MDT中外面对面”成功举行。会议汇聚上海交通大学附属胸科医院陆舜教授团队、瑞士日内瓦大学医院Alfredo Addeo教授团队、北京大学人民医院燕翔教授团队和广西医科大学附属肿瘤医院周韶璋教授团队等国内外顶尖肺癌研究团队,聚焦肺癌免疫治疗前沿领域,深入探讨诊疗现状及未来研究方向,为该领域的发展提供重要思路与交流平台。【肿瘤资讯】特别整理会议精华内容,以飨读者。

免疫介导坏死性肌炎肺腺癌患者——病例分享
本病例由瑞士日内瓦大学医院Alfredo Addeo教授分享,具体诊疗过程如下:
病史资料
42岁女性
2019年确诊免疫介导的坏死性疾病,伴有抗SRP抗体阳性,曾接受皮质类固醇、硫唑嘌呤、IVIG和利妥昔单抗治疗。
2022年出现颈部皮下肿块、疼痛、呼吸困难及面部水肿等症状,检查发现淋巴系统病变、上腔静脉血栓、纵膈病灶,活检确诊为肺腺癌,PD-L1表达高达80%,脑部MRI未见转移。
2020年基因检测仅发现TP53突变,未见其他有意义的驱动突变。
诊疗经过
2019-2022年,患者接受皮质类固醇、免疫抑制剂(硫唑嘌呤、IVIG、利妥昔单抗)治疗免疫介导的坏死性疾病。
2022年,采用卡铂联合培美曲塞方案并引入帕博利珠单抗治疗,疗效评估为PR,后停用卡铂,转为培美曲塞联合帕博利珠单抗治疗。
2022年5月,患者CK异常升高,肌肉无力症状加重,采用静脉注射免疫球蛋白与强的松治疗。
2022年11月,患者病情恶化,出现呼吸衰竭,紧急送入ICU并接受机械通气,转而采用免疫抑制剂治疗,联合使用利妥昔单抗与IVIG,病情趋于稳定。
2023年11月起,患者每2周接受1次贝伐珠单抗治疗,直至2025年4月,病情得到有效控制。
2025年6月,患者心外膜出现4cm转移病灶,提示肿瘤进展。
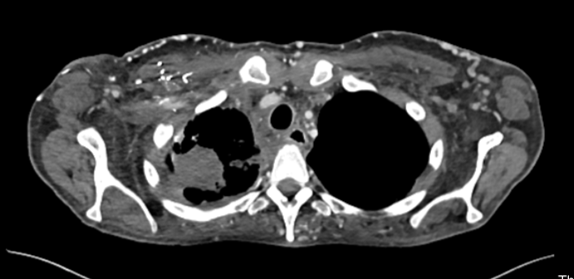
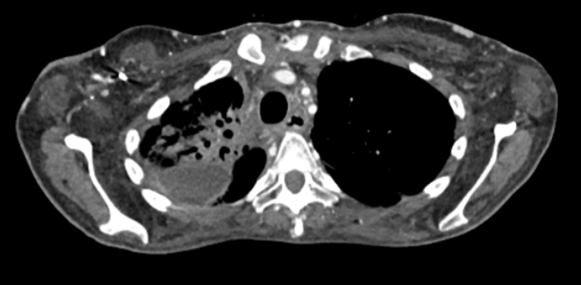
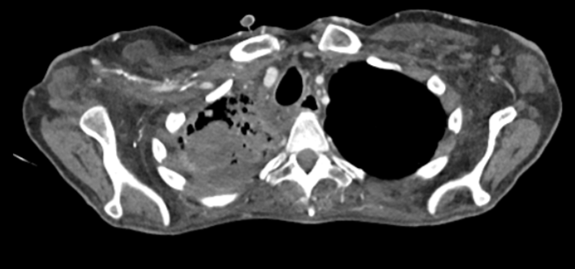
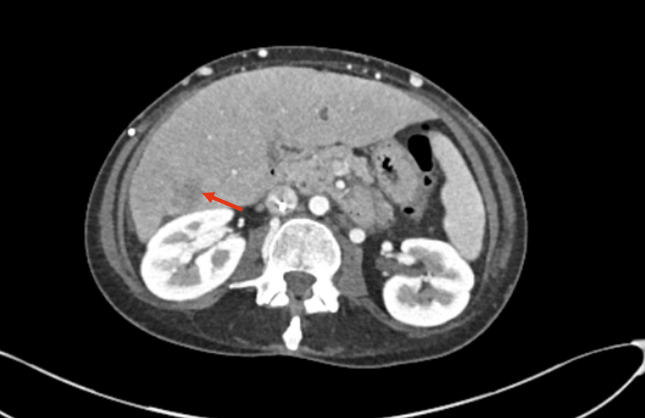
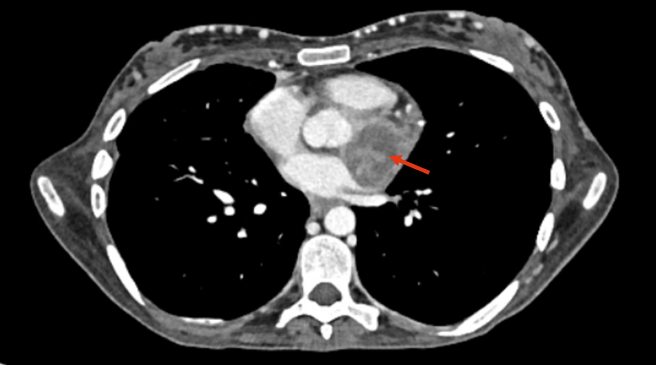
本病例讨论点:
1.在2020年,关于患者的初始治疗应如何选择?
2.2023年3月,CT检查发现肿瘤进展,应如何处理?
3.2025年6月,心外膜出现4cm转移病灶,下一步治疗有何建议?
北京大学人民医院燕翔教授:患者确诊肺腺癌,PD-L1高表达且无驱动基因突变,初期治疗建议首选PD-L1抑制剂联合化疗,以增强疗效。2023年3月肿瘤进展,肺炎病因需明确是否为感染或药物不良反应,鉴于抗PD-L1治疗效果不佳且影响生活质量,建议转用TKI治疗,依健康状况决定是否联合化疗或贝伐珠单抗。2025年6月心外膜出现4cm转移病灶,先明确病灶进展类型,若为单一病灶,优先考虑放疗,不可行时依据NGS测序结果,特别是MET扩增情况,推荐TKI治疗。
广西医科大学附属肿瘤医院周韶璋教授:患者为肺腺癌,PD-L1高表达且无驱动基因突变。初始治疗建议PD-L1抑制剂联合化疗提升疗效。2023年3月肿瘤进展,此时以观察为主,后续依病情调整方案,暂不建议重复免疫治疗。2025年6月心外膜出现4cm转移病灶,MET扩增拷贝数超10,提示驱动基因变化,可考虑单药靶向治疗,具体依患者情况和数据定。
上海交通大学附属胸科医院李子明教授:年轻女性患者,Ⅳ期NSCLC并伴有自身免疫性疾病。鉴于其PD-L1高表达但免疫疾病风险,应优先选择标准化疗,并针对性地加入局部治疗以缓解疼痛,提升生活质量。2023年3月肿瘤进展,CT显示肿瘤进展,标志疾病复发。患者身体状况尚可,建议采用标准二线治疗方案,并持续监测病情,以便及时调整治疗策略。2025年6月,患者出现心外膜出现4cm转移病灶,已接受心包引流。基因检测显示MET扩增显著,提示TKI治疗可能更有效。在中国,TKI是可行方案,我们考虑为患者争取临床试验机会,尝试更个性化治疗。
上海交通大学附属胸科医院陆舜教授:患者初始治疗时,鉴于PD-L1高表达,建议帕博利珠单抗或单药化疗,避免铂类化疗加重免疫负担,同时局部治疗缓解疼痛。2023年3月肿瘤进展,患者身体虚弱但有恢复迹象,若全身评估1-2级,可化疗联合贝伐珠单抗或EGFR-TKI,需综合器官功能、身体状态等确定方案。2025年6月心外膜转移,MET高扩增但驱动基因阴性,可考虑特泊替尼、卡马替尼等MET抑制剂,若为中国患者,则建议参与临床试验或选择国产MET抑制剂,具体依患者情况定。
本病例由北京大学人民医院韩天晓教授分享,具体诊疗过程如下:
病史资料
62岁男性,有吸烟史。
辅助检查
胸部CT显示,右肺下叶基底段存在21×10mm的结节状阴影,SUVmax为3.3。右肺门纵隔及双侧锁骨区多发淋巴结肿大,SUVmax达21.1。
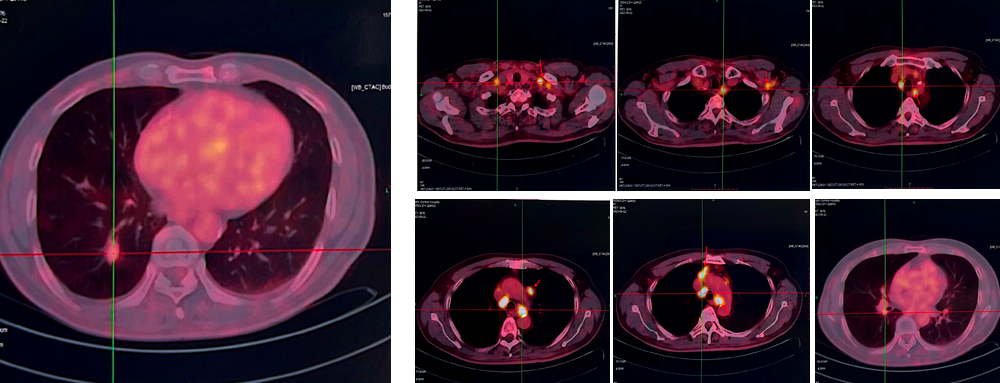
病理结果显示,锁骨上淋巴结穿刺活检确诊为低分化肺腺癌,且双肺均存在肺腺癌。病理检测显示,PD-L1 TPS表达为70%。
分子检测发现,KRAS G12A突变。
临床诊断
右肺下叶腺癌(T1cN3M0 ⅢB期)
诊疗经过
2022年10月至2023年6月,患者接受4周期免疫治疗联合化疗(贝伐珠单抗+培美曲塞+卡铂)治疗后,疗效评估为PR,右肺下叶原发灶及多组淋巴结病灶代谢降低。
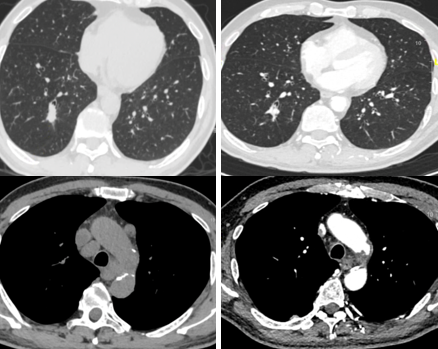
2023年7月至10月,针对原发灶和转移性淋巴结,给予根治性放疗,剂量50-60Gy/12-25f。
2023年11月至2025年6月,放疗后接受度伐利尤单抗免疫巩固治疗13周期,期间主要病灶持续稳定,但部分区域代谢活性有所升高。
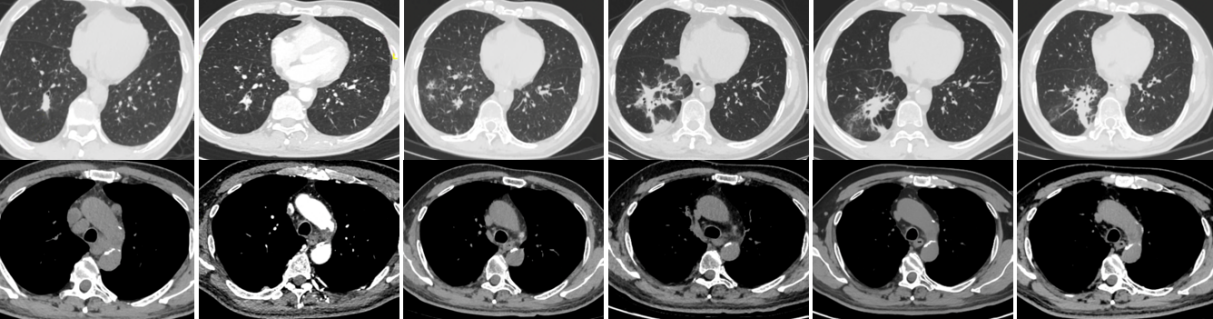
2025年7月,疾病进展风险显著升高后,患者接受右下肺叶切除术,病理结果显示MPR,未发现残余癌细胞。术后影像随访未见新发病灶,ctDNA检测呈阴性。
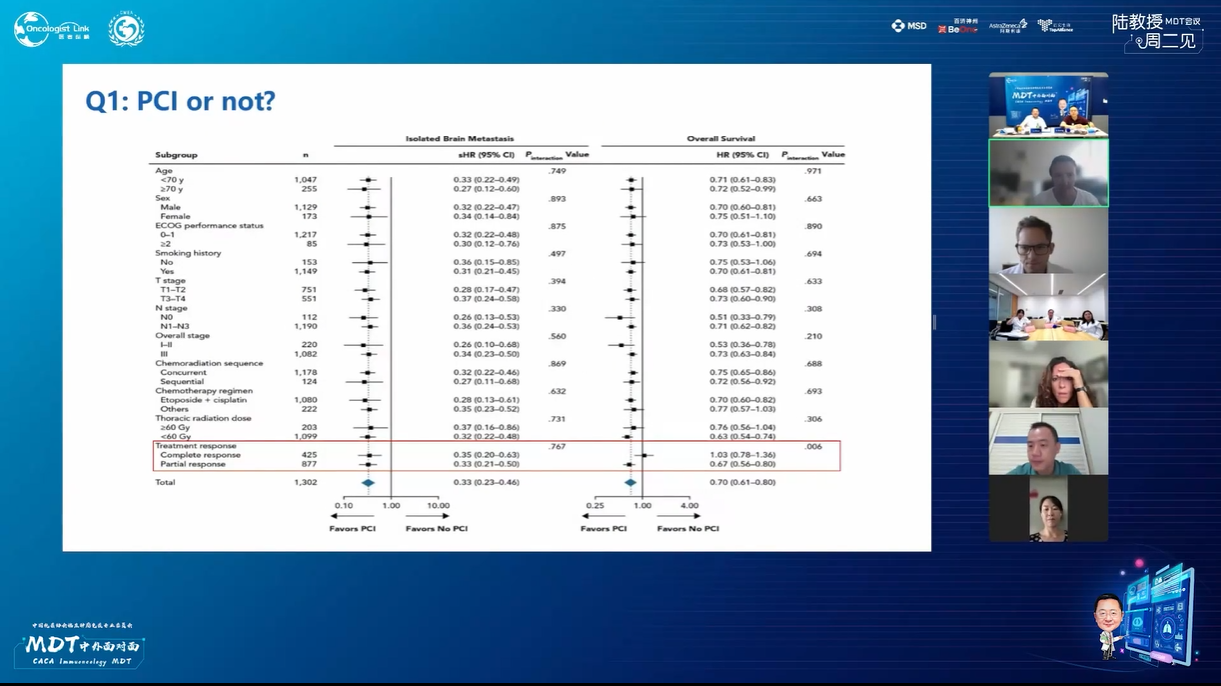
本病例讨论点:
1. 不可切除III期NSCLC的初始治疗策略及诱导治疗方案选择有哪些?
2. 驱动基因阳性III期NSCLC患者的治疗选择有哪些?
3. III期NSCLC的手术地位、干预时机及潜在益处有哪些?
瑞士日内瓦大学医院Alfredo Addeo教授:若锁骨淋巴结转移确诊为N3,需谨慎制定化疗方案,因这通常意味着病情较晚且治疗难度较大。当患者PD-L1高表达且有吸烟史时,化疗联合免疫治疗是更合理的选择。对于ⅢB期且锁骨淋巴结为N2或N3的患者,同样推荐化疗联合数月免疫治疗。PD-L1阴性患者化疗效果不一,免疫治疗因其能激活免疫系统对抗肿瘤,可能成为替代方案。而EGFR阳性患者,LAURA试验表明精准治疗对转移性疾病更有效。在确定不可切肺癌患者的手术时机时,应综合考虑患者情况和治疗缓解效果,其中化疗联合免疫治疗的疗效是关键参考因素。
广西医科大学附属肿瘤医院周韶璋教授:患者病情显示存在明显的N3转移及锁骨上淋巴结转移,属于不可切除的ⅢB期NSCLC。根据最新治疗指南,推荐采用铂类为基础的化疗联合度伐利尤单抗治疗,以控制病情进展并改善生存率。手术切除效果分为完整切除、不完全切除和不确定切除三种类型。针对该患者,因存在淋巴结转移及锁骨上转移,其切除效果被归为不完全切除。不完全切除虽能部分控制肿瘤,但手术本身无法彻底解决问题,残余病灶仍需后续放疗干预。因此,融合PD-L1免疫巩固治疗、辅助化疗、针对性放疗及手术等MDT策略,将是控制病情、提升患者长期生存机会的优选方案。
上海交通大学附属胸科医院李子明教授:患者为PD-L1高表达的ⅢB期不可切除NSCLC患者。计划与放射科医生会诊,讨论放化疗方案。若条件允许,将先实施放化疗,接着使用PD-L1抑制剂,最后进行维持治疗。对于驱动基因阳性患者,治疗策略需根据病情分组。病灶或淋巴结较大的患者,建议先进行诱导治疗如TKI,后续治疗方案则需通过MDT讨论综合制定,部分患者可能通过手术获益,但多数仍需同步或序贯放化疗。对于驱动基因阴性患者,以同步或序贯放化疗为主。洛拉替尼是驱动基因阳性患者的标准治疗,但在临床实践中,对于病灶较大的患者,也可考虑TKI诱导后同步放化疗及TKI维持,不过这需要更多数据支持。
上海交通大学附属胸科医院陆舜教授:针对该患者,初步治疗方案为免疫治疗联合化疗。2-3周期后评估疗效和不良反应,再决定后续治疗。若选择放化疗或手术等局部治疗,需注意多发病变和淋巴结体积小可能带来的治疗难度。建议在免疫联合化疗后考虑无创手术干预,但需与患者充分沟通,因这属于非标准治疗。同时,维持性免疫治疗也是一种选择。对于不可切除的Ⅲ期NSCLC,治疗策略需综合考量驱动基因状态、PD-L1表达及肿瘤负荷。EGFR阳性患者主要采用化疗联合放疗及靶向药物,EGFR野生型患者则依据PD-L1表达和肿瘤负荷选择治疗方案。部分高选择性、肿瘤负荷高的患者,免疫联合化疗诱导治疗可能使约25%患者达到pCR,但手术适用性仍有争议。治疗方案还涉及化疗联合免疫治疗的周期数建议,通常至少3周期,耐受性差者可减少至2周期。对于诱导治疗后可能从手术获益的高选择性患者,手术切除的额外获益尚需探讨。
LS-SCLC患者——病例分享
本病例由广西医科大学附属肿瘤医院潘信斌教授分享,具体诊疗过程如下:
病史资料
48岁男性,因“体检发现右肺肿物”入院。既往无吸烟饮酒史,无结核病史。体格检查显示,ECOG评分为0分,未触及明显淋巴结肿大。
辅助检查
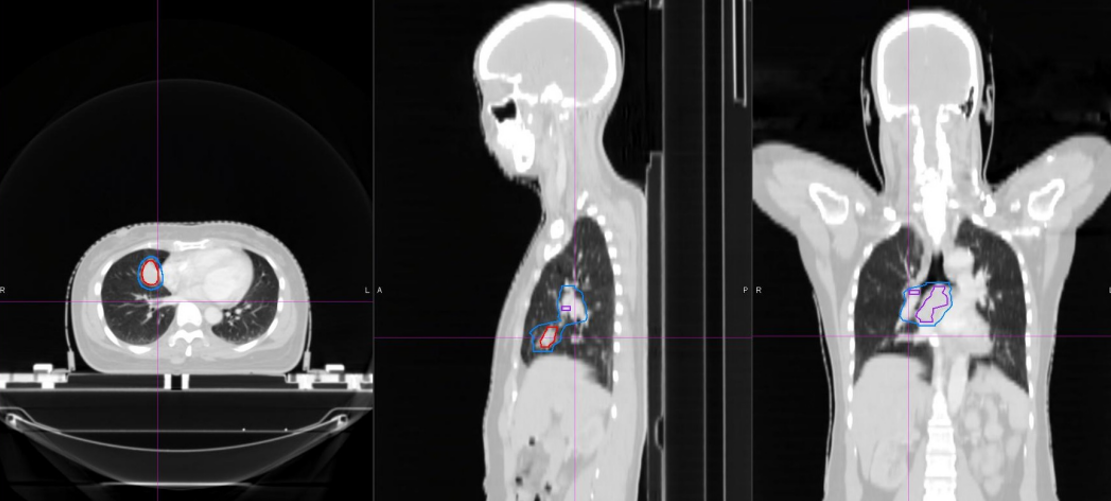
胸部CT显示右肺肿块,初步提示可疑肺癌。
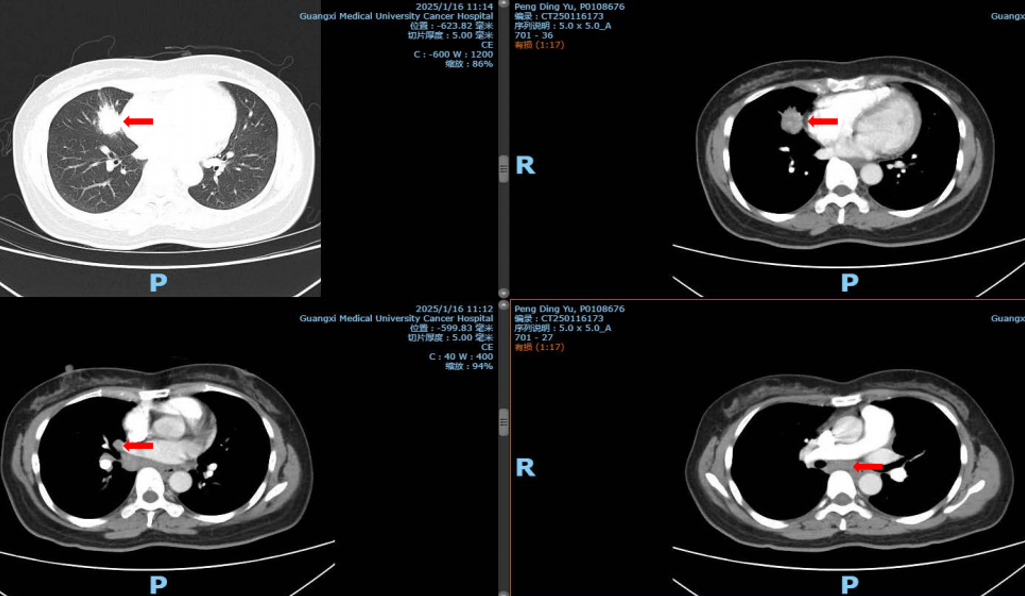
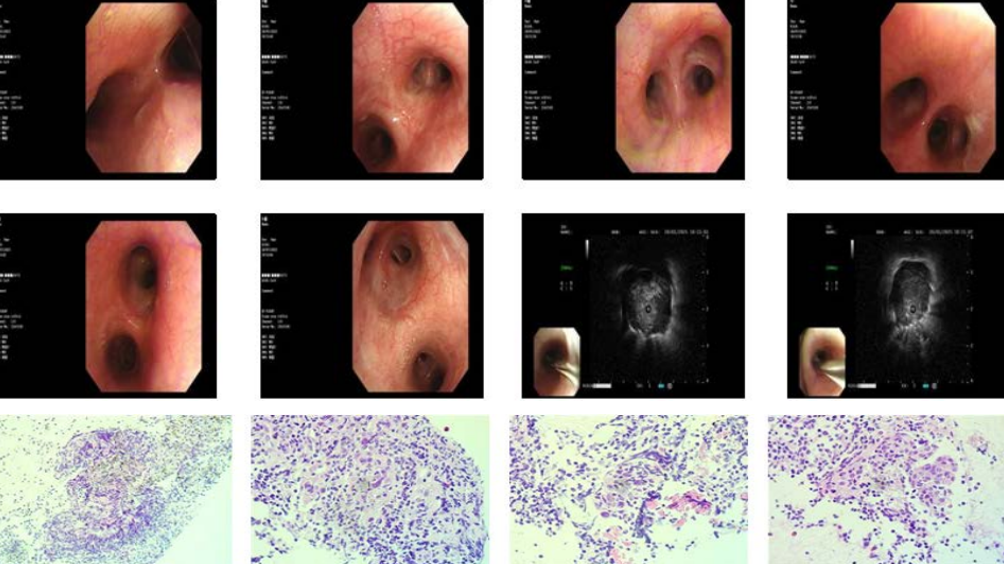
病理检查显示SCLC,内镜及病理如图所示。
ECT及MRI未发现远处骨转移或其他重要器官受累。
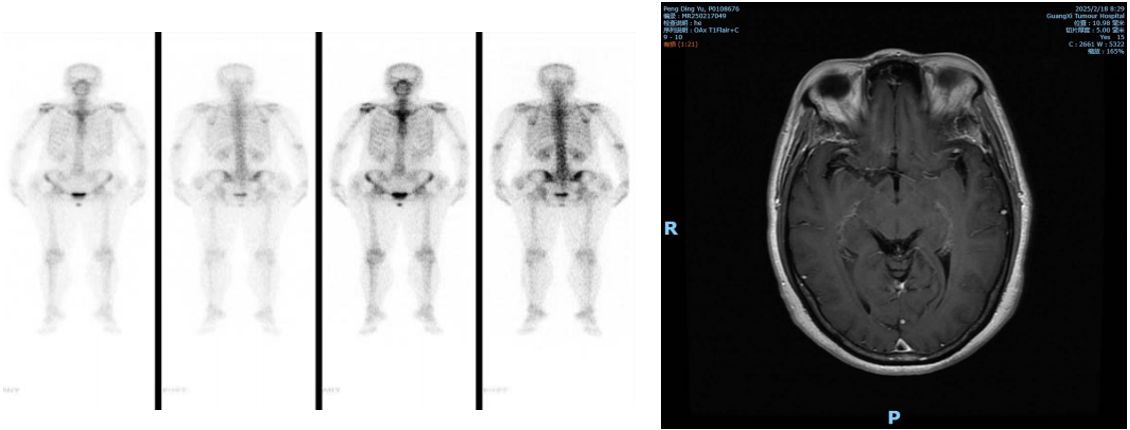
临床诊断
LS-SCLC,T2bN2aM0 IIIA期。
诊疗经过
经MDT讨论后,建议患者采用CCRT的治疗方案。
2025年1月23日至2025年4月4日,患者接受EP方案。
2025年2月19日至2025年4月3日,患者接受IMRT,总剂量为45Gy/30f,分两次每日1.5Gy照射。
治疗后疗效评估为PR。
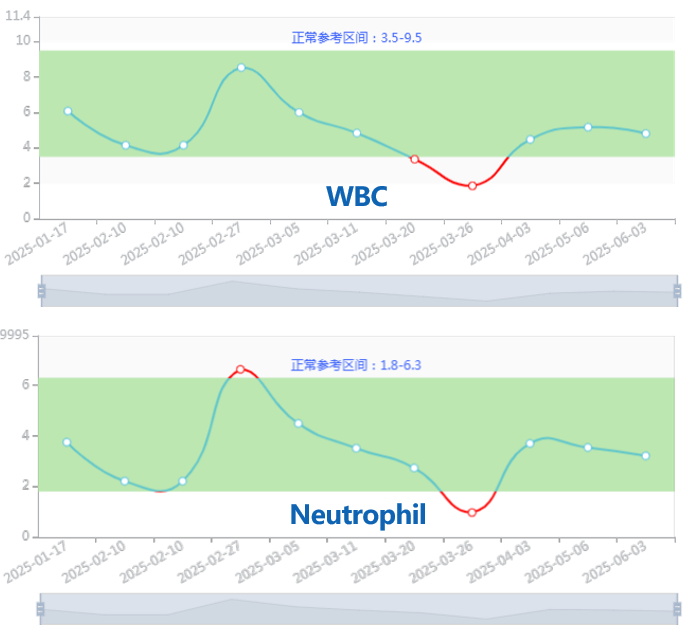
治疗过程中出现3级白细胞减少及3级中性粒细胞减少的不良反应。
自2025年7月25日起,患者接受4周期的PD-L1抑制剂度伐利尤单抗作为巩固治疗。
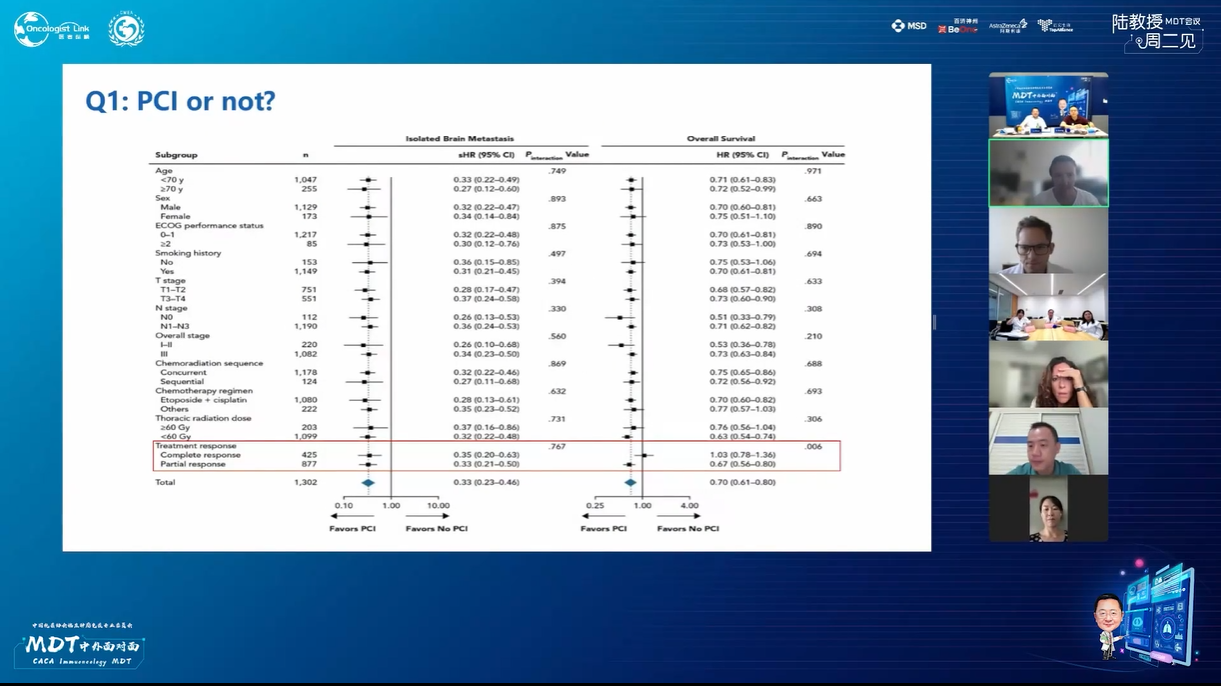
本病例讨论点:
1. 在确认完全缓解的情况下,能否考虑省略PCI治疗?
2. 若患者每日接受2次放疗,那么在4化疗周期结束后,是否可以立即接受放疗?
3. PD1和PD-L1抑制剂是否适合作为辅助免疫疗法,以增强治疗效果?
瑞士日内瓦大学医院Alfredo Addeo教授:在处理LS-SCLC时,我们遵循指南推荐放化疗方案。面对早期较小的T1病灶,优先活检明确诊断,避免误判。确诊后,与患者深入讨论综合治疗方案,涵盖化疗、放疗、PCR检测及PCI。即使部分患者可能拒绝PCI,我们仍会充分沟通并推荐。放疗方案上,倾向每日1次高剂量,平衡疗效与患者耐受性。同时,根据患者情况推荐MRI监测,虽不在常规指南内,但有助于病情监测。
北京大学人民医院燕翔教授:PCI治疗在特定患者群体中存在争议,因其有效性证据不足,目前仅建议用于诱导治疗后完全缓解且肿瘤缓解显著的患者,此类患者较少,故PCI适用范围较窄,建议治疗周期为3-4周期以观察评估疗效。目前PD-1药物数据尚不充分,仅有PD-L1药物相关数据,但该领域发展迅速,预计未来1-2年将获得更多数据,有望为患者带来更多治疗选择。
上海交通大学附属胸科医院李子明教授:PCI治疗在特定患者群体中存在争议,因其有效性证据不足,目前仅建议用于诱导治疗后完全缓解且肿瘤缓解显著的患者,此类患者较少,故PCI适用范围较窄,建议治疗周期为3-4周期以观察评估疗效。目前PD-1药物数据尚不充分,仅有PD-L1药物相关数据,但该领域发展迅速,预计未来1-2年将获得更多数据,有望为患者带来更多治疗选择。
上海交通大学附属胸科医院陆舜教授:在SCLC治疗领域,随着新技术和新药的涌现,部分患者无需PCI也可获益,因此在充分沟通后,我倾向于不推荐使用PCI。4周期化疗是标准方案,但放疗时机对疗效影响重大,研究证实放疗在化疗前3周期内同步开展能显著提升总生存期,对肿瘤负荷大的患者,可适当缩短化疗诱导期至2-3次,但总化疗周期应控制在4次以内以减轻患者负担。在免疫治疗方面,PD-L1抑制剂已成为一线治疗首选,但未来在PD-L1与PD-1药物间精准选择仍面临挑战,需深入研究特定患者群体的疗效差异及依据生物特性优化治疗策略。
总结
在2025年8月26日的“MDT中外面对面”学术会议上,国内外肺癌专家深入探讨肺癌免疫治疗、靶向治疗及MDT的前沿进展。会议聚焦免疫治疗策略优化、不可切除III期NSCLC治疗选择及LS-SCLC综合治疗策略,强调精准化、个体化治疗理念和MDT的重要性。专家们认为,免疫治疗与靶向治疗结合、化疗联合免疫治疗规划及根据患者基因特征制定个性化方案是肺癌治疗发展的关键。会议成果为肺癌治疗决策提供依据,指明未来研究方向,彰显MDT在复杂肺癌治疗中的核心价值。
排版编辑:肿瘤资讯-CTY












 苏公网安备32059002004080号
苏公网安备32059002004080号


