乳腺癌已成为中国女性最常见的恶性肿瘤之一,随着发病率的持续上升以及确诊人群呈现年轻化趋势,临床实践面临新的挑战:年轻患者往往表现出更强的肿瘤侵袭性,同时由于发病年龄较轻、预期寿命较长,其对长期生存质量和社会功能恢复的关注更为突出,这对治疗策略提出了更高要求。卵巢功能抑制(OFS)是HR+年轻乳腺癌患者内分泌治疗的关键手段,其应用方式和药物选择直接关系到患者预后。国产2.2类新药戈舍瑞林微球通过将经典戈舍瑞林与先进微球制剂技术融合,以三大核心优势推动临床进步:突释效应更弱、血药浓度更平稳、雌激素抑制更深,为HR+早期乳腺癌的治疗提供了一种新的可选方案。
在此,【肿瘤资讯】特别邀请到中国医学科学院肿瘤医院王昕教授权威拆解戈舍瑞林微球机制及临床优势,指引HR+乳腺癌内分泌治疗的未来方向。
本期特邀专家——王 昕 教授
乳腺外科主任医师、博士生导师、北京杰青
首届国家医学高层次人才(优秀青年医师)
北京市政协委员、北京市青联医药卫生界别 主任
北京乳腺病防治学会青年学术委员会 主任委员
北京围手术期医学学会乳腺外科专委会 主任委员
中国抗癌协会肿瘤微创治疗专委会乳腺学组 副主任委员
中国民族卫生协会医疗科普专业委员会 副主任委员
中国康复医学会外科快速康复专业委员会 副主任委员
中国研究型医院学会乳腺疾病专业委员会 常委
中国医药教育学会乳腺疾病专业委员会 常委
中国抗癌协会乳腺癌专业委员会 委员
中国临床肿瘤学会CSCO乳腺癌专业委员会 委员
获茅以升北京青年科技奖、中国抗癌协会青年科学家奖
主持国家重点研发计划、科技创新2030重大项目、国家自然科学基金等课题20余项
我国乳腺癌年轻化趋势加剧,治疗策略亟需“进阶”
王昕教授指出,国家癌症中心最新流行病学调查数据显示2022年中国女性乳腺癌新发病例数35.72万,位居女性恶性肿瘤新发病例数第二位,仅次于肺癌[1]。除高发病率外,我国乳腺癌发病年龄较西方国家提前约10年[2],且呈显著年轻化趋势,已成为一项亟待应对的公共卫生挑战。我国年轻乳腺癌患者比例持续升高,35岁以下人群占比达7.6%[3]。在乳腺癌总体发病率持续上升的背景下,该年龄段的增长趋势尤为明显。
乳腺癌发病年轻化带来了临床治疗上的两方面挑战。病理层面,年轻乳腺癌患者往往表现出侵袭性更强的生物学行为,导致复发风险增加和总体生存期缩短[4]。此类年龄与预后的负相关关系与年轻患者卵巢功能活跃密切相关,为卵巢功能抑制(OFS)治疗策略提供了循证依据[5,6]。生活质量层面,年轻患者在完成治疗后通常有较强的职业和社会参与需求,同时在家庭中承担更多责任,对长期生活质量的关注度更高[3]。因此,在我国年轻乳腺癌患者比例较高的背景下,治疗策略需要在控制疾病的同时兼顾患者的长期功能恢复和生活质量。
GnRHa类药物戈舍瑞林循证充分,为OFS治疗经典选择
据王昕教授介绍,我国年轻乳腺癌患者中,HR+乳腺癌约占50%–60%。雌激素与ER结合后促进肿瘤细胞增殖的证据已较充分[7]。队列研究提示,雌激素暴露时间延长或水平升高(如早发初潮、绝经延迟,或接收激素替代治疗)是乳腺癌发生的重要危险因素[8]。绝经前女性因卵巢功能活跃,雌激素水平分泌旺盛,复发风险相对增高,OFS成为降低该风险的策略之一。
OFS的实现方式包括手术、放疗和药物。其中使用促性腺激素释放激动剂(GnRHa)药物方案因创伤小且停药后卵巢功能可恢复,被中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)[7]及ASCO指南[9]等多项指南共识列为OFS首选项。戈舍瑞林在SOFT&TEXT、STO-5、ASTRRA等Ⅲ期研究中显示了降低复发风险的效果[10–12],循证夯实,成为临床常用的GnRHa类药物。
技术革新与临床证据并行,应对年轻化趋势与复杂病理挑战
王昕教授指出,传统戈舍瑞林首次问世于1987年,然而,其植入剂剂型因独特的崩解过程,或可导致药物缓释波动大,持续性面临挑战[13-15]。而微球剂型能够维持相对平稳的血药浓度,并实现较持久的药物释放[13-15]。在长效、平稳抑制雌激素水平的需求推动下,戈舍瑞林微球技术平台逐步成熟,并在制剂工艺、药物释放特性及临床有效性和安全性方面均取得一定进展。目前,该药物已作为2.2类新药获批,为GnRHa类药物在临床中的应用提供了新的选择。
戈舍瑞林微球成功实现治疗进阶的背后在于其创新性的三大核心技术突破:星型结构的PLGA原料、二代水包油包固(S/O/W)微球制备工艺及符合FDA标准的高质量现代化制药生产工艺水平。
其中PLGA因具有良好的成囊和成膜的物理延展性而被微球产品中广泛用为聚合物材料,然而PLGA通常为线型结构[16],戈舍瑞林微球创新性采用星型结构PLGA原料,得益于星型结构的“发散性”,在药物递送方面具有许多线性聚合物不存在优异的性能,如多支化结构使得疏水空腔较大,可以保证较高的载药量,与活性药物可以更好地结合,同时又保持较小的粒径,且增加亲水性[17]。最终,星型结构的PLGA原料显著提升了药物载体的稳定性和均一性,为药物的有效传递打下坚实基础。

与此同时,戈舍瑞林微球采用S/O/W工艺,解决了困扰药物的突释问题,确保药物可以稳定、持续地缓慢释放,接近“零级释放”标准。这项技术的关键在于其独特的双层乳化包裹体系,核心原理是先将药物颗粒分散在油相中形成初乳(油包固),再用外部水相基质对这一初乳进行二次封装,最终形成“水相→油相→固相”的三层包裹结构。这种结构设计旨在保护药物活性:由于多肽类药物在高温高压下易水解断裂,导致主链结构破坏和活性丧失;而油相在整个体系中充当了一道重要的隔离屏障,防止了内部固体药物与外部水相的直接接触,从而确保了药物的稳定缓释。
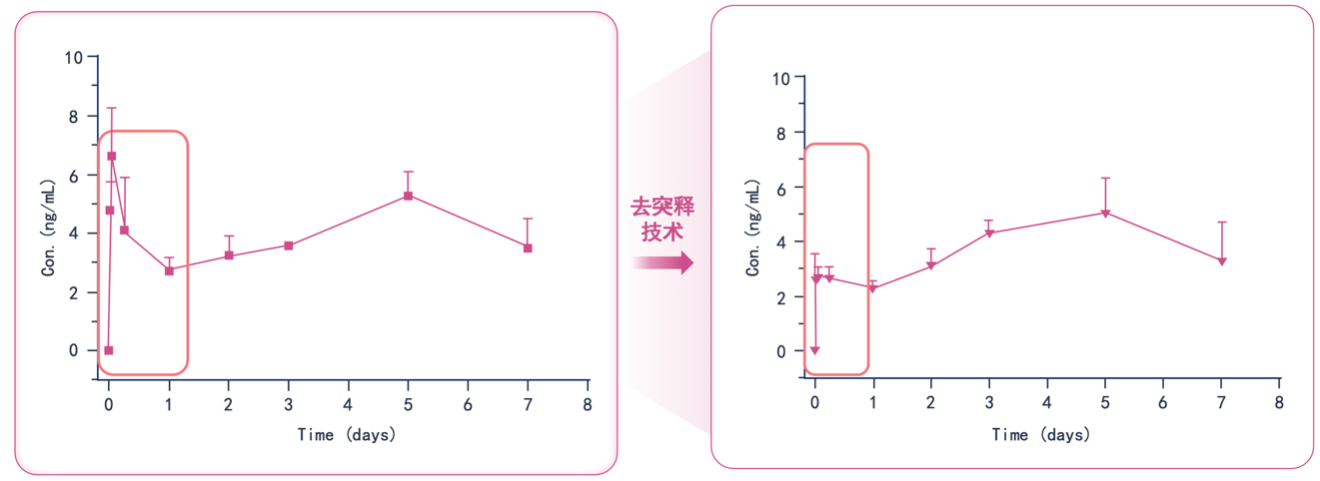
戈舍瑞林微球能够实现接近“零级释放”的第三项技术突破,在于其生产工艺全面符合FDA标准,确保了产品的可靠质量。该微球采用先进的S/O/W双重乳化技术,不仅实现了缓释结构的稳定性,还使药物包封率达到90%以上。同时,依托完善的生产体系,制剂批次间差异小,质量均一性高,符合FDA与NMPA的相关标准。从戈舍瑞林微球在不同放大倍数下的扫描电镜图中可以清晰看出,其微球形态致密、结构均匀,进一步印证了工艺的成熟性与可靠性。

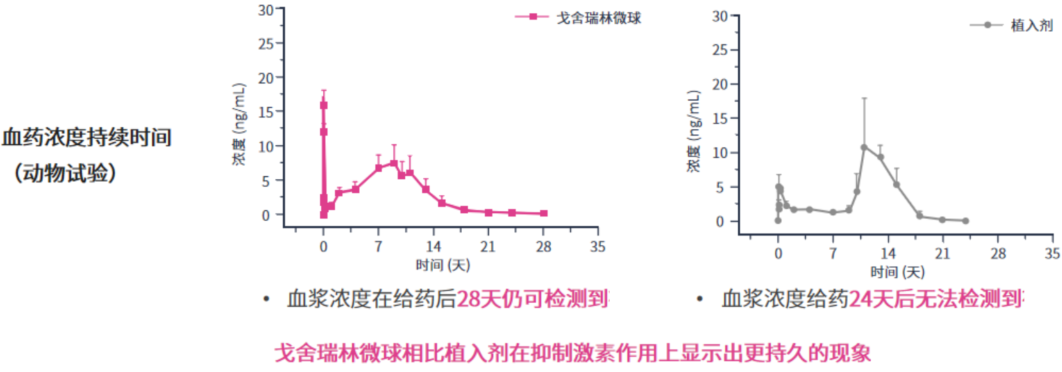
凭借三大核心技术突破,戈舍瑞林微球独特的缓释特性展现出显著的临床优势:单次给药后血药浓度平稳可控,初始2天内突释量严格控制在2%以下,有效避免了血药浓度急剧波动(图4);此外,药代动力学研究显示给药28天后仍可检测到有效血药浓度,证实其具有持续稳定的药物释放能力(图5)。这种特性确保了在传统GnRHa方案28天给药周期内治疗的有效性,且平稳的药物释放曲线降低了患者个体差异对疗效的影响,从而显著提升了治疗依从性[13-15,18]。
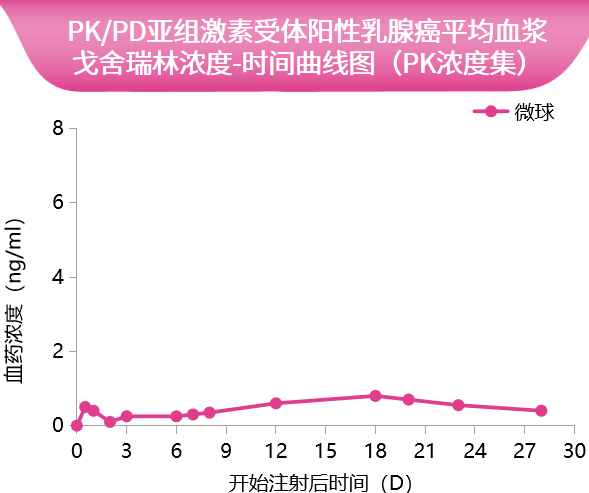
前瞻性研究提示,PK/PD亚组患者首次给药后,血浆中戈舍瑞林在1小时左右出现第1个峰值,浓度为(0.29±0.12)ng/ml,之后戈舍瑞林从微球中缓慢释放,血药浓度较平稳。首次给药28天内药物总暴露浓度-时间曲线下面积(AUC)0~t为 138.89 h·ng/ml,初始释放的暴露量 AUC0~48 h为2.52 h・ng/ml,仅占总暴露量的1.8%,再次印证其突释控制良好[19]。
此外,戈舍瑞林微球高效抑雌,“雌激素抑制更深”,特别适合卵巢功能活跃的绝经前患者群体[15]。头对头对比戈舍瑞林微球与传统戈舍瑞林植入剂的III期临床研究303研究提示,戈舍瑞林微球组和戈舍瑞林植入剂组患者第29天至第85天维持雌二醇(E2)在绝经后水平(≤30pg/ml)的概率达到了非劣效标准。亚组分析提示,在<45岁患者亚组中,戈舍瑞林微球更展现出优越的E2抑制维持率(第29-85天:92.8% vs 84.3%),提示其对年轻乳腺癌患者可能具有额外临床获益。总体而言,现有证据表明戈舍瑞林微球在药物释放稳定性、突释控制以及雌激素抑制方面均表现出一定优势,为HR+乳腺癌患者提供了新的治疗选择,期待戈舍瑞林微球助力我国更多年轻HR+乳腺癌患者跨越治疗困境。
[1] Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024;4(1):47-53.
[2] Sun K, Zhang B, Lei S, et al. Incidence, mortality, and disability-adjusted life years of female breast cancer in China, 2022. Chin Med J (Engl). 2024;137(20):2429-2436.
[3]Wang X, et al. EClinicalMedicine. 2023 Sep 22;64:102243.
[4]Shin DS, et al. JAMA Netw Open. 2024 Nov 4;7(11):e2442663.
[5]Giovannelli P, et al. World J Stem Cells. 2019 Sep 26;11(9):594-603.
[6]Cancer Epidemiol Biomarkers Prev. 2008 March ; 17(3): 614–620.
[7]中国抗癌协会乳腺癌专业委员会,胡夕春,等. 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)[J].中国癌症杂志,2024,34(3):316-334.
[8]Kim J, et al. Estrogens and breast cancer. Ann Oncol. 2025 Feb;36(2):134-148.
[9]Burstein HJ, et al. Adjuvant Endocrine Therapy for Women With Hormone Receptor-Positive Breast Cancer: ASCO Clinical Practice Guideline Focused Update. J Clin Oncol. 2019 Feb 10;37(5):423-438.
[10]Francis PA,et al. 15-year outcomes for women with premenopausal hormone receptor-positive early breast cancer (BC) in the SOFT and TEXT trials assessing benefits from adjuvant exemestane (E) + ovarian function suppression (OFS) or tamoxifen (T)+OFS. 2025 ASCO. 505.
[11]Johansson A, et al. Twenty-Year Benefit From Adjuvant Goserelin and Tamoxifen in Premenopausal Patients With Breast Cancer in a Controlled Randomized Clinical Trial. J Clin Oncol. 2022 Dec 10;40(35):4071-4082.
[12]Bae SJ, et al. Updated survival outcomes and predictors of benefit from ovarian function suppression in premenopausal women with hormone-receptor–positive breast cancer: Results from the ASTRRA trial. 2025 ASCO.506.
[13] Li, Xuebing, et al. Materials Horizons 11.12 (2024): 2820-2855.
[14] Qi, Pan, et al. Molecular pharmaceutics 16.8 (2019): 3502-3513.
[15] Wang, **aoyi, and Diane J. Burgess. Advanced Drug Delivery Reviews 178 (2021): 113912.
[16]周嘉安,江庆泉,宋文婧.基于微流控技术的PLGA多孔载细胞微球制备、表征与性能评价[J].实验技术与管理,2025,42(03):72-79.
[17]王锐,等.高分子材料载体在天然抗肿瘤药物中的研究进展 [J]. 中草药, 2021, 52(10): 3133-3141
[18]Yutong, Mao, et al. "Pharmacological and toxicological studies of a novel goserelin acetate extended-release microspheres in rats." Frontiers in Pharmacology 14 (2023): 1125255.
[19]邵喜英等.LY01005和诺雷得®治疗绝经前乳腺癌的多中心随机对照Ⅲ期临床研究.10.3760/cma.j.cn112152-20240126-00051
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


