急性髓系白血病(AML)和高危骨髓增生异常综合征(MDS)均为基因异质性疾病,患者长期生存率较低。研究显示,BCL-2抑制剂维奈克拉联合去甲基化药物或小剂量阿糖胞苷,虽能提高新诊断老年AML患者的缓解率,但仍有约43%的患者面临治疗失败,且该部分患者的中位总生存期(OS)仅2.4个月[1],失败的原因与维奈克拉耐药密切相关。因此,复发/难治性(R/R)AML和MDS目前仍缺乏有效治疗手段,亟需新型治疗药物。
BTX A51作为一种新型口服多激酶抑制剂,凭借其多靶点协同的独特机制,能特异性且高效地诱导白血病干细胞凋亡。一项I期临床研究评估了BTX A51在R/R AML和高危MDS患者中的疗效和安全性,旨在进一步明确BTX A51的推荐II期剂量(RP2D)[2]。【肿瘤资讯】特此整理,以飨读者。

从剂量探索到治疗潜力:BTX A51挑战R/R AML与MDS临床难题
尽管多数AML患者经一线治疗可实现形态学缓解,但仍有约50%的患者会出现疾病复发[3]。目前,不携带IDH或FLT3突变 R/R AML患者的治疗选择尤为有限,其2年OS率不足30% [4]。而高危MDS患者经一线去甲基化药物治疗失败后,预后更为严峻,中位OS仅5.6个月[5]。尽管学术界在R/R AML与MDS的生物学机制研究方面已取得显著进展,但二者的临床治疗仍面临严峻挑战,相关有效治疗手段亟待拓展。
在R/R AML患者的治疗中,维奈克拉的耐药机制主要涉及两种,一是抗凋亡BCL2家族成员(如MCL1、BCL-XL)的过表达[6],二是由MDM2、MDMX过表达导致的p53失活[7]。这两种机制均会引发白血病细胞凋亡抵抗,最终导致患者治疗失败,成为R/R AML患者临床治疗的难点。
BTX A51是一种新型口服多激酶抑制剂,可直接抑制CK1α、CDK7及CDK9的表达。其中,CK1α通过增强p53与MDMX、MDM2的结合来负调控p53;CDK7和CDK9 则选择性抑制超级增强子(SE)驱动的MCL1等关键癌基因转录,减少抗凋亡蛋白表达。BTX A51凭借其多靶点协同的独特机制,能特异性且高效地诱导白血病干细胞凋亡。
该研究是一项开放标签、I期首次人体剂量递增研究,纳入年龄≥18岁、经组织学确诊为R/R AML或MDS、ECOG评分0~2分、WBC≤25×10⁹/L且器官功能良好的患者。其中,入组MDS患者需经IPSS-R评估为高危或极高危,且接受去甲基化药物治疗后未达缓解或疾病进展。
该研究入组患者均接受BTX A51口服给药,28天为1个治疗周期,按 1mg~42mg的剂量范围设置研究队列。初始队列采用间歇给药模式,在每个周期(28天)内,队列1为每周给药5天,前21天给药;队列2~7为每周给药3天,前21天给药。研究团队还探索了一个额外队列,该队列中BTX A51的给药剂量为21mg,每周给药3天,全周期(28天)给药。
该研究的主要终点为BTX A51的安全性、最大耐受剂量(MTD)及RP2D;次要终点为初步疗效、OS和无事件生存期(EFS)。
CR/CRi率达30%:BTX A51精准发力,RUNX1突变患者新曙光
截至2022年2月28日,该研究共纳入31例患者,其中28例为R/R AML患者,3例为R/R MDS患者。入组患者的中位年龄为75岁,既往接受治疗的中位线数为2线;97%的患者曾接受过维奈克拉联合去甲基化药物治疗;43%的患者经两线诱导化疗后仍未达缓解;13例患者检测到RUNX1基因突变(表1)。
表1.入组患者的基线特征
该研究的意向性治疗分析显示,31例患者中共有3例(10%)患者达到血液学未完全恢复的完全缓解(CRi)。这3例患者的BTX A51给药剂量分别为11mg(1例)和21mg(2例),其中2例患者在治疗第1周期后达到CRi,1例患者在治疗第2周期后达到CRi。3例CRi患者的中位缓解持续时间(DOR)为1.9个月(图1)。
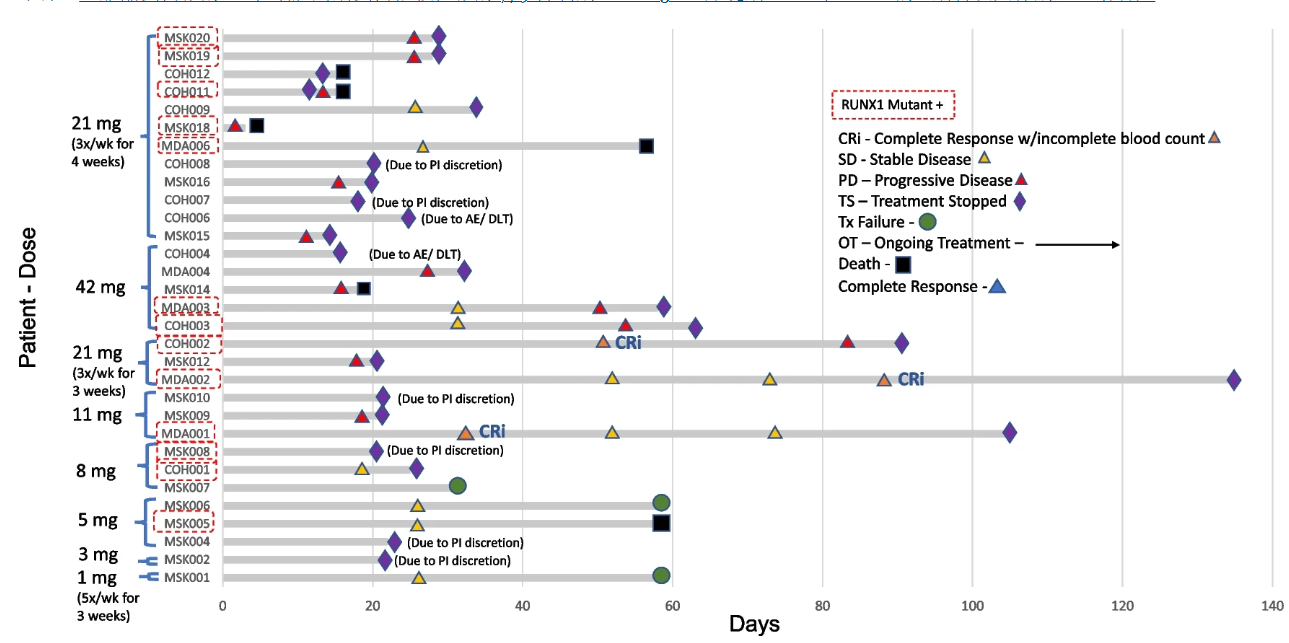
在13例检测到RUNX1基因突变的患者中,23%(3/13)的患者达到CRi。而在接受11mg及以上剂量的10例RUNX1突变患者中,30%(3/10)的患者达到CRi(图2)。

在接受BTX A51治疗的31例患者中,所有患者在治疗期间均出现过至少1次不良事件(TEAE),其中常见TEAE包括恶心(67%)、呕吐(63%)、低钾血症(53%)、腹泻(40%)、呼吸困难(37%)、发热性中性粒细胞减少(37%)、贫血(37%)和发热(33%)。研究中观察到的≥3级TEAE包括发热性中性粒细胞减少(33%)、贫血(33%)、血小板减少(23%)和低钾血症(23%)等。
此外,2例患者在治疗第1周期出现了剂量限制性毒性(DLT),其中1例患者在21mg剂量水平下出现3级碱性磷酸酶升高,停药4天后恢复至基线水平;另1例患者在42mg剂量水平下出现3级肝功能衰竭,停药2周后肝功能指标及脑病症状均缓解。
研究期间及末次给药后28天内,共11例患者死亡,其中5例患者归因于疾病进展;另6例患者在无明显疾病进展的情况下死亡,死因包括肺部感染、心脏骤停、颅内出血、真菌感染及感染性休克。
该研究最终确定BTX A51的MTD 及RP2D为21mg(口服剂量,给药频次每周3次,全周期[28天]给药)。
双管齐下:BTX A51为RUNX1突变AML/MDS患者点亮希望
凋亡逃逸是癌症的标志性特征,其发生常与p53失活及BCL2家族抗凋亡成员(BCL-2、MCL-1、BCL-XL、BCL-W)上调相关。在AML患者中,p53基因多未发生突变,但其功能常因抑制因子(主要是MDM2和MDMX,二者在AML中频繁扩增)的作用而失活。因此,增强p53活性并抑制抗凋亡蛋白表达,成为改善R/R髓系肿瘤及其他恶性肿瘤预后的潜在策略。
在该项首次人体I期研究中,口服CK1α及CDK7/9抑制剂BTX A51可升高p53激活的替代标志物MIC-1水平,并抑制MCL1、MYC及MDM2的表达。
在疗效方面,研究中BTX A51的抗白血病活性在较高剂量下更为显著,3例达到CRi的患者均接受11mg或21mg剂量的治疗。虽然接受RP2D(21mg)治疗患者的CRi率仅为13%(2/15)但考虑到该研究队列的高危特征,研究中观察到的初步疗效良好。此外,BTX A51的抗白血病活性在RUNX1突变的R/R AML或MDS患者中更为突出,3例达到CRi的患者均携带RUNX1突变。
安全性方面,患者接受BTX A51治疗的耐受性整体良好,多数TEAE为1~2级。研究中最常见的TEAE为胃肠道毒性(恶心、呕吐、腹泻)和低钾血症,临床上及时干预可快速恢复正常。而转氨酶升高及血液学毒性仅见于少数患者。
综上,该研究结果表明,BTX A51在R/R AML或MDS患者的治疗中耐受性良好,不良反应可控。尽管BTX A51在R/R AML中整体疗效中等,但在较高剂量下(尤其在RUNX1突变患者中)的抗肿瘤活性已显价值。目前,BTX A51与阿扎胞苷、阿扎胞苷联合维奈克拉的联合治疗方案正处于探索阶段。
[1] Abhishek M, Caitlin RR, Jorge EC, et al. Outcomes of relapsed or refractory acute myeloid leukemia after frontline hypomethylating agent and venetoclax regimens. Haematologica. 2020;106(3):894–8.
[2] Ball B.J., Xiao W., Borthakur G., et al. Phase I first-in-human dose escalation study of the oral casein kinase 1α and cyclin dependent kinase 7/9 inhibitor BTX A51 in advanced MDS and AML. J Hematol Oncol 18, 73 (2025).
[3] Döhner H, Weisdorf DJ, Bloomfield CD. Acute myeloid leukemia. N Engl J Med. 2015;373(12):1136–52.
[4] Wattad M, Weber D, Döhner K, et al. Impact of salvage regimens on response and overall survival in acute myeloid leukemia with induction failure. Leukemia. 2017;31(6):1306–13.
[5] Prebet T, Gore SD, Esterni B, et al. Outcome of high-risk myelodysplastic syndrome after azacitidine treatment failure. J Clin Oncol. 2011;29(24):3322–7.
[6] Pan R, Hogdal LJ, Benito JM, et al. Selective BCL-2 inhibition by ABT-199 causes on-target cell death in acute myeloid leukemia. Cancer Discov. 2014;4(3):362–75.
[7] Kadia TM, Jain P, Ravandi F, et al. TP53 mutations in newly diagnosed acute myeloid leukemia: clinicomolecular characteristics, response to therapy, and outcomes. Cancer. 2016;122(22):3484–91.
排版编辑:Grady











 苏公网安备32059002004080号
苏公网安备32059002004080号


