B细胞急性淋巴细胞白血病(B-ALL)的治疗正迎来“免疫时代”的重大变革,其中,贝林妥欧单抗是全球首个且目前唯一获批B-ALL适应症的CD19×CD3双特异性抗体,既往已有研究证实其治疗成人或儿童B-ALL均具有显著疗效优势。近日,发表于ASCO Educational Book的一项综述研究,系统梳理了贝林妥欧单抗在成人、儿童及婴儿B-ALL中的循证学数据,不仅证实其可显著降低复发率、提升长期生存率,更直面药物给药、毒性管理及公平可及性等现实挑战,为优化临床实践、探索未来治疗策略提供了关键指引。

本研究为系统性综述,纳入2008年至2025年全球范围内开展的贝林妥欧单抗相关临床试验(含Ⅰ期、Ⅱ期、Ⅲ期)、真实世界研究及专家共识,按“成人B-ALL”“儿童B-ALL”“婴儿B-ALL” 及“Ph⁺B-ALL”分层分析疗效数据,同时结合美国儿童肿瘤协作组(COG)2021 年机构调查结果(192家机构中150家响应,95%受访者为护士),梳理临床给药、毒性管理及公平可及性等实践挑战,并基于现有证据提出未来研究方向。核心评估指标包括无病生存期(DFS)、总生存期(OS)、MRD阴性率、复发率及不良事件发生率。
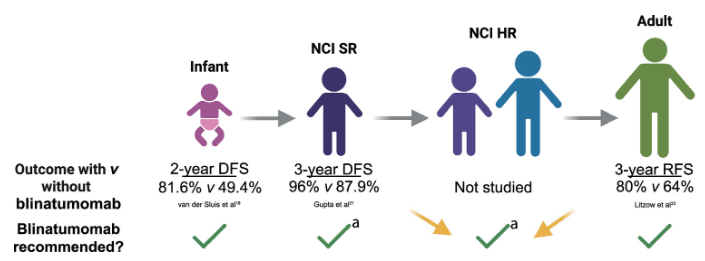
贝林妥欧单抗在各人群中的疗效突破
成人B-ALL:MRD阳性与阴性患者均获益,Ph⁺亚群实现“化疗减量”
MRD阳性患者:BLAST试验纳入144例MRD≥0.1%的成人B-ALL患者,接受1~4周期贝林妥欧单抗治疗后,78%患者实现MRD转阴;其中首次CR(CR1)患者中位OS达41.2个月,36例MRD转阴且未接受造血干细胞移植(HSCT)的患者中,7例随访5年仍维持缓解,推动2018年FDA适应症拓展。
MRD阴性患者:Ⅲ期E1910试验将30~70岁MRD阴性Ph⁻成人B-ALL患者随机分至“标准巩固化疗”组与“化疗+ 4周期贝林妥欧单抗”组,中期分析显示联合组3年OS率(85% vs 68%)、RFS率(80% vs 64%)显著更高,试验提前终止随机化。亚组分析证实,无论年龄、分子风险分层或是否接受HSCT,贝林妥欧单抗均能带来获益,2024年FDA据此批准其用于所有成人B-ALL巩固治疗。
Ph⁺患者:GIMEMA LAL216(D-ALBA)试验纳入63例新诊断Ph⁺成人B-ALL患者(中位年龄54岁),采用“地塞米松+达沙替尼诱导+2~4周期贝林妥欧单抗联合达沙替尼”方案,53 个月DFS率、OS率分别达75.8%、80.7%;29例分子学缓解后仅接受达沙替尼维持且未行HSCT的患者,4年随访时28例仍处于缓解状态。另有单中心Ⅱ期试验显示,贝林妥欧单抗联合泊那替尼(可抑制T315I耐药突变),分子学缓解率优异,进一步挑战了HSCT在Ph⁺B-ALL中的“标准地位”。
儿童B-ALL:标准风险组复发率骤降,高危组亦可获益
标准风险(SR)患者:Ⅲ期AALL1731试验纳入1440例10岁以下、诊断时白细胞计数(WBC)<50×10⁹/L的儿童SR B-ALL患者,随机分至“标准化疗”组与“化疗+ 2周期贝林妥欧单抗”组。中位随访2.5年时,联合组3年DFS率达96.0%(化疗组 87.9%),复发率从11.8%降至3.3%;其中平均风险(SR-Avg)患者DFS率97.5%(化疗组 90.2%),高风险(SR-High)患者DFS率94.1%(化疗组 84.8%),且所有细胞遗传学、种族、MRD状态亚群均获益。需注意的是,贝林妥欧单抗对孤立中枢神经系统(CNS)复发无改善作用,与其血脑屏障穿透性有限相关。
高危(HR)患者:目前尚无直接对比试验,但基于HR儿童与AALL1731中SR-High儿童、E1910中年轻成人的治疗策略及预后相似性,临床普遍认为HR儿童B-ALL患者可从贝林妥欧单抗中获益,指南已推荐其纳入治疗方案。
婴儿B-ALL:破解KMT2A重排“难治困局”
婴儿B-ALL中约80%存在KMT2A基因重排(KMT2Ar),传统化疗的2年DFS率仅49.4%、OS率65.8%。国际多中心Ⅱ期试验纳入30例<1岁的新诊断KMT2Ar婴儿B-ALL患者,在Interfant-06化疗方案基础上,于诱导后添加1周期28天贝林妥欧单抗(仅纳入骨髓原始细胞<25%的患者),结果显示2年DFS率、OS率分别提升至81.6%、93.3%,复发累积发生率降至13%,且无CD19丢失或谱系转换,无治疗相关不良事件,目前贝林妥欧单抗已成为该人群标准治疗。
临床实践挑战:给药、毒性与可及性的多重难题
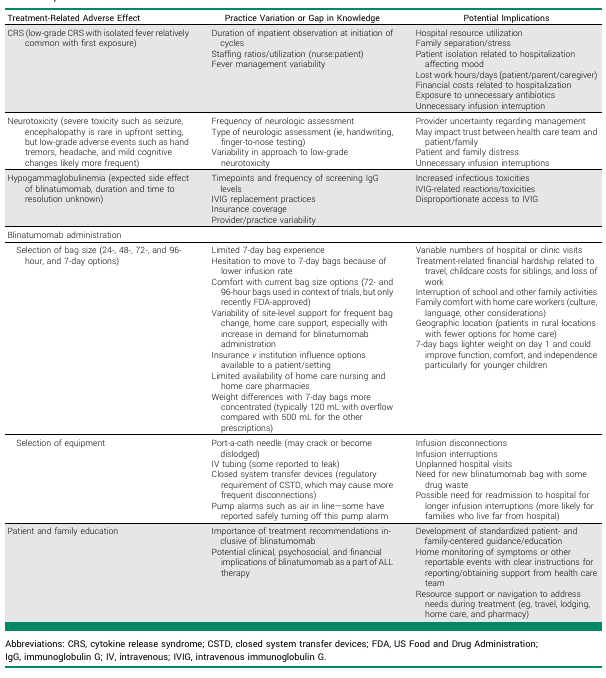
给药与护理:流程不统一增加患者负担
住院观察时长:FDA推荐MRD阴性B-ALL患者首次使用贝林妥欧单抗时至少监测72小时,但COG机构调查显示,实际住院观察时长1~9天不等,仅1/3机构遵循72小时标准。过长住院不仅增加医疗资源消耗,还导致患者家庭面临交通、误工、儿童保育等额外负担,且提升院内感染风险(如中心静脉导管相关血流感染)。
输液装置与频率:目前临床使用的贝林妥欧单抗输液袋规格包括24小时、48小时、72小时、96小时及7天(168小时),72小时和96小时袋为试验常用类型,7天袋虽能减少输液袋更换频率(降低感染风险及门诊次数),但因输注速率低,部分医护人员对其安全性存疑。仅34%机构可提供居家护理,多数患者需反复往返医院更换输液袋,增加经济与时间成本。
操作细节争议:药物说明书与试验方案均建议避免输液过程中冲管,但临床中因给药支持治疗、导管维护等需求常需冲管,3mL冲管液会导致贝林妥欧单抗短时间内大量注入(常规输注速率5mL/h),引发患者不适;此外,输液泵空气报警、管路泄漏等问题频发,部分机构为减少中断,甚至违规关闭空气报警或移除密闭式输液装置。
毒性管理:低级别与长期毒性认知不足
细胞因子释放综合征(CRS)与神经毒性:临床试验中多聚焦≥3级毒性(如AALL1731中CRS发生率低),但真实世界中1~2级CRS(如孤立发热)、1~2级神经毒性(如头痛、疲劳)更常见,且缺乏统一管理指南——部分机构仅观察,部分机构使用广谱抗生素或延长住院,增加不必要医疗干预。2024年FDA更新说明书,建议儿童出现2级免疫效应细胞相关神经毒性综合征(ICANS)时中断输注,此前标准为≥3级,凸显低级别毒性管理的紧迫性。
低丙种球蛋白血症:贝林妥欧单抗导致的B细胞耗竭会引发低丙种球蛋白血症,成人研究显示其可持续至治疗后1年,但儿童人群数据缺失,且临床监测免疫球蛋白(IgG)水平、静脉注射免疫球蛋白(IVIG)补充的时机与标准差异大,部分机构因成本或政策限制,IVIG可及性低,可能增加感染风险(AALL1731 中观察到感染事件增多趋势)。
公平可及性:社会经济因素加剧治疗差距
研究显示,经济稳定性差、交通不便、社会支持不足的患者,更难完成贝林妥欧单抗治疗——如农村患者因居家护理资源匮乏,需频繁长途往返医院;低收入家庭可能因误工、交通费用放弃治疗。此外,青少年及年轻成人(AYA)、少数族裔、语言障碍患者也面临更高的治疗中断风险,需针对性干预。
表1.贝林妥欧单抗的特殊注意事项
未来优化方向:从治疗方案到护理模式的全面升级
化疗减量与联合策略
现有试验多将贝林妥欧单抗添加至标准化疗中,未来方向为“以贝林妥欧单抗为核心的低强度/无化疗方案”:
英国UKALL研究显示,对标准化疗不耐受的儿童B-ALL患者,用贝林妥欧单抗替代部分化疗后,预后与完成标准化疗患者相当;对中等风险KMT2Ar婴儿,用1周期贝林妥欧单抗替代2个高强度化疗模块,仍实现优异疗效。
成人研究中,贝林妥欧单抗联合CD22靶向抗体药物偶联物奥加伊妥珠单抗的无化疗方案,在Ph⁻老年B-ALL患者中实现94% MRD阴性率、5年OS率46%,为不耐受化疗人群提供新选择。
给药方式革新
皮下注射(SQ)制剂:Ⅰ期试验在复发/难治成人B-ALL中测试两种SQ方案(低剂量组:首周250mg/天,后续3天/周500mg/天;高剂量组:首周500mg/天,后续3天/周1000mg/天),CR率分别为85.7%(12/14)、92.3%(12/13),多数为MRD阴性CR,虽≥3级CRS(23%)与神经毒性(34.6%)较常见,但经剂量调整后可控制,目前儿童SQ制剂试验正在研发中,有望替代静脉持续输注,提升便利性。
短疗程方案:回顾性研究显示,儿童复发/难治B-ALL患者接受6~10天贝林妥欧单抗治疗,与28天标准疗程疗效相当;另有研究发现,治疗第15天时,大部分将实现MRD阴性CR的患者已达目标,且28天持续输注可能导致T细胞耗竭(影响疗效),短疗程联合治疗间歇期或可解决这一问题,相关前瞻性试验正在开展。
毒性与护理标准化
需开展专项研究明确低丙种球蛋白血症的持续时间(尤其儿童)、IVIG补充的最佳时机,以及1~2级CRS/神经毒性的管理流程;COG已制定贝林妥欧单抗给药FAQ手册(含冲管、报警处理等细节),未来需推广至全球机构,同时建立“中心化咨询模型”——由经验丰富的中心为新开展贝林妥欧单抗治疗的机构提供指导,统一操作标准。
公平可及性提升
建议通过肿瘤登记系统追踪符合贝林妥欧单抗适应症的患者,识别治疗中断高风险人群(如低收入、农村患者),提供针对性支持(如交通补贴、居家护理资源对接);同时在临床试验中前瞻性收集患者报告结局(如生活质量、经济负担),确保治疗优化兼顾疗效与可及性。
结论
贝林妥欧单抗已彻底改变B-ALL治疗格局,在成人、儿童及婴儿患者中均实现“提升缓解率、降低复发率”的核心目标,尤其为化疗不耐受人群(如老年、婴儿)提供了低毒性治疗选择。然而,临床实践中仍面临给药流程不统一、低级别毒性管理缺乏指南、部分患者可及性不足等挑战,需通过标准化护理流程、研发皮下注射及短疗程制剂、完善支持性护理政策等方式解决。
未来研究应聚焦三大方向:一是明确不同人群的最佳化疗减量方案,在维持疗效的同时降低毒性;二是优化给药方式,提升患者便利性与治疗依从性;三是建立公平的治疗可及性体系,确保所有潜在获益患者均能获得治疗。随着这些问题的逐步解决,贝林妥欧单抗将进一步推动B-ALL治疗向“精准、低毒、可及”的目标迈进。
Zupanec S, Beauchemin M, Rau R E. Navigating B-ALL in the Era of Blinatumomab[J]. American Society of Clinical Oncology Educational Book, 2025, 45(3): e472778.
排版编辑:mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


